TLR3激动剂poly(I∶C)对ApoE-/-小鼠动脉粥样硬化斑块形成的影响及相关分子机制
2017-12-15耿瑞丽金贺赵培路永刚
耿瑞丽 金贺 赵培 路永刚
·论著·
TLR3激动剂poly(I∶C)对ApoE-/-小鼠动脉粥样硬化斑块形成的影响及相关分子机制
耿瑞丽 金贺 赵培 路永刚
目的观察TLR3激动剂poly(I∶C)对ApoE-/-小鼠动脉粥样硬化(AS)斑块形成的影响及相关分子机制。方法10只SPF级雄性载脂蛋白E基因敲除(ApoE-/-)小鼠,随机分为模型组和poly(I∶C)组,每组5只。分别给予高脂饲料、高脂饲料+腹腔注射poly(I∶C)喂养。另设5只C57BL/6J小鼠为对照组,给予普通饲料喂养。给药14周后处死小鼠。比较3组体重、纤维帽厚度、血管内-中膜厚度、血清生化指标[总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-c)、高密度脂蛋白胆固醇(HDL-c)、一氧化氮(NO)、丙二醛(MDA)、超氧化物歧化酶(SOD)]、炎性因子[白介素6(IL-6)、白介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)]、黏附分子[血管细胞黏附因子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)、P-选择素(P-selection)]、Toll样受体3(TLR3)及其下游依赖β-干扰素TIR结构域衔接蛋白(TRIF)、磷酸化p38丝裂原活化蛋白激酶(p-p 38)、磷酸化c-jun氨基末端激酶(p-JNK)、磷酸化细胞外信号调节(p-ERK)蛋白表达变化。结果模型组、poly(I∶C)组小鼠体重增加明显快于对照组(Plt;0.05),但模型组、poly(I∶C)组间体重比较差异无统计学意义(Pgt;0.05)。对照组主动脉管壁无斑块形成。模型组可见明显的主动脉斑块形成和血管内-中膜厚度增加(Plt;0.05);与模型组比较,poly(I∶C)组纤维帽厚度、血管内-中膜厚度明显减小(Plt;0.05)。与对照组比较,模型组TC、TG、LDL-C、MDA、IL-6、IL-1β、TNF-α、VCAM-1、ICAM-1、P-selection、TLR3、TRIF、p-p38、p-JNK、p-ERK蛋白表达明显增加,HDL-C、NO、SOD明显降低(Plt;0.05);与模型组比较,poly(I∶C)组TC、TG、LDL-C、MDA、IL-6、IL-1β、TNF-α、VCAM-1、ICAM-1、P-selection、TLR3、TRIF、p-p38、p-JNK、p-ERK蛋白表达明显降低,HDL-C、NO、SOD明显增加(Plt;0.05)。结论TLR3激动剂poly(I∶C)通过抑制TLR3/TRIF信号通路的激活及炎症因子的释放减轻ApoE-/-小鼠AS病变。
Toll样受体3;动脉粥样硬化;ApoE基因缺陷
动脉粥样硬化(AS)是以脂质代谢紊乱、主动脉管壁过量脂质沉积为特征的慢性炎症性疾病,而斑块破裂合并血栓形成是导致多种心脑血管疾病的病理基础[1-3]。近年来,AS发病率和死亡率逐年增加,寻找防治AS的药物及探索AS发生发展的分子机制至关重要[4]。Toll样受体(TLRs)是一类模式识别受体,主要表达在巨噬细胞、血管内皮细胞、T、B淋巴细胞上,而这些细胞均与AS发生发展有关[5]。TLR3是TLRs家族的重要成员,可识别双链RNA(dsRNA)及其类似物poly(I∶C)发挥抑制肿瘤细胞增殖、诱导细胞凋亡等生物学功能[5,6]。研究发现,TLR3信号途径与泡沫细胞形成、血管内皮细胞功能受损及炎性反应密切相关,从而加速AS斑块形成[7-9]。然而,TLR3激动剂poly(I∶C)能否通过激活TLR3信号途径发挥抗炎、降脂、延缓AS发生发展的作用目前尚未见报道。本实验首先建立ApoE-/-小鼠AS模型,研究poly(I∶C)对AS的作用及其分子机制,以期为临床防治AS提供实验依据。
1 材料与方法
1.1 动物 6~8周龄ApoE-/-小鼠10只[购自北京大学医学部,合格证号:SCXK(京2011-0012)],体重20~30 g,随机分为2组,每组5只。模型组:给予高脂饲料喂养。poly(I∶C)组:给予高脂饲料喂养,同时腹腔注射poly(I∶C),5 μg/g,1次/d。另设相同周龄、健康雄性C57BL/6J小鼠5只为对照组,给予普通饲料喂养,腹腔注射等量0.9%氯化钠溶液。给药14周后处死小鼠。
1.2 试剂与仪器 小鼠抗VCAM-1、ICAM-1、P-selection、TLR3、TRIF、p-p38、p-JNK、p-ERK抗体购自美国Santa Cruz 公司;细胞裂解液、BCA蛋白浓度测定试剂盒购自美国Gibco-BRL公司;TC、TG、LDL-c、HDL-c、NO、MDA、SOD试剂盒购自南京建成生物工程研究所;7170A 型全自动生化分析仪购自日本日立公司;Chemi DocTM XRS+化学发光凝胶成像系统购自美国Biorad公司。
1.3 检测方法
1.3.1 生化指标:处死小鼠前,采集小鼠尾静脉血,3 000 r/min,离心15 min,分离血清。采用全自动生化分析仪测定血清TC、TG、LDL-C、HDL-C、NO、MDA、SOD水平。
1.3.2 苏木素-伊红(HE)染色:采用HE染色检测小鼠主动脉纤维帽厚度、血管内-中膜厚度。剪去心脏,分离主动脉根部,4%多聚甲醛固定,脱水,石蜡包埋,制作5 μm厚切片,HE染色,100倍光学显微镜下观察组织形态,Image-ProPlus 6.0软件测定主动脉纤维帽厚度和血管内-中膜厚度。
1.3.3 酶联免疫吸附实验(ELISA):采用ELISA测定血清IL-6、IL-1β、TNF-α水平,试剂盒购自武汉博士德生物工程有限公司,严格按照试剂盒说明书操作。
1.3.4 Western-blot:采用Western-blot检测主动脉VCAM-1、ICAM-1、P-selection、TLR3、TRIF、p-p38、p-JNK、p-ERK蛋白表达。提取组织总蛋白,BCA法进行蛋白定量。SDS-PAGE电转至PVDF膜,10%脱脂奶粉封闭2 h。依次加入特异性一抗和辣根过氧化物酶标记的羊抗鼠IgG,化学发光法显色、定影。用UVP软件扫描测定蛋白条带IOD值,β-actin作为内参照,以目的蛋白与β-actin吸光度值的比值表示目的蛋白相对表达水平。
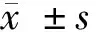
2 结果
2.1 3组体重比较 与对照组比较,模型组、poly(I∶C)组小鼠体重明显增加,差异有统计学意义(Plt;0.05);模型组、poly(I∶C)组小鼠体重比较差异无统计学意义(Pgt;0.05)。见表1。
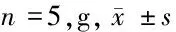
表1 3组体重比较
注:与对照组比较,*Plt;0.05
2.2 3组主动脉纤维帽厚度、血管内-中膜厚度比较 对照组主动脉管壁无斑块形成。与对照组比较,模型组主动脉纤维帽厚度、血管内-中膜厚度明显增加,差异有统计学意义(Plt;0.05);与模型组比较,poly(I∶C)组主动脉纤维帽厚度、血管内-中膜厚度明显减少,差异有统计学意义(Plt;0.05)。见表2。

表2 3组主动脉纤维帽厚度、血管内-中膜厚度比较
注:与对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05
2.3 3组血脂水平比较 与对照组比较,模型组TC、TG、LDL-C水平明显升高,HDL-C水平明显下降,差异有统计学意义(Plt;0.05);与模型组比较,poly(I∶C)组TC、TG、LDL-C水平明显下降,HDL-C水平明显升高,差异有统计学意义(Plt;0.05)。见表3。
2.4 3组血清炎性因子比较 与对照组比较,模型组IL-6、IL-1β、TNF-α水平明显升高,差异有统计学意义(Plt;0.05);与模型组比较,poly(I∶C)组IL-6、IL-1β、TNF-α水平明显降低(Plt;0.05)。见表4。
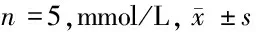
表3 3组血脂水平比较
注:与对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05

表4 3组血清炎性因子比较
注:与对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05
2.5 3组血清NO、MDA、SOD比较 与对照组比较,模型组MDA水平明显增加,NO、SOD水平明显降低,差异有统计学意义(Plt;0.05);与模型组比较,poly(I∶C)组MDA水平明显降低,NO、SOD水平明显增加,差异有统计学意义(Plt;0.05)。见表5。
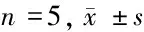
表5 3组血清NO、MDA、SOD比较
注:与对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05
2.6 3组主动脉黏附分子表达比较 与对照组比较,模型组ICAM、VCAM、E-selection蛋白表达明显升高,差异有统计学意义(Plt;0.05);与模型组比较,poly(I∶C)组ICAM、VCAM、E-selection蛋白表达明显降低,差异有统计学意义(Plt;0.05)。见表6。
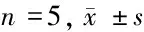
表6 3组主动脉黏附分子表达比较
注:与对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05
2.7 3组主动脉TLR3/TRIF信号通路相关分子表达比较 与对照组比较,模型组TLR3、TRIF、p-p38、p-ERK1/2、p-JNK蛋白表达明显增加,差异有统计学意义(Plt;0.05);与模型组比较,poly(I∶C)组TLR3、TRIF、p-p38、p-ERK1/2、p-JNK蛋白表达明显降低,差异有统计学意义(Plt;0.05)。见表7。
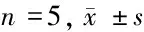
表7 3组主动脉TLR3/TRIF信号通路相关分子表达水平比较
注:与对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05
3 讨论
目前,冠心病、脑缺血等心脑血管疾病的发病率逐年增加,致死率和致残率高,严重影响患者身心健康,而AS是导致上述疾病的主要原因。脂代谢紊乱是引起AS发生发展的主要因素,通过诱导炎性反应、损伤血管内皮等加速AS进程[10,11]。研究发现,采用高脂饲料喂养的ApoE-/-小鼠AS模型能够高度模拟人AS进程[12,13]。本研究结果显示,高脂饲料喂养ApoE-/-小鼠14周后小鼠血脂水平明显升高,HE染色结果可见主动脉斑块形成和血管内-中膜厚度增加,提示造模成功,与以往研究[14]一致。
TLR3是广泛表达在免疫细胞、胰岛β细胞、神经细胞的跨膜信号转导受体。TLR3的配体主要为病毒来源的dsRNA及其类似物多聚肌胞苷酸poly(I∶C),通过TRIF激活和募集下游信号分子,其中最关键的是与炎性反应相关的重要呈递分子MAPK系统(p38、JNK、ERK),从而诱导IL-6、IL-1β、TNF-α等炎性因子合成和释放[15]。Baiersdrfer等[16]研究发现,TLR3基因敲除小鼠主动脉斑块形成明显加快,提示TLR3在AS小鼠模型中发挥保护作用。这与之前发现的激活TLR3促进炎性因子释放和AS形成的观点矛盾。因此,TLR3在AS发生发展中似乎发挥双重作用。此外,TLR3参与AS形成的具体分子机制尚未阐明。
本研究结果发现,poly(I∶C)激活TLR3能够明显降低ApoE-/-小鼠TC、TG、LDL-C水平,升高HDL-C水平,同时主动脉纤维帽厚度、血管内-中膜厚度明显减小(Plt;0.05),说明poly(I∶C)能够有效降脂、延缓AS进程。此外,与模型组比较,poly(I∶C)组MDA、IL-6、IL-1β、TNF-α、VCAM-1、ICAM-1、P-selection、TLR3、TRIF、p-p38、p-JNK、p-ERK蛋白表达明显降低,HDL-C、NO、SOD明显升高(Plt;0.05),说明poly(I∶C)激活TLR3/TRIF通路通过抑制MAPKs家族磷酸化程度发挥抗炎作用,这可能是poly(I∶C)抗AS的机制之一。
综上所述,poly(I∶C)能够降低高脂饮食诱导的ApoE-/-小鼠血脂水平,减小主动脉纤维帽厚度、血管内-中膜厚度,其机制可能与抑制MAPK信号通路中p38、JNK、ERK蛋白磷酸化及炎性反应有关。本研究为poly(I∶C)防治AS提供了新思路和新策略。
1 Jacobs AK,Anderson JL,Halperin JL,et al.The evolution and future of ACC/AHA clinical practice guidelines:a 30-year journey:a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines.Circulation,2014,130:1208-1217.
2 孙佳艺,赵冬,刘静,等.中国缺血性脑卒中住院患者颈动脉粥样硬化病变性别差异的分析.心肺血管病杂志,2016,35:81-86.
3 王月,张华,刘振东,等.动脉粥样硬化斑块与血清Ox-LDL关系的临床观察研究.中国循环杂志,2015,S1:52-53.
4 Go AS,Mozaffarian D,Roger VL,et al.Heart disease and stroke statistics-2014 update:a report from the American Heart Association.Circulation,2014,129:399-410.
5 Shen P,Jiang TW,Lu HQ,et al.Combination of Poly I:Cand arsenic trioxide triggers apoptosis synergistically via activation of TLR3 and mitochondrial pathways in hepatocellular carcinoma cells.Cell Biol Int,2011,35:803-810.
6 Zimmer S,Steinmet ZM,Asdonk T,et al.Activation of endothelial Toll-Like receptor 3 impairs endothelial function.Circ Res,2011,108:157-158.
7 Ishibashi M,Sayers S,D’Armiento JM,et al.TLR3 deficiency protects against collagen degradation and medial destruction in murine atherosclerotic plaques.Atherosclerosis,2013,229:52-61.
8 Lundberg AM,Ketelhuth DF,Johansson ME,et al.Toll-like receptor 3 and 4 signalling through the TRIF and TRAM adaptors in haematopoietic cells promotes atherosclerosis.Cardiovasc Res,2013,99:364-373.
9 Cole JE,Navin TJ,Cross AJ,et al.Unexpected protective role for Toll-like receptor 3 in the arterial wall.Proc Natl Acad Sci USA,2011,108:2372-2377.
10 Marungruang N,Fak F,Tareke E.Heat-treated high-fat diet modifies gut microbiota and metabolic markers in apoe-/-mice.Nutr Metab(Lond),2016,13:1-11.
11 Jawien J.The role of an experimental model of atherosclerosis:apoE-knockout mice in developing new drugs against atherogenesis.Curr Pharm Biotechnol,2012,3:2435-2439.
12 Panjwani N,Mulvihill EE,Longuet C,et al.GLP-1 receptor activation indirectly reduces hepatic lipid accumulation but does notattenuate development of atherosclerosis in diabetic male ApoE(-/-)mice.Endocrinology,2013,154:127-139.
13 Parlevliet ET,Wang Y,Geerling JJ,et al.GLP-1 receptor activation inhibits VLDL production and reverses hepatic steatosis by decreasing hepatic lipogenesis in high-fat-fed APOE*3-Leiden mic.PLoS One,2012,7:e49152.
14 尚茹茹,刘晓红,张锦,等.致动脉粥样硬化过程中不同表型的巨噬细胞对泡沫细胞形成的影响及机制.中西医结合心脑血管病杂志,2015,13:1273-1275.
15 Jelinek I,Leonard JN,Price GE,et al.TLR3-specific double-stranded RNA oligonucleotide adjuvants induce dendritic cell cross-presentation, CTLresponses,and antiviral protection.J Immunol,2011,186:2422-2429.
16 Baiersdrfer M,Schwarz M,Seehafer K,et al.Toll-like receptor 3 mediates expression of clusterin/apolipoprotein J in vascular smooth muscle cells stimulated with RNA released from necrotic cells.Exp Cell Res,2010,16:3489-3500.
EffectsofTLR3activator-poly(I∶C)onatheroscleroticplaqueformationinApoE-/-miceanditsmolecularmechanism
GENGRuili*,JINHe,ZHAOPei*,etal.
*DepartmentofClinicalLaboratory,HebeiProcincialPeople’sHospital,Shijiazhuang050051,China
ObjectiveTo investigate the effects of TLR3 activator-poly(I∶C)on atherosclerotic plaque formation in ApoE-/- mice and its molecular mechanism.MethodsA total of 10 specific pathogen free(SPF)male ApoE-/- mice were randomly divided into model group and poly(I∶C)group,with 5 mice in each group.The mice in model group and poly(I∶C)group were fed with high fat diet and high fat diet+poly (I∶C), respectively,and the other five C57BL/6J mice fed with normal diet C57BL/6J were served as control group.After 14-week feeding,all the mice were sacrificed,then the body weight,fiber-cap thickness,vascular intima-media thickness,TC,TG,LDL-C,HDL-C,NO,MDA,SOD,IL-6,IL-1β,TNF-α,VCAM-1,ICAM-1,P-selection and the expression levels of TLR3, TRIF,p-p38,p-JNK and p-ERK were observed and compared among the three groups.ResultsThe body weight in model group was significantly higher than that in control group(Plt;0.05),but there was no significant difference in body weight between model group and poly(I∶C)group (Pgt;0.05). No aortic plaque formation was found in control group, however, obvious aortic plaque formation and increase of vascular intima-media thickness were found in model group (Plt;0.05). As compared with those in model group,the aortic plaque formation and vascular intima-media thickness were significantly decreased in poly(I∶C)group (Plt;0.05). As compared with those in control group,the levels of TC,TG,LDL-C,MDA,IL-6,IL-1β,TNF-α,VCAM-1,ICAM-1,P-selection and the expression levels of TLR3,TRIF,p-p38,p-JNK,p-ERK proteins in model group were significantly increased,however, the levels of HDL-C,NO,SOD were significantly decreased (Plt;0.05). As compared with those in model group,the levels of TC,TG,LDL-C,MDA,IL-6,IL-1β,TNF-α and the expression levels of VCAM-1,ICAM-1,P-selection,TLR3,TRIF,p-p38,p-JNK,p-ERK proteins were significantly decreased in poly(I∶C)group,however, the levels of HDL-C, NO and SOD were significantly increased (Plt;0.05).ConclusionTLR3 activator-poly(I∶C)can inhibit atherogenesis and relieve AS lesion in ApoE-/- mice by inhibiting the activation of TLR3/TRIF signal pathway and decreasing inflammatory factors release.
Toll-like acceptor 3; atherosclerosis; ApoE genetic flaw
10.3969/j.issn.1002-7386.2017.24.008
050051 石家庄市,河北省人民医院检验科(耿瑞丽、赵培、路永刚);河北中医学院国际教育学院(金贺)
R 543
A
1002-7386(2017)24-3712-04
2017-06-19)
