PTEN与Survivin分子在肾透明细胞癌组织中差异表达的意义
2017-12-15徐芝立张丽红张翼梁长春马志强
徐芝立 张丽红 张翼 梁长春 马志强
·论著·
PTEN与Survivin分子在肾透明细胞癌组织中差异表达的意义
徐芝立 张丽红 张翼 梁长春 马志强
目的检测肾透明细胞癌组织中PTEN与Survivin蛋白分子的表达差异,探讨其在基因靶向治疗和外科手术中的应用价值。方法利用Western blot实验检测肾透明细胞癌组织、癌旁0.5 cm肾组织以及癌旁1.0 cm肾组织中PTEN与Survivin蛋白分子的表达量差异并进行相关分析。结果Western Blot实验检测PTEN蛋白相对表达量:癌组织的PTEN蛋白表达水平(1.482±0.320)明显低于癌旁0.5 cm组(10.861±1.347)以及癌旁1.0 cm组(10.947±1.744),差异有统计学意义(Plt;0.05)。癌旁0.5 cm组与癌旁1.0 cm组的PTEN蛋白表达水平差异无统计学意义(Pgt;0.05)。Western Blot实验检测Survivin蛋白相对表达量:癌组织的Survivin蛋白表达水平(17.113±3.367)明显高于癌旁0.5 cm组(3.233±1.898)以及癌旁1.0 cm组(2.924±1.612),差异有统计学意义(Plt;0.05)。癌旁0.5 cm组与癌旁1.0 cm组的Survivin蛋白表达水平差异无统计学意义(Pgt;0.05)。Pearson相关分析显示,癌组织中的PTEN蛋白与Survivin蛋白的表达水平呈现负相关性(r=-0.908,Plt;0.05)。结论PTEN和Survivin基因可能共同促进了肾癌的发生与发展,对基因靶向治疗和外科手术切口有应用和指导价值。
Survivin基因;PTEN基因;Western blot;肾透明细胞癌
肾癌是泌尿生殖系统常见肿瘤,占肾脏恶性肿瘤的80%~90%,占成人恶性肿瘤的3%,近年来的发病率逐渐提高,大约60%的新发病例被偶然发现,其中约四分之一的患者确诊时已经出现肿瘤转移[1]。尽管肿瘤分级、分期以及脉管浸润程度能有效预测肾癌的恶性行为,但相同临床分期、分级的肿瘤患者预后却有明显差别,这说明肾癌在发生进展过程存在显著的异质性[2]。因此,寻找有效预测肾癌进展与预后转归的瘤标分子对于肾癌患者的临床治疗和预后判断有重要导意义。现代分子生物学认为,恶性肿瘤的发生、发展与某些抑癌基因的失活、原癌基因的激活密切相关。PTEN(phosphatase and tensin homology deleted on chromosome10),又称MMAC1或TEP1,是人体第10号染色体缺失的磷酸酶和张力蛋白同源基因,在众多恶性肿瘤中频繁丢失与突变,促进了肿瘤细胞增殖,抑制了肿瘤细胞凋亡,与肿瘤恶性进展密切相关[3,4]。Survivin基因是凋亡抑制蛋白IAP家族的重要成员,可以调控肿瘤细胞凋亡与侵袭,肿瘤间质血管生成等过程,参与了多种恶性肿瘤的发生和发展。临床研究发现,尤文氏肉瘤、小细胞肺癌、膀胱癌等多种恶性肿瘤的发生、发展、不良预后与Survivin基因密切相关[5-7]。还有学者发现,肾癌组织中Survivin基因表达增高与患者总生存时间及肿瘤特异性生存时间呈反向相关,提示Survivin分子表达增加促进了肿瘤的恶性发展[2]。由于PTEN与Survivin基因在人体癌组织与正常组织中存在的显著表达差异,使其成为肿瘤基因靶向治疗的理想靶点。肾癌又名肾腺癌,其主要病理类型是透明细胞癌。我们的课题拟利用Western blot实验精确检测肾透明细胞癌组织、癌旁0.5 cm正常肾组织以及癌旁1.0 cm正常肾组织中PTEN与Survivin分子表达量的差异,了解肾癌发展过程中两分子的表达变化及相关性,为进一步针对肾透明细胞癌患者开展PTEN与Survivin基因功能研究和靶向治疗提供实验依据,也为早期局限性肾癌患者施行肾脏部分切除术选取安全手术边距提供分子学实验依据,笔者在国内尚未见相关报道。
1 资料与方法
1.1 一般资料 收集2013至2015年我院泌尿外科肾癌患者施行根治性肾切除的离体新鲜肾脏标本16例。其中男11例,女5例;年龄53~78岁,平均年龄(61±9)岁;患者均无肾炎、肾病、肾衰、肾盂肾炎及糖尿病、免疫性疾病史,术前均未接受放化疗、免疫靶向药物治疗。所有肾癌标本经过HE染色、读片,确诊为肾透明细胞癌。分3组于癌组织、癌旁0.5 cm处、癌旁1.0 cm 处取材。组织细胞裂解液(RIPA)、蛋白酶抑制剂(PMSF)、蛋白上样缓冲液均购自北京索莱宝公司,兔抗人PTEN单抗(ab32199)、Survivin单抗(ab76424)、β-actin单抗(ab8227)以及羊抗兔荧光二抗(ab131366)均购自英国Abcam公司。所有实验研究有患者知情同意授权。
1.2 试验方法
1.2.1 组织细胞裂解:新鲜组织用微型粉碎器粉碎后,收集到1.5 ml EP管中。加入含蛋白酶抑制剂的细胞裂解液(RIPA∶PMSF=100∶1),吹打混匀,冰置15 min。4℃,10 000 g离心20 min,收集上清为细胞总蛋白,进行后续实验。
1.2.2 Western Blot实验:将提取的总蛋白先行定量测定,酶标仪测定波长为572 nm时的吸光度值,根据标准曲线计算蛋白样品的浓度。取适量蛋白样品加入SDA-PAGE凝胶中4℃条件下,恒压90 V,电泳,分别切下包含50~60 kDa (PTEN)、16~20 kDa (Survivin)、37~50 kDa (β-actin)蛋白区带凝胶,置于转膜缓冲液中浸泡转膜,滴加一抗,4℃孵育过夜,滴加二抗,孵育,洗涤,Odyssey双色红外荧光扫描系统分析结果。
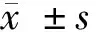
2 结果
2.1 Western Blot实验检测PTEN蛋白相对表达量 癌组织的PTEN蛋白表达水平(1.482±0.320)明显低于癌旁0.5 cm组织(10.861±1.347)以及癌旁1.0 cm 组织(10.947±1.744),差异有统计学意义(Plt;0.05)。癌旁0.5 cm组织与癌旁1.0 cm组织的PTEN蛋白表达水平差异无统计学意义(Pgt;0.05)。见表1,图1、2。
2.2 Western Blot实验检测Survivin蛋白相对表达量 癌组织的Survivin蛋白表达水平(17.113±3.367)明显高于癌旁0.5 cm组织(3.233±1.898)以及癌旁1.0cm组织(2.924±1.612),差异有统计学意义(Plt;0.05)。癌旁0.5 cm组织与癌旁1.0 cm组织的Survivin蛋白表达水平差异无统计学意义(Pgt;0.05)。见表1,图1、2。
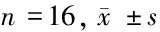
表1 不同部位肾癌标本中PTEN与Survivin蛋白相对表达量
注:与癌组织比较,*Plt;0.05
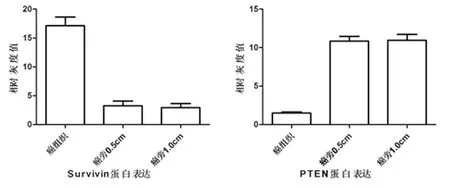
图1 不同部位肾癌标本中PTEN与Survivin蛋白表达差异

图2 不不同部位肾癌标本Survivin及PTEN蛋白电泳条带
2.3 Pearson相关分析显示,癌组织中的PTEN蛋白与Survivin蛋白的表达水平呈现负相关性(r=-0.908,Plt;0.05)。见图3。
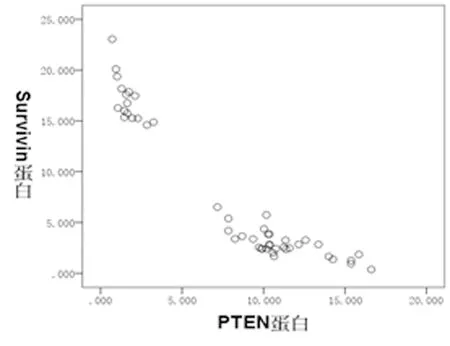
图3 肾癌标本中PTEN与Survivin蛋白表达相关分析散点图
3 讨论
PTEN是人类恶性肿瘤中缺失和突变率最高的抑癌基因。Esteva等[8]对乳腺癌的研究发现,PTEN基因的突变、丢失和甲基化导致的分子表达异常与肿瘤的分化、转移和预后等明显相关。在泌尿系统恶性肿瘤的研究中也发现了该基因的突变与失活,这导致PTEN蛋白表达出现异常,促进了肿瘤的发生、进展过程[4,9]。
基础研究显示,PTEN基因位于人类染色体10q23.3,广泛表达于人体正常组织细胞,具有编码脂质磷酸酶和蛋白磷酸酶的双重特异性磷酸酶活性,可以通过阻断PIP3/PI3K/AKT通路、负向调节丝裂原激活的蛋白激酶信号通路以及调控P53/MDM2通路和NF-KB/IKB信号通路等影响肿瘤细胞的增殖、分化、凋亡等过程[10]。例如:通过使黏着斑激酶(FAK)去磷酸化引起FAK失活,下调其下游调控信号p130CAS,控制细胞的存活和黏附、运动,调节细胞的转移与侵袭功能[11];在结肠癌的研究中,Roy等[12]学者发现抑癌基因PTEN可使PIP3转化成PIP2,进而阻断PIP3/PI3K/AKT信号通路,抑制细胞增殖、促进细胞凋亡。另外,还有学者发现抑制PTEN/PI3K/AKT 通路的激活可有效抑制前列腺癌细胞的增殖和转移[13]。
Schneider等[14]用Western Blot实验对肾癌组织检测发现,低表达PTEN的大部分肾透明细胞癌患者多死于肾癌转移,提示肾癌组织PTEN蛋白参与了肿瘤的恶性进展,PTEN表达下降与肿瘤不良预后密切相关。本实验利用Western Blot技术对新鲜离体肿瘤标本的不同部位进行取材并定量测定PTEN蛋白表达量。实验发现,肾癌组织的PTEN蛋白表达水平明显低于癌旁0.5 cm处肾组织,也明显低于癌旁1.0 cm 处肾组织,而后两者的PTEN蛋白表达水平无显著差异,这表明了在正常肾组织渐变至癌组织的过程中PTEN基因突变或缺失所导致的蛋白表达变化,说明PTEN蛋白表达与肾癌发生与进展密切相关。
Survivin是凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)家族的新成员,Survivin基因位于人类染色体17q25,片段长14.7 kb,编码142个氨基酸组成的蛋白,分子质量约16.5 kDa,含有杆状病毒IAPs(inhibition of apoptosis proteins)序列,是1997年由Ambrosini等利用效应细胞蛋白酶受体-1(effector cell protease receptor-1,EPR-1)cDNA在人类基因组库的杂交筛选中分离出来的[15]。Survivin分子高表达在人的胚胎组织和多种恶性肿瘤细胞中,除胸腺和生殖腺外,在人类正常分化成熟的组织中检测不到Survivin表达,参与抑制细胞凋亡、调控细胞增殖和促进肿瘤血管生成等生理过程,并在多种恶性肿瘤中呈现高表达,与肿瘤进展密切相关[7,16]。
在泌尿系统肿瘤的临床研究中,Xiong等[2]通过meta分析发现肾癌肿瘤组织中Survivin基因表达增高,会导致患者肿瘤特异性生存时间下降,认为Survivin促进了肿瘤恶性进展过程。学者Wang等[17]报道Survivin分子高表达在前列腺癌组织中,且外周血循环肿瘤细胞的Survivin mRNA水平与前列腺癌远转移率明显相关,更进一步揭示出Survivin基因表达可能通过促进肿瘤细胞的侵袭转移行为而参与了肿瘤进展机制。本实验发现,肾癌组织的Survivin蛋白表达水平明显高于癌旁0.5 cm处肾组织,也明显高于癌旁1.0 cm处肾组织,这说明Survivin基因表达水平在肾癌组织及癌旁组织中的变化体现了肾脏细胞癌变的发生与进展过程,Survivin基因表达对肾癌发挥促癌作用。
肿瘤的迅速增殖、组织浸润、血管侵袭、转移及耐药产生是影响肿瘤预后的重要因素,Survivin能参与其中多个过程而显著降低肿瘤的治疗效果和缩短总生存时间,是恶性细胞转化的标志[18]。在肿瘤细胞中,Survivin主要表现为两种功能作用[19]:(1)调控细胞有丝分裂影响细胞增殖。Survivin通过与纺锤体微管蛋白特异性结合形成染色体乘客络合体(chromosomal passenger complex,CPC),稳定微管结构,防治纺锤体被水解,保护有丝分裂细胞器的完整性,有利于有丝分裂持续进行,促进肿瘤细胞不断增殖。Survivin基因高表达可以促进细胞由G1期向S期转换,在G2/M期可见Survivin表达明显升高[20]。(2)抑制细胞凋亡。Survivin蛋白的IAPs重复序列可以直接与凋亡通路下游蛋白酶Caspase3和Caspase7相结合,发挥直接的抗凋亡作用。Survivin蛋白与X连锁凋亡抑制蛋白结合形成的Survivin-XIAP复合体可以抑制Caspase9的活性而发挥间接的抗凋亡作用。另外,肿瘤组织中Survivin基因的高表达增强了β-catenin、T细胞因子以及血管内皮生长因子(vascular endothelial growth factor,VEGF)的转录活性与表达水平;提示Survivin基因可能促进肿瘤间质中血管的形成,而这种促进基质血管形成的能力是肿瘤侵袭转移的必需因素[21]。
众多研究已证实,肿瘤抑制基因PTEN的纯合型或杂合性丢失可以导致磷酸肌醇3-激酶(phosphoinositide3-kinase,PI3K)信号网络的异常激活,这在肿瘤发展中是最重要的常见事件之一,尤其多见于恶性侵袭与转移性肿瘤疾病中。所以,PTEN经常单独或与其他分子联合作为预测肿瘤预后的生物标记物[22]。而PI3K可以通过产生许多因子和调控各种细胞通路促进细胞生长增殖与分化,其中包括极为重要的PI3K/PIP3/AKT通路。有学者研究髓样白血病发现,PI3K途径在mRNA和蛋白水平均对Survivin有调控作用[23]。我们的实验对PTEN和Survivin 蛋白表达量进行相关分析发现,两个蛋白分子的表达水平呈现显著负相关性,这表明PTEN和Survivin 基因很可能通过调控细胞周期与凋亡的机制共同参与肾癌的发展过程。据此可以推理:在正常生理情况下,PTEN基因抑制PI3K/Akt通路,从而抑制Survivin的表达;而在肿瘤细胞PTEN基因表达下调或缺失的异常情况下,PTEN对PI3K/Akt通路的抑制作用减弱,Survivin表达上调,促进细胞分裂与增殖,抑制细胞凋亡,促进肾癌的形成与恶性进展。
由于PTEN和Survivin基因在人体正常组织和肿瘤组织中表达水平的明显差异,使其成为基因靶向治疗的理想靶分子。因此,针对PTEN和Survivin基因的分子机制研究和靶向治疗策略已经成为肿瘤防治的重点领域。劳玲娟等[24]利用RNA干扰技术,降低直肠癌细胞株SW480的PTEN表达,可显著削弱白藜芦醇对体外SW480细胞的增殖抑制和凋亡诱导作用,证实PTEN在白藜芦醇发挥抗直肠癌效应中发挥了主导作用。在胃癌移植瘤模型中,利用Survivin显性负性突变体C84A,可以抑制胃癌瘤体生长,并可增强5-氟尿嘧啶对胃癌细胞的化疗效果[17]。这些研究表明,下调Survivin表达能阻抑肿瘤的发生、恶性发展,Survivin作为肿瘤抗原基因具有应用于肿瘤基因治疗的巨大潜力。
根治性肾切除术历来是针对肾癌的金标准手术方式。但是近年来,对于局限性肾癌患者,肾部分切除手术逐渐被接受和推崇。对于直径≤4.0 cm的肾脏肿瘤,实施保留肾单位的肾部分切除手术,其术后无瘤生存率和局部复发率与根治性肾切除手术有相似的效果。如何更好地确定保留肾部分切除术的安全手术边距成为众多外科医师极为关心的问题。我们的实验发现癌旁0.5~1.0 cm范围内的肾组织没有出现显著的PTEN基因表达下调及Survivin基因表达增加,这从分子学水平上提示,肾部分切除术的安全手术边距可以确定为肿瘤假包膜外0.5~1.0 cm范围肾组织。
总之,本实验检测到肾癌及癌旁组织的PTEN和Survivin 蛋白表达量有明显差异,两个基因分子可能共同促进了肾癌的发生与发展。虽然众学者的实验结果已经强烈提示了PTEN和Survivin 在肿瘤发生进展中的潜在相互作用机制,仍需进一步进行分子信号通路的研究,并进行动物模型实验进行验证。实验结果显示了PTEN和Survivin 作为免疫治疗靶分子的巨大潜力,并为保留肾单位的肾部分切除术确定安全手术边距提供了有力的实验依据。
1 Koike H,Nitta,Sekine Y,et al.YM155 reverses rapamycin resistance in renal cancer by decreasing survivin.J Cancer Res Clin Oncol,2014,140:1705-1713.
2 Xiong CH,Liu HP,Chen,ZX,et al.Prognostic role of survivin in renal cell carcinoma:A system review and meta-analysis.Eur J Intern Med,2016,33:102-107.
3 Li J,Yen C,Liam D,et al.PTEN,a putative protein tyrosine phosphates gene mutated in human brain,breast,and prostate cancer.Science,1997,275:1943-1947.
4 Cairns P,Evron E,Okami K,et al.Point mutation and homozygous deletion of PTEN/MMAC1 in primary bladder cancers.Oncogene,1998,16:3215-3218.
5 Shelake S,Sankpal UT,Bowman WP,et al.Targeting specificity protein 1 transcription factor and survivin using tolfenamic acid for inhibiting Ewing sarcoma cell growth.Invest New Drug,2017,35:158-165.
6 Chen P,Zhu J,Liu DY,et al.Over-expression of survivin and VEGF in small-cell lung cancer may predict the poorer prognosis.Med Oncol,2014,31:775.
7 Srivastava AK,Singh PK,Srivastava K,et al.Diagnostic role of survivin in urinary bladder cancer.Asian Pac J Cancer Prev,2013,14:81-85.
8 Esteva FJ,Guo H,Zhang S,et al.PTEN,PIK3CA,p-p70S6K status association with trastuzumab response and survival in patients with HER2-positive metastatic breast cancer.Am J Patho,2010,177:1647-1656.
9 Hollander MC,Blumenthal GM,Dennis PA,et al.PTEN loss in the continuum of common cancers,rare syndromes and mouse models.Nat Rev Cancer,2011,11:289-301.
10 Bronisz A,Godlewski J,Wallace JA,et al.Reprogramming of the tumour microenvironment by stromal PTEN-regulated miR-320.Nat Cell Biol,2011,14:159-167.
11 John JK,Paraiso KH,Rebecca VW,et al.GSK3β inhibition blocks melanoma cell/host interactions by downregulating N-cadherin expression and decreasing FAK phosphorylation.J Invest Dermatol,2012,132:2818-2827.
12 Roy S,Yu Y,Padhye SB,et al.Difluorinated-Curcumin (CDF)restores PTEN epression in colon cancer cells by downregulating miR-21.PloS One,2013,8:e68543.
13 Gai WT,Yu DP,Wang XS,et al.Anti-cancer effect of ursolic acidactivates apoptosis through ROCK/PTEN mediated mitochondrial translocation of cofilin-1 in prostate cancer.Oncol Lett,2016,12:2885.
14 Schneider E,Keppler R,Prawitt D,et al.Migration of renaltumor cellsdepends on dephosphorylation of Shcby PTEN.Int J Oncol,2011,38:823-831.
15 Ambrosini G,Adida C,Altieri DC.A novel antiapoptosisgene,survivin,expressed in cancerand lymphoma.Nat Med,1997,3:917-921.
16 Sun B,Xu H,Zhang G,et al.Basic fibroblast growth factor upregulates survivin expression in hepatocellular carcinoma cells via aprotein kinase B-dependent pathway.Oncol Rep,2013,30:385-390.
17 Wang HS,Yang MS,Xu J,et al.Survivin mRNA-circulating tumor cells are associated with prostate cancer metastasis.Tumor Biol,2016,37:723-727.
18 殷海森,赵新颖,苏长青.以Survivin为靶标的肿瘤治疗策略.第二军医大学学报,2016,37:342-348.
19 Khan Z,Khan AA,Yadav H,et al.Survivin,a molecular target for therapeutic interventions in squamous cell carcinoma.Cell Mol Biol Lett,2017,22:1-32.
20 Wheatley SP.The functional repertoire of survivin’s tails.Cell Cycle,2015,14:261-268.
21 Fernandez JG,Rodriguez DA,Valenzuela M,et al.Survivin expression promotes VEGF-induced tumor angiogenesis via PI3K/Akt enhanced β-catenin/TCF-Lef dependent transcription.Mol Cancer,2014,13:209.
22 Wise HM,Hermida MA.Leslie NR.Prostate cancer,PI3K,PTEN and prognosis.Clinical Science,2017,131:197-210.
23 Carter BZ,Milella M,Altieri DC,et al.Cytokine-regulated expression of survivin myeloid leukemia.Blood,2001,97:2784-2790.
24 劳玲娟,宋新江,徐佳.PTEN在白藜芦醇对体外直肠癌细胞生长和凋亡的影响.中国中药杂志,2017,42:1730-1735.
25 Weng Y,Fei B,Chi AL,et al.Inhibition of gastric cancer cell growth in vivo by overexpression of adeno-associated virus-mediated survivin mutant C84A.Oncol Res,2013,20:411-417.
SignificanceofdifferentialexpressionofPTENandSurvivininhumanrenalclearcellcancer
XUZhili,ZHANGLihong,ZHANGYi,etal.
DepartmentofUrology,TheThirdHospitalofShijiazhuangCity,Shijiazhuang050011,China
ObjectiveTo investigate the differences of expressions of PTEN and Survivin in human renal clear cell cancer and tumor adjacent tissues,and to explore their application value in gene-targeted therapy and surgery.MethodsThe expression level of PTEN and Survivin protein in human renal clear cell cancer tissues,tumor adjacent tissues (0.5cm) and adjacent tissues (1.0cm) were detected by Western Blot,moreover, the differences of expressions of PTEN and Survivin were observed,and the correlation of expressions between PTEN and Survivin was analyzed.ResultsThe expression levels of PTEN protein in cancer tissues were significant lower than those in adjacent tissues of cancer (0.5cm) (1.482±0.320 vs 10.861±1.347,Plt;0.05) and lower than those in adjacent tissues of cancer (1.0cm) (1.482±0.320 vs 10.947±1.744,Plt;0.05). However there were no significant differences in the expression levels of PTEN protein between adjacent tissues of cancer (0.5cm) and adjacent tissues of cancer (1.0cm)(Pgt;0.05).The expression levels of Survivin in cancer tissues were significant higher than those in adjacent tissues of cancer (0.5cm) (17.113±3.367 vs 3.233±1.898,Plt;0.05) and higher than those in adjacent tissues of cancer (1.0cm) (17.113±3.367 vs 2.924±1.612,Plt;0.05). However there were no significant differences in the expression levels of Survivin between adjacent tissues of cance (0.5cm) and adjacent tissues of cancer (1.0cm)(Pgt;0.05).Besides the Pearson correlation analysis showed that the expression levels of PTEN protein were negatively correlated with those of Survivin protein in cancer tissues (r=-0.908,Plt;0.05).ConclusionPTEN and Survivin gene may jointly promote the pathogenesis and development of renal cancer,which has potential application and instruction value for gene-targeted therapy and surgery.
Survivin gene; PTEN gene;Western Blot; renal clear cell cancer
10.3969/j.issn.1002-7386.2017.24.002
项目来源:石家庄市科学技术研究与发展指导计划(编号:131462333)
050011 河北省石家庄市第三医院泌尿外科
R 737.11
A
1002-7386(2017)24-3689-05
2017-07-28)
