超声造影对颈动脉粥样硬化斑块内新生血管诊断试验Meta分析
2017-12-15吴平勇陈文卫胡伟孙彬陈辽黄星月黄鑫
吴平勇,陈文卫,胡伟,孙彬,陈辽,黄星月,黄鑫
超声造影对颈动脉粥样硬化斑块内新生血管诊断试验Meta分析
吴平勇1,陈文卫1,胡伟1,孙彬1,陈辽1,黄星月1,黄鑫1
目的研究超声造影用于颈动脉粥样硬化斑块诊断的精确性。方法计算机检索The Cochrane Library(2016年第3期)、EMbase及PubMed,收集采用超声造影与金标准(病理活检)比较诊断颈动脉粥样硬化斑块的诊断性试验,检索时限均为从1982年至2016年11月。由2位研究者根据纳入与排除标准独立筛选文献、提取资料,纳入研究包括斑块内新生血管的诊断与组织学标本的定量分析和/或发生斑块相关症状的目测比较,参数评价包括斑块和斑块超声造影定量超声强度及视觉分级;对敏感性(SEN)、特异性(SPE)、阳性似然比(+LR)、阴性似然比(-LR)、诊断比值比(DOR)进行异质性检验和合并分析。采用随机效应进行似然比、诊断比值比的Meta分析,并根据受试者工作曲线特征计算曲线下面积。结果最终纳入7个研究,507例患者,Meta分析结果显示:SEN合并=0.68,95%CI:0.63~0.73;SPE合并=0.78,95%CI:0.72~0.84;+LR=2.92,95%CI:1.60~5.33;-LR=0.34,95%CI:0.19~0.61;DOR合并=9.47,95%CI:3.33~26.95;AUC=0.8346。结论超声造影对颈动脉粥样硬化斑块有较高的敏感性、较高的特异性,可作为诊断颈动脉粥样硬化斑块有效可行的方法。
颈动脉粥样硬化斑块;斑块内新生血管;超声造影;诊断性试验;Meta分析
近年来有研究显示炎症反应、血管生成、脂质积累和血栓形成等病变,可能是动脉粥样硬化斑块产生及进一步发生病理生理改变最终致硬化斑块破裂的危险因素[1]。虽然无症状斑块重塑为易脆性斑块的确切机制目前尚不明确,但是在动脉粥样硬化斑块内出现新生毛细血管的现象被普遍认为是病程进展为脆性斑块并最终破裂的重要因素[2]。血管壁发生上述病理变化没有显著的特征性,相反,更容易被诊断为周围血管疾病。在临床实践中,通常选择颈动脉作为评估动脉粥样硬化斑块特征的检测路径,对于诊断颈动脉粥样硬化斑块的形成及导致的狭窄,B超和彩色多普勒检查是常用的检测手段。Feinstein[3]首次报道用超声造影检查识别颈动脉斑块内新生血管(IPN)的可行性。最近,多项研究[4-6]表明超声造影能明显改善(CEUS)CEUS显像效果。因为在检查过程中,造影剂产生的微气泡能增强IPN的信号强度,高质量的显像可以进行目测评判[7]。本文汇总CEUS相关的诊断方法及通过检测IPN判断疾病预后的相关研究,重点对CEUS诊断动脉粥样硬化斑块内新生血管的精确性进行了Meta分析。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 在国、内外正式刊物上公开发表关于CEUS诊断颈动脉粥样硬化斑块疾病的所有文献,均为随机对照研究,文种限中、英文。
1.1.2 研究对象 ①研究对象男女均可,性别不限;②研究人群进行了病理组织学检查或者伴有斑块相关的临床症状[8](如中风、短暂性脑缺血发作、或一过性黑朦等,时间界定:<12个月)或两者都有;③能获得彩色多普勒超声独立筛查颈动脉粥样硬化斑块的真阳性值(TP)、假阳性值(FP)、真阴性值(TN)及假阴性值(FN)等数据。
1.1.3 诊断方法进行包括同行评审研究,定量和定性的评价CEUS诊断IPN的准确性,待评价实验为CEUS(线型探头5~14 MHz)金标准为病理检查或发生斑块相关性临床症状。
1.1.4 结局指标 敏感性(SEN)、特异性(SPE)、阳性似然比(+LR)、阴性似然比(-LR)、诊断比值比(DOR)以及受试者工作特征(SROC)曲线下面积(AUC)。
1.1.5 排除标准 ①综述评论、新闻宣传和会议报告;②结局指标报道不全者;③测量指标方法无详细说明者;④同一篇文献多反重复发表者;⑤排除仅文题涉及超声和颈动脉粥样硬化斑块,而文献内容与超声诊断颈动脉粥样硬化斑块无关的文献。
1.2 检索方法
计算机检索Medline、EMBASE、The Cochrane Library(2016年第4期),收集CEUS诊断颈动脉粥样硬化斑块的随机对照研究,检索时间从数据库建库开始到2016年11月。英文检索词:carotid、contrast-enhanced carotid ultrasound、contrast-enhanced carotid US、CEUS、atherosclerotic plaque、intra-plaque neovascularization。未做手工检索。以Medline Data为例,具体检索策略见图1。
1.3 文献筛选与数据提取
1.3.1 文献筛选 根据已经制定的纳入与排除标准,由两名评价者阅读并筛选所有的标题和摘要,独立评价CEUS诊断IPN的定量研究或视觉分级的定性研究相关文献,两位评判者之间出现不一致时,将通过讨论解决,并由第三方介入评审,初步决定需纳入文献,然后评价全文,纳入符合标准的文献。
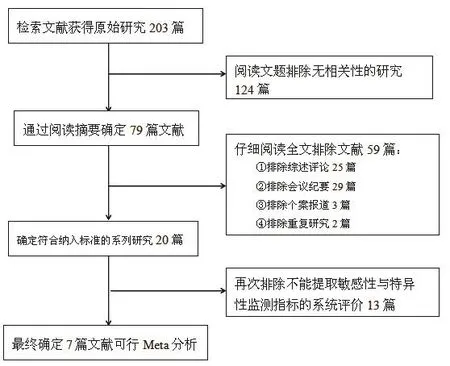
图1 文献筛选流程图
1.3.2 数据提取 ①设计数据提取表,根据研究目的确定需提取的内容:研究人群的特点、数量、纳入患者平均年龄、性别分布、临床心血管危险因素、冠状动脉疾病史、造影方法等。②提取TP、FP、TN、FN指标数据,计算SEN、SPE。SEN=TP/(TP+FN)、SPE=TN/(TN+FP)。③对纳入的每个研究,均由两位评论家背靠背地独立应用诊断性研究的质量评估工具进行纳入文献质量方法学评估。
1.4 文献质量评价
采用Cochrane协作网推荐的诊断试验性研究质量评价标准,该标准参考QUDAS[9]标准制定11项,结合本Meta分析的情况,对上述每条做出“是”、“否”或“不清楚”的判断,均由两位评审员独立完成。
1.5 统计学方法
采用I2检验及Cochrane-Q检验对各研究DOR结果进行异质性分析。I2<25%为低度异质性,I2<50%为中度异质性,I2>50%则存在高度异质性;若P<0.05则认定为研究间有统计学异质性,采用随机效应模型分析。P>0.05认定为研究间具同质性,采用固定效应模型分析;按照相应的效应模型,将各研究的诊断参数进行Logit变换,再按权重大小进行汇总。最后进行Logit变换得出加权汇总诊断参数及95%CI;采用Meta-Disc软件绘制SROC曲线,并计算AUC和Q*指数,Q*指数为SROC曲线与直线(SEN=SPE)相交处的敏感度,Q*指数越大,AUC越接近1,表示诊断试验的准确性和诊断价值越高[10]。在合并效应量中,如果存在阈值效应,即SROC曲线呈“肩臂状”分布,则使用分层综合受试者工作特征曲线法(HSROC)进行合并[11];如果不存在阈值效应,则用Meta-Disc软件直接绘制SROC曲线,计算AUC。
2 结果
2.1 文献检索结果
初检出相关文献203篇。经逐层筛选后,最终纳入7 篇文献[8,12-17],其中,有3项Shah[12]、Giannoni[14]、Iezzi[15]研究金标准为病理检查,4项Owen[8]、Huang[15]、Zhou[16]、Xiong[17]研究金标准为临床症状;2项研究Shah[12]造影剂为Optison或Zhou[16]造影剂为Definity,5项研究Xiong[13]、Giannoni[14]、Owen[8]、Huang[15]使用的造影剂为Sonovue;机械指数≤0.2研究有4项Shah[12]、Xiong[13]、Zhou[16]、Iezzi[17],>0.2的研究有3项Owen[8]、Huang[15]、Giannoni[16],研究文献检索流程及结果(图1)。
2.2 纳入研究的基本特征
最终纳入7项研究中共有507例患者,其中,男性340例,女性167例,平均年龄62~70岁。疾病类型:心脑血管病患者280例,其中伴斑块厚度>2 mm的患者104例,缺血性脑卒中患者176例;颈动脉狭窄>30%的患者227例,其中狭窄>30%的患者190例;所有患者伴发其他疾病见表1。
2.3 文献纳入方法学质量评价
7个纳入研究中,1篇[17]满足11条标准,5篇[8,12,13,15,16]达到10条标准,1篇[14]满足9条标准。因此,纳入的7篇文献能完全代表所研究疾病,表明接受检查的研究对象人群代表性较好,发生疾病谱偏倚的可能性较小。7篇文献两方法间检测时间间隔短,发生疾病进展偏倚的可能性小,所有文献试验组均接受了金标准试验,表明无多重参照偏倚发生的可能。另外,所有文献均清楚描述CEUS的结果判读是在不知晓金标准试验结果的情况下进行,提示对诊断性试验判读偏倚是否会发生描述清楚。7篇文献[8,12-17]均对结果进行了描述(表2)。
2.4 Meta分析结果
在本研究中,Meta-Disc 1.4软件输出的SROC 曲线不呈“肩臂”状分布,且Spearman相关系数=0.148,P=0.751,提示SEN与1-SPE呈阴性相关,不存在阈值效应;对其他来源进行异质性检验结果为:各研究结果间SPE(χ2=23.10,P=0.0008,I2=74.0%)、SEN(χ2=79.31,P=0.0000,I2=92.4%),DOR(Cochran-Q=24.05,P=0.005)。鉴于文献间存在显著的异质性,采用随机效应模型进行Meta 分析结果显示SPE合并=0.78,95%CI:0.72~0.84;SEN合并=0.68,95%CI:0.63~0.73;+LR=2.92,95%CI:1.60~5.33;-LR=0.34,95%CI:0.19~0.61;DOR合并=9.47,95%CI:3.33~26.95;AUC=0.8346。基于亚组分析诊断比值比与异质性结果,见表3。将每个研究逐一排除后进行敏感性分析,结果显示SEN合并和SPE合并未见明显改变,说明结果的稳定性较好(图2~7)。
3 讨论
3.1 颈动脉粥样硬化斑块检查方法
颈总动脉、颈动脉分叉和颈内动脉进行动脉粥样硬化斑块的定义为内膜中层厚度>1.2 mm[18]。彩色多普勒超声检查虽然是早期发现、早期诊断和鉴别颈动脉粥样硬化斑块的有效检查手段之一,灰阶超声能较准确地显示斑块的大小、形态、边界、内部回声、后方有无衰减、侧方有无声影、纵横比,另外彩色血流显像可以观察肿块内部及周边有无血流信号,确定血流信号的强度及分布情况,并进行多血管、多部位取样,对取得的脉冲多普勒进行分析,但由于混响存在和分辨力的限制,有时诸多部位与组织例如心内膜显示模糊,无法显示小血管,则应结合超声造影来增强病灶显示协助诊断。
超声造影剂最初被批准用于技术上存在困难的患者, 例如增强心腔边界强度提高超声心动图图像的质量。这些化合物有薄而柔软的超薄壳外膜,其内含高密度的惰性气体[19],可产生微气泡与血液内红细胞一起循环流动,并迅速通过肺循环代谢[20]。利用现代一应俱全的商业超声设备的超声成像策略,超声造影技术清晰地显示在组织内血管和微循环灌注影像成为可能。此应用程序已被用于区分正常与异常灌注心肌,以及描述类似像肿瘤或血栓的心室腔内肿块。相比在血栓内对比信号的缺失,与血管瘤中新生血管形成的对比信号显示得更为丰富,目前该设想已经应用到与动脉粥样硬化相关联的滋养层血管可视化检测与诊断领域,对其诊断准确性定量和定性的Meta分析结果也得到一致认同。
3.2 Meta分析的主要发现
在纳入的507例患者,结果显示:采用CEUS诊断颈动脉粥样硬化斑块的SEN为68%,SPE为78%,说明漏诊率为32%,误诊率22%。+LR为2.92>1,说明CEUS诊断颈动脉粥样硬化斑块为阳性时,有患颈动脉粥样硬化斑块的可能性;-LR为0.34<1,说明彩色CEUS诊断颈动脉粥样硬化斑块为阴性时,不能排除患颈动脉粥样硬化斑块可能性。AUC为0.8346,表明其诊断效能较高。OR为9.47,提示CEUS对鉴别粥样硬化斑块内新生血管具有较高的准确性。本研究结果也充分显示了在诊断人群中,CEUS的SEN变化范围不大(0.63~0.73),提示该诊断稳定性较好。
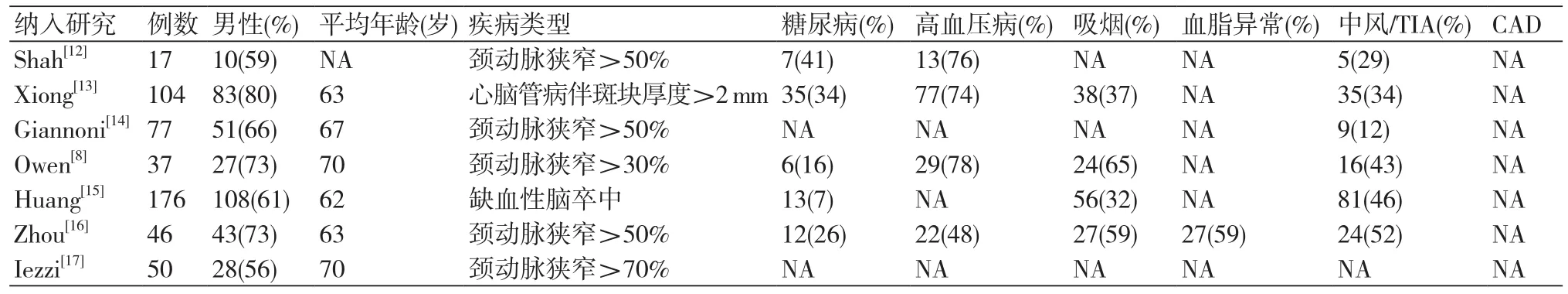
表1 纳入研究的基本特征
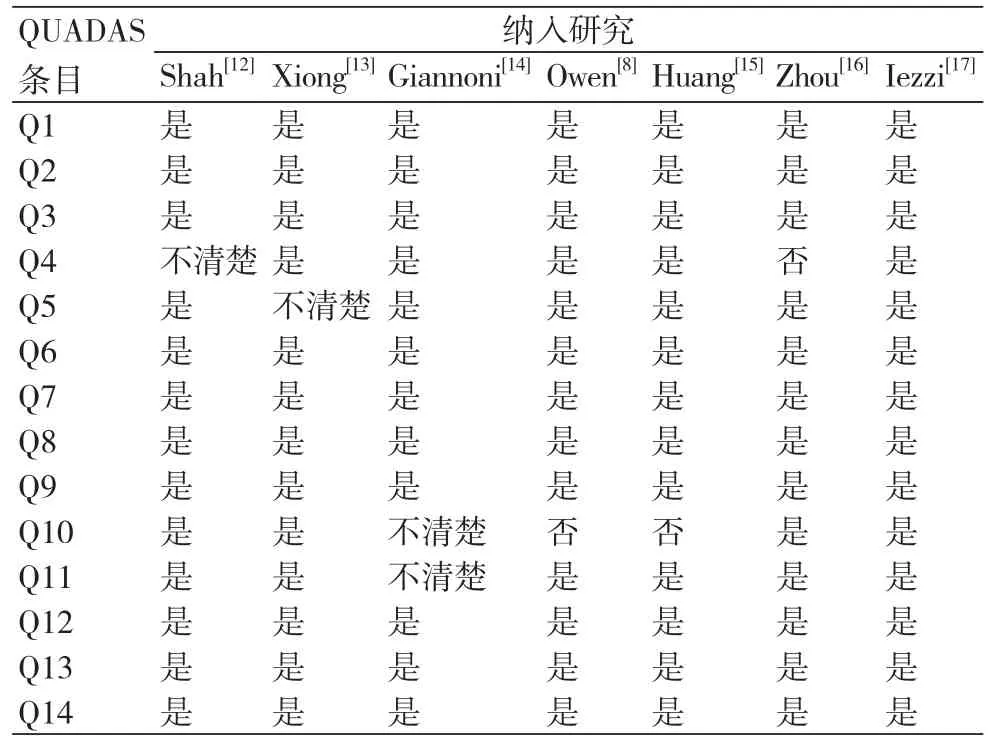
表2 纳入研究的方法学质量评价
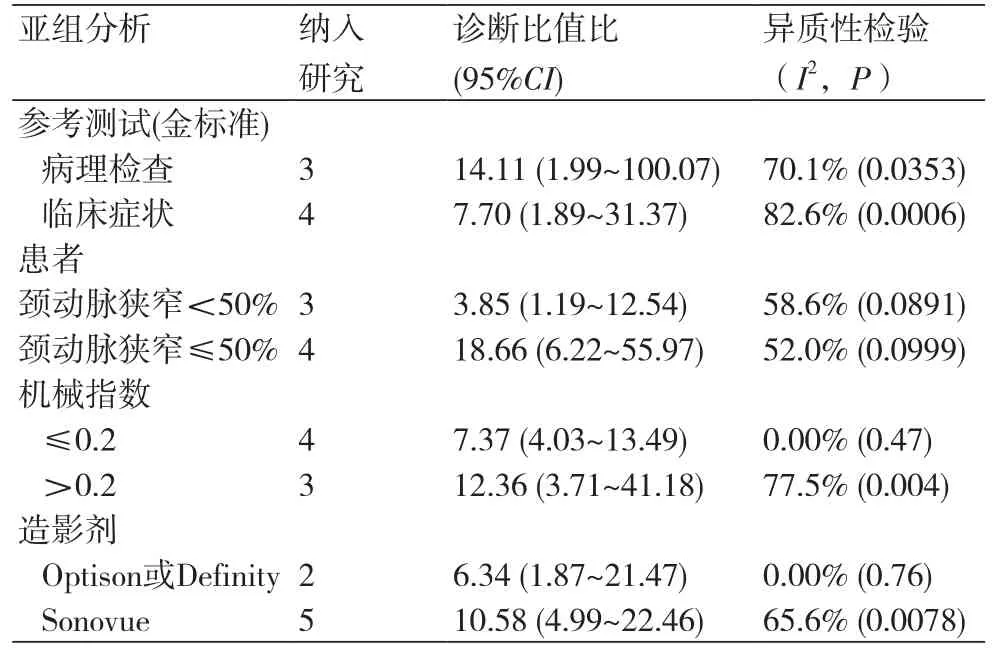
表3 Meta分析在研究方法论的差异汇总结表
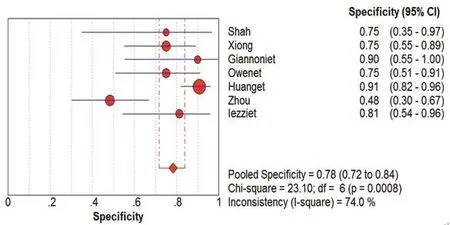
图2 CUES诊断颈动脉粥样硬化斑内新生血管SPE的Meta分析
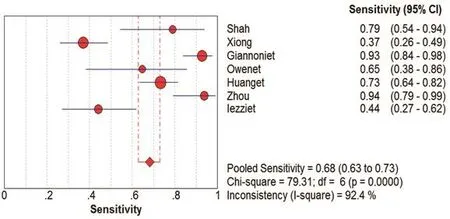
图3 CUES诊断颈动脉粥样硬化斑内新生血管SEN的Meta分析
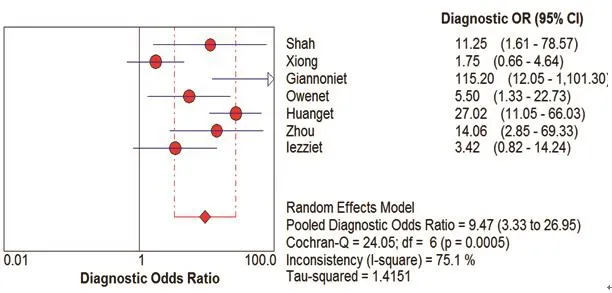
图4 CUES诊断颈动脉粥样硬化斑内新生血管DOR的Meta分析
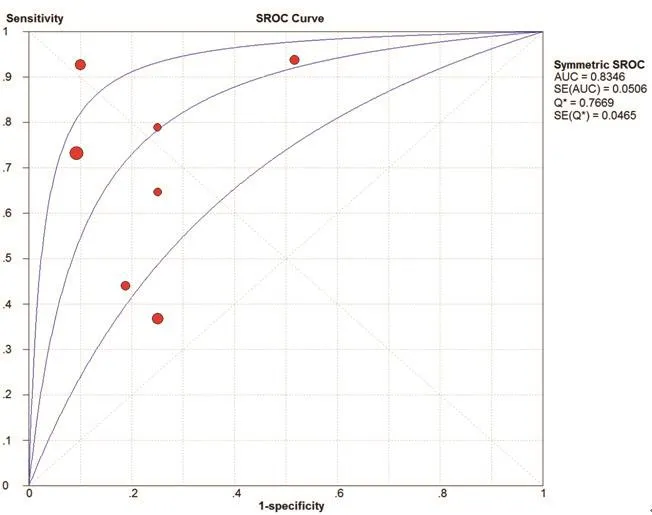
图5 纳入研究的SROC曲线
本次Meta分析中,CEUS诊断动脉粥样硬化斑块存在一定漏诊率(32%)和误诊率(22%),提示CEUS定量方法存在一定的局限性:①在斑块的流量通常是由离散的移动微气泡间歇性出现反映,而不是像在大血管内连续大量的灌注,CEUS定量比较困难或不准确;②由于颈动脉搏动和呼吸动作将导致斑块体表位置不断改变,造成参数测量不准确;③当目标血管因为动脉搏动或患者呼吸时,强烈的微气泡信号从颈动脉管腔内,可能被无选择地采集成反映直接相邻斑块的映射信号。由于空间异质性衰减效应[21],时间强度曲线分析也可能是有限的,是由非均匀的组织分布或探头和皮肤间的不均匀接触引起的,然而,该半自动软件的进一步成熟有可能克服这些限制。最近,新的计算机辅助定量软件衰减校正、最大强度投影、运动补偿技术已发展到能实现斑块灌注可靠和重复性试验等分析[22,23]。定量方法可能是对IPN变化更有用的串行的比较,特别是在对IPN的进展药物干预的疗效评价。
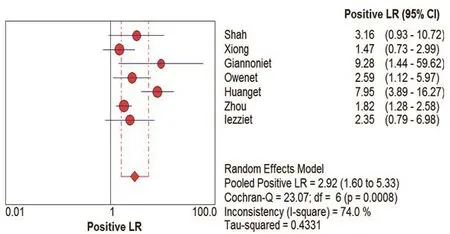
图6 CUES诊断颈动脉粥样硬化斑内新生血管+LR的Meta分析

图7 CUES诊断颈动脉粥样硬化斑内新生血管-LR的Meta分析
由于纳入7项研究间有轻—中度的异质性,根据颈动脉狭窄程度、机械指数、造影剂进行亚组分析(表3),结果显示研究间的异质性与下列因素相关:①颈动脉狭窄程度;②使用不同的造影剂;③使用不同的机械指数值。上述这些结果提示超声造影需要提高试验方法的标准化以确保可靠性和可重复性,只有这样才能切实有效地整合到临床实践中。显然,统一、规范超声造影方法对颈动脉粥样硬化斑块新生血管诊断很有必要。针对此类现象,可考虑采用以下基本策略:首先,获得基线B型超声颈动脉图像(在颈动脉球远端的1.5 cm处),以确定斑块的存在。其次,当静脉滴注或缓慢手推注)造影剂时,建议使用低的机械指数(0.17~0.20)生成颈动脉影像,同时数字化采集和存储实时增强纵向和短轴颈动脉超声造影录像。第三、定性评估造影剂可能出现的位置和强度等级(G评分系统[24]或VV评分系统[25])。
3.3 本研究的优势与局限性
本项Meta分析是有限使用病理组织学或临床症状作为对比标准的参考测试,样本选择可能存在偏倚,其中包括组织学样本之间的差异和超声图像选择的切面差异,以及两者之间微血管的解剖和灌注状况不同均可降低组织标本和CEUS之间的检测结果的相关性;第二,新生血管不仅在颈动脉内膜切除术证实有明显狭窄斑块中发现,且在没有明显生理学狭窄的斑块中也可检测到新生血管。因此,临床事件作为主要结局指标可能是未来优先研究的热点。本研究对作为组织学和临床诊断的“对比试验”进行了亚组分析,两组的DOR存在中度的异质性,一方面,因斑块所产生明显的临床症状或无症状取决于是否在最近的一项临床脑血管事件中形成新生血管。它被认定是颈动脉斑块病变导致临床事件发生的主要诱因。然而,在有症状组的一些脑血管事件可继发于无心脑血管疾病,因为这些患者没有发现颈动脉斑块形成。另一方面,大部分无症状伴有斑块的患者,其影像图谱上显示有丰富的新生血管形成,但未引起神经系统症状,提示斑块内新生血管形成与临床症状之间无明显的因果关系。此外,由于操作者经验和技巧对超声诊断结果具有一定的影响,这是超声检查的局限性之一。CEUS对颈动脉粥样硬化斑块诊断准确性尚需更多高质量的前瞻性多中心研究进一步验证。
3.4 临床意义和未来研究方向
现有研究证实CEUS诊断IPN敏感性和特异性都较高。然而,需考虑以下影响因素:首先,有研究[26]表明CUES检查过程中超声束会发生非线性传播。这种现象随造影剂量增加将更明显,并且取决于血管内造影剂的浓度及气泡的大小。因此,确保斑块内新生血管显像质量最优方案是病灶内保持较低浓度小微泡。Nakamura等[27]随机选择20例患者,在收缩期和舒张末期阶段心电门控序列帧之间比较目标区域斑块灰度变化,结果发现没有两帧之间灰度等级没有变化,表明循环变化所产生的运动伪影对定量评价的影响最小。Iezzi[17]等发现,两种改进的诊断性能和更大的定量对比度增强趋势是通过增加造影剂剂量来实现。第二,有限的检测在高对比度增强和伴随着相关的声学阴影的钙化斑块可能会干扰阳性研究结果。建议使用多维度超声切面,可以避免伪影从而提高诊断正确率。Gourineni等[28]最近三维超声造影的初步研究中,利用四维探头、使用新型半自动图像分析算法来区分管腔、血管腔内斑块、斑块内血管后,最终获得了颈动脉和斑块的容积成像,证实了CEUS检测斑块内血管强度与磁共振检测及计算机断层扫描结果高度一致。在未来,三维对比颈动脉图像将有可能成为检测和分析粥样硬化斑块新生血管的首选方法,而不仅仅是单一的切面。最后,目前超过一半的研究选择明显的颈动脉狭窄或最厚的斑块为研究目标,但最厚的斑块可能不是主要致病因素。
综上所述, CEUS对诊断颈动脉粥样硬化斑块新生血管更有优势,伴随着三维容积成像及计算机辅助成像等现代新技术的进一步发展和联合应用,颈动脉粥样硬化斑块的诊断准确性将会逐渐提高、其治疗及预后评估也会更加完善。
[1]Jaipersad AS,Shantsila A,Silverman S,et al. Evaluation of carotid plaque neovascularization using contrast ultrasound[J]. Angiology,2013,64(6):447-50.
[2]Narula J,Nakano M,Virmani R,et al. Histopathologic characteristics of atherosclerotic coronary disease and implications of the findings for the invasive and noninvasive detection of vulnerable plaques[J]. J Am CollCardiol,2013,61(10):1041-51.
[3]Feinstein SB. Contrast ultrasound imaging of the carotid artery vasa vasorum and atherosclerotic plaque neovascularization[J]. J Am Coll Cardiol,2006,48(2):236-43.
[4]Caplice NM, Martin K. Contrast enhanced ultrasound and the enigma of plaque neovascularization[J]. JACC Cardiovasc Imaging,2010,3(12):1273-5.
[5]Staub D,Patel MB,Tibrewala A,et al. Vasa vasorum and plaque neovascularization on contrast-enhanced carotid ultrasound imaging correlates with cardiovascular disease and past cardiovascular events[J]. Stroke,2010,41(1):41-7.
[6]Hoogi A,Adam D,Hoffman A,et al. Carotid plaque vulnerability:quantification of neovascularization on contrast enhanced ultrasound with histopathologic correlation[J]. AJR Am J Roentgenol,2011,196(2):431-6.
[7]Xiong L,Deng YB,Zhu Y,et al. Correlation of carotid plaque neovascularization detected by using contrast enhanced US with clinical symptoms[J]. Radiology,2009,251(2):583-9.
[8]Owen DR,Shalhoub J,Miller S,et al. Inflammation within carotid atherosclerotic plaque: assessment with late-phase contrast enhanced US[J]. Radiology,2010,255(2):638-44.
[9]Penny W,Anne WR,Johannes BR,et al. The development QUADAS:a tool for the quality assessment of diagnostic accuracy included in systematic reviews[J]. Chin J Evid Based Med,2007,7(4):296-306.
[10]Habel LA,Capra AM,Oestreicher N,et al. Mammographic density in a multiethnic cohort[J]. Menopause,2007,14(5):891-9.
[11]Rutter CM,Gatsonis CA. A hierarchical regression approach to meta-analysis of diagnostic test accuracy evaluations[J]. Stat Med,2001,20(19):2865-84.
[12]Shah F,Balan P,Weinberg M,et al. Contrast enhanced ultrasound imaging of atherosclerotic carotid plaque neovascularization: a new surrogate marker of atherosclerosis[J]? VascMed,2007,12(4):291-7.
[13]Xiong L,Deng YB,Zhu Y,et al. Correlation of carotid plaque neovascularization detected by using contrast-enhanced US with clinical symptoms[J]. Radiology,2009,251(2):583-9.
[14]Giannoni MF,Vicenzini E,Citone M,et al. Contrast carotid ultrasound for the detection of unstable plaques with neoangiogenesis: a pilot study[J]. Eur J Vasc Endovasc Surg,2009,37(6):722-7.
[15]Huang PT,Chen CC,Aronow WS,et al. Assessment of neovascularization within carotid plaques in patients with ischemic stroke[J]. World J Cardiol,2010,2(4):89-97.
[16]Zhou Y,Xing Y,Li Y,et al. An assessment of the vulnerability of carotid plaques: a comparative study between intra-plaque neovascularization and plaque echogenicity[J]. BMC Medical Imaging,2013,13:13.
[17]Iezzi R,Petrone G,Ferrante A,et al. The role of contrast enhanced ultrasound (CEUS) in visualizing atherosclerotic carotid plaque vulnerability: which injection protocol? Which scanning technique[J]?Eur J Radiol,2015,84(5):865-71.
[18]Salcuni M,Di Lazzaro V,Di Stasi C,et al. The role of Doppler US in the study of carotid system[J]. J Rays,1995,20(4):406-25.
[19]Schneider M,Arditi M,Barrau MB,et al. BR1: a new ultrasonographic contrast agent based on sulfur hexafluoride-filled microbubbles[J].Invest Radiol,1995,30(8):451-7.
[20]Bokor D. Diagnostic efficacy of SonoVue[J]. Am J Cardiol,2000,86(4A):19G-24G.
[21]Thapar A,Shalhoub J,Averkiou M,et al. Dose-dependent artifact in the far wall of the carotid artery at dynamic contrast-enhanced US[J].Radiology,2012,262(2):672-9.
[22]Cheung WK,Gujral DM,Shah BN,et al. Attenuation correction and normalisation for quantification of contrast enhancement in ultrasound images of carotid arteries[J]. Ultrasound Med Biol,2015,41(7):1876-83.
[23]Akkus Z,Hoogi A,Renaud G,et al. New quantification methods for carotid intra-plaque neovascularization using contrast enhanced ultrasound[J]. Ultrasound Med Biol,2014,40(1):25-36.
[24]Staub D,Partovi S,Schinkel AF,et al. Correlation of carotid artery atherosclerotic lesion echogenicity and severity at standard US with intra-plaque neovascularization detected at contrast-enhanced US[J].Radiology,2011,258:618-26.
[25]Staub D,Patel MB,Tibrewala A,et al. Vasa vasorum and plaque neovascularization on contrast-enhanced carotid ultrasound imaging correlates with cardiovascular disease and past cardiovascular events[J]. Stroke,2010,41(1):41-7.
[26]Ten Kate GL,Renaud GG,Akkus Z,et al. Far-wall pseudo enhancement during contrast enhanced ultrasound of the carotid arteries: clinical description and in vitro reproduction[J]. Ultrasound Med Biol,2012,38:593-600.
[27]Nakamura J,Nakamura T,Deyama J,et al. Assessment of carotid plaque neovascularization using quantitative analysis of contrast enhanced ultrasound imaging is useful for risk stratification in patients with coronary artery disease[J]. Int J Cardiol,2015,195:113-9.
[28]Gourineni V,Saha S,CaoK,et al. Abstract 17471: 3D Contrast enhanced ultrasound (CEUS) Imaging of Carotid Artery Plaques and Intra-plaque Angiogenesis[J]. Circulation,2014,130:A17471.
The role of carotid atherosclerotic plaque neovascularization in the indicator of plaque vulnerability:a meta-analysis
Wu Pingyong*, Chen Wenwei, Hu Wei, Sun Bin, Chen Liao, Huang Xingyue, Huang Xin.
*Department of ultrasound, Ren-min Hospital, Wuhan Medical University, Wuhan 200433, China.
Corresponding author: Chen Weiwen, Email: pingyong71@163.com
ObjectiveTo study the clinical value of contrast enhanced ultrasound (CEUS) for diagnosing carotid atherosclerotic plaque.MethodsWe searched the databases including The Cochrane Library (Issue 3, 2016), EMbase,PubMed for diagnostic tests on carotid atherosclerotic plaque diagnosed with CEUS vs. with pathological biopsy or systemic (golden standard) from 1982 to the November, 2016. Two reviewers independently screened literature according to the inclusion and exclusion criteria, extracted data, and assessed the methodological quality of the included studies according to (Quality Assessment of Diagnostic Accuracy Studies, QUADAS) items. The Meta-DiSc software (version 1.4) was used to conduct pooling on sensitivity, specificity, positive likelihood radio, and negative likelihood radio. Heterogeneity test was performed and the summary receiver operating characteristic curve (SROC) was drawn for area under the curve (AUC). ResultsA total of 7 studies involving 507 patients were included. The results of meta-analysis showed that, SEN, SPE, +LR, -LR and DOR were (0.68, 95%CI: 0.63~0.73), (0.78, 95%CI: 0.72~0.84),(3.16, 95%CI: 0.93~10.72), (0.34, 95%CI: 0.19~0.61) and (9.47, 95%CI: 3.33~26.95), respectively. The AUC of SROC curve was 0.8346.ConclusionCurrent evidence shows that CEUS is a promising noninvasive diagnostic modality for detecting intra-plaque neovascularization. Standardization of quantitative analysis and visual grading classification is needed to increase reliability and reduce technical heterogeneity.
Carotid atherosclerotic plaque; Contrast enhanced ultrasound; Meta-analysis; Diagnostic test;Intra-plaque neovascularization
R543.5
A
1674-4055(2017)11-1310-06
1200433 武汉,武汉大学人民医院超声影像科
陈文卫,E-mail:pingyong71@163.com
10.3969/j.issn.1674-4055.2017.11.06
本文编辑;张超,姚雪莉
