不锈钢中铬在氢和氯离子作用下的腐蚀反应机理
2017-12-14,,,
,, ,
(上海出入境检验检疫局,上海 200135)
不锈钢中铬在氢和氯离子作用下的腐蚀反应机理
龚思维,楚民生,周韵,郅惠博
(上海出入境检验检疫局,上海 200135)
0Cr18Ni9、1Cr13不锈钢是餐具常用的材料,通过试验建立了反应机理的反应体系,测定了在不同温度、酸度和盐浓度的溶液中铬的迁移量,应用化学动力学的理论,推导了反应机理,计算了反应速率常数。
不锈钢;铬;腐蚀;反应机理;反应速率常数
不锈钢材料由于“不锈”的特性,近百年来,被广泛地应用在各行各业,尤其在与人的身体有密切接触的行业,如:餐饮食品行业——不锈钢的餐具、容器和食品加工机械;医药行业——不锈钢的医疗器具、植入人身体的不锈钢辅助性器具、制药设备;体育运动行业——不锈钢的运动器械等。但是,不锈钢材料并不是真正“不锈”的材料,随着使用时间的延长,铬、镍、锰等元素会在人的体液、汗液及餐饮食品佐料的作用下从不锈钢上“迁移”出来,直接或间接进入人体,从而给人的健康带来危害[1-3]。
本工作通过试验,以典型的食品接触用不锈钢材料0Cr18Ni9、1Cr13为研究对象,获得了铬在水溶液中发生腐蚀反应的最主要诱因——氢离子、氯离子,并通过模拟不锈钢在这些化学成分作用下的反应,探讨了不锈钢中铬在氢、氯离子作用下发生反应的反应机理,求得其反应速率常数k。
1 试验
试验材料为0Cr18Ni9和1Cr13不锈钢板。将2种不锈钢板切割成尺寸为50 mm×100 mm的试片,用洗洁精洗净后,一级水漂洗,再用酒精棉擦拭,干燥后待用。
在1 kg一级水中,加入柠檬酸、柠檬酸三钠及氯化钠配制成不同含盐量(mNaCl=0.1、0.2、0.3、0.4、0.5、1.0、1.5、2.0 mol/kg)、不同pH (pH=2.00、2.50、3.00、3.50)的试验溶液。溶液pH由带温度补偿功能的pH计检测。柠檬酸及其盐、氯化钠均为优级纯试剂。
将试样置于试验溶液中不同时间后,采用Thermo iCAP 6000等离子体原子发射光谱仪(ICP-AES)、Agilent 7700等离子体质谱仪(ICP-MS)测定溶液中的铬含量。采用5 μg·g-1铬(III)标准储备液用于ICP-MS测量;采用500 μg·g-1铬(III)标准储备液用于ICP-AES测量。
2 结果与讨论
2.1 1Cr13试样
1Cr13不锈钢在现行国家标准[4]被重新定牌号为12Cr13,又称410不锈钢。由图1可见:当溶液中NaCl质量摩尔浓度为2 mol/kg时,溶液中的铬离子量低于NaCl质量摩尔浓度为1.5 mol/kg时的。这是因为:当氯离子含量足够多时,溶液中大量的氯离子对试样表面铬络合离子的溶解(腐蚀)产生了阻碍作用(相对氢离子而言),过多的氯离子妨碍了氢离子与试样表面的有效接触,使得反应速率不能明显增加,随着时间的推移,溶入溶液中的铬总量有所下降;当氢离子的浓度下降时,相应现象也会出现,只是氯离子的浓度也相应会下降。
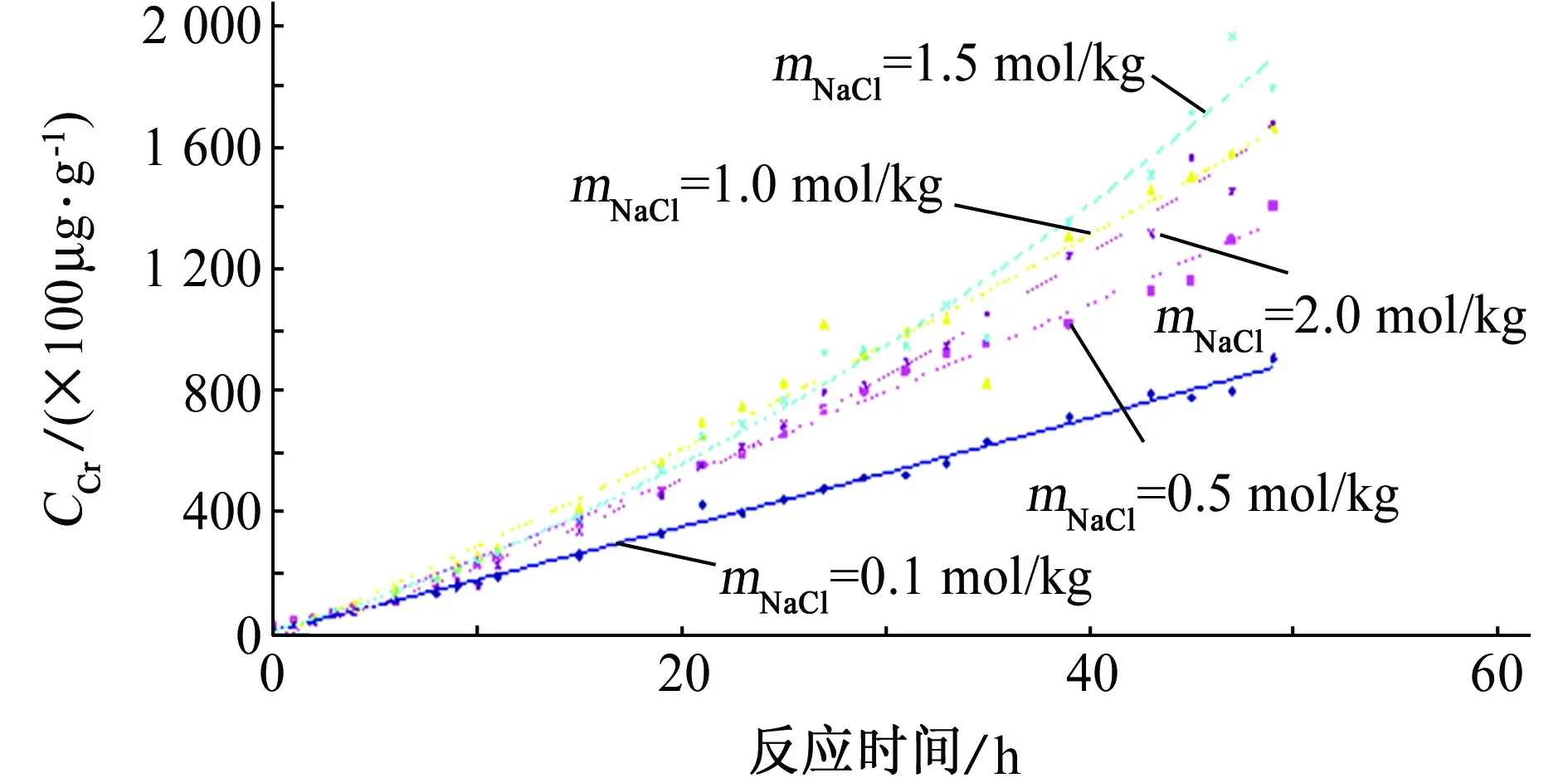
图1 1Cr13试样浸泡在含不同量NaCl的溶液中浸泡不同时间后,水中铬含量随时间的变化曲线(50 ℃,pH=2.00)Fig. 1 Cr content in water vs. time curves for 1Cr13 samples immersed in the solution containing different content of NaCl for different times (50 ℃,pH=2.00)
铬在含有氢离子、氯离子水溶液中的反应方程式为

按照化学动力学的理论[1],反应速率为
式中:c反应物为反应物浓度,c生成物为生成物浓度,t为反应时间,k为反应速率常数。
采用“拟一级”的方式——即固定一种离子的浓度,观察随另一种离子浓度变化,测量反应体系中铬的变化情况,见图1;对试验所得数据进行处理,铬的表观反应速率常数kobs列于表1中。
根据实际反应的特点,结合化学反应机理[2]和配位化学[3]的知识, 1Cr13试样中铬迁移到水溶液中的基元反应为



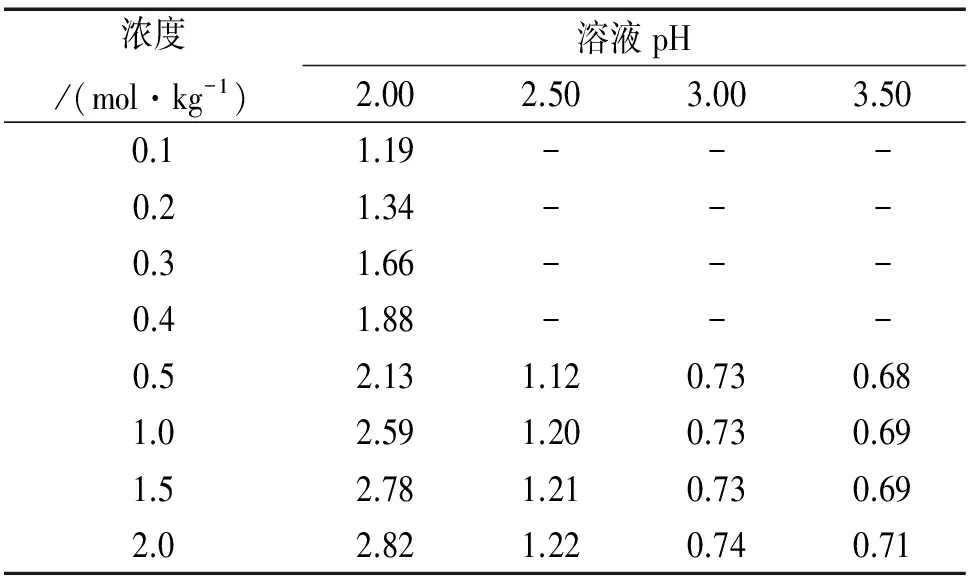
表1 铬的kobs×104 (50.0 ℃)Tab. 1 kobs×104 of Cr (50.0 ℃) mol·kg-1·h-1

按照金属键理论:金属的结构是由金属原子、金属离子和自由电子组成的,在一定的条件(例如:电压)下,金属中的自由电子会有规律地向一个方向运动。当不锈钢样品放入含有氢离子的水溶液中时,完全具备了形成原电池的条件,其电动势(电压)为
基元反应式(3),(4)是会发生的。对于基元反应式(5),有
随着水溶液酸度的变化,1Cr13试样中铬的反应速率随之变化,此试验验现象说明了基元反应式(5)是存在的。
当[Cl-]≥0.5 mol/kg时,不锈钢明显发生了腐蚀反应,这表明氯离子参与了反应,基元反应式(6)、(7)也确实发生了。
在氯离子浓度一定时,将kobs对氢离子浓度作图,得一直线,如图2所示。
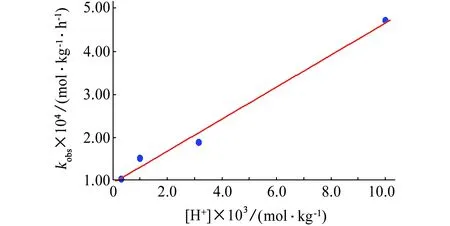
图2 kobs与mH+的关系图(60.0 ℃)Fig. 2 Relation of kobs with mH+ (60.0 ℃)
从图2中直线的斜率可求算基元反应(5)的反应速率常数k5。
将kobs对氯离子质量摩尔浓度(0.1~0.5 mol/kg)作图,得到一条直线,见图3所示。
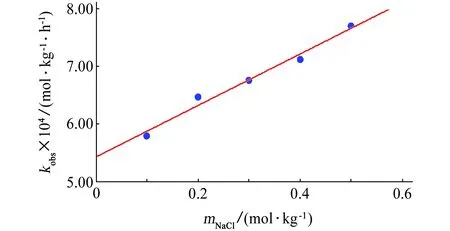
图3 kobs与mCl-的关系图示例(70.0 ℃)Fig. 3 Relation of kobs with mCl- (70.0 ℃)
同理,从图3中直线的斜率可求算基元反应(7)的反应速率常数k7。
表2汇总了各温度下基元反应(5)和(7)的反应速率常数k。

表2 410不锈钢的反应速率常数kTab. 2 Reaction rate constant k for 410 stainless steel
2.2 0Cr18Ni9试样
0Cr18Ni9不锈钢,在现行国家标准[4]中被重新定牌号为06Cr19Ni10,又称304不锈钢。304不锈钢具有非常优异的耐蚀性,被广泛应用于各行各业,尤其应用在高温条件下,如:食品加工、制药及日常家庭的烹饪。由于304强大的耐蚀性,在50,60 ℃时,溶液中的铬量随时间的变化如图4所示,数据无法进行计算;只有在70 ℃和pH≤1.00的条件下,由ICP-MS获得的数据作图,相似于图1,可用来计算反应速率常数k,见表3。
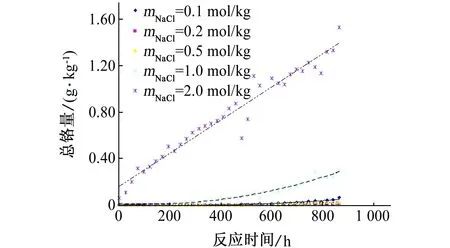
图4 0Cr18Ni9试样浸泡在含不同量NaCl的溶液中不同时间后,水中铬量随时间的变化曲线(50, 60 ℃,pH=2)Fig. 4 Cr content in water vs. time curves for 0Cr18Ni9 samples immersed in the solution containing different content of NaCl for different times (50, 60 ℃, pH=2.00)
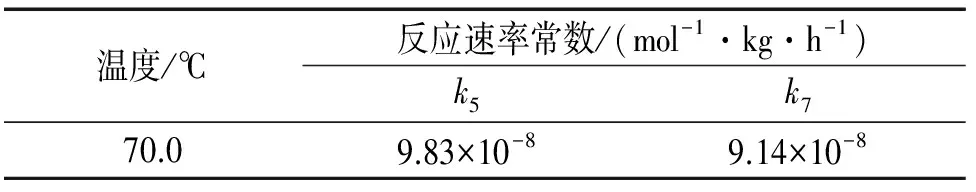
表3 304不锈钢的反应速率常数kTab. 3 Reaction rate constant k for 304 stainless steel
3 结论
在相同条件(温度)下,比较了304不锈钢与410不锈钢的反应速率常数k,可以定量地用数据来描述不锈钢材料的腐蚀或防腐蚀性能。简单而言,304不锈钢的腐蚀速率约是410不锈钢的万分之一,即304不锈钢的耐蚀性更加好。
[1] 傅献彩,沈文霞,姚天扬. 物理化学[M]. 北京:高等教育出版社,2005.
[2] 张华麟. 无机反应机理[M]. 上海:上海科学技术出版社,1989.
[3] 杨帆,林纪筠,单永奎. 配位化学[M]. 上海:华东师范大学出版社,2009.
[4] GB/T 20878-2007 不锈钢和耐热钢 牌号及化学成分[S].
ReactionMechanismforCrinStainlessSteelCorrodedbyHydrogenandChlorideIon
GONG Siwei, CHU Mingsheng, ZHOU Yun, ZHI Huibo
(Shanghai Entry-Exit Inspection and Quarantine Bureau, Shanghai 200135, China)
0Cr18Ni9 and 1Cr13 stainless steels are typical materials for cutlery. A reaction system for studying the reaction mechanism was built. Cr concentration was determined at different temperatures, different acidity and different NaCl concentrations. Using the theory of chemical kinetics, the reaction mechanism was derived, the reaction rate constants were calculated.
stainless steel; chromium; corrosion; reaction mechanism; reaction rate constant
10.11973/fsyfh-201711012
2017-05-26
国家质量监督检验检疫总局科研项目(2016IK224)
龚思维(1962-),高级工程师,从事化学反应的反应机理的相关研究工作,gongsiwei@sina.com
TG172
A
1005-748X(2017)11-0877-03
