Raney Ni催化碱性硼氢化钠溶液水解制氢
2017-12-14魏磊马麦霞付君宇高静董晓龙魏丕叶
魏磊,马麦霞,付君宇,高静,董晓龙,魏丕叶
Raney Ni催化碱性硼氢化钠溶液水解制氢
魏磊,马麦霞,付君宇,高静,董晓龙,魏丕叶
(廊坊师范学院化学与材料科学学院,河北廊坊 065000)
以NiAl合金粉末为原料,经浓碱溶液处理后制得Raney Ni催化剂,并用于催化碱性硼氢化钠溶液水解制氢。通过场发射扫描电子显微镜和氮气吸附/脱附法对催化剂微观物理结构进行表征,考察了硼氢化钠溶液组成、反应温度、催化剂用量和循环使用对体系产氢速率的影响。研究结果表明,当硼氢化钠和氢氧化钠质量分数分别为15%和10%时,产氢速率达到1085mL/(min·g)(25℃);相应表观活化能为38.6kJ/mol;催化剂用量与单位时间内氢产量成线性关系。循环测试结果表明,经过4次重复使用后,产氢速率降低78%,其原因主要在于硼化物的累积和镍的氧化。
制氢;Raney Ni;硼氢化钠;水解;催化
作为一种洁净、高效的新型能源,氢能的开发和利用在能源与环境问题日益突显的今天尤为重要。随着氢燃料电池的不断商业化应用,一个“氢经济”时代即将到来[1-2]。氢气作为能量载体,属于二次能源,需要从烃类、醇类、氨、化学氢化物中获得,如天然气重整、甲醇水蒸气重整、氨分解、肼分解、水电解等[3]。
目前,化学氢化物类储氢材料及相关制氢技术的研究较为普遍。硼氢化钠(NaBH4)的储氢密度高达10.6%,是一种理性的储氢材料,其储氢密度已高于美国能源部对车载能源系统储氢密度7.5%的标准[4-5]。通常情况下,以硼氢化钠碱性溶液为储氢介质,并在催化剂的作用下能够实现常温反应和可控制氢,反应方程式为式(1)。

其副产物偏硼酸钠可回收利用合成硼氢化钠,反应产氢纯度高,无其他杂质气体,可直接供应质子交换膜燃料电池(PEMFC)[6-7]。OH等[8]利用硼氢化钠制氢技术为200W PEMFC供氢。MINKINA等[9]同样采用硼氢化钠水解放氢原理设计开发了具有1.5m3/h产能的氢气发生系统,并为巴拉德PEMFC NexaTM模块供氢。
BRACK等[10]对硼氢化钠水解放氢所用均相和非均相催化剂进行了较为详尽的综述。目前,研究者们更倾向于对非均相金属催化剂的开发和应 用[11]。Pt、Ru等贵金属催化活性虽高,但高昂的成本限制了其大规模应用。非贵金属催化剂中以Co基、Ni基催化剂为代表,对硼氢化钠水解过程表现出优异的催化活性。Raney Ni是一种常见的工业催化剂,通过对NiAl合金粉末进行碱处理脱铝而制得比表面积大、金属活性位多的骨架镍材料。它在催化脱氢方面活性高,成本较低,且方便易得。LIU等[12]对比了镍粉、钴粉、Co2B、Ni2B、Raney Ni和Raney Co等对硼氢化钠水解反应的催化效果,发现Raney Ni性能最佳。
本工作以市售NiAl合金粉末为原料,采用碱蚀的手段脱除合金中的铝,进而获得Raney Ni催化剂。通过扫描电子显微镜和氮气吸附/脱附法对催化剂的微观物理结构进行表征。将所制催化剂应用于硼氢化钠水解制氢反应,考察反应液组成、反应温度、催化剂用量、循环使用对氢气产生速率的影响,以确定催化剂的最佳工作条件。
1 实验部分
1.1 Raney Ni催化剂的制备
NiAl合金粉末购于济南福景化工有限公司。硼氢化钠(NaBH4,AR)、氢氧化钠(NaOH,AR)购于国药集团化学试剂有限公司。去离子水为实验室自制,电阻率大于18MW·cm。称取一定质量的合金粉末置于过量的饱和NaOH溶液中,70℃下持续反应直至无气体产生。对产物反复水洗至中性,60℃下真空干燥5h后得Raney Ni催化剂。
1.2 催化剂表征与性能测试
采用场发射扫描电子显微镜(FESEM,SUPRA 55 ZEISS)对催化剂表面微观形貌进行分析,加速电压为2.0kV。根据氮气吸附/脱附原理,借助Kubo-X1000型比表面及孔径分析仪对催化剂比表面积与孔径分布进行测定。通过X射线光电子能谱仪(XPS,ESCALAB 250Xi Thermo Fisher)对催化剂表面元素成分及化学价态进行分析。
准确称取Raney Ni 0.03g,在一定温度下催化10mL碱性硼氢化钠溶液水解放氢,并采用排水法记录氢气产量随时间的变化规律,测试装置如文献[13]所示。产氢速率()定义为单位时间内单位质量催化剂作用下反应体系中氢气的生成量。值借以评价催化剂在不同反应条件下的性能。
2 结果与讨论
2.1 催化剂微观结构分析
NiAl合金粉末与浓NaOH溶液反应后,所得Raney Ni催化剂微观形貌如图1所示。随机选取了粒径10mm左右的金属颗粒作为表征对象,对其局部进行放大后发现颗粒表面存在大量的纳米级孔洞[图1(b)],这显然是由于铝被脱除而造成的。此种纳米孔表面为催化反应提供了较大的有效面积和丰富的活性位点。
依据氮气吸附/脱附原理对所制备催化剂的比表面积和孔径分布进行了测定,具体结果见图2。Raney Ni催化剂的比表面积为31.5m2/g,平均孔径为4.17nm,属于介孔范围,且孔径分布较窄。

图1 所制备Raney Ni催化剂表面微观形貌
2.2 反应液组成对HGR的影响
通常情况下,催化剂性能和受反应液组成的影响较为明显,且存在某一最适组成。WANG等[14]通过化学镀法制备了Co-Ni-Mo-P/g-Al2O3催化碱性NaBH4溶液水解放氢,并考察了反应液组成对的影响,发现当NaBH4和NaOH质量分数分别为7%和10%时体系的最高,所制备催化剂性能最佳。JEONG等[15]和XIANG等[16]也都发现了类似的影响规律。
本工作首先固定反应液中NaOH质量分数为5%,考察了不同NaBH4质量分数(6%、10%、15%、20%)对的影响,具体结果如图3(a)所示。当硼氢化钠质量分数为6%时,体系的为610mL/(min·g),当其质量分数增至10%~20%时,有明显提升,说明在低的反应物质量分数下,催化剂尚存在未被利用的活性区域[14-17]。当NaBH4质量分数分别为10%、15%、20%时,对应体系的分别为848mL/(min·g)、860mL/(min·g)、833mL/(min·g),此范围内催化剂性能变化不明显,说明催化剂有效催化面积已被充分利用。由于液相黏度大、离子扩散阻力大、反应副产物吸附累积等问题的存在,继续增加NaBH4质量分数将无法获得更高的产氢速率[14-17]。在后续的研究中,反应液中硼氢化钠质量分数均固定为15%。

图2 氮气吸附/脱附曲线及孔径分布曲线
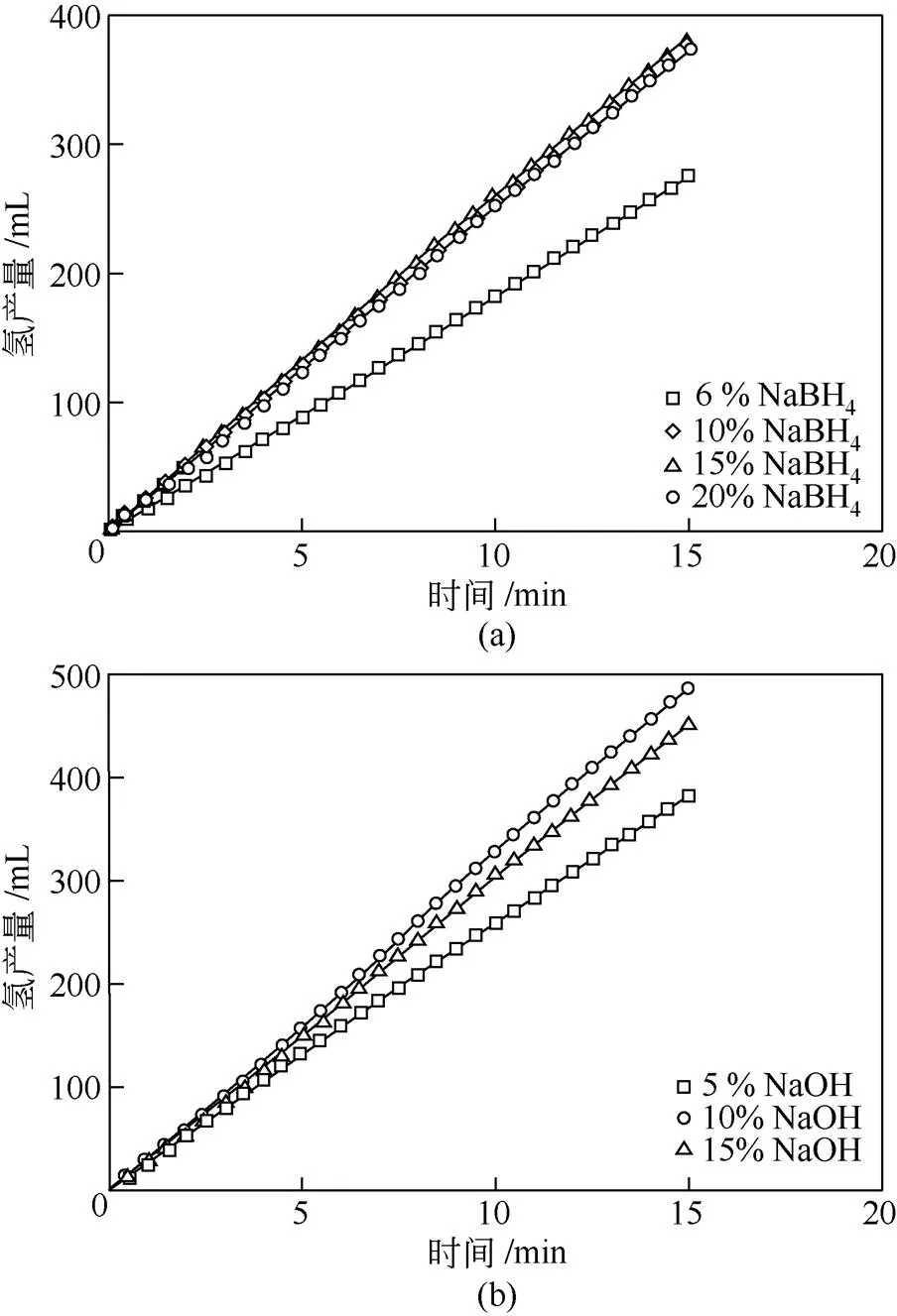
图3 NaBH4浓度和NaOH浓度对HGR的影响
(反应温度25℃)
图3(b)展示了反应液中不同NaOH质量分数(5%、10%、15%)对的影响。其中,当NaOH质量分数为10%时,体系的为1085mL/(min·g),高于其他浓度条件。WANG等[14]发现在一定浓度范围内,增加NaOH浓度对NaBH4水解过程有促进作用。李忠等[17]认为过高的NaOH浓度会降低反应副产物偏硼酸钠的溶解度,使其在催化剂表面析出,并占据活性位。综上,当NaBH4和NaOH质量分数分别为15%和10%时,体系的最高,催化剂性能最佳。在后续研究中均使用该组成的反应液。
2.3 反应温度对HGR的影响
图4展示了不同反应温度(25℃、30℃、35℃、40℃)对体系的影响规律。随着反应温度的提高,单位时间内氢气的生成量随之增大,说明升高温度有利于促进NaBH4水解速率,这与文献中的结果一致[13-17]。对数据点进行线性拟合得到,在25℃、30℃、35℃、40℃下,体系的分别为1085mL/(min·g)、1333mL/(min·g)、1855mL/(min·g)、2233mL/(min·g)。

图4 反应温度对HGR的影响
(反应液为15% NaBH4+ 10% NaOH)

图5 NaBH4水解反应表观活化能
NaBH4水解放氢反应的表观活化能(a)依据Arrhenius公式计算,如式(2)。
ln=ln0-a/(2)
式中,为反应速率,mL/(min·g);0为速率常数,L/(min·g);为气体常数,8.31J/(mol·K);为反应温度,K。
对ln和1000/进行拟合,结果如图5所示,计算得出表观活化能为38.6kJ/mol,明显小于Raney Co(53.7kJ/mol[12])、Co-Ni-Mo-P(52.4kJ/mol[14])、CoB(64.9kJ/mol[15])、Co-Ni-B(55.7kJ/mol[18])等文献结果,这有利于反应的发生和进行。
2.4 催化剂用量与单位时间氢产量的关系
NaBH4水解放氢过程需要催化剂的作用,水解速率和氢气的产生快慢易受催化剂用量的影响。本工作考察了不同催化剂用量对单位时间内氢气产量的影响,具体结果如图6(a)所示。随着催化剂用量的增加,单位时间内氢气的生成量显著增加。当催化剂用量为0.02g时,氢气产率为18.5mL/min,当催化剂用量提高4倍(即0.08g)时,相应氢产率为71.6mL/min,提升3.9倍。图6(b)表明,催化剂用量与单位时间内氢产量存在较好的线性关系。
2.5 循环使用性能
待反应体系无氢气生成后,对Raney Ni催化剂进行多次洗涤至中性,进行循环重复测试,具体结果见图7(测试温度为25℃)。随着循环使用次数的增多,单位时间内氢气的生成量不断发生衰减。经4次循环使用后,HGR由最初的1085mL/(min·g)降低至235mL/(min·g),催化剂性能衰减约78%。由文献中同类结果可知,造成催化剂性能衰减的主要原因可归结为硼化物(如BO(OH)、BO·H2O)的强吸附累积,占据活性位后催化剂难以发挥作 用[14,19-21]。BET测试发现,循环使用后的催化剂比表面积降至18.7m2/g,约为初始值的59.4%,这很可能是由于硼化物在催化剂孔洞内的吸附沉积所造成。对催化剂表面进行了XPS表征(图8),结果表明,大量硼化物存在于Raney Ni表面,其中硼元素为+3价,B与Ni的原子比约为2.5∶1。XPS结果还表明,Raney Ni存在部分氧化,这也是造成催化剂性能衰减的因素之一。
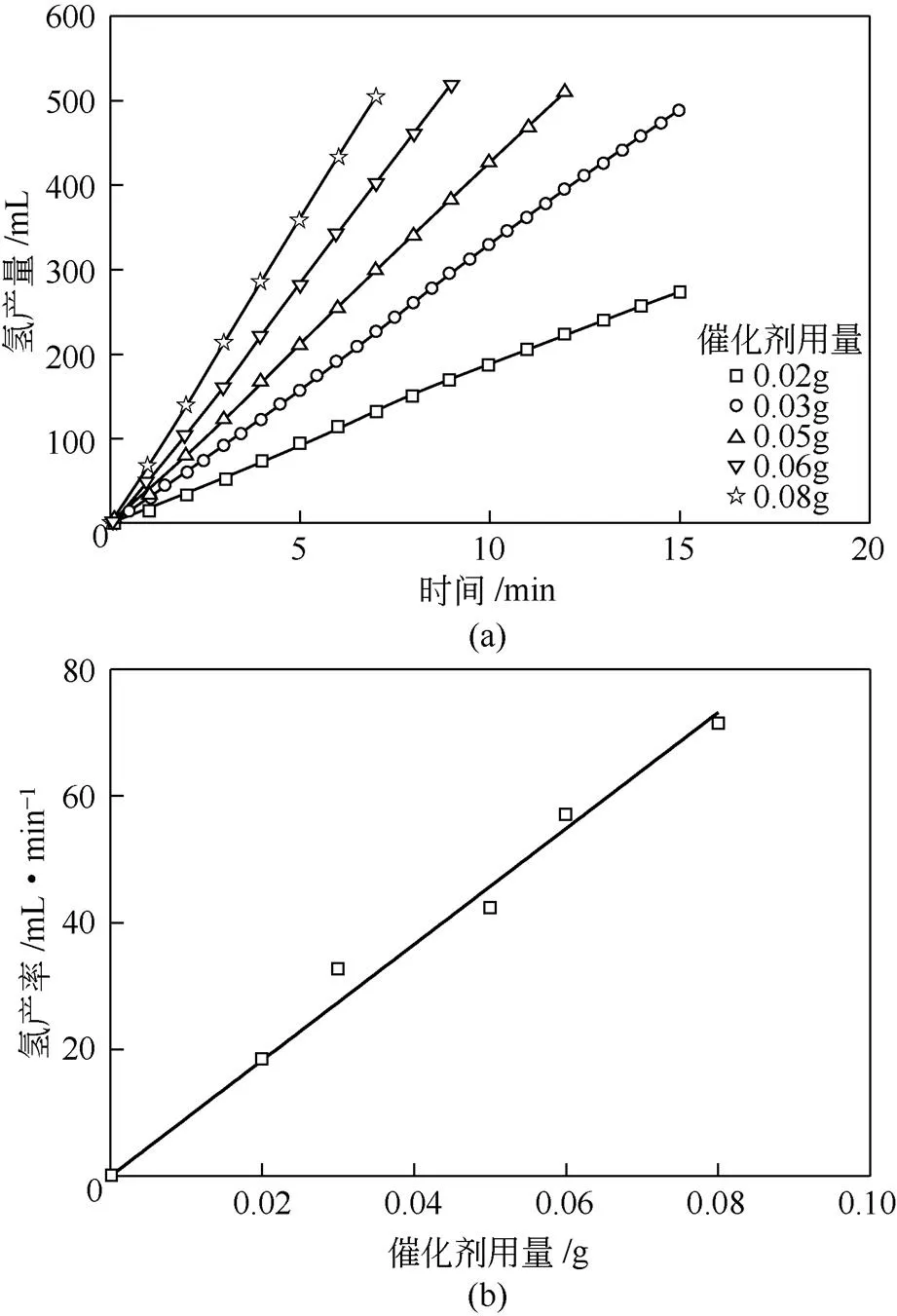
图6 催化剂用量对HGR的影响以及单位时间内氢气生成量与催化剂用量的关系

图7 催化剂循环使用情况

图8 XPS分析结果
3 结论
通过对NiAl合金粉末进行浓碱脱铝处理制得Raney Ni催化剂,该催化剂对碱性硼氢化钠溶液水解产氢具有良好的催化性能。研究发现,该催化剂最为适宜的反应液组成为15% NaBH4和10%NaOH,高达1085mL/(min·g)(25℃),相应表观活化能(38.6kJ/mol)小于文献结果。循环性能测试表明,硼化物在催化剂表面的强吸附和催化剂的部分氧化是造成Raney Ni活性衰减的原因。
[1] 毛宗强. 氢能——21世纪的绿色能源[M]. 北京:化学工业出版社,2005.
MAO Z Q. Hydrogen energy——clean energy for 21st century[M]. Beijing:Chemical Industry Press,2005.
[2] FERNANDES T R C,CHEN F Z,CARVALHO M G. “HySociety” in support of European hydrogen projects and EC policy[J]. International Journal of Hydrogen Energy2005,30(3):239-245.
[3] 吴川,张华民,衣宝廉. 化学制氢技术研究进展[J]. 化学进展,2005,17(3):423-429.
WU C,ZHANG H M,YI B L. Recent advances in hydrogen generation with chemical methods[J]. Progress in Chemistry,2005,17(3):423-429.
[4] MUIR S S,YAO X. Progress in sodium borohydride as a hydrogen storage material:development of hydrolysis catalysts and reaction systems[J]. International Journal of Hydrogen Energy,2011,36(10):5983-5997.
[5] DEMIRCI U B,AKDIM O,ANDRIEUX J,et al. Sodium borohydride hydrolysis as hydrogen generator:issues,state of the art and applicability upstream from a fuel cell[J]. Fuel Cell,2010,10(3):335-350.
[6] 徐东彦,张华民,叶威. 硼氢化钠水解制氢[J]. 化学进展,2007,19(10):1598-1605.
XU D Y,ZHANG H M,YE W. Hydrogen production from sodium bornhydride[J]. Progress in Chemistry,2007,19(10):1598-1605.
[7] 梁艳,王平,戴洪斌. 硼氢化钠催化水解制氢[J]. 化学进展,2009,21(10):2219-2228.
LIANG Y,WANG P,DAI H B. Hydrogen generation from catalytic hydrolysis of sodium borohydride solution[J]. Progress in Chemistry,2009,21(10):2219-2228.
[8] OH T H,GANG B G,KIM H K,et al.Sodium borohydride hydrogen generator using Co-P/Ni foam catalysts for 200W proton exchange membrane fuel cell system[J]. Energy,2015,90:1163-1170.
[9] MINKINA V G,SHABUNYA S I,KALININ V I. Hydrogen generation from sodium borohydride solutions for stationary applications[J]. International Journal of Hydrogen Energy,2016,41(22):9227-9233.
[10] BRACK P,DANN S E,WIJAYANTHA K G U. Heterogeneous and homogenous catalysts for hydrogen generation by hydrolysis of aqueous sodium borohydride(NaBH4) solutions[J]. Energy Science & Engineering,2015,3(3):174-188.
[11] 谢广文,王丽娜,李忠. 硼氢化钠水解制氢金属催化剂的研究进展[J]. 青岛科技大学学报,2015,36(1):1-9.
XIE G W,WANG L N,LI Z. Progress in metal catalysts for hydrogen generation through hydrolysis of sodium borohydride[J]. Journal of Qingdao University of Science and Technology,2015,36(1):1-9.
[12] LIU B H,LI Z P,SUDA S. Nickel- and cobalt-based catalysts for hydrogen generation by hydrolysis of borohydride[J]. Journal of Alloys and Compounds,2006,415(1):288-293.
[13] HUANG Y,WANG Y,ZHAO R,et al. Accurately measuring the hydrogen generation rate for hydrolysis of sodium borohydride on multiwalled carbon nanotubes/Co-B catalysts[J]. International Journal of Hydrogen Energy,2008,33(23):7110-7115.
[14] WANG L,LI Z,ZHANG P,et al. Hydrogen generation from alkaline NaBH4solution using Co-Ni-Mo-P/g-Al2O3catalysts[J]. International Journal of Hydrogen Energy,2016,41(3):1468-1476.
[15] JEONG S U,KIM R K,CHO E A,et al. A study on hydrogen generation from NaBH4solution using the high-performance Co-B catalyst[J]. Jorunal of Power Sources,2005,144(1):129-134.
[16] XIANG C,JIANG D,SHE Z,et al. Hydrogen generation by hydrolysis of alkaline sodium borohydride using a cobalt-zinc-boron/graphene nanocomposite treated with sodium hydroxide[J]. International Journal of Hydrogen Energy,2015,40(11):4111-4118.
[17] 李忠,王丽娜,王桂雪,等. 负载型Ni-Co-P/CNFs催化剂的制备及释氢性能[J]. 燃料化学学报,2015,43(3):372-378.
LI Z,WANG L N,WANG G X,et al. Hydrogen generation from the hydrolysis of sodium borohydride solution over the supported Ni-Co-P/CNFs catalysts[J]. Journal of Fuel Chemistry and Technology,2015,43(3):372-378.
[18] XU D,WANG H,GUO Q,et al. Catalytic behavior of carbon supported Ni-B,Co-B and Co-Ni-B in hydrogen generation by hydrolysis of KBH4[J]. Fuel Processing Technology,2011,92(8):1606-1610.
[19] ZHUANG D W,DAI H B,ZHONG Y J,et al. A new reactivation method towards deactivation of honeycomb ceramic monolith supported cobalt-molybdenum-boron catalyst in hydrolysis of sodium borohydride[J]. International Journal of Hydrogen Energy,2015,40(30):9373-9381.
[20] KIM D R,CHO K W,CHOI Y I,et al. Fabrication of porous Co-Ni-P catalysts by electrodeposition and their catalytic characteristics for the generation of hydrogen from an alkaline NaBH4solution[J]. International Journal of Hydrogen Energy,2009,34(6):2622-2630.
[21] WANG Y,QI K,WU S,et al. Preparation,characterization and catalytic sodium borohydride hydrolysis of nanostructured cobalt-phosphorous catalysts[J]. Journal of Power Sources,2015,284:130-137.
Hydrogen production from hydrolysis of alkaline sodium borohydride solution using Raney nickel catalyst
WEI Lei,MA Maixia,FU Junyu,GAO Jing,DONG Xiaolong,WEI Piye
(School of Chemistry and Materials Science,Langfang Teachers University,Langfang 065000,Hebei,China)
In this work, Raney Ni catalyst was prepared by treating the NiAl alloy powder with alkaline solution. The obtained catalyst was then used for the catalytic hydrolysis of sodium borohydride (NaBH4)solution toward hydrogen generation. Field-emission scanning electron microscopy and nitrogen absorption/desorption method were carried out to characterize the microstructure of the catalyst. Effects of the reaction solution composition, reaction temperature, catalyst amount and reusing operation on the hydrogen generation rate(HGR)were investigated. The results showed that when the concentration of NaBH4and NaOH was 15% and 10%, respectively, HGR was as high as 1085mL/(min·g) at 25℃ and the apparent activation energy was measured to be 38.6kJ/mol. A good linear relationship was established between the hydrogen volume per minute and the catalyst amount. The HGR was decreased by 78% after recycled for four times, which could be attributed to the accumulation of boron compounds and the oxidation of nickel.
hydrogen production;Raney Ni;sodium borohydride;hydrolysis;catalysis
TQ116.2
A
1000–6613(2017)12–4462–06
10.16085/j.issn.1000-6613.2017-0473
2017-03-21;
2017-08-15。
河北省自然科学基金(B2017408042)、河北省教育厅资助科研项目(BJ2016044)及廊坊师范学院科学研究项目(LSLB201701)。
魏磊(1986—),男,博士,讲师,研究方向为催化制氢。E-mail:weilei1108@163.com。
