如何对元素周期律化繁就简
2017-12-14吴霞
吴 霞
云南
如何对元素周期律化繁就简
吴 霞

元素周期律是指元素性质随元素的原子序数的增加而呈现周期性变化的规律。它把许多化学事实联系起来,说明了元素性质上的周期性变化,并在化学知识系统化过程中起到重要作用,使化学学习、研究减少了盲目性。
高中化学考纲要求:以第三周期为例,掌握同一周期内性质(如:原子半径、化合价、单质及其化合物性质)的递变规律与原子结构的关系;以ⅠA、ⅡA为例,掌握同一主族内元素性质递变规律与原子结构的关系。
在学生的学习中、平常测验、学业水平考试和高考中常常以短周期的元素和ⅠA、ⅡA、ⅦA的元素为例,同时考查同周期和同主族的元素性质递变规律与原子结构的关系,也就是常说的对“位”“构”“性”三者之间的关系的考查。这是对知识点“运用”层次的考查,是有一定的难度和技巧的。而如果学习者对元素周期律不能很准确地记忆,势必在知识的掌握、运用上大打折扣。
经过多年教学、摸索和比较,我针对性地找到了一点解决方法,现和大家交流一下:
一、在元素周期律的教学中遇到的问题和困难
首先是同学们对元素周期律的理解有困难。元素周期律的归纳及理解是建立在对原子结构、元素周期表结构和元素化合物性质的学习基础上的,一环紧扣着一环,这就需要知识的积累和记忆!
其次是即使能准确归纳出元素周期律,同学们对其具体内容的记忆存在困难,容易混淆。
最后也是最关键的就是不会运用!元素周期律的运用最终落实在“位”“构”“性”的具体运用上,这就要求学生“人人心中有张表”。知道各元素的相对位置,推测结构,判断性质;或者知道结构,判断位置,预测性质;或者通过实验知道性质,推测结构,寻找位置等。
二、元素周期律的学习和记忆策略
机械式的学习和记忆元素周期律,不利于对这一规律的理解和应用。时间一长、内容一多容易混淆。
我们经常使用的教学方法是以第三周期和ⅠA、ⅦA的元素为例,引导学生归纳了如下“两段话”。
同周期元素:
从左到右,原子半径逐渐变小,金属性逐渐减弱、非金属性逐渐增强,置换氢气的能力减弱、与氢气化合的能力逐渐增强、氢化物的稳定性逐渐增强,最高价氧化物对应水化物碱性减弱、酸性增强。
同主族元素:
从上到下,原子半径逐渐变大,金属性逐渐增强、非金属性逐渐减弱,置换氢气的能力增强、与氢气化合的能力逐渐减弱、氢化物的稳定性逐渐减弱,最高价氧化物对应水化物碱性增强、酸性减弱。
通过“两段话”的教学,发现学生容易将金属性和非金属性的一些实验事实混淆,递变规律记反了,渐渐失去学会元素周期律的信心。针对这一现象,笔者运用分类的方法帮学生整理推导了“两条线”:
元素原子半径越大→失去电子的能力越强→元素金属性越强→金属单质的还原性越强→置换氢气的能力越强→最高价氧化物对应水化物的碱性越强
元素原子半径越小→得到电子的能力越强→元素非金属性越强→非金属单质的氧化性越强→与氢气化合的能力越强→氢化物的稳定性越强→最高价氧化物对应水化物的酸性越强
利用这“两条线”,让学生清楚哪些性质是和金属性对应,哪些性质是和非金属性对应的。再通过对同周期、同主族一些具体元素的金属性(或非金属性)的比较,尝试着学会应用。最后,回忆同周期和同主族性质的递变规律,试推导关系,找到“两个点”。
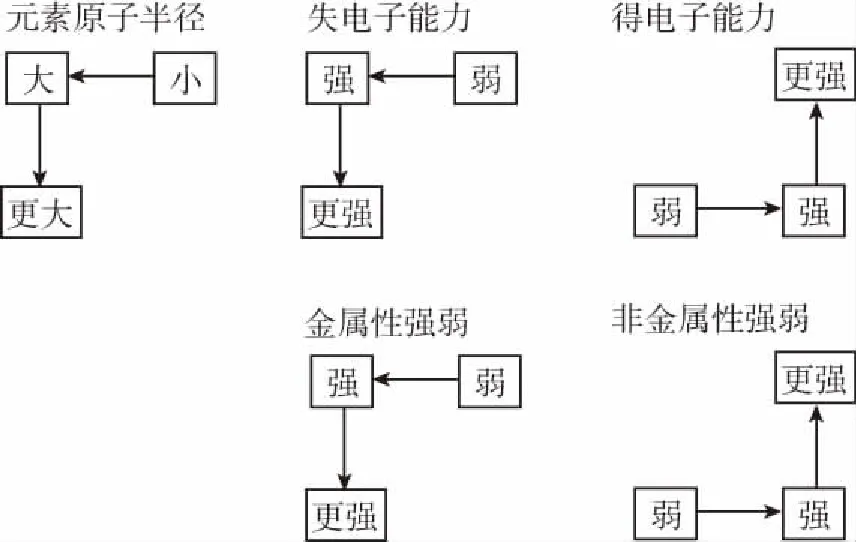
【小结】所以,“两个点”就是在元素周期表中:
越靠左边越靠下边,金属性越强,左下角金属性最强;
越靠右边越靠上边,非金属性越强,右上角非金属性最强。
基本的做题思路:
第一种思路:先判断元素在周期表中的相对位置,依据“两个点”判断出该元素体现金属性还是非金属性,强弱如何;接下来再依据“两条线”判断该元素所对应的单质性质、氢化物稳定性、最高价氧化物对应水化物酸碱性强弱。
第二种思路:运用“两条线”判断题目要求判断的性质与对应元素的金属性(或非金属性)的关系是否一致,再依据“两个点”判断具体物质性质的强弱。
通常第二种思路在做题过程中更为常见。
【具体示例】
下列各组物质性质比较不正确的是
( )
A.氧化性:F2>Cl2>S
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.金属单质置换出氢气的能力:K>Na>Li
D.酸性:H2SiO4>H2SO4>H3PO4
解析:非金属单质的氧化性强弱与非金属性强弱一致,在元素周期表中位置靠右靠上的氧化性强,即F>Cl>S,A正确。碱性强弱与金属性强弱一致,在元素周期表中靠左靠下的金属性强,即Na>Mg>Al,B正确。金属单质置换氢气的能力与金属性一致,即K>Na>Li,C正确。非金属元素最高价含氧酸的酸性强弱与对应元素的非金属性强弱一致,即S>P>Si,D错误。所以答案为D。
【迁移应用】
1.下列各组物质及粒子性质变化不正确的是
( )
A.酸性:HCl>H2SO4>H3AsO4>H3PO4
B.碱性:Ca(OH)2>Mg(OH)2>Al(OH)3
C.金属单质置换出氢气的能力:Cs>Rb>K>Ca
D.氧化性:F2>O2>S
答案:A
2.下列排序正确的是
( )
A.热稳定性:H2O>HF>H2S
B.酸性:H2CO3>H3PO4>H2SO4
C.非金属性:Cl>S>Si
D.最高正化合价:F>N>C
答案:C
三、教学反思

云南省丽江市古城区第一中学)
趣味化学
水果解酒之谜

饮酒过量常为醉酒,也称为酒精中毒。醉酒多有先兆,语言渐多,舌头不灵,面颊发热发麻,头晕,站立不稳……都是醉酒的先兆,这时需要解酒。 不少人知道,吃一些带酸味的水果或饮服干净的食醋可以解酒。什么道理呢?
这是因为,水果里含有机酸。例如,苹果里含有苹果酸,柑橘里含有柠檬酸,葡萄里含有酒石酸等,而酒里的主要成分是乙醇,有机酸能与乙醇相互作用而形成酯类物质,从而达到解酒的目的。
食醋解酒之谜

同样的道理,食醋也能解酒是因为食醋里含有3%~5%的乙酸,乙酸能跟乙醇发生酯化反应生成乙酸乙酯。 尽管带酸味的水果和食醋都能使过量乙醇的麻醉作用得以缓解,但由于上述酯化反应在体内进行时受到多种因素的干扰,效果并不十分理想。因此,防醉酒的最佳方法是不贪杯。
(转载自网络,有删改)
