氧化还原视角下的电化学高考试题解题技巧
2017-12-14洪兹田陈女婷
洪兹田 陈女婷
福建
氧化还原视角下的电化学高考试题解题技巧
洪兹田 陈女婷

一、电化学知识在高考中的地位
原电池、电解池原理及其应用涉及化学理论、元素化合物知识以及化工生产应用,是高考必考的重点内容,电极反应式的书写是电化学考查的重点和难点。纵观近几年全国卷高考试题,对原电池、电解池的考查从未间断,其中应用原电池、电解池的工作原理分析新型电池、电极方程式的书写是高考热点。如2014年全国Ⅰ非选择题中的四室电渗析法制备次磷酸,全国Ⅱ选择题中的水溶液锂离子电池体系;2015年全国Ⅰ选择题中的微生物电池;2016年全国Ⅰ选择题中的三室式电渗析法处理含Na2SO4废水,全国Ⅱ选择题中的Mg-AgCl电池,Ⅲ卷选择题中的锌-空气燃料电池等。
二、氧化还原视角下建构电化学知识体系
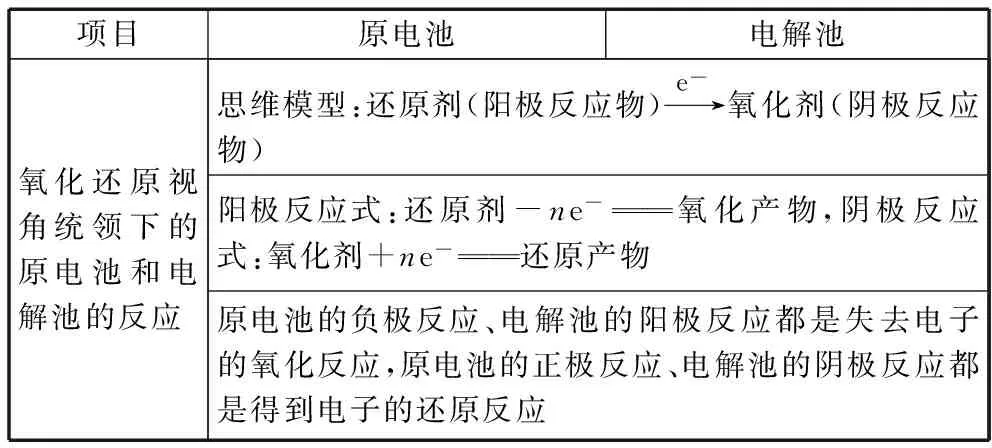
1.氧化还原反应与电化学反应的关系
氧化还原反应的知识是电化学学习的基础,电化学的应用是对氧化还原反应知识的升华。电极反应实际上是氧化还原反应的半反应。将电化学和氧化还原反应进行联系,把电极反应式的书写和缺项配平进行综合,电极反应式的书写就变成了氧化还原反应的缺项配平。所以,电化学实际上是氧化还原反应的另一种考查形式。
2.氧化还原视角统领下电化学反应规律
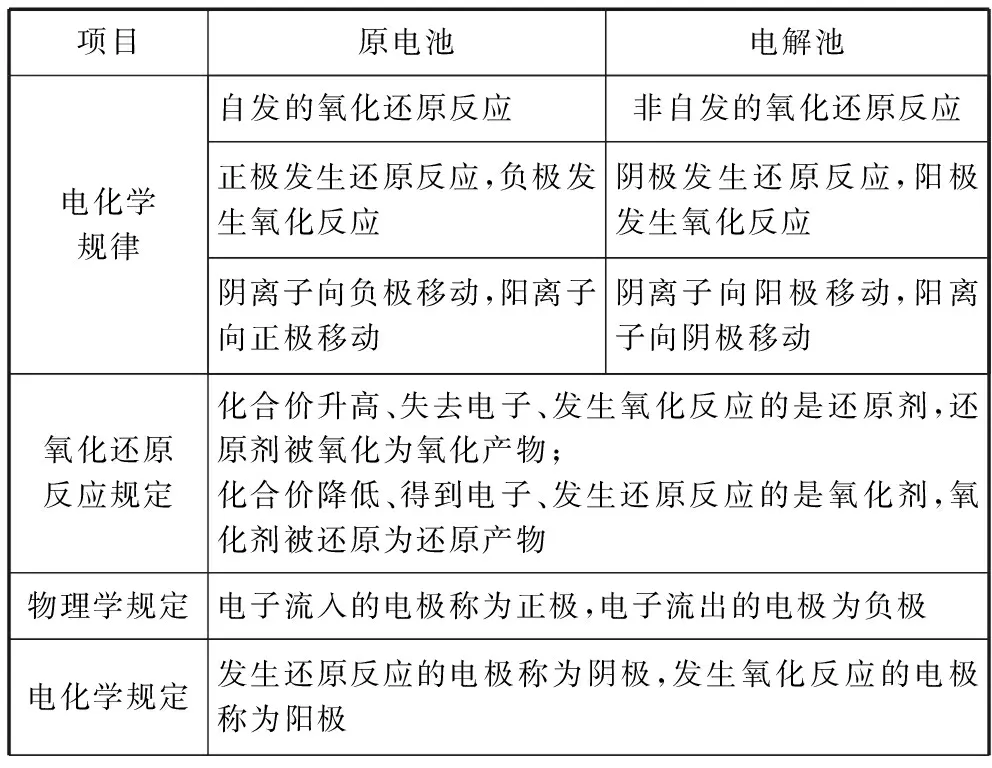
项目原电池电解池电化学规律自发的氧化还原反应非自发的氧化还原反应正极发生还原反应,负极发生氧化反应阴极发生还原反应,阳极发生氧化反应阴离子向负极移动,阳离子向正极移动阴离子向阳极移动,阳离子向阴极移动氧化还原反应规定化合价升高、失去电子、发生氧化反应的是还原剂,还原剂被氧化为氧化产物;化合价降低、得到电子、发生还原反应的是氧化剂,氧化剂被还原为还原产物物理学规定电子流入的电极称为正极,电子流出的电极为负极电化学规定发生还原反应的电极称为阴极,发生氧化反应的电极称为阳极
续表
三、原电池和电解池的思维模型
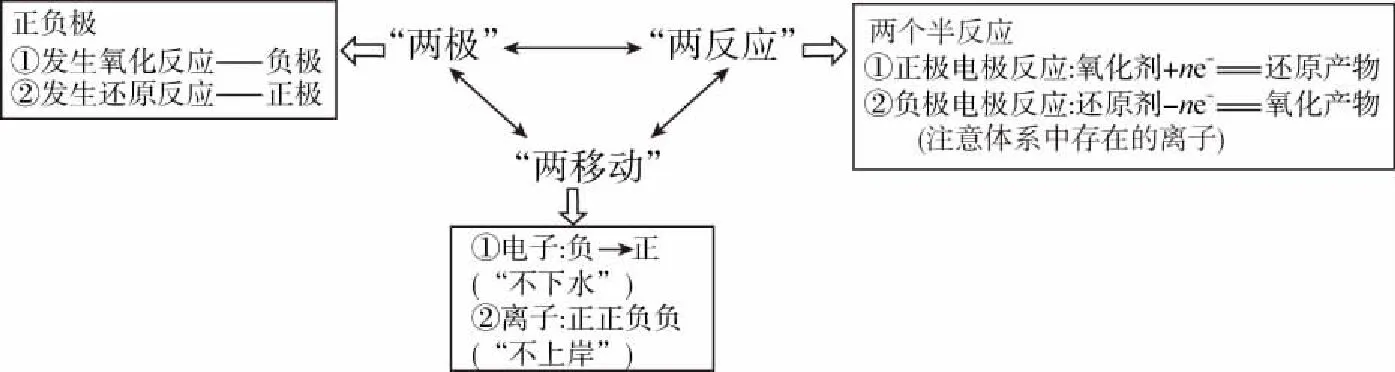
1.原电池的思维模型
原电池通常由五部分组成:负极材料、正极材料、还原剂、氧化剂、电解质。负极材料与正极材料的主要作用是导电,电解质溶液传递离子形成电流回路,还原剂在负极上失去电子,氧化剂则在正极上得到电子。生产和生活中各种新型化学电源(包括各种燃料电池),虽然反应原理比较复杂,但还是遵循原电池的基本原理。即利用“两极”“两移动”“两反应”进行分析,思维模型如图所示。
例题1(2016全国Ⅱ,11)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
( )


C.电池放电时Cl-由正极向负极迁移


答案:B
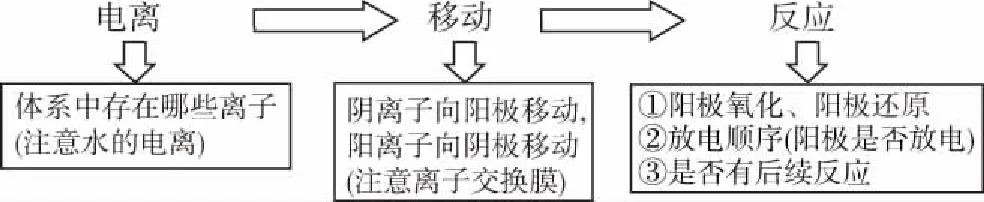
2.电解池的思维模型
电解池通常由六部分组成:电源、阴极材料、阳极材料、还原剂、氧化剂、电解质。阳极材料与阴极材料的主要作用是导电,电解时电子由电源负极流向阴极,由阳极流向电源正极,电解质溶液中离子的定向移动形成电流。还原剂在阳极上失去电子,氧化剂则在阴极上得到电子。以此模型去分析生产和生活中的新型电解池,思维模型如图所示。
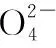
( )
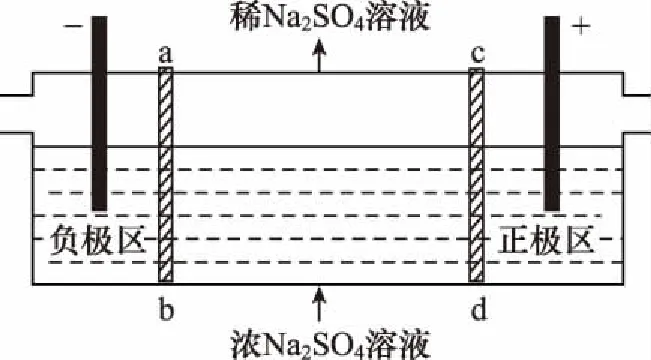
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品

D.当电路中通过1 mol电子的电量时,会有0.5 mol的O2生成
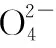
答案:B
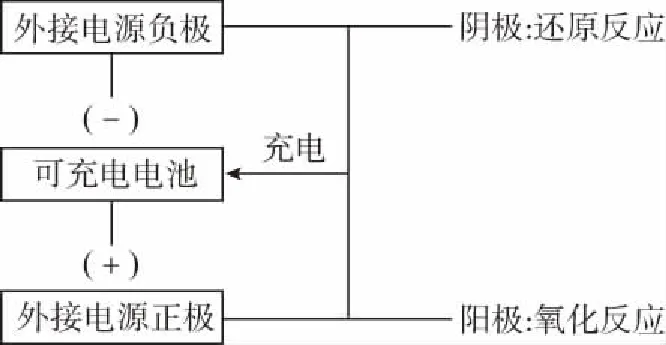
3.二次电源的思维模型
二次电池放电时发生原电池反应,充电时发生电解池反应。放电时负极失去电子,而充电时充电电池的负极需要重新得到电子,必须作电解池的阴极,应与电源的负极相连。正极放电时得到电子,而充电时则失去电子做阳极,思维模型如图所示。

( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小

D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况)

答案:C
四、氧化还原视角下电极反应式的书写
电化学反应中考查电极反应式的具体书写,所涉及的往往是新型电池。结合氧化还原反应原理进行分析,建立如下思维步骤:
1.根据题给信息判断电池类型(原电池或电解池);
2.根据总反应或者题给信息,找出氧化剂、还原剂以及对应的产物;


4.利用化合价升降相等推出正确的转移电子数;
5.反应式两端添加电解质中存在的离子,使反应式电荷守恒;
6.利用元素守恒写出完整的电极反应式。
若是多池组合,可采用“拆解法”分段进行分析。
例题4利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。(1)a为电源的________(填“正极”或“负极”);(2)阳极的电极反应式为____________,阴极的电极反应式为____________。
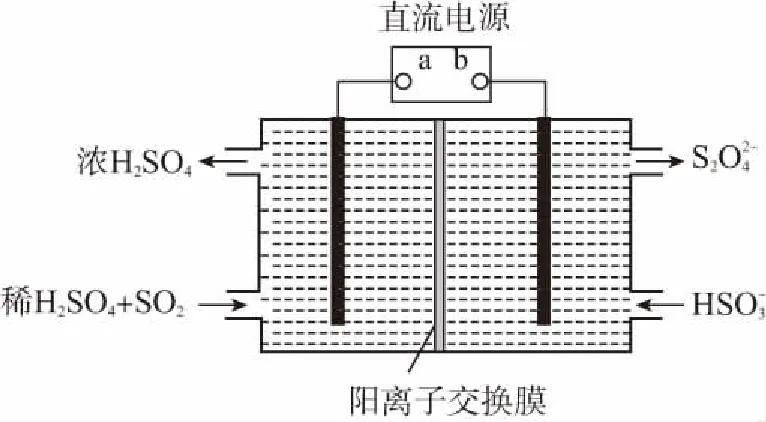
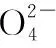
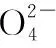
答案:(1)正极

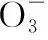
福建省厦门市翔安第一中学)
趣味化学
“宝刀”的秘密
我国古代很讲究使用钢刀,优质锋利的钢刀称为“宝刀”。战国时期,相传越国就有人制造“干将” “莫邪”等宝刀宝剑,那真是锋利无比,“削铁如泥”,头发放在刀刃上,吹口气就会断成两截。当然,传说难免有点夸张,但是“宝刀” 锐利却是事实。过去只有少数工匠掌握生产这类“宝刀”的技术。现在我们通过科学研究知道,制造这类“宝刀”的主要秘密就是其中含有钨、钼一类的元素。
事实上,往钢里加进钨和钼,哪怕只要很少的一点点,比如百分之几甚至千分之几,就会对钢的性质产生重大的影响。这个事实直到十九世纪中叶才被人们所认识,接着大大地促进了钨、钼工业的发展。有计划地往普通钢里加进一种或几种像钨、钼一类的元素——合金元素,就能制造出各种性能优异的特殊钢材——合金钢。
烧不坏的手帕
一次晚会上,小红同学表演节目,她拿了一块既新又漂亮的花手帕,在一个盛着水的玻璃杯中浸了浸,取出之后挤了挤水,然后用铁钳夹住手帕一角,放到酒精上点燃。霎时间,全场灯光都熄灭了。只有点燃的火,在台上燃烧着。不一会儿火渐渐地灭了,台下的观众都在为这个漂亮的花手帕白白地被烧掉而感到可惜。它一定化为灰烬了。突然,场灯大亮,这个花手帕竟然完整无损。这是什么原因呢?观众们也许能猜着吧!
问题很简单。原来,玻璃杯中盛的是两份酒精和一份水的混合液,酒精的燃点很低,它很快地燃烧了,而且酒精的沸点只有78℃,水的沸点是100℃,所以,酒精很容易从手帕中挥发出来燃烧掉,一部分水仍然留在手帕上,保护着手帕。另外,在酒精燃烧的过程中,有一部分水变成蒸气挥发了,带走了手帕上的一部分热量,从而降低了手帕的温度,使其达不到燃点。以上的两个因素保护了手帕的安全。
(转载自网络,有删改)
