例谈无机工艺流程中化学反应的条件控制
2017-12-14钱明安韩万中
钱明安 韩万中
河北
例谈无机工艺流程中化学反应的条件控制
钱明安 韩万中

课程标准强调:有将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会问题做出合理的判断。自2015年以来,以现代化工生产为背景的工艺流程题型已成为全国卷理综化学卷的主流题型,旨在启迪学生认识化学与科学技术进步和社会发展的关系,并从中考查学生获取信息、整合信息的能力以及分析问题、解决实际问题的能力。
工艺流程涉及较多的化学反应,这些化学反应都需要在一定条件下进行,条件控制是决定生产效益高低和产品是否纯净的关键环节。条件控制主要包括溶液pH控制、温度控制、溶剂选择以及反应氛围等情况,本文欲对条件控制的原理、方法及效果作一简要说明,力求打破工艺流程问题中反应条件控制的藩篱,提高学生的化学工程素养。
一、温度控制
温度控制是影响化学反应的一项重要条件,对产品质量、生产效率、安全生产及节约能源等方面有着重要的意义。温度条件的选择,可从以下几方面思考:①从原料的物理、化学性质出发,考虑物质的挥发性和热稳定性;②从化学动力学角度出发,考虑温度对反应速率或固体溶解速率的影响;③从热力学角度分析,考虑温度对反应平衡转化率的影响;③从反应的复杂性角度分析,考虑副反应的发生;④从催化剂的使用出发,考虑温度与催化剂活性的相关性;⑤从物质的溶解度出发,考虑温度对晶体析出的影响以及对溶解在溶液中气体(如氧气、氯气)的影响。
例1(2017全国Ⅰ,27节选)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
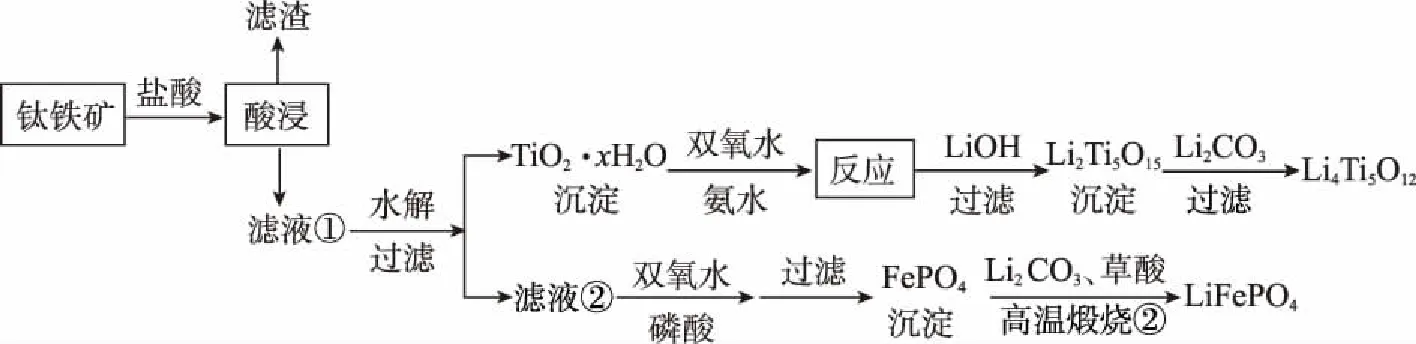
TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
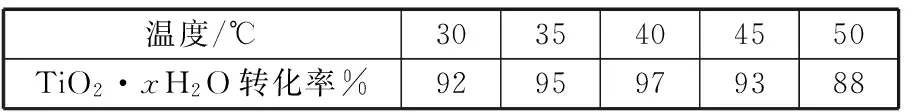
温度/℃3035404550TiO2·xH2O转化率%9295979388
分析40℃时TiO2·xH2O转化率最高的原因:____________。
分析:化合物的热稳定性是相对的,像硝酸、草酸、过氧化氢、金属氢氧化物、铵盐、银盐、碳酸氢盐、硝酸盐、草酸盐等,当达到一定温度条件时,它们大多会发生不同情况的分解反应。物质的挥发性属于物理性质,盐酸、硝酸、氨水、液溴等均易挥发。
在本小问中,低于40℃时,TiO2·xH2O转化反应速率随着温度升高而增加,因而其相同时间内的转化率也随之增加;温度高于40℃时,H2O2受热分解、氨水挥发出NH3,反应物浓度下降,导致TiO2·xH2O转化反应速率下降,其转化率也随之下降。
答案:低于40℃时,TiO2·xH2O转化反应速率随着温度升高而增加;超过40℃时,H2O2分解、NH3逸出导致TiO2·xH2O转化反应速率下降。
总结:在设问中如果出现回答选择某温度或某一温区的原因时,应从低于该温度或温区下限和高于该温度或温区上限两个方面回答。
例2(2016全国Ⅲ,26节选)过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂,以下是一种制备过氧化钙的实验方法。

步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈________(填“酸”“碱”或“中”)性。将溶液煮沸,趁热过滤。将溶液煮沸的作用是____________。

答案:酸 除去溶液中溶解的CO2
二、溶液的pH控制
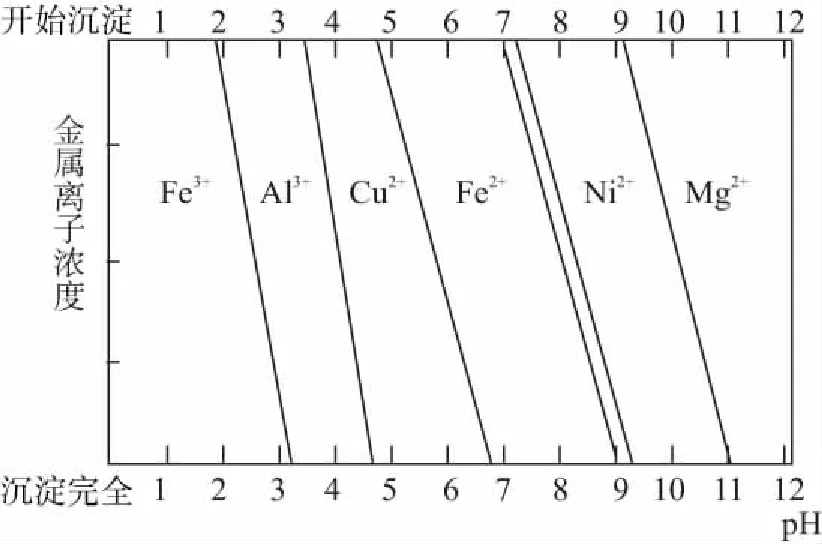
1.促使某些离子水解形成沉淀而被除去
根据不同金属阳离子完全沉淀的pH数据,升高溶液的pH使之处于某范围内,使杂质金属离子沉淀,并确保所需要的金属离子依旧存留在溶液中。这一点,在2013年重庆卷第8题中给出的曲线信息体现得很直观,在去除杂质金属离子方面有较好的指导作用,如下图所示。由于Fe2+沉降时要求的溶液pH较高,同时与一些其他离子沉淀的pH范围重叠,一般是加入H2O2、酸性高锰酸钾溶液、氯水等氧化剂将其氧化成易沉降的Fe3+。
例3(2017全国Ⅱ,26节选)水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
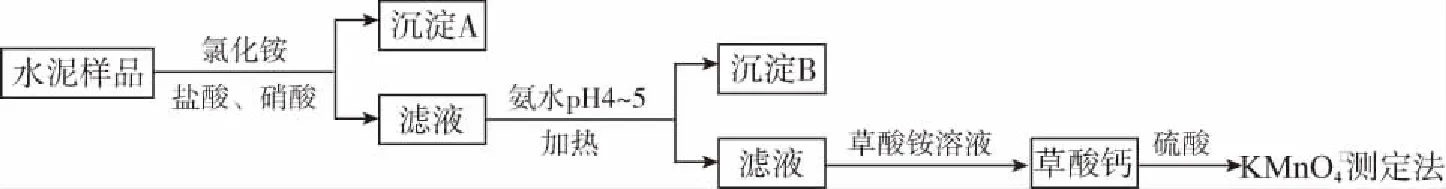
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是____________,还可使用________代替硝酸。
(2)加氨水过程中加热的目的是________。沉淀B的主要成分为________、________(填化学式)。
解析:由题给信息可知水泥熟料中的杂质中可能含有FeO,分解水泥样品过程中的滴加硝酸操作显然是针对Fe2+而设的,目的是将Fe2+氧化为Fe3+,Fe3+及Al3+在随后“氨水pH=4~5”一步时彻底水解生成难溶性氢氧化物而被过滤除去。
答案:(1)将Fe2+氧化为Fe3+H2O2溶液 (2)促进Fe3+和Al3+水解 Fe(OH)3、Al(OH)3
同理,对于部分弱酸根离子,可采用降低溶液pH的方法促使杂质阴离子水解而沉降除去。
例4(2017全国Ⅲ,27节选)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
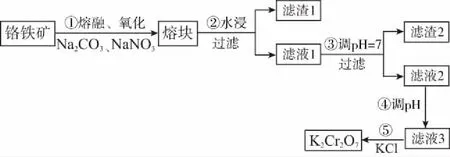
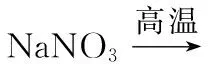
滤渣2的主要成分是________及含硅杂质。
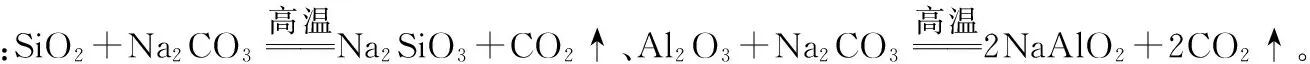
答案:Al(OH)3
点评:全国卷Ⅱ26题和全国Ⅲ卷27题,可谓“花开并蒂燕双飞”,两道试题并列一起分析,都是调节溶液的pH,由于离子的电性不同,前者采用升高溶液pH,后者则是降低溶液pH,正反对照,交相辉映,能使学生真正把握溶液pH控制的方法和实质。
2.抑制某些离子的水解,防止产品混入杂质

例5以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
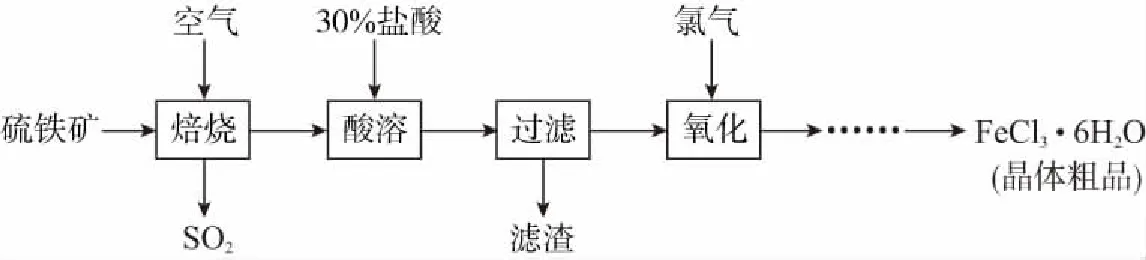
酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率及___________。

答案:抑制Fe3+水解
3.控制盐的水解反应进行的程度

例6(2014江苏,16节选)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6—2x]溶液,并用于烟气脱硫研究。
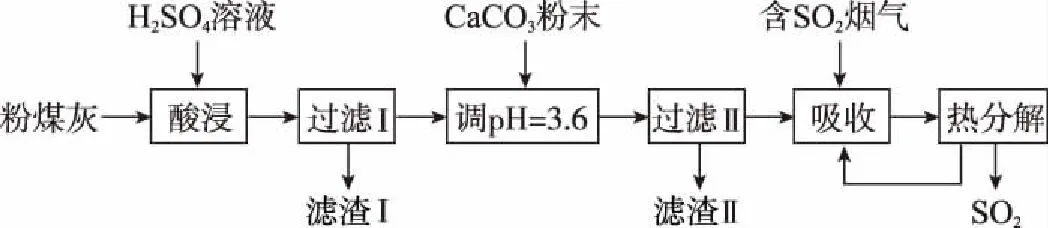
加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为___________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是____________(用离子方程式表示)。
分析:制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液的原理,就是加入CaCO3消耗酸性溶液中的H+,使溶液的pH升高,Al2(SO4)3发生一定程度的水解反应,把握这个的关键是调节溶液pH=3.6。若溶液的pH过低,水解受到抑制;pH偏高,Al2(SO4)3水解过度以致生成难溶于水的Al(OH)3,就会导致Al2(SO4)x(OH)6-2x中的x减小,即溶液中铝元素的含量降低。
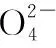
4.溶液的酸碱性影响离子的稳定性和存在形式
例7在例4中,步骤④调滤液2的pH使之变________(填“大”或“小”),原因是____________(用离子方程式表示)。
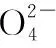
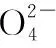
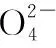
三、化学反应氛围控制
依据产品质量要求以及反应物的“个性”,工业实践中需将化学反应置于某种氛围中进行,最常见的情况主要有①隔绝空气:主要是防止还原性物质被空气中的O2氧化;②在空气中:空气是廉价的原料,借助其中的成分尤其是氧气参与化学反应;③通入稀有气体:考虑防止物质被氧化、潮解等。
例8为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如下图所示。
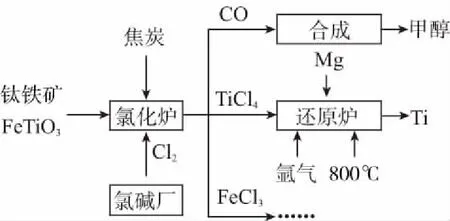
氩气通入还原炉中并不参与反应,通入氩气的作用是____________。
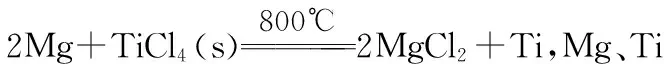
答案:氩气性质不活泼,可以防止Mg和Ti等具有强还原性的物质被氧化
四、溶剂控制
许多无机化学反应是在水溶液中进行的,也有一些反应需加入某种有机溶剂以改变某些性状。无机反应中,选择溶剂主要考虑物质在溶剂中的溶解性和溶剂的挥发性。
例9以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
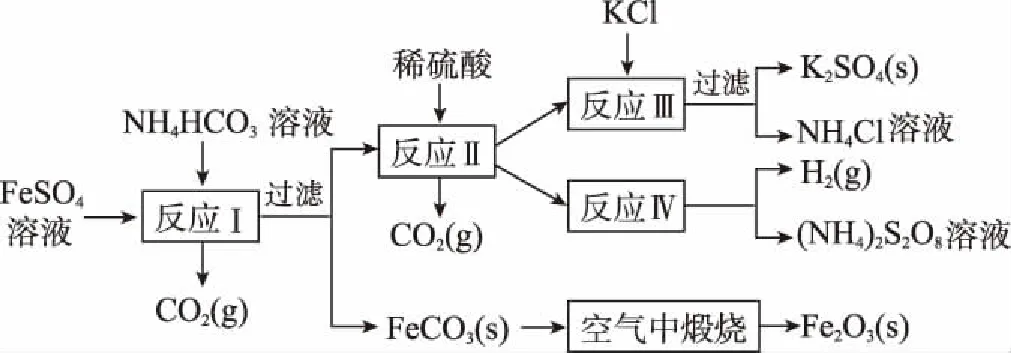
工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是____________。

答案:降低K2SO4的溶解度,有利于K2SO4析出
五、压强控制
对于有气体参加的化学反应,增加气体的分压可提高化学反应速率,在一定时间段内提高较贵重原料的转化率。
例10(2016全国Ⅰ,36节选)以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
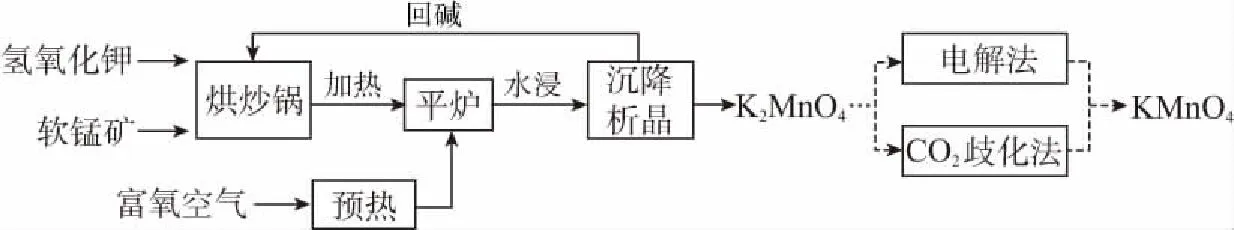
“平炉”中需要加压,其目的是____________。
分析:由于上述反应中氧气是气体,在“平炉”中加压,就可以使反应物氧气的浓度增大,根据外界条件对化学反应速率的影响,增大反应物的浓度,可以使化学反应速率加快;任何反应密闭条件下都具有一定的可逆性,增大压强,可以使化学平衡向气体体积减小的正反应方向移动,故可以提高原料的转化率。
答案:增大反应物的浓度,可使化学反应速率加快,同时使反应物的转化率增大

河北省清河中学)
