慢性失眠障碍患者血清肿瘤坏死因子与记忆的相关性研究☆
2017-12-14王芳瞿萍夏兰陈贵海
王芳瞿萍夏兰陈贵海
慢性失眠障碍患者血清肿瘤坏死因子与记忆的相关性研究☆
王芳*瞿萍△夏兰△陈贵海※○☆
目的 探索慢性失眠障碍(chronic insomnia disorder,CID)患者血清肿瘤坏死因子(tumor necrosis factor,TNF)α和(sTNF-α和sTNF-β)及其可溶性受体(sTNF-R1和sTNF-R2)水平的变化,分析其与睡眠质量和记忆功能损害间的关系。方法 纳入在睡眠障碍门诊就诊的CID患者44例,以39名健康睡眠者为对照。采用匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)评估失眠程度、九盒迷宫评估记忆功能。用蛋白芯片检测血清sTNF-α、sTNF-β、sTNF-R1和sTNF-R2含量,分析相关性。结果 CID组的空间工作(Z=5.362,P<0.001)和物体再认记忆(Z=3.260,P=0.001)错误数显著高于对照组。CID患者血清sTNF-α和sTNF-β显著高于对照组(Ps<0.001),而 sTNF-R1和 sTNF-R2显著低于对照组(Ps<0.001)。sTNF-α 和 sTNF-β 与 PSQI分呈正相关(Ps<0.001),而 sTNF-R1和 sTNF-R2与 PSQI分呈负相关(Ps<0.001)。CID 患者 sTNF-α 与空间工作记忆(γ=0.380,P=0.017)和物体再认记忆(γ=0.349,P=0.030)错误数呈正相关,而sTNF-β含量只与空间工作记忆错误数呈正相关(γ=0.414,P=0.009)。sTNF-R1和sTNF-R2水平与记忆成绩无显著相关性(Ps>0.05)。结论 CID患者血清sTNF-α和sTNF-β水平较正常人升高而sTNF-R1和sTNF-R2下降;升高的sTNF-α和sTNF-β可能与患者记忆障碍有关,而sTNF-R1和sTNF-R2与记忆受损无关。
失眠 肿瘤坏死因子 可溶性肿瘤坏死因子受体 记忆
慢性失眠障碍 (chronic insomnia disorder,CID)是一种持续性睡眠起始和/或维持困难并导致某种日间功能损害的主观体验[1]。目前的证据表明CID患者不仅存在主观学习记忆能力下降[2]也有选择性客观记忆能力改变,如(空间)工作记忆和情景(物体再认)记忆损害[3-5]。但是,CID患者选择性客观记忆损害的机制尚未明确。睡眠与炎症因子存在一定的联系。研究证实肿瘤坏死因子α(tumor necrosis factors-α,TNF-α) 和白细胞介素1β(interleukin-1β,IL-1β)参与生理性睡眠调节,尤其增加慢波睡眠[6-8]。但是,有关CID患者炎症因子的变化仅见少量小样本研究,且探索的是IL-6[9-10]。我们前期研究发现CID患者血液TNF-α水平升高[11],但未探讨TNF-β及其可溶性TNF受体(sTNF-R)的水平,更不知这些蛋白与记忆损害的联系。本研究旨在探讨CID患者血清肿瘤坏死因子水平改变及其与记忆的相关性。
1对象与方法
1.1研究对象 收集2013年1月至2015年1月在安徽医科大学第一附属医院睡眠门诊就诊的CID患者。CID诊断符合国际睡眠障碍分类第三版诊断标准[2]。入组标准:①患者病程≥6个月;②年龄18~60岁;③初中及以上文化,无理解障碍;④匹兹堡睡眠质量指数(PSQI)总分>7分;⑤汉密尔顿抑郁量表17项(HAMD17)总分<17分。排除存在下列情况之一的患者:①两周内服用过抗抑郁药、抗精神病药、催眠药等;②检查不合作,无法完成试验;③有脑器质性疾病、严重内科疾病及药物滥用;④视力、听力明显障碍;⑤合并其他精神疾病;⑥受孕期及哺乳期;⑦慢性炎症性疾病患者。最后选取CID者44例。对照组为本医院体检正常人群39名。要求无失眠主诉和相关病史,PSQI<5分、HAMD17<7分。本研究经安徽医科大学第一附属医院伦理委员会审核批准,所有受试者均签署知情同意书。
1.2研究方法
1.2.1一般资料收集 收集年龄、病程、教育年限等资料后,患者经PSQI和蒙特利尔认知评估量表(MoCA)分别评估失眠和总体认知功能。
1.2.2记忆检测 按照既往程序[5,12-13],使用九盒迷宫检测受试者的物体/空间参考记忆、物体/空间工作记忆以及物体再认记忆能力。记录错误数进入统计。错误数越多,表示相应记忆能力越差。
1.2.3 血清TNF系统水平检测 于8:00 A.M.~10:00 A.M.采取受试者肘静脉血液约2 mL(采血前受试者空腹、避免剧烈活动以及精神刺激)。静置30 min以3000 r/min的速度离心5 min,取血清置于-80℃冷冻保存。订制相关抗体芯片,采用RayBiotech芯片检测方法测定血清 sTNF-α、sTNF-β、sTNF-R1和 sTNF-R2含量。 具体实验步骤参照试剂盒操作流程。
1.3统计学方法 采用SPSS16.0进行统计学处理。首先对资料进行正态性检验。正态分布资料采用±s表示,组间比较采用成组设计的t检验。非正态分布资料用四分位数间距[P50(P25, P75)]描述。组间差异采用成组设计的秩和检验 (Mann-Whitney U)。采用Spearman法分析血清蛋白与各类记忆错误数的相关性。检验水准α=0.05,双侧检验。
2结果
2.1背景资料 两组间年龄(Z=0.023,P=0.982)、性别 (χ2=1.338,P=0.247)、 教育程度 (Z=0.234,P=0.815)和 MoCA 分(Z=0.650,P=0.516)均无统计学差异(见表1)。CID组的PSQI分均显著高于正常对照组(Z=7.864,P<0.001),表明受试者入组质量理想。
2.2记忆能力 两组间的物体参考 (Z=0.310,P=0.756)、空间参考(Z=0.909,P=0.363)和物体工作记忆(Z=1.741,P=0.082)错误数均无统计学差异。CID 组空间工作记忆错误数(Z=5.362,P<0.001)和物体再认记忆错误数(Z=3.260,P=0.001)显著高于对照组(见表2)。
2.3血清TNF及其可溶性受体的含量 CID组sTNF-α(t=8.402,P<0.001)和 sTNF-β(Z=7.350,P<0.001)含量均显著高于对照组;血清sTNF-R1(Z=7.801,P<0.001) 和 sTNF-R2(Z=4.526,P<0.001)含量均显著低于对照组(见表2)。
2.4血清TNF及受体与睡眠质量的相关性 对所有对象而言控制年龄、性别和教育程度,Spearman相关分析显示(见表3)血清TNF-α和TNF-β含量与PSQI分呈显著正相关 (Ps<0.001),而血清sTNF-R1和sTNF-R2含量与PSQI分呈显著负相关(Ps<0.001)。
2.5血清TNF及受体与记忆功能的相关性 失眠(PSQI分)与血清TNF及其可溶性受体间均存在联系,故在分析血清TNF及其受体与记忆功能间相关性时,我们控制了失眠及年龄、性别、教育程度。Spearmen相关分析显示(见表3)所有受试者的血清 sTNF-α与空间工作记忆错误数 (r=0.266,P=0.019)和物体再认记忆错误数 (r=0.329,P=0.003) 正相关,sTNF-β含量也与空间工作记忆错误数呈正相关(r=0.279,P=0.013)。分组分析结果显示 (见表4)CID组的sTNF-α与空间工作记忆错误数(r=0.380,P=0.017)、物体再认记忆错误数(r=-0.349,P=0.030)呈正相关,sTNF-β含量与空间工作记忆错误数呈正相关 (r=0.414,P=0.009);sTNF-R1和 sTNF-R2水平与记忆成绩无显著相关性(Ps>0.05)。
3讨论
既往认为CID患者缺乏明确的记忆损害,但近期不断有研究表明CID患者有客观记忆损害[3-5,12-13]。本研究再次表明CID患者存在空间工作记忆和物体再认记忆损害,与我们以前的研究一致[5,13]。然而,目前对CID患者记忆损害的机制探索很少。
TNF是多功能细胞因子,包括α和β两种形式。sTNF-a和sTNF-β来源不同,但作用于共同的受体(TNF-R1和TNF-R2),具有相似的生物学功能。研究已证明TNF-α对睡眠-觉醒行为的特异性效应[13]。非致热剂量TNF增加非快动眼睡眠[14],但高剂量时抑制非快动眼睡眠和快动眼睡眠[8]。阻断TNF的作用可减少睡眠,削弱睡眠剥夺后睡眠压力的增加[8]。人血浆TNF水平与脑电图δ强度相关[9]。

表1两组的背景资料
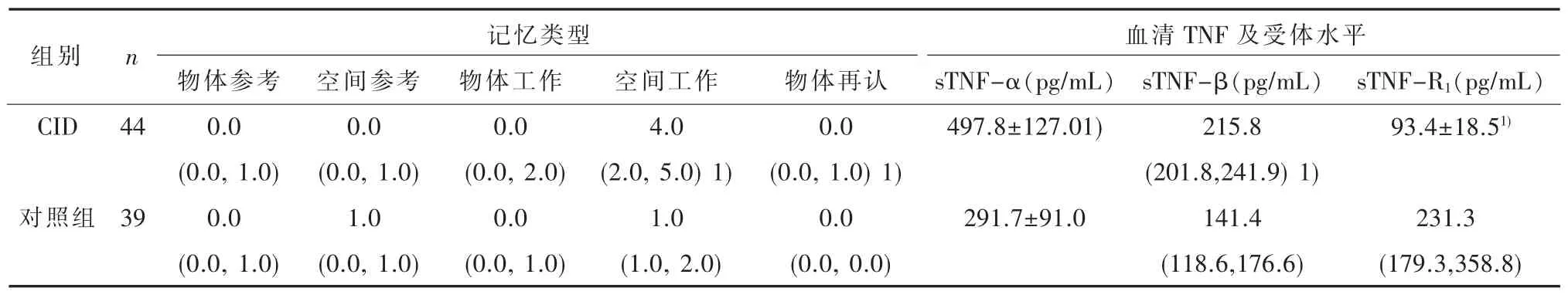
表2两组间的记忆成绩(错误数)、血清肿瘤坏死因子及受体的比较
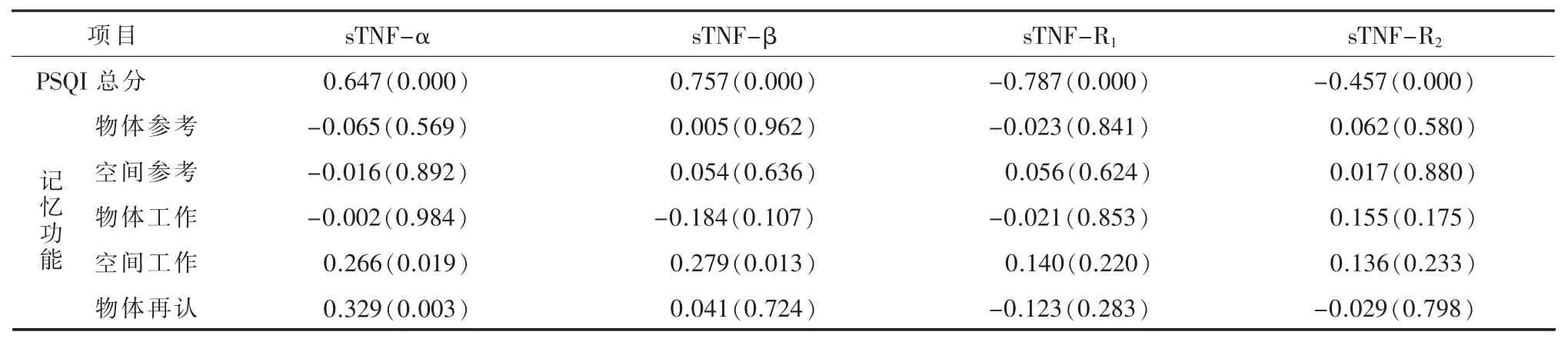
表3 所有受试者血清肿瘤坏死因子及受体与失眠和记忆功能的相关性[r(P)]

表4 CID组血清肿瘤坏死因子及受体与记忆功能的相关性[r(P)]
睡眠紊乱与炎症因子间的关系已有大量研究。Meta分析表明睡眠紊乱与2个系统性炎症标志(C反应蛋白和IL-6)间存在联系[15]。然而,睡眠紊乱可能与TNF-α无关,但此结论受统计学把握度低的限制[15]。对于失眠与炎症因子间的关系,目前仅能发现2项小样本国外研究,且都是关于IL-6的[9-10]。我们前期的结果表明CID患者血液中sTNF-α水平增加[11]。本研究证实了我们以前的结果,并首次显示CID患者血液中sTNF-β也显著增加。我们的结果表明CID患者sTNF-α和sTNF-β水平分别比对照组增加了70%和50%(表2)。有趣的是,我们的结果还显示升高的sTNF-α联系着损害的空间工作记忆和物体再认记忆,sTNF-β也与空间工作记忆错误数成正相关(表3和表4)。这提示sTNF-α比sTNF-β可能更多地联系了CID患者的记忆损害。可能是TNF-β对神经的保护作用强于sTNF-α的缘故[16]。
sTNF-Rs是自然产生的TNF活性抑制剂和调节剂[17]。 有 2 个 sTNF-Rs,即 sTNF-R1(p55)和sTNFR2(p75)。 在许多临床情况下 sTNF-Rs增加,可作为疾病活性的标志[17]。侧脑室注射sTNF-R1可削弱生理性睡眠,即sTNF-R1涉及TNF致睡眠效应的抑制[17]。在外周循环sTNF-Rs水平的改变(即便是皮克级)都可能影响复杂的脑功能,如睡眠、情绪。仅有一项研究探索了sTNF-R1睡眠-觉性依赖性变异,发现sTNF-R1在经受88 h完全性睡眠剥夺含量增加,但这种效应不见于每12 h打盹2 h的个体[18]。一项节律性研究发现,sTNF-R1和sTNFR2的24 h变异以单余弦曲线为特征,高峰时间近早6点(即将醒来之前)[18]。本研究似乎是首次描述CID患者血中sTNF-R1和sTNF-R2浓度的变化及其与记忆损害的关系。结果表明患者血清2个可溶性受体浓度都显著低于对照组,即sTNFR1仅为对照组的约40%,sTNF-R2仅为对照组的约 70%(表2)。 血清 sTNF-R1和 sTNF-R2浓度与记忆成绩无显著相关性(表3和表4)。这些结果表明sTNF-R1和sTNF-R2不涉及CID患者认知功能的改变。
本研究探讨了CID患者客观记忆功能、血清TNF及其受体水平的变化,结果提示CID患者血清TNF水平改变可能与其客观认知障碍有关,这为CID患者认知损害的神经生物学机制提供了理论基础。本研究样本量相对较小,睡眠监测指标较单一,且未细化干扰因素,及未检测其它炎症因子水平,未来的研究有待引入更多因素并扩大样本量,探索CID患者炎症因子与认知损害的因果关系。
[1]陈贵海,黄流清,赵忠新.失眠.//赵忠新主编.睡眠医学[M].第一版,北京:人民卫生出版社,2016,83-116.
[2]AMERICAN ACADEMY OF SLEEP MEDICINE.International classification of sleep disorders,3rd ed[M].Darien,IL:American Academy of Sleep Medicine,2014.
[3]SHEKLETON JA,FLYNN-EVANS EE,MILLER B,et al.Neurobehavioral performance impairment in insomnia:relationships with self-reported sleep and daytime functioning [J].Sleep,2014,37(1):107-116.
[4]FORTIER-BROCHU E,MORIN CM.Cognitive impairment in individuals with insomnia:clinical significance and correlates[J].Sleep,2014,37(11):1787-1798.
[5]ChEN GH,XIA L,WANG F,et al.Patients with chronic insomnia have selective impairments in memory that are modulated by cortisol[J].Psychophysiology,2016,53(10):1567-1576.
[6]LORTON D,LUBAHN CL,ESTUS C,et al.Bidirectional communication between the brain and the immune system:implications for physiological sleep and disorders with disrupted sleep[J].Neuroimmunomodulation,2006,13(5-6):357-374.
[7]CLINTON JM,DAVIS CJ,ZIELINSKI MR,et al.Biochemical regulation of sleep and sleep biomarkers[J].J Clin Sleep Med,2011,7(S5):S38-S42.
[8]KAPSIMALIS F,RICHARDSON G,OPP MR,et al.Cytokines and normal sleep[J].Curr Opin Pulm Med,2005,11(6):481-484.
[9]VGONTZAS AN,ZOUMAKIS M,PAPANICOLAOU DA,et al.Chronic insomnia is associated with a shift of interleukin-6 and tumor necrosis factor secretion from nighttime to daytime[J].Metabolism,2002,51(7):887-892.
[10]BURGOS I,RICHTER L,KLEIN T,et al.Increased nocturnal interleukin-6 excretion in patients with primary insomnia:A pilot study[J].Brain Behav Immun,2005,20(3):246-253.
[11]黄艳,夏兰,陈贵海.原发性失眠患者肿瘤坏死因子-α改变的研究 [J].中华临床医师杂志(电子版),2013,7(7):87-89.
[12]魏启国,陈贵海,夏兰,等.失眠障碍患者不同亚型间记忆和睡眠参数的差异及其相关性研究[J].中华神经科杂志,2015,48(9):763-767.
[13]JEWETT KA,KRUEGER JM.Humoral sleep regulation;interleukin-1 and tumor necrosis factor[J].Vitam Horm,2012,89:241-257.
[14]SHOHAM S,DAVENNE D,CADY AB,et al.Recombinant tumor necrosis factor and interleukin 1 enhance slow-wave sleep[J].Am J Physiol,1987,253(1 Pt 2):R142-R149.
[15]IRWIN MR,OLMSTEAD R,CARROLL JE.Sleep disturbance,sleep duration,and inflammation:a systematic review and metaanalysis of cohort studies and experimental sleep deprivation[J].Biol Psychiatry,2016,80(1):40-52.
[16]PAE CU.Potential role of lymphotoxin-alpha (tumor necrosis factor-beta)in the development of schizophrenia [J].Med Hypotheses,2007,68(6):1359-1362.
[17]WATANABE E,BUCHMAN TG,HIRASAWA H,et al.Association between lymphotoxin-α (tumor necrosis factor-?) intron polymorphism and predisposition to severe sepsis is modified by gender and age[J].Crit Care Med,2010,38(1):181-193.
[18]HAACK M,POLLM A..CHER T.Diurnal and sleep-wake dependent variations of soluble TNF-and IL-2 receptors in healthy volunteers[J].Brain Behav Immun,2004,18(4):361-367.
The study on the correlation of serum levels of tumor necrosis factor with memory in the patients with chronic insomnia disorder.
WANG Fang,QU Ping,XIA Lan,CHEN Gui-hai.Department of Neurology,the First Affiliated Hospital of Anhui Medical University,Hefei 230022,China.Department of Neurology,the Second Affiliated Hospital of Anhui Medical University,Hefei 230601,China.Department of Neurology,the Affiliated Chaohu Hospital and the Center in Psychologic Medicine of of Anhui Medical University,Hefei,238000,China.Tel:0551-82324252
Objective To explore the changes of serum levels of tumor necrosis factors(sTNF-α and sTNF-β)and their soluble receptors (sTNF-R1and sTNF-R2),and analyze their relationship with sleep quality and memory in patients with chronic insomnia disorder(CID).Methods Forty-four CID patients and 39 normal controls were enrolled.Pittsburgh Sleep Quality Index (PSQI)and Nine-Box Maze Test were used to assess the insomnia severity and memory functions,respectively.The serum levels of sTNF-α,sTNF-β,sTNF-R1and sTNF-R2were examined using protein-chip technology.Results Compared to the controls,CID patients had significantly higher number of errors in spatial working(Z=5.362,P<0.001)and object recognition memories (Z=3.260,P=0.001)in the Nine-Box Maze.In addition,CIDpatients had higher levels of sTNF-α and sTNF-β (Ps<0.001),and lower levels of sTNF-R1and sTNF-R2(Ps<0.001).The Spearmen correlation analysis showed that the levels of sTNF-α and sTNF-β were positively correlated with the scores of PSQI(Ps<0.001),whereas the levels of sTNF-R1and sTNF-R2were negatively correlated with the scores of PSQI(Ps<0.001).In the CID patients,sTNF-α levels were positively correlated with the errors in both spatial working(γ=0.380,P=0.017)and object recognition (γ=0.349,P=0.030)memories,whereas sTNF-β levels were only positively correlated with the error in spatial working memory(γ=0.414,P=0.009).The levels of sTNF-R1and sTNFR2were not correlated with memory performance (Ps>0.05).Conclusion CID patients have increased levels of sTNF-α and sTNF- whereas have decreased levels of R1and R2.The elevated sTNF-α and sTNF-β levels are correlated with memory disorders in CID patients.
Insomnia Tumor necrosis factor Soluble tumor necrosis factor receptor Memory
R730.264
A
10.3969/j.issn.1002-0152.2017.09.005
☆ 安徽省年度重点科研计划项目(编号:1301043041)
* 安徽医科大学第一附属医院神经内科(合肥230022)
△ 安徽医科大学第二附属医院神经内科
※ 安徽医科大学附属巢湖医院神经内科
○☆ 通信作者(E-mail:doctorcgh@163.com)
2017-06-05)
李立)
