液质联用检测微生物菌群高丝氨酸内酯类信号分子
2017-12-13*
*
(1.河北科技大学 环境科学与工程学院,石家庄 050018;2. 天津城建大学 环境与市政工程学院,天津 300384)
液质联用检测微生物菌群高丝氨酸内酯类信号分子
刘云曼1李亚静2张燕2宋圆圆2牛文钰1廉静1*郭建博2
(1.河北科技大学 环境科学与工程学院,石家庄 050018;2. 天津城建大学 环境与市政工程学院,天津 300384)
建立了高效液相色谱-串联质谱法同时定量检测高丝氨酸内酯类信号分子的方法。利用群体感应规律揭示颗粒污泥反应器快速启动机制。本方法首先取自反应器的活性污泥经离心分离,用乙酸乙酯萃取,旋转蒸干后经甲醇溶解定容可直接进样测量;然后选取C18(50mm×4.6mm,1.8μm)色谱柱进行分离,甲醇与水(含0.1%甲酸)作为流动相进行梯度洗脱,采用电喷雾正离子模式(ESI+)电离,多反应监测(MRM)模式进行定性定量测定,分析时间为8.5min。对7种AHLs检测的结果表明,在10~1000μg/L的范围内呈现良好的线性关系,检出限为310μg/L,在低、中、高3个加标水平下的回收率为96.57%~122.70%,相对标准偏差为0.21%~5.87%。
厌氧氨氧化 信号分子 酰基高丝氨酸内酯 高效液相色谱-串联质谱
群体感应是细胞间进行通信且协调生理过程的行为,发生在细胞群体水平,依赖于细胞密度的变化。微生物细胞间的交流通过检测微生物分泌的化学信号、电信号等进行分析[3]。信号分子是微生物用于细胞交流而分泌的一类特殊的菌体代谢产物,是群体感应中的重要媒介,且在不同种类的菌体间具有通用性[4]。当信号分子的浓度达到一定的阈值时可调控基因的表达[5],如毒性因子的表达、抗生素和胞外酶的产生、细胞膜的生成等[6-9]。
群体感应中细菌分泌的信号分子主要有三类:革兰氏阴性菌分泌的带不同酰基侧链的高丝氨酸内酯类(AHLs);革兰氏阳性菌分泌的寡肽类(AIP);革兰氏阴性菌和革兰氏阳性菌均可分泌的2号诱导物类(AI-2),种内和种间交流均可使用的特异性交流信号[1,6,7, 10]。厌氧氨氧化菌为革兰氏阴性菌,分泌AHLs类信号分子。由于微生物产生的信号分子的浓度极低,检测困难,探索合适的检测信号分子的方法很有意义。
检测信号分子的方法有多种,传统的检测方法有利用生物传感菌作为传感器来检测AHLs的存在;还有利用薄层层析与生物感应器相结合的方法检测AHLs的种类[11, 12],但是无法进行准确的定性定量分析。近年来高效液相色谱-质谱联用、气相色谱-质谱联用技术作为新的检测方法被用来检测信号分子的存在[11],有关利用此技术测定反硝化颗粒污泥快速启动厌氧氨氧化反应器过程中信号分子的研究尚未有报道。本研究以7种AHLs(C4、C6、C8、3-OXO-C8、C10、C12、C14)为标样,在低浓度条件下,建立了HPLC-MS对复杂菌群信号分子的快速检测和定量分析方法,对厌氧氨氧化菌和反硝化菌分泌的信号分子进行检测,通过颗粒污泥群体感应规律,揭示反硝化颗粒污泥快速启动厌氧氨氧化反应器的机制。
1 实验部分
1.1 仪器与试剂
Agilent 6410B液质联用仪,美国安捷伦公司; RE-5203旋转蒸发仪,上海亚荣生化仪器厂。
N-丁基高丝氨酸内酯(C4-HSL),N-己基高丝氨酸内酯(C6-HSL),N-辛基高丝氨酸内酯(C8-HSL),N-OXO-辛基高丝氨酸内酯(3-OXO-HSL),N-癸酰基高丝氨酸内酯(C10-HSL), N-十二烷基高丝氨酸内酯(C12-HSL),N-十四基高丝氨酸内酯(C14-HSL)(7种信号分子结构式见图1)的标准品均购自美国Sigma公司;甲醇、甲酸(色谱纯),乙酸乙酯(分析纯),购自天津市化学试剂供销公司。用甲醇溶解标准品,配制成250mg/L的标准储备液,-20℃存储备用。实验用水为超纯水。

图1 7种AHLs结构式
1.2 样品前处理
实验样品取自本实验室利用UASB反应器培养驯化的厌氧氨氧化污泥[13],此污泥利用反硝化颗粒污泥掺杂少量的厌氧氨氧化污泥的驯化方法培养。取30mL颗粒污泥与出水的混合样品用研钵捣碎后超声破碎2min,在17000g/min离心10min,取上清液过0.45μm的滤膜后,用等量的乙酸乙酯萃取3次,取上层有机相旋转蒸干[14, 15],用甲醇定容至2mL,HPLC-MS/MS分析。
1.3 实验方法
1.3.1色谱条件
C18色谱柱(安捷伦公司,50mm×4.6mm,1.8μm),柱温35℃,流速300μL/min,进样体积10μL,分析时间8.5min;流动相:A为甲醇,B为含有0.1%甲酸的超纯水。梯度洗脱条件见表1。

表1 梯度洗脱参数
1.3.2 质谱条件
采用电喷雾正离子扫描模式(ESI+),多反应离子监测(MRM);电喷雾电压:4000V;离子源温度:350℃;雾化气压力:40psi,载气为N2,流量9L/min。粉碎电压:60~105V;碰撞能:10eV;倍增电压:200 V。
2 结果与讨论
2.1 色谱条件的优化
分别选用甲醇-水和乙腈-水作为流动相,实验结果表明,以甲醇-水为流动相得到的色谱图分离效果较好。同时,在流动相中加入0.1%的甲酸提高了检测的灵敏度,降低了检出限和定量限。在上述选定的条件下对AHLs分析检测,得到7种AHLs的色谱图(图2),样品在8.5min可完全分离。
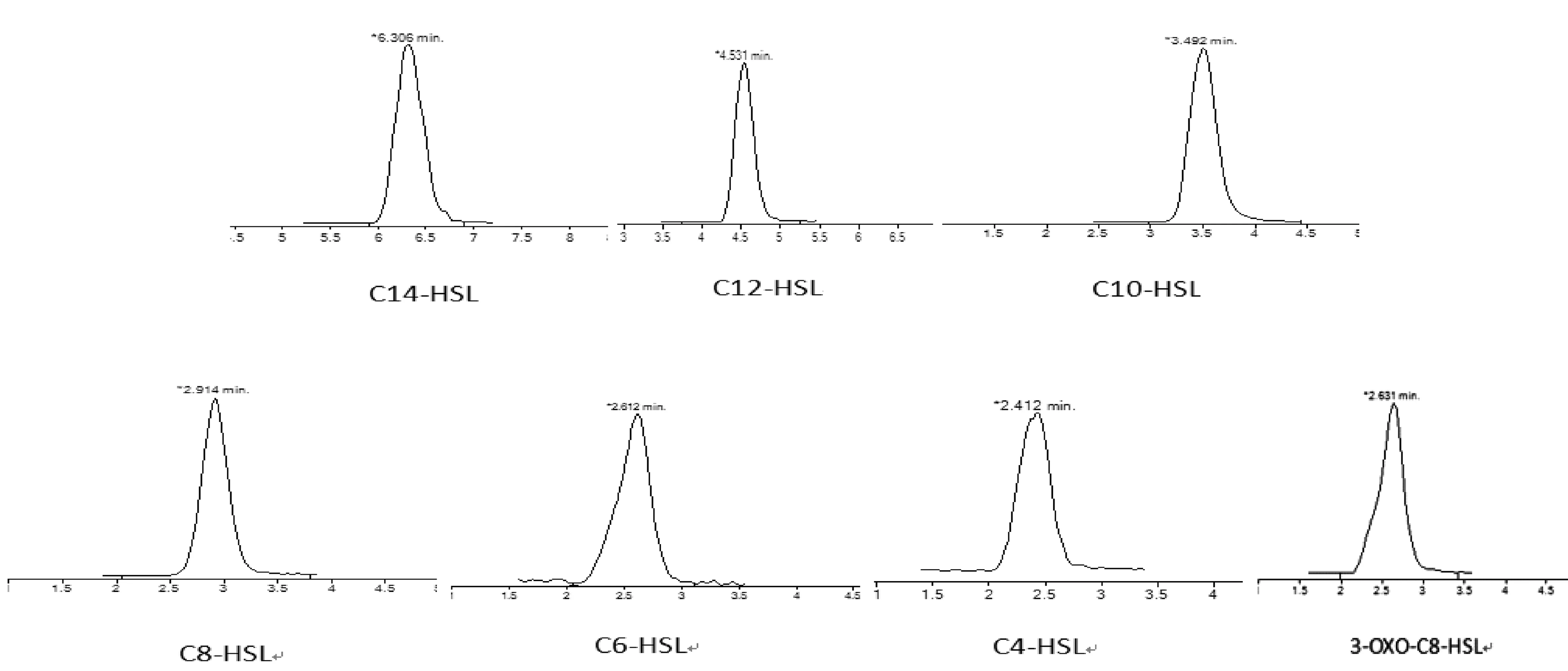
图2 7种AHLs色谱图
2.2 质谱条件的优化
采用MRM模式对粉碎电压、碰撞能、母离子和两对子离子等条件进行优化,7种信号分子优化后的条件见表2。

表2 多反应监测(MRM)模式下7种AHLs优化后的质谱条件
2.3 线性关系和检出限
用甲醇配制7种信号分子的混合标准液,设置6个质量浓度梯度,标准系列分别为10、20、50、 100、500和1000μg/L。以质量浓度为横坐标,定量离子m/z102的峰面积为纵坐标,绘制标准工作曲线。结果表明,在10~1000μg/L的范围内,7种信号分子浓度与对应的峰面积有良好的线性关系,相关系数R2均大于0.997。以S/N=3计算出的检出限为2~3μg/L,以S/N=10计算出的定量限为6.7~20μg/L(见表3)。

表3 7种AHLs的线性关系和检出限及定量限
2.4 方法的准确度和精密度
向待测样中分别加入20μg/L、100μg/L和500μg/L的混合标准液,对低、中、高3个加标水平平行测量6次,根据峰面积计算回收率,结果如表4。7种信号分子的平均回收率为96.6%~122.7%,相对标准偏差为0.21%~5.87%。

表4 7种AHLs的回收率与相对标准偏差
2.5 实际样品的分析
从实际运行的厌氧氨氧化反应器和反硝化反应器中取20g湿污泥,按1.2所述的方法对泥样进行前处理后,检测两种微生物分泌的信号分子,检测结果表明Anammox确实存在群体感应系统。如图3所示,利用反硝化污泥掺杂少量的厌氧氨氧化污泥培养驯化的厌氧氨氧化颗粒污泥与反硝化颗粒污泥分泌相同种类的信号分子,通过图3可以看出两种微生物分泌的C8-HSL与3-OXO-C8-HSL的量基本相同。但是对于C10-HSL和C12-HSL,反硝化菌的分泌量明显高于厌氧氨氧化菌,由此推测可能是C10-HSL和C12-HSL两种信号分子共同起作用,触发某种群体感应系统,实现了反硝化菌与厌氧氨氧化菌之间的“语言交流”,促进了厌氧氨氧化反应器的快速启动,此推论需进一步实验进行验证。

图3 Anammox与反硝化菌释放的AHLs的含量
3 结论
本研究建立高效液相色谱-质谱法检测高丝氨酸内酯类信号分子。通过对检测条件的优化,能够对信号分子进行快速、准确的定量分析。同时,应用此检测方法对反应器中实际的厌氧氨氧化和反硝化颗粒污泥样品进行分析测定,证明anammox确实存在群体感应系统,而且两种微生物能够分泌相同种类的信号分子,为进一步揭示二者协同作用关系提供了理论依据,也为其它种类信号分子的检测提供了技术支撑。
[1]王立燕,刘永生.细菌群体感应种类及其信号分子的研究进展[J].中国预防兽医学报,2015,37(4):318-320.
[2]Li Yaochen, Zhu Jianrong.Role of N-acyl homoserine lactone (AHL)-based quorum sensing (QS) in aerobic sludge granulation[J].Appl Microbiol Biotechnol, 2014,98(17): 7623-7632.
[3]戴昕,周佳恒,朱亮,徐向阳.生物聚集体中群体感应作用的研究进展[J].应用生态学报,2014,25(4:):1206-1212.
[4]郑昕,汪美贞,沈东升.群体感应对生物强化过程影响[J].科技通报,2013,29(11):189-194.
[5]Gobbetti M, Angelis M D, Cagno R D,et al.Cell-cell communication in food related bacteria.Int J Food Microbiol, 2007, 120(1-2): 34-45.
[6]Ding Yangcheng, Feng Huajun, Huang Wenkun, et al.A sustainable method for effective regulation of anaerobic granularsludge: Artificially increasing the concentration of signal molecules bycultivating a secreting strain[J]. Biochemical Engineering Journal, 2015, 103: 270-276.
[7]Hooshangi Sara, Bentley W E. From unicellular properties to multicellular behavior:bacteria quorum sensing circuitry and applications[J].Curr Opin Biotechnol, 2008, 19(6): 550-555.
[8]Ding Yangcheng, Feng Huajun, Huang Wenkun,et al. A sustainable method for effective regulation of anaerobic granularsludge: Artificially increasing the concentration of signal molecules bycultivating a secreting strain[J]. Bioresour Technol, 2015, 196: 273-278.
[9]Sun Supa, Liu Xiang, Ma Buyun ,et al. The role of autoinducer-2 in aerobic granulation using alternating feedloadings strategy[J].Bioresour Technol, 2016, 201: 58-64.
[10]张彩凤.细菌群体感应系统信号分子的分类及检测[J].生命科学仪器,2011,9:52-53.
[11]郭秀春,郑立,张魁英,徐鲁燕,王小如.气相色谱-质谱法检测细菌中氮酰基高丝氨酸内酯类信号分子.分析测试学报, 2012,31(3):347-350.
[12]储卫华,刘永旺,朱卫. 群体感应信号分子及其抑制剂快速检测方法的建立[J].生物技术通报,2011,3:166-169.
[13]Guo Jianbo, Wang Sihui, Lian Jing, et al.Rapid start-up of the anammox process: Effects of five different sludge extrac-ellular polymeric substances on the activity of anammox bacteria[J]. Bioresour Technol, 2016, 220: 641-646.
[14]Feng Huajun, Ding Yangcheng,Wang Meizhen, et al.Where are signal molecules likely to be locatedin anaerobic granular sludge[J]. Water Res, 2014, 50: 1-9.
[15]马晨晨,李柏林,欧杰,王婧,赵俊虹.高效液相色谱-串联质谱法同时测定细菌群体感应11 种 AHLs类信号分子.分析化学,2010,38(10):1428-1432.
SimultaneousdeterminationofsevenN-acyl-homoserinelactone(AHLs)secretedusingbacteriabyHPLC-MS/MS.
LiuYunman1,LiYajing2,ZhangYan2,SongYuanyuan2,NiuWenyu1,LianJing1*,GuoJianbo2
(1.HebeiUniversityofScienceamp;Technology,Shijiazhuang050018,China;2.TianjinChengjianUniversity,Tianjin300384,China)
The activated sludge from the reactor was separated by centrifugation and extracted with ethyl acetate, and the sample was directly measured by dissolution of methanol after the rotary drying. C18- (50mm × 4.6mm, 1.8μm) column was selected as a HPLC column while methanol and water (containing 0.1% formic acid) were used as the mobile phase for gradient elution. Electrospray ionization mode (ESI _+) ionization and multiple reaction monitoring (MRM ) model were used for qualitative and quantitative determination.The analysis time was 8.5min. The results of the seven AHLs showed that the detection limit was 3-10μg/L, and the recoveries were 96.57%-122.70% at the three levels of low, medium and high. The relative standard deviations (RSDs) were 0.21%-5.87%. The linearship was good in the range of 10-1000μg/L.
anammox; signal mocelule; acyl-homoserine lactones;HPLC-MS/MS
国家自然科学基金资助项目(No. 51678387);天津市自然科学基金重点项目,
10.3969/j.issn.1001-232x.2017.05.005
2017-05-08
刘云曼,女,1993年出生,研究生,E-mail:ydmb1993@163.com。
