利用烟气脱硫中间产物亚硫酸钙与芒硝制备亚硫酸氢钠
2017-12-13吕凯孟红霞洪成林乔秀文齐誉但建明
吕凯 ,孟红霞 ,洪成林 ,乔秀文 ,齐誉 ,但建明 *
(1石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/省部共建国家重点实验室培育基地/材料化工新疆维吾尔自治区重点实验室,新疆 石河子 832003;2新疆天业集团天辰水泥公司,新疆 石河子 832000)
利用烟气脱硫中间产物亚硫酸钙与芒硝制备亚硫酸氢钠
吕凯1,孟红霞2,洪成林1,乔秀文1,齐誉1,但建明1*
(1石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/省部共建国家重点实验室培育基地/材料化工新疆维吾尔自治区重点实验室,新疆 石河子 832003;2新疆天业集团天辰水泥公司,新疆 石河子 832000)
湿法石灰/石灰石-石膏法为目前主要的烟气脱硫技术,但其中间产物亚硫酸钙的氧化过程需消耗大量能源且烟气中硫资源未被回收利用。为简化湿法烟气脱硫氧化过程和节省电能消耗,并实现烟气硫资源的回收利用,本文研究将亚硫酸钙转化为亚硫酸氢钠。本文以亚硫酸钙转化率为指标,亚硫酸钙、硫酸钠和硫酸为反应物,探究反应物比例、亚硫酸钙浓度、硫酸浓度、反应温度等因素对转化率及反应液NaHSO3浓度的影响。通过正交实验确定该反应的最优条件为:亚硫酸钙浓度为 30%,反应物比例关系为 nCaSO3∶nH2SO4∶nNa2SO4=1∶1.1∶1,硫酸浓度为 3 mol/L,反应温度为 20℃。最优条件下,转化率可达到94.05%,反应液NaHSO3浓度达到205 g/L,这表明脱硫中间产物亚硫酸钙制备亚硫酸氢钠具有可行性,符合环保循环理念,具有重要的理论意义和现实意义。
脱硫中间产物;亚硫酸钙;硫酸钠;亚硫酸氢钠;转化率
我国硫资源短缺[1],过渡依赖进口硫,烟气脱硫技术向回收硫资源、可再生方向发展。湿法石灰/石灰石—石膏法作为烟气脱硫的主要技术[2],技术成熟、脱硫效率高且稳定[3-4],但其为不可再生脱硫技术[5]。该法在脱硫过程中将脱硫中间产物亚硫酸钙强制氧化成石膏[6-8],不仅消耗大量电能,且烟气中的SO2未被回收利用。与此同时,我国芒硝资源十分丰富[9],氯碱工业也产生大量工业芒硝,但由于其附加价值低,不利于远距离运输利用。
亚硫酸盐是一种应用范围广、用量较大的基础化工产品,其附加价值较高,具有广阔的市场前景[10-11]。若将烟气脱硫中间产物亚硫酸钙和氯碱化工副产物芒硝转化为具有较好附加价值的亚硫酸氢钠,则不仅可以简化湿法脱硫工艺、节省设备投资、降低电能消耗,循环利用工业固废,还可得到较高附加价值的亚硫酸盐。目前直接利用烟气中SO2制备亚硫酸钠或亚硫酸氢钠目前也有较多研究。徐小勇[12]对烟气中低浓度SO2制备亚硫酸氢钠的可行性进行分析,提出该过程存在两个问题,即烟气中二氧化硫浓度过低以及烟气成分复杂。姜孝先[13]等研究以石灰、芒硝吸收SO2后用石灰中和制备亚硫酸钠,所制得产品中亚硫酸钠含量仅为90%。李春萍[14]等研究由芒硝、石灰采用两步吸收反应制备高浓度的亚硫酸钠。以上研究尚无利用脱硫中间产物亚硫酸钙和工业芒硝制备亚硫酸氢钠的研究。
通过研究亚硫酸钙与芒硝和硫酸间的反应,使烟气中低浓度的SO2资源转化成附加值较高的亚硫酸氢钠,在简化脱硫工艺的同时提升脱硫产物的附加产值,符合环保循环经济理念,具有重要的理论意义和现实意义。本文利用脱硫中间产物亚硫酸钙与芒硝和硫酸反应制备亚硫酸氢钠,其反应方程式为:2CaSO3+Na2SO4+H2SO4+4H2O=2CaSO4·2H2O+2NaHSO3。
1 实验部分
1.1 材料和仪器
1.1.1 材料
亚硫酸钙,纯度90%,购自上海阿拉丁生化科技股份有限公司;无水硫酸钠,分析纯,购自天津市盛奥试剂有限公司;浓硫酸,98%,分析纯,购自天津市富宇精细化工有限公司。
1.1.2 仪器设备
电子天平XY600-2C,常州市幸运电子设备有限公司;机械搅拌器 RW20digital,IKA;搅拌恒温水浴锅 RCT basic,IKA;三口烧瓶,250 mL,四川蜀玻(集团)有限责任公司;恒压分液漏斗,60 mL,北京欣维尔玻璃仪器有限公司。
1.2 实验方法
1.2.1亚硫酸氢钠的制备
将亚硫酸钙配成悬浮液,一定温度下以300 r/min搅拌15 min,在密闭条件下将溶有硫酸钠的硫酸混合溶液以一定的速度滴至亚硫酸钙悬浮液中,混合液滴加完后继续反应30 min,减压抽滤,蒸馏水洗涤沉淀数次,合并滤液和洗涤液,并定容,为反应制备NaHSO3溶液。
1.2.2 反应转化率及HSO3-浓度的测定
根据HG/T 2967-2010《工业无水亚硫酸钠》[15]和HG/T3814-2006《工业亚硫酸氢钠》[16]测定原料CaSO3及制备NaHSO3溶液中SO2含量。反应转化率计算公式如下:

上式中:V1,V2分别为制备 NaHSO3溶液和 CaSO3滴定消耗Na2S2O3溶液体积,mL。
制备NaHSO3溶液中HSO3-浓度计算公式如下:

式(2)中:cNa2S2O3为 Na2S2O3标准溶液浓度,mol/L;VNa2S2O3为滴定NaHSO3所需Na2S2O3标准溶液体积,mL;MNaHSO3为 NaHSO3的摩尔质量,g/mol;V反应液为制备NaHSO3溶液总体积,L。
2 结果与分析
2.1 硫酸加入量对亚硫酸钙转化率的影响
反应物比例为 nCaSO∶nNa2SO4=1∶1.2,亚硫酸钙悬浮液浓度为10%,硫酸浓度为0.5 mol/L,反应温度为30℃,考察硫酸加入量对转化率的影响,结果如图1所示。
图1显示:随着硫酸量的增加,当硫酸量为80%-105%时,反应转化率呈上升趋势,而当硫酸量超过105%时,反应转化率明显下降。其原因是:亚硫酸钙为碱性物质,随着硫酸逐滴加入到亚硫酸钙悬浮液中,亚硫酸钙与硫酸反应不断生成可溶性的亚硫酸氢盐。当硫酸量为105%时,亚硫酸钙转化率达到最大,接近95%。因亚硫酸氢盐只能存在于弱酸性体系中,当硫酸用量超过105%时,体系酸度过高,此时过量硫酸与反应体系中生成的HSO3-反应生成SO2而逸出反应体系,造成反应体系中亚硫酸氢盐浓度降低,最终表现为亚硫酸钙反应转化率降低。故硫酸加入量为105%左右为宜。

图1 硫酸加入量对亚硫酸钙转化率的影响Fig.1 The effect of amount of sulphuric acid on the CaSO3conversion
2.2 硫酸钠加入量对亚硫酸钙转化率的影响
反应物比例为 nCaSO3∶nH2SO4=1∶1,亚硫酸钙悬浮液浓度为10%,硫酸浓度为0.5 mol/L,反应温度为30℃,考察硫酸钠加入量对转化率的影响,其结果如图2所示。
由图2可知:随着硫酸钠量增加,亚硫酸钙转化率逐渐增大,当硫酸钠量达到100%时,转化率达到最大值为94.36%,当硫酸钠量超过100%时,反应转化率降低。这是由于该反应过程中,亚硫酸钙与硫酸反应生成硫酸钙与亚硫酸氢钙,亚硫酸氢钙电离出钙离子,加入硫酸钠可与钙离子发生沉淀反应生成硫酸钙和亚硫酸氢钠,当加入硫酸钠量过多,造成硫酸-硫酸钠混合溶液粘度过大,则不利于反应的进行,使反应转化率降低。故硫酸钠量为100%为宜。

图2 硫酸钠加入量对亚硫酸钙转化率的影响Fig.2 The effect of amount of sodium sulfate on the CaSO3conversion
2.3 反应温度对亚硫酸钙转化率的影响
由图3可知:在研究温度范围内,转化率均达到90%以上,反应温度对转化率的影响较小。当反应温度低于20℃时,转化率随反应温度升高而增大,当反应温度超过20℃时,转化率随反应温度升高逐渐降低。这是由于该反应为放热反应,在低浓度反应体系中,升高反应温度可提高反应速率,防止亚硫酸钙与硫酸反应时因局部过浓而生成SO2,使反应正向进行,反应转化率增大;反应温度过高,反应体系中SO2溶解度降低,将造成SO2未能及时与CaSO3反应而逸出反应体系,造成转化率降低。故保持反应体系的温度为20℃左右为宜。

图3 反应温度对亚硫酸钙转化率的影响Fig.3 The effect of reaction temperature on the CaSO3 conversion
2.4 亚硫酸钙浓度对亚硫酸钙转化率及NaHSO3浓度的影响

图4 亚硫酸钙悬浮液浓度对亚硫酸钙转化率及NaHSO3浓度的影响Fig.4 The effect of concentration of calcium sulfite on the CaSO3conversion and concentration of NaHSO3
由图4可知:增大亚硫酸钙悬浮液浓度,反应转化率增大,当亚硫酸钙浓度为15%时,转化率达到94.39%,继续增大亚硫酸钙悬浮液浓度,反应转化率急剧降低后趋于稳定,这是由于当亚硫酸钙浓度过大时,反应体系体积过小,造成反应体系溶解SO2能力降低,而滴加硫酸因局部过浓生成的SO2未能及时与亚硫酸钙反应而逸出反应体系,造成体系转化率降低。由于亚硫酸钙浓度增大,反应后反应液NaHSO3含量逐渐升高,最高可达到74.9 g/L,但亚硫酸钙浓度过高会造成反应体系粘稠,流动性差。综合考虑亚硫酸钙浓度对转化率及反应液NaHSO3浓度的影响,故亚硫酸钙浓度以25%左右为宜。
2.5 硫酸浓度对亚硫酸钙转化率及NaHSO3浓度的影响
由图5可知,当硫酸浓度从0.5 mol/L增加到2.5 mol/L时,反应体系转化率基本保持不变,这是由于亚硫酸钙浓度过低,反应体系体积大,对滴加混合溶液起到稀释作用而未造成局部浓度过大,使反应转化率基本保持不变。当硫酸浓度达到3.0 mol/L时,硫酸钠不能全部溶解且混合液粘稠,造成反应未能完全进行而使转化率急剧下降。随着硫酸浓度的增大,使反应液中NaHSO3含量逐渐升高,但硫酸浓度达到3.0 mol/L时,因转化率急剧降低使反应液中NaHSO3含量也急剧降低。综合考虑硫酸浓度对转化率及液相中HSO3-浓度的影响,硫酸浓度选用2.5 mol/L为宜。
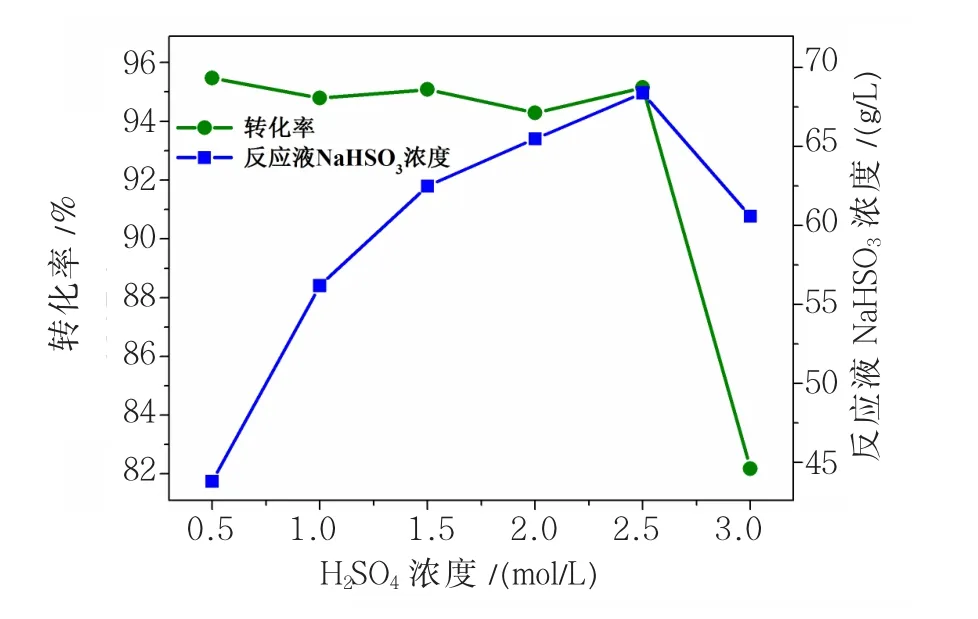
图5 硫酸浓度对亚硫酸钙转化率及NaHSO3浓度的影响Fig.5 The effect of concentration of?sulphuric acid on the CaSO3conversion and concentration of NaHSO3
2.6 正交实验确定最优反应条件
通过对该反应进行单因素实验后,对该实验进行五因素三水平正交实验:硫酸浓度(因素A,mol/L),硫酸钠用量(因素 B,%),硫酸用量(因素C,%),亚硫酸钙浓度(因素D,%),温度(因素E,℃)。检测指标为转化率(指标 x,%)和 NaHSO3浓度(指标y,g/L)。实验结果如表1所示。计算各因素各水平下每种试验指标的数据和以及平均值,并计算极差R,计算结果如表2所示。
根据极差大小列出各指标下的因素主次顺序,对转化率而言,主次顺序为CBEDA,优化水平组合为C3B3E1D1A1;对NaHSO3浓度而言,主次顺序为DABEC,优化水平组合为D3A3B2E1C2。
在2个指标中,NaHSO3浓度为关键指标,转化率为一般指标,从亚硫酸钙浓度与硫酸浓度来看,当D取D3和A取A3时,NaHSO3浓度分别增长43.7%和15.5%,而转化率仅降低1.2%和0.9%,所以取D3A3;当温度为30℃时,反应液流动性差,固液难以分离,当温度为10℃时,相对于20℃时转化率仅提高0.2%,但对实验条件更为苛刻,故选E2;同理可分析,B 取 B3,C 取 C3,优组合为 A3B3C3D3E2。

表1 正交试验结果Tab.1 The data of orthogonal test

表2 正交试验分析结果Tab.2 The analysis result of orthogonal test
2.7 验证实验
由正交实验得到最优实验条件如下:
反应物比例为 nCaSO3∶nH2SO4∶nNa2SO4=1∶1.1∶1,亚硫酸钙悬浮液浓度为30%,硫酸浓度为3 mol/L,反应温度为20℃,对其进行重复性实验,转化率为93.29%、94.48%、94.37%,平均值为94.05%,标准偏差为0.83;NaHSO3浓度分别为204、207、207 g/L,平均值为206 g/L,标准偏差为1.22。
3 讨论
(1)李晓文通过计算得出二氧化硫溶解于溶液中主要以亚硫酸氢盐的形式存在[17]。因此,该特性为离子液等再生型脱硫剂的工业应用成为可能,而这一理论结果也说明亚硫酸钙、硫酸与硫酸钠反应时反应液中主要以亚硫酸氢盐的形式存在,进一步证明本研究反应的可行性。
(2)利用 NaOH或者 NaCO3吸收烟气中 SO2制备亚硫酸钠或者亚硫酸氢钠也被广泛研究[18-22]。王亮[20]利用NaOH吸收SO2烟气直接生产亚硫酸钠和亚硫酸氢钠,二氧化硫吸收率达100%,产品中NaSO3含量为97.3%,符合工业无水亚硫酸钠优等品指标。张成立等[22]通过Na2CO3逆流吸收SO2烟气制备亚硫酸钠,二氧化硫回收率高达98.6%以上。这些方法具有二氧化硫回收率高、物料处理周期短、产量大等优点,但生产成本高。
本研究所用的方法亚硫酸钙的转化率为94.05%,相对较低,但该方法不仅针对大众型脱硫技术,且钙质脱硫剂比氢氧化钠价廉易得,对烟气中二氧化硫回收弥补我国硫资源不足的现状,提高火电厂脱硫效益,符合节约环保的经济体系,对实际生产具有重要意义。
(3)利用石灰、芒硝吸收SO2烟气制备亚硫酸钠或者亚硫酸氢钠也有相关研究[13-14]。姜孝先[13]等研究以石灰、芒硝吸收SO2制备亚硫酸钠,所制得产品中亚硫酸钠含量仅为90%,且反应需在体系二氧化硫饱和度高的条件下进行。李春萍[14]等研究由芒硝、石灰采用两步吸收反应制备高浓度的亚硫酸钠,反应液中Na2SO3含量占20.97%,但将该反应与脱硫过程简单结合,实验条件较为苛刻。与之相比,本文探讨以脱硫中间产物亚硫酸钙与芒硝、硫酸反应制备亚硫酸钠溶液,与脱硫过程相隔离,反应条件容易实现,同时为烟气脱硫过程回收硫资源提供新思路。
4 结论
(1)以亚硫酸钙、无水硫酸钠和硫酸反应制备高浓度亚硫酸氢钠,该实验转化率在90%以上,证明该反应是可行的。
(2)亚硫酸钙、硫酸钠、硫酸反应的最优条件:反应比例为 nCaSO3∶nH2SO4∶nNa2SO4=1∶1.1∶1,亚硫酸钙悬浮液浓度为30%,硫酸浓度为3 mol/L,反应温度为20℃,对最优条件进行重复实验,该反应转化率达到94.05%,NaHSO3浓度达到 206 g/L。
(3)在最优条件下,反应液流动性差,固液分离困难,同时NaHSO3浓度达到206 g/L,未达到亚硫酸氢钠的饱和浓度,有待后期研究改进。
[1]张建斌,马凯,李强,等.湿法烟气脱硫技术[J].精细石油化工,2007,24(2):64-68.Zhang J B,Ma K,Li Q,et al.Technology of wet desulfurization of flue gas[J].Speciality Petrochemicals,2007,24(2):64-68.
[2]Warych J,Szymanowski M.Model of the wet limestone flue gas desulfurization process for cost optimization[J].Ind Eng Chem Res,2001,40(12):2597-2605.
[3]唐家彬,李茹,王欢,等.湿法烟气脱硫技术现状分析[J].广东化工,2015,42(2):93-94.Tang J B,Li R,Wang H,et al.Analysis of present status of wet flue gas desulfurization[J].Guangdong Chemical Industry,2015,42(2):93-94.
[4]武春锦,吕武华,梅毅,等.湿法烟气脱硫技术及运行经济性分析[J].化工进展,2015,34(12):4368-4374.Wu C J,Lv W H,Mei Y,et al.Application and running economic analysis of wet flue gas desulfurization technology[J].Chemical Industry and Engineering Process,2015,34(12):4368-4374.
[5]Patricia Córdoba.Status of flue gas desulphurisation(FGD)systems from coal-fired power plants:overview of the physic-chemical control processes of wet limestone FGDs[J].Fuel,2015,144:274-286.
[6]Zhong Y,Gao X,Huo W,et al.A model for performance optimization of wet flue gas desulfurization systems of power plants[J].Fuel Processing Technology,2008,89(11):1025-1032.
[7]Lancia A,Musmarra D,Prisciandaro M,et al.Catalytic oxidation of calcium bisulfite in the wet limestone-gypsum flue gas desulfurization process[J].Chemical Engineering Science,1999,54(15-16):3019-3026.
[8]Lancia A,Musmarra D.Calcium bisulfite oxidation rate in the wet limestone-gypsum flue gas desulfurization process[J].Environ.Sci.Technol.,1999,33(11):1931-1935.
[9]王诗瑜.我国的芒硝资源及其利用研究[J].化学工程师,2004(1):37-38.Wang S Y.Study on the utilization of glauber's salt and resouree in our country[J].Chemical Engineer,2004(1):37-38.
[10]Liao F Y,Ye H Y,He P.Effects of NaHSO3on the photosynthesis and its application[J].Journal of Jishou University(Natural Sciences Edit),2005,26(3):49-52.
[11]Wang H W,Mi H L,Ye J Y,et al.Low concentrations of NaHSO3increase cyclic photophosphorylation and photosynthesis in cyanobacterium synechocystis PCC6803[J].Photosynthesis Research,2003,75(2):151-159.
[12]徐小勇.烟气中二氧化硫制备亚硫酸氢钠的可行性分析[J].浙江化工,2007,38(8):26-27.Xu X Y.Analysis of the feasibility of using SO2in flue gas to prepare NaHSO3[J].Zhe Jiang Chemical Industry,2007,38(8):26-27.
[13]姜孝先,徐国治,牛新书.由芒硝制亚硫酸钠的研究[J].河南师范大学学报(自然科学版),1990(4):97-99.Jiang X X,Xu G Z,Niu X S.The study of the manufacture of sodium sulphite anhydrous from sodium sulfate anhydrous[J].Journal of Henan Normal University(Natural Science),1990(4):97-99.
[14]李春萍,吉仁塔布,杨伟,等.天然芒硝和石灰制取亚硫酸钠[J].纯碱工业,1998(3):27-29.Li C P,Ji R T B,Yang W,et al.The manufacture of sodium sulphite anhydrous from sodium sulfate anhydrous and lime[J].Soda Industry,1998(3):27-29.
[15]中华人民共和国工业和信息化部.工业无水亚硫酸钠:HG/T 2967-2010[S].北京:化学工业出版社,2010:3.
[16]中华人民共和国国家发展和改革委员会.工业亚硫酸氢钠:HG/T 3814-2006[S].北京:化学工业出版社,2006:4.
[17]李晓文.浅谈二氧化硫气体溶解度常数的工业化应用[J].山东化工,2016,45(6):81-83.Li X W.Discuss solubility constant of sulfur dioxide applied to industrial production[J].Sandong Chemical Industry,2016,45(6):81-83.
[18]瞿尚君,高磊,唐照勇,等.吸收低浓度二氧化硫烟气副产无水亚硫酸钠的研究[J].硫酸工业,2015(1):51-52.Zhai S J,Gao L,Tang Z Y,et al.The research of preparing anhydrous sodium sulfite by absorbing low-concentration sulfur dioxide in flue gas[J].Sulphuric Acid Industry,2015(1):51-52.
[19]陈志刚.浅谈SO2尾气回收生产七水亚硫酸钠工艺[J].中国钼业,2015,39(2):7-9.Chen Z G.The process of recovering Na2SO3·7H2O from SO2-containingexhaust[J].ChinaMolybdenum Industry,2015,39(2):7-9.
[20]王亮.钠碱法合成亚硫酸钠和亚硫酸氢钠中试研究[J].广州化工,2013,41(11):140-142.Wang L.Pilot study on sodium alkali method for the synthesis of sodium sulfite and sodium bisulfite[J].Guangzhou Chemical Industry,2013,41(11):140-142.
[21]彭祥燕,李律.工业碱渣生产亚硫酸钠的工艺研究与应用[J].盐业与化工,2014,43(8):5-8.Peng X Y,Li L.Study and application of sodium sulfite production technology using alkaline residue[J].Journal of Salt and Chemical Industry,2014,43(8):5-8.
[22]张成立,张庆国.SO2烟气碱吸收连续化生产亚硫酸钠的研究[J].铁合金,2011(4):39-41.Zhang C L,Zhang Q G.Research on SO2smoke to produce sodium sulfite by basicity absoption[J].Ferro-alloys,2011(4):39-41.
Preparing NaHSO3with CaSO3of flue gas desulfurization and glauber's salt
Lv Kai1,Meng Hongxia2,Hong Chenglin1,Qiao Xiuwen1,Qi Yu1,Dan Jianming1*
(1 School of Chemistry and Chemical Engineering,Shihezi University/Key Laboratory for Green Processing of Chemical Engineering of Xinjiang Bingtuan/Engineering Research Center of Materials-Oriented Chemical Engineering of Xinjiang Production and Construction Corps/Key Laboratory of Materials-Oriented Chemical Engineering of Xinjiang Uygur Autonomous Region,Shihezi,Xinjiang 832003,China;2 Xinjiang Tianye Group Tianchen Cement Company,Shihezi,Xinjiang 832003,China)
Recently,the wet lime/limestone-gypsum method is the main flue gas desulfurization technology,but oxidation process from intermediate products CaSO3to gypsum demands vast energy,simultaneously,sulfur resource in flue gas not being utilized.To simplify oxidation process in the wet flue gas desulfurization technology,save energy consumption and fulfill cyclic utilization of CaSO3,the feasibility of the conversion from CaSO3to NaHSO3was researched in the paper.The article introduced a reaction between CaSO3,Na2SO4and H2SO4,regarding transformation rate as index,to prepare high-concentration NaHSO3.In the article,the effect of four factors on the conversion and concentration of NaHSO3,such as the proportion of all reagents,reaction temperature and the concentration of CaSO3and H2SO4were discussed,and then the optimal experimental condition was determined by orthogonal test,as follows:the proportion of all reagents wasnCaSO3∶nH2SO4∶nNa2SO4=1∶1.1∶1,reaction temperature was 20℃,the concentration of CaSO3was 30%and the concentration of H2SO4was 3 mol/L.Under the optimum conditions transformation rate and concentration of NaHSO3were 94.05%and 205 g/L respectively,indicating the feasibility of preparation of NaHSO3from intermediate products CaSO3.At the same time,the improvement accords with the theory of environmental economy and possesses significant theoretical and practical meaning.
intermediate products of desulfurization process;calcium sulfite;sodium sulfate;sodium bisulfite;transformation rate
TQ131.12;X781.3
A
10.13880/j.cnki.65-1174/n.2017.05.007
1007-7383(2017)05-0564-06
2016-09-23
江苏省机动车尾气治理重点实验室基金项目(OVEC021)
吕凯(1990-),男,硕士研究生,专业方向为无机非金属材料。
*通信作者:但建明(1968-),男,教授,从事无机非金属材料研究,e-mail:djm_tea@shzu.edu.cn。
