新型含吡唑基衍生物的合成与表征
2017-12-13费婷虹周英雷刘方明
费婷虹 , 周英雷,刘方明
(1.杭州师范大学材料与化学化工学院 ,浙江 杭州 310036;2.杭州和泽医药科技有限公司,浙江 杭州 310018)
新型含吡唑基衍生物的合成与表征
费婷虹1, 周英雷2,刘方明1
(1.杭州师范大学材料与化学化工学院 ,浙江 杭州 310036;2.杭州和泽医药科技有限公司,浙江 杭州 310018)
为提供具有高活性的新型先导化合物,创制高效并具有多种功效的药物新品种和良好活性的药物中间体,本文以苯肼和乙酰乙酸乙酯为起始原料,经过一系列的反应合成了12种新型含吡唑基的衍生物,并通过IR、MS、1H-NMR、元素分析及单晶衍射等方法对目标化合物进行了表征.
通过晶体表征可知其中化合物6j的晶体结构为单斜晶系,空间群为P21/c,该分子内的七元环呈扭船式构象,晶体内π-π堆积作用和氢键的存在,使得此类化合物的结构相对稳定.
吡唑; 1,5-苯并硫氮杂; 噁二唑
引 言
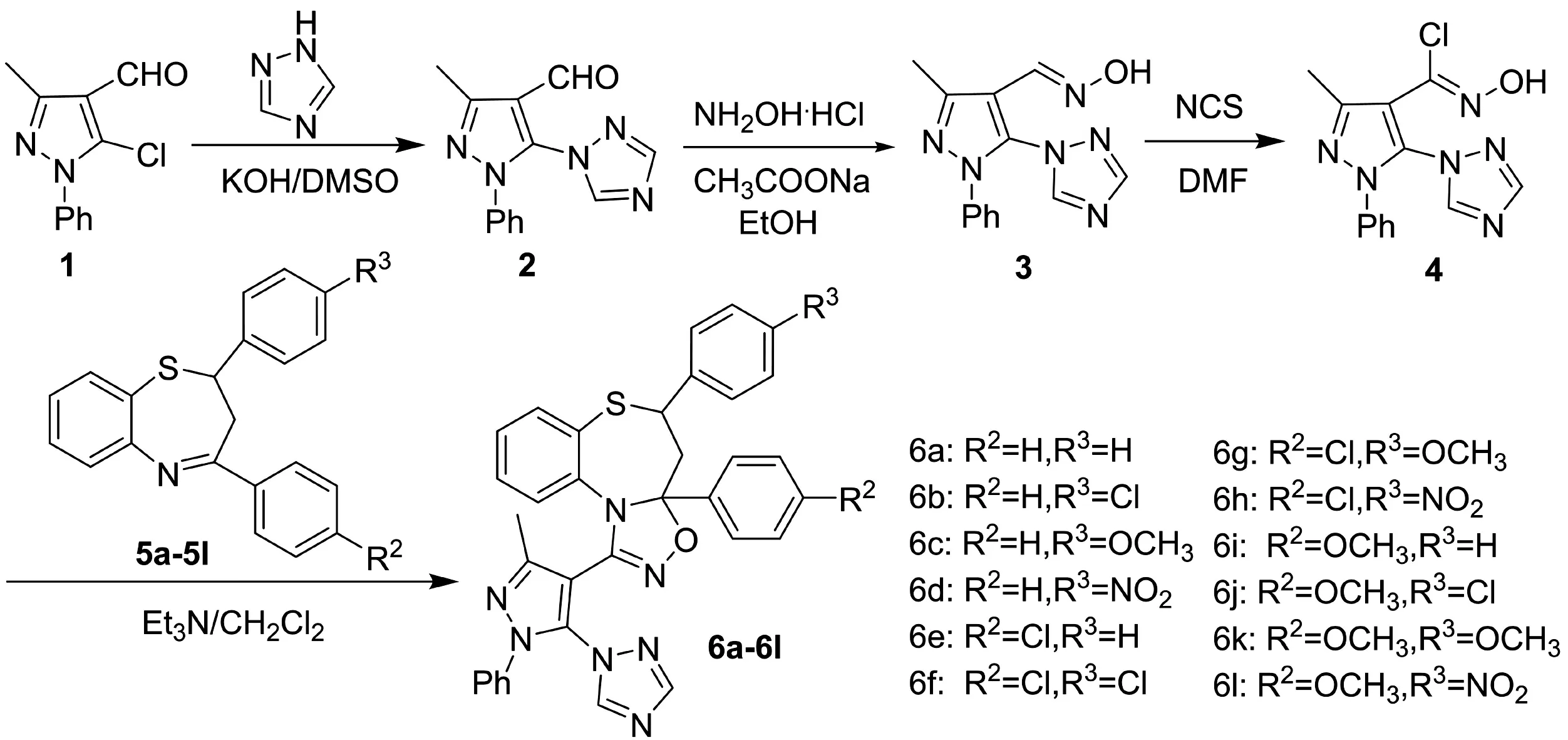
图1 目标化合物的合成路线Fig. 1 Synthetic route of target compound
基于药物合成中的活性叠加原理,本文设计并通过1,3-偶极环加成的方法合成了一系列新型的含吡唑基衍生物,有望起到活性叠加的效果.实验合成路线如图1所示.
1 实验部分
1.1 仪器与试剂
北京泰克X-5显微熔点仪; Agilent-5975质谱仪;Bruker-Tensor 27红外光谱仪(KBr压片); Bruker 400型核磁共振仪(TMS为内标);Hitachi F-4500,R-AXIS SPIDER单晶衍射仪;Perkin-Elmer 2400型元素分析仪.
1.2 化合物的合成

在20 mL的乙醇中加入三氮唑(30 mmol)和KOH(31 mmol),超声反应30min左右,旋蒸除去乙醇,再向反应瓶中加入15 mL DMSO使其溶解.温度控制在50 ℃以下,将15 mmol化合物1分批次加入,TLC跟踪,反应完全后,倒入水中待析出大量固体后,抽滤,水洗,干燥,用95%乙醇重结晶,得到产物2.产率:92%,m.p.120 ℃.
1.2.4 3-甲基-1-苯基-5-(1,2,4-三氮唑-1-基)-4-吡唑甲醛肟3的合成
在50.0 mL乙醇中加入化合物2(20.0 mmol),取少量的蒸馏水将盐酸羟胺(316.0 mg)和醋酸钠(464.0 mg)完全溶解,用恒压滴液漏斗滴加至前面溶液中,加热回流(反应过程中会有大量固体析出),TLC跟踪,待反应结束后,冷却至室温,抽滤,水洗,产物用95%乙醇重结晶,得到产物3.
1.2.5 3-甲基-1-苯基-5-(1,2,4-三氮唑-1-基)-α-氯-4-吡唑甲醛肟4的合成
在12.5 mL DMF中加入化合物3(10.0 mmol),常温搅拌下使其完全溶解,将反应控制在35 ℃以下,分5~10次分批加入15.0 mmol NCS.TLC跟踪,反应完全后倒入水中,用乙醚萃取3次,萃取后的溶液用无水硫酸镁干燥,旋蒸出去乙醚,用氯仿/石油醚重结晶,得到化合物4.

在20 mL二氯甲烷中加入化合物5a-5l(1 mmol)和化合物4(1.5 mmol),用恒压滴液漏斗滴加三乙胺(0.5 mL)和二氯甲烷(5mL)的混合液至上述溶液中,滴毕后继续常温搅拌24 hrs,TLC跟踪,待反应完全后旋蒸除去溶剂,取2~5 mL乙酸乙酯溶解待用,最后用V(乙酸乙酯):V((石油醚)= 1:5柱层析分离得到目标产物6a-6l.
6a: 白色固体, 产率 26%, mp 214-215℃. IR(KBr)v/cm-1: 3079(Ar-H), 2968(CH3), 1599(C=N), 761(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.62-6.79(m, 15H, Ar-H), 8.05(s, 1H, triazol-H), 7.98(s, 1H, triazol-H), 3.33(dd, 1H, H5x), 2.77(dd, 1H, H4b), 2.56(s, 3H, -CH3), 2.43(dd, 1H, H4a)ppm; MS(EI)m/z(%): 581(M+). Anal. Calcd. for C34H27N7OS: C, 70.20; H, 4.68; N, 16.86; Found: C, 70.14; H, 4.73; N, 16.82.
6b: 白色固体, 产率 28%, mp 195-196℃. IR(KBr)v/cm-1:3097 (Ar-H), 2971(CH3), 1596(C=N), 766(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.61-6.73(m, 15H, Ar-H), 8.12(s, 1H, triazol-H), 8.02(s, 1H, triazol-H), 3.34(dd, 1H, H5x), 2.78(dd, 1H, H4b), 2.61(s, 3H, -CH3), 2.42(dd, 1H, H4a)ppm; MS(EI)m/z(%): 616(M+). Anal. Calcd. for C34H26ClN7OS: C, 66.28; H, 4.25; N, 15.91; Found: C, 66.23; H, 4.29; N, 15.87.
6c: 白色固体, 产率 30%, mp 204-205℃. IR(KBr)v/cm-1: 3101(Ar-H), 2977(CH3), 1611(C=N), 759(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.60-6.77(m, 15H, Ar-H), 8.09(s, 1H, triazol-H), 7.95(s, 1H, triazol-H), 3.83(s, 3H, -OCH3), 3.30(dd, 1H, H5x), 2.74(dd, 1H, H4b), 2.52(s, 3H, -CH3), 2.41(dd, 1H, H4a)ppm; MS(EI)m/z(%): 611(M+). Anal. Calcd. for C35H29N7O2S: C, 68.72; H, 4.78; N, 16.03; Found: C, 68.64; H, 4.83; N, 16.00.
6d: 白色固体, 产率 27%, mp 229-230℃. IR(KBr)v/cm-1: 3085(Ar-H), 2967(CH3), 1599(C=N);1H NMR(CDCl3, 400MHz)δ: 7.59-6.75(m, 15H, Ar-H), 8.08(s, 1H, triazol-H), 7.97(s, 1H, triazol-H), 3.31(dd, 1H, H5x), 2.82(dd, 1H, H4b), 2.58(s, 3H, -CH3), 2.46(dd, 1H, H4a)ppm; MS(EI)m/z(%): 626(M+). Anal. Calcd. for C34H26N8O3S: C, 65.16; H, 4.18; N, 17.88; Found: C, 65.11; H, 4.22; N, 17.85.
6e: 白色固体, 产率 29%, mp 194-195℃. IR(KBr)v/cm-1: 3113(Ar-H), 2963(CH3), 1615(C=N), 760(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.61-6.73(m, 15H, Ar-H), 8.11(s, 1H, triazol-H), 8.03(s, 1H, triazol-H), 3.35(dd, 1H, H5x), 2.84(dd, 1H, H4b), 2.54(s, 3H, -CH3), 2.43(dd, 1H, H4a)ppm; MS(EI)m/z(%): 616(M+). Anal. Calcd. for C34H26ClN7OS: C, 66.28; H, 4.25; N, 15.91; Found: C, 66.24; H, 4.30; N, 15.88.
6f: 白色固体, 产率 28%, mp 206-207℃. IR(KBr)v/cm-1: 3136(Ar-H), 2980(CH3), 1597(C=N), 756(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.60-6.73(m, 15H, Ar-H), 8.07(s, 1H, triazol-H), 7.96(s, 1H, triazol-H), 3.31(dd, 1H, H5x), 2.74(dd, 1H, H4b), 2.60(s, 3H, -CH3), 2.54(dd, 1H, H4a)ppm; MS(EI)m/z(%): 650(M+). Anal. Calcd. for C34H25Cl2N7OS: C, 62.77; H, 3.87; N, 15.07; Found: C, 62.71; H, 3.82; N, 15.01.
6g: 白色固体, 产率 33%, mp 232-233℃. IR(KBr)v/cm-1: 3125(Ar-H), 2969(CH3), 1613(C=N), 763(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.59-6.72(m, 15H, Ar-H), 8.05(s, 1H, triazol-H), 7.98(s, 1H, triazol-H), 3.72(s, 3H, -OCH3), 3.32(dd, 1H, H5x), 2.78(dd, 1H, H4b), 2.57(s, 3H, -CH3), 2.44(dd, 1H, H4a)ppm; MS(EI)m/z(%): 646(M+). Anal. Calcd. for C35H28ClN7O2S: C, 65.06; H, 4.37; N, 15.17; Found: C, 65.00; H, 4.41; N, 15.11.
6h: 白色固体, 产率 31%, mp 251-252℃. IR(KBr)v/cm-1: 3099(Ar-H), 2977(CH3), 1616(C=N), 765(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.60-6.72(m, 15H, Ar-H), 8.09(s, 1H, triazol-H), 7.95(s, 1H, triazol-H), 3.83(s, 3H, -OCH3), 3.30(dd, 1H, H5x), 2.74(dd, 1H, H4b), 2.52(s, 3H, -CH3), 2.43(dd, 1H, H4a)ppm; MS(EI)m/z(%): 661(M+). Anal. Calcd. for C34H25ClN8O3S: C, 61.77; H, 3.81; N, 16.95; Found: C, 61.71; H, 3.84; N, 16.86.
6i: 白色固体, 产率 28%, mp 201-202℃. IR(KBr)v/cm-1: 3089(Ar-H), 2968(CH3), 1595(C=N), 763(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.61-6.76(m, 15H, Ar-H), 8.07(s, 1H, triazol-H), 7.97(s, 1H, triazol-H), 3.79(s, 3H, -OCH3), 3.30(dd, 1H, H5x), 2.71(dd, 1H, H4b), 2.58(s, 3H, -CH3), 2.43(dd, 1H, H4a)ppm; MS(EI)m/z(%): 611(M+). Anal. Calcd. for C35H29N7O2S: C, 68.72; H, 4.78; N, 16.03; Found: C, 68.64; H, 4.84; N, 15.99.
6j: 白色晶体, 产率 30%, mp 209-210℃. IR(KBr)v/cm-1: 3133(Ar-H), 2971(CH3), 1599(C=N), 761(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.58-6.73(m, 15H, Ar-H), 8.05(s, 1H, triazol-H), 7.99(s, 1H, triazol-H), 3.81(s, 3H, -OCH3), 3.29(dd, 1H, H5x), 2.81(dd, 1H, H4b), 2.55(s, 3H, -CH3), 2.47(dd, 1H, H4a)ppm; MS(EI)m/z(%): 646(M+). Anal. Calcd. for C35H28ClN7O2S: C, 65.06; H, 4.37; N, 15.17; Found: C, 65.00; H, 4.42; N, 15.13.
6k: 白色固体, 产率 35%, mp 199-200℃. IR(KBr)v/cm-1: 3088(Ar-H), 2965(CH3), 1598(C=N), 758(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.57-6.78(m, 15H, Ar-H), 8.02(s, 1H, triazol-H), 7.96(s, 1H, triazol-H), 3.82(s, 3H, -OCH3), 3.75(s, 3H, -OCH3), 3.29(dd, 1H, H5x), 2.81(dd, 1H, H4b), 2.53(s, 3H, -CH3), 2.49(dd, 1H, H4a)ppm; MS(EI)m/z(%): 641(M+). Anal. Calcd. for C36H31N7O3S: C, 67.38; H, 4.87; N, 15.28; Found: C, 67.31; H, 4.96; N, 15.22.
6l: 白色固体, 产率 27%, mp 258-259℃. IR(KBr)v/cm-1: 3098(Ar-H), 2966(CH3), 1599(C=N), 762(C-S-C);1H NMR(CDCl3, 400MHz)δ: 7.61-6.74(m, 15H, Ar-H), 8.11(s, 1H, triazol-H), 8.02(s, 1H, triazol-H), 3.75(s, 3H, -OCH3), 3.29 (dd, 1H, H5x), 2.80(dd, 1H, H4b), 2.57(s, 3H, -CH3), 2.48(dd, 1H, H4a)ppm; MS(EI)m/z(%): 656(M+). Anal. Calcd. for C35H28N8O4S: C, 64.01; H, 4.30; N, 17.06; Found: C, 63.97; H, 4.35; N, 17.01.
2 结果与讨论
2.1 化合物的合成
以苯肼和乙酰乙酸乙酯作为起始原料经过一系列反应合成12种新型的含吡唑基衍生物(6a-6l).
我们在合成化合物2时使用了超声的方法代替了常规的加热回流制备方法,此方法既绿色环保符合当前的合成理念,又大大降低了操作难度.另外,由于3-甲基-1-苯基-5-(1,2,4-三氮唑-1-基)-α-氯-4-吡唑甲醛肟和三乙胺反应得到的偶极子,而偶极子非常容易发生自聚现象,因此在这步反应中需要加入过量的上述两种物质,以免影响反应收率.
2.2 目标化合物的谱图表征
红外:3136-3079cm-1范围内出现了Ar-H伸缩振动峰,2980-2963cm-1范围内有CH3(C-H)特征峰,1616-1595cm-1范围内有C=N特征峰,C-S-C特征峰出现在指纹区766-756cm-1范围内.化合物6j的红外光谱图如下:

图2 化合物6j的红外光谱图Fig.2 IR spectrum of compound 6j
质谱:目标化合物都出现了明显的分子离子峰,化合物6j的质谱图见图3,从化合物6j的质谱图中可以看出明显的分子离子峰m/z645,其他的碎片峰m/z507,357,241,135也非常显著,证明了其结构的正确性.我们对其有可能的裂解机理进行了探讨,裂解图见图4.
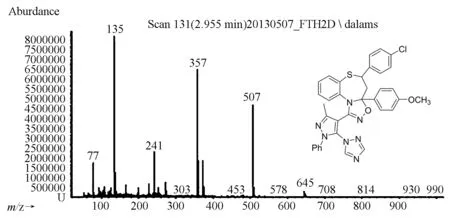
图3 化合物6j的质谱图Fig.3 MS of compound 6j
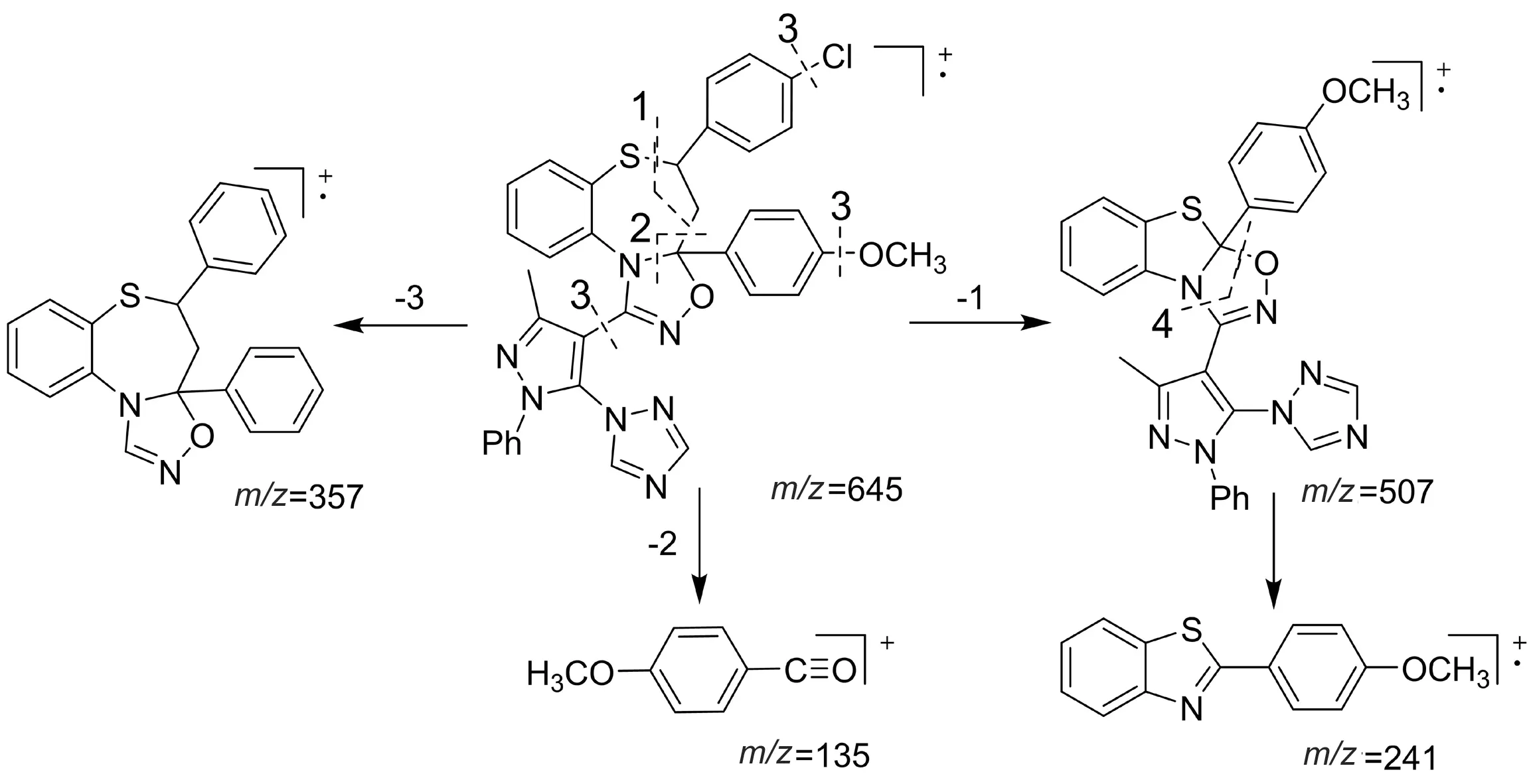
图4 化合物6j的裂解机理Fig.4 The pyrolysis mechanism of compound 6j
核磁:三氮唑基上的2个氢质子表现为两个单峰,由于氮原子的作用这两个单峰出现在相对低场(δ: 8.12-7.95 ppm),苯环上的氢质子显示为较密集的多重峰(δ: 7.62-6.72 ppm),在δ:3.36-2.39 ppm范围内出现了ABX体系的12重特征峰,归属为七元环上的3个氢质子H5x、H4b和H4a.甲氧基上的3个氢质子表现为单峰(δ: 3.83-3.72 ppm),在高场δ: 2.61-2.52 ppm范围内的单峰归属为甲基的3个氢质子.化合物6i的核磁氢谱如下:.
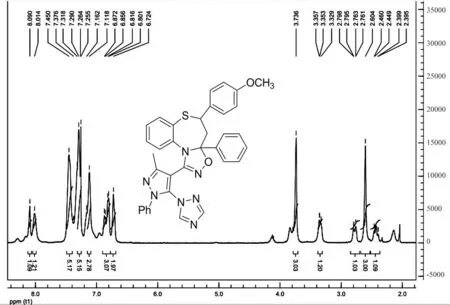
图5 化合物6i的核磁氢谱Fig.5 1H NMR spectrum of compound 6i
单晶:在化合物6j中有3个五元环(plane1=O(1)-C(9)、plane2=N(3)-C(25)、 plane3=N(5)-C(29)),4个苯环(plane4=C(1)-C(6)、plane5=C(10)-C(15)、plane6=C(17)-C(22)、plane7=C(30)-C(35))及1个七元环(plane8=S(1)-C(17)).其中我们选择性测量了两环之间的二面角,plane1/plane2,plane2/plane3,plane5/ plane8, plane4/plane7的二面角分别为51.40°,64.86°,80.31°,53.39°.此化合物中七元环以顺时针方向开始计算,转扭转角分别为-68.6(2)°,65.0(2)°,-83.3(2)°,66.0(3)°,4.3(3)°,-56.04(19)°,71.98(15)°,可见C(8),C(17),C(22)3个原子偏离C(7),C(9),N(1),S(1)4个原子构成的平面.因此,由数据表明七元环是扭船式构象.
该分子中没有典型的氢键,但有 C-H...O、C-H...N 之间的相互作用,其中C(6)-H(6)...O(1)、C(8)-H(8A)...N(7)的代码分别为1-x,1-y,1-z、1-x,-1/2+y,1/2-z.除此以外,该分子还存在着微弱的π-π堆积作用.由于π-π堆积作用和氢键的存在,此类化合物的结构相对稳定.晶体结构图及晶体堆积图如图6,图7所示.
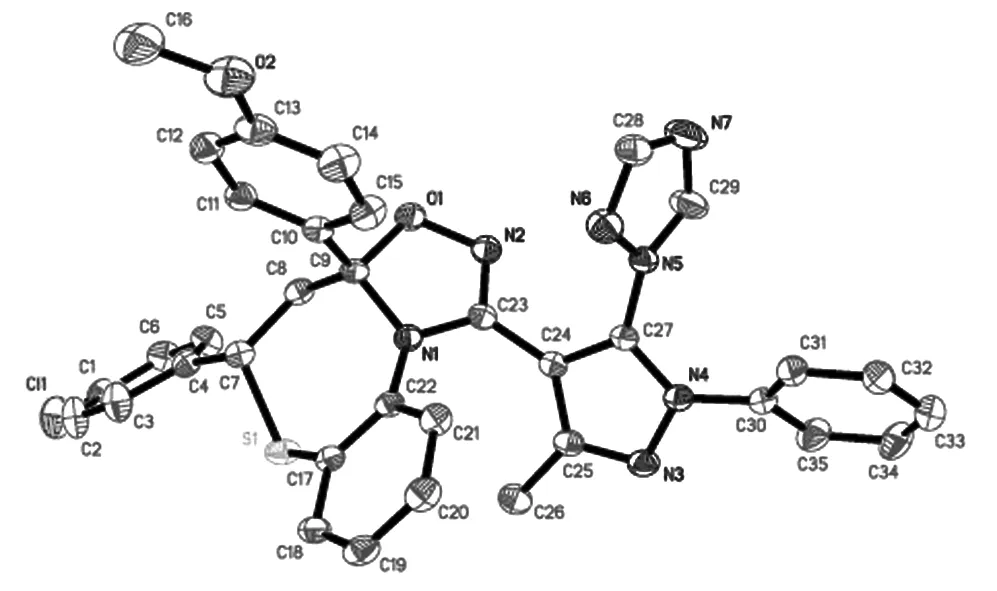
图6 化合物6j的晶体结构图Fig.6 Molecular structure of compound 6j
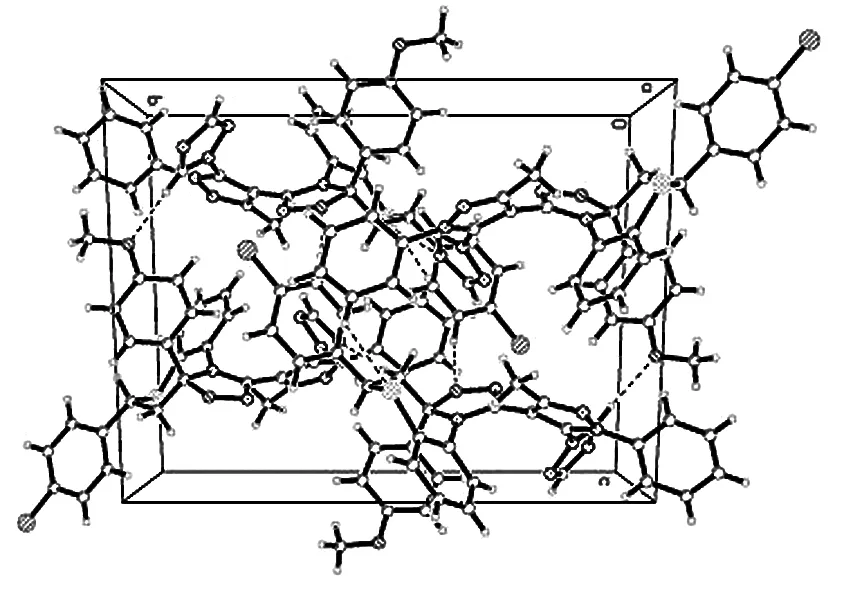
图7 化合物6j的晶体堆积图Fig.7 Packing diagram of compound 6j
其他的晶体数据见表1和表2.

表1 化合物6j的晶体参数Tab. 1 The crystal parameter of compound 6j

表2 化合物6j的键长(Å)、键角(°)、扭转角(°)Tab.2 Selected bond lengths(Å), angles(°), and torsionangles(°) of compound 6j
[1] COTTINEAU B, TOTO P, MAROT C, et al. Synthesis and hypoglycemic evaluation of substituted pyrazole-4-carboxylic acids[J]. Bioorg Med Chem Lett, 2002, 12(16): 2105-2108.
[2] LEE K Y, KIM J M ,KIM J N. Regioselective synthesis of 1,3,4,5-tetrasubstituted pyrazoles from Baylis-Hillman adducts[J]. Tetrahedron Lett, 2003, 44(35): 6737-6740.
[3] JIA Z J, WU Y, HUANG W, et al. 1-(2-Naphthyl)-1H-pyrazole-5-carboxylamides as potent factor Xa inhibitors. Part 3: Design, synthesis and SAR of orally bioavailable benzamidine-P4 inhibitors[J]. Bioorg Med Chem Lett, 2004, 14(5): 1229-1234.
[4] JOHN W L, PATERA R M, PLUMMER M J, et al. Synthesis, mechanism of action, and QSAR of herbicidal 3-substituted-2-aryl-4,5,6,7-tetrahydroindazoles[J]. Pest Management Science, 2010,42(1):29-36.
[5] DI SANTO R D, COSTI R. 2H-Pyrrolo[3,4-b][1,5]benzothiazepine derivatives as potential inhibitors of HIV-1 reverse transcriptase[J].ⅡFarmaco. 2005, 60(5): 385-392.
[6] ZHAO H Y, LIU G. The development of benzothiazepine derivatives[J]. Chin J Med Chem,2007, 17(2): 122-128.
[7] CHERKUPALLY S R, GURRALA P R, ADKI N, et al. Synthesis and biological study of novel methylene-bis-benzofuranyl-[1, 5]-benzothiazepines[J]. Organic Communications, 2008, 1(4):84-94.
[8] GARG N, CHANDRA T, JAIN A B, et al. Synthesis and evaluation of some new substituted benzothiazepine and benzoxazepine derivatives as anticonvulsant agents[J]. Eur J Med Chem, 2010, 45(4): 1529-1535.
[9] AMETA K L, RATHORE N S, KUMAR B. Synthesis and in vitro anti-breast cancer activity of some novel 1,5-benzothiazepine derivatives[J]. J Serb Chem Soc, 2012, 77(6): 725-731.
[10] INOUE H, KONDA M, HASHIYAMA T, et al. Synthesis and biological evaluation of alkyl, alkoxy, alkylthio, or amino-substituted 2,3-dihydro-1,5-benzothiazepin-4(5H)- ones[J]. Chem Pharm Bull,1997, 45(6): 1008-1026.
[11] FORSYTH C M, FRANCIS C L, JAHANGIRI S, et al. N,N-Dialkyl-N'-chlorosulfonyl chloroformamidines in heterocyclic synthesis. Part IX. Novel triazolo-fused thiatriazoles and pyrazolo-fused oxathiazines[J]. Austra J Chem, 2010, 63(5): 785-791.
[12] DATTERL B, TROSTNEER N, KUCHARSKI D, et al. Heterocyclic analogues of xanthone and xanthione. 1H-Pyrano [2, 3-c: 6, 5-c] dipyrazol-4 (7H)-ones and thiones: synthesis and NMR data[J]. Molecules, 2010, 15(9): 6106-6126.
[13] STEPHENS W D, FIELD L. Note. A seven-membered heterocycle from o-aminobenzenethiol and chalcone[J]. J Org Chem, 1959, 24 (10): 1576.
SynthesisandCharacterizationofNovelPyrazoleDerivatives
FEI Tinghong1, ZHOU Yinglei2, LIU Fangming1
(1.College of Materials and Chemical Engineering, Hangzhou Normal University, Hangzhou 310036, China; 2.Hangzhou Heze Pharmaceutical Technology Co.,Ltd, Hangzhou 310018, China)
In order to provide a novel lead compound with high activity and create new drugs with various functions and pharmaceutical intermediates with good activity,twelve novel pyrazole derivatives were synthesized using phenylhydrazine and ethyl acetoacetate as stating materials via a series of reactions. These target compounds were determined by IR, MS,1H-NMR, elemental analysis, and X-ray crystallographic analysis.The crystal structure was monoclinic and space group was P21/c,the seven-membered ring adopted a twist-boat conformation, the crystal structure was stabilized by hydrogen bonds and π-π stacking interactions.
pyrazole;1,5-benzothiazepine; oxadiazole
2016-12-20
浙江省自然科学基金项目(Y14B020050).
刘方明(1966—),男,教授,博士,主要从事药物合成研究.E-mail: fmliu859@sohu.com
10.3969/j.issn.1674-232X.2017.05.002
O626.5
A
1674-232X(2017)05-0454-07
