枸杞叶黄酮类化合物体外清除自由基作用研究
2017-12-13范艳丽韩丽娜付丽霞孟雪梅田建文
范艳丽,韩丽娜,付丽霞,孟雪梅,田建文
(1.宁夏大学 农学院,银川 750021;2.宁夏科技厅,银川 750001)
枸杞叶黄酮类化合物体外清除自由基作用研究
范艳丽1,韩丽娜1,付丽霞1,孟雪梅1,田建文2
(1.宁夏大学 农学院,银川 750021;2.宁夏科技厅,银川 750001)
采用有机溶剂浸提法(70%乙醇)提取枸杞叶中的黄酮类化合物,然后以枸杞叶黄酮提取物为研究对象,以Vc和BHT为阳性对照,通过自由基清除实验体外评价产物的抗氧化活性。结果表明:枸杞叶黄酮提取物中黄酮类化合物的含量为277.7 mg/g。枸杞叶黄酮提取物对超氧阴离子自由基、羟基自由基、DPPH+、亚硝基自由基、ABTS+具有显著的清除能力,其最大清除率分别为62%,84%,80%,34%,78%,对Fe3+的还原能力达到Vc和BHT还原能力的50%。结论:所提取的枸杞叶黄酮类化合物具有较高的体外抗氧化活性,可为枸杞叶黄酮类化合物资源的开发利用提供依据。
枸杞叶;黄酮类化合物;抗氧化
枸杞属落叶灌木植物,是我国传统的药食同源植物[1]。枸杞叶与枸杞子同根同源,其营养成分种类与枸杞果基本相同,含有丰富的蛋白质、氨基酸、矿物质等营养成分以及黄酮类化合物、甜菜碱、阿托品等活性成分[2]。《中华本草》记载:枸杞叶“味苦;甘;性凉,补虚益精;清热明目。主虚劳发热;烦渴;目赤昏痛”[3],指明枸杞叶具有清热解暑、养肝明目、软化血管的保健功效。一直以来,我国民间就有饮用枸杞叶茶和烹制枸杞叶瘦肉汤的饮食方法。黄酮类化合物属于植物次级代谢产物,主要以甙元和糖甙两种形式存在,生理活性及药理作用多样,如清除氧自由基[4]、抑制肿瘤细胞生长[5]、抗过敏[6]、抗炎保肝[7]等。研究证实:枸杞叶中总黄酮含量远高于枸杞果[8]。将枸杞叶黄酮提取物添加到高营养的复合羊肉糜中,不仅赋予羊肉糜特有香气,保持羊肉糜的硬度、胶黏性和咀嚼性,还能够显著抑制羊肉糜中不饱和脂肪酸氧化,是一种天然的功能性调味品[9]。本实验采用有机溶剂浸提法提取枸杞叶中的黄酮类化合物,并进一步研究其体外抗氧化活性,意在探明枸杞叶黄酮类化合物的抗氧化活性及应用前景,为枸杞叶资源能够更充分合理地利用提供依据。
1 材料与方法
1.1 材料与试剂
枸杞芽茶为食品级,购于宁夏科苑示范基地;98%BHT为食品级,购于徐州广皓生物科技有限公司;DPPH,购于西安沃尔森生物科技有限公司;抗坏血酸(Vc)、N-1-萘乙二胺盐酸盐、邻菲罗啉、无水对氨基苯磺酸、三氯化铁、30%过氧化氢、焦性没食子酸、氯化亚铁、无水乙醇、芦丁、ABTS、Tris等试剂均为分析纯,购于天津市大茂化学试剂厂。
1.2 仪器与设备
WK-600A型高速中药粉碎机 上海新诺仪器设备有限公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;SHB-III型循环水式多用真空泵 郑州长城科工贸有限公司;JDG-0.2型真空冻干试验机 兰州科近冻干技术有限公司;TA-XT2i质构分析仪、DL-5-A型台式离心机 上海安亭科学仪器厂;7230G可见分光光度计 上海精密科技有限公司;101-3型电热恒温鼓风干燥箱 上海东星建材实验设备有限公司;AL204型电子天平 梅特勒-托利多仪器(上海)有限公司;HH.SY21-Ni6-C电热恒温水浴锅 北京长源实验设备厂;DF-2集热式磁力搅拌机 常州爱华仪器制造有限公司。
1.3 试验方法
1.3.1 枸杞叶黄酮化合物的提取及含量测定
1.3.1.1 枸杞叶黄酮化合物的提取[10]
将枸杞芽茶粉碎,按照料液比1∶70采用70%乙醇于70 ℃下搅拌提取2 h,重复提取1次,合并提取液,在3000 r/min下离心取上清液,55 ℃下旋转蒸发,浓缩至较小体积后加入石油醚进行脱脂处理,去除叶绿素。用分液漏斗将大部分的石油醚弃除后再进行旋转蒸发,蒸掉石油醚后经真空冷冻干燥,即得到枸杞叶黄酮类化合物粗品。
1.3.1.2 芦丁标准曲线的制定
采用硝酸铝-亚硝酸钠比色法,以70%的乙醇溶解芦丁标准品配成浓度为0.20 mg/mL的标准溶液,分别移取标准溶液0.0,0.2,0.4,0.6,0.8,1.0,2.0,3.0 mL于10 mL容量瓶中,加入4%的NaNO2溶液0.3 mL,摇匀静置6 min,加入10%的Al(NO3)3溶液0.3 mL,摇匀静置6 min,加入5%的NaOH溶液4.0 mL,用70%乙醇定容,摇匀静置15 min。以不加标准品为空白,在510 nm下测定吸光度值,建立回归方程。
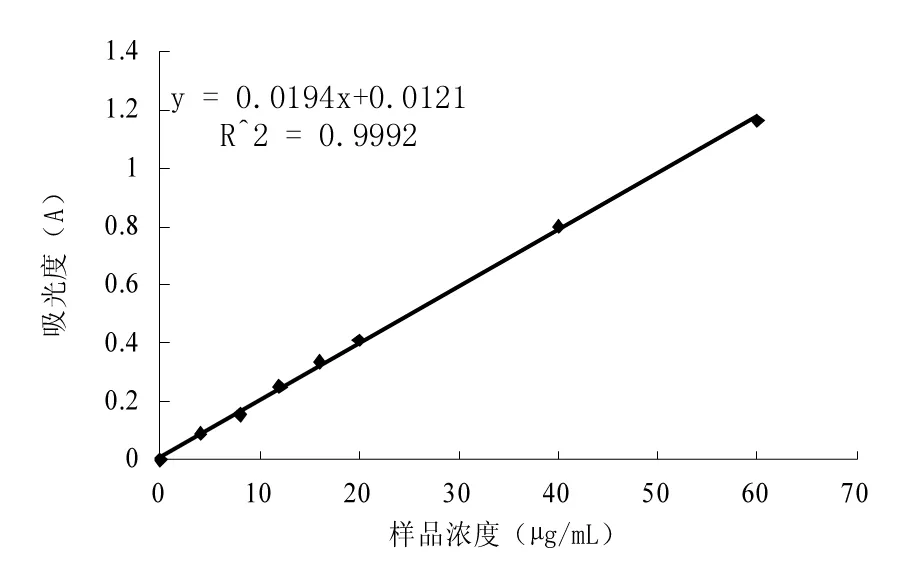
图1 芦丁标准曲线Fig.1 Standard curve of rutin
1.3.1.3 枸杞叶黄酮提取物的含量测定
配制0.20 mg/mL样品溶液,进行显色测定吸光度,根据回归方程计算出黄酮的浓度,按公式(1)计算产物的黄酮含量。

(1)
式中:X为黄酮含量(mg/g);Y为根据标准曲线方程计算出的提取物质量浓度(mg/mL);V1为定容后的黄酮的体积(mL);C为配制的黄酮溶液的浓度(mg/mL);V2为测定吸光度时所用的黄酮溶液的体积(mL)。
1.3.2 枸杞叶黄酮提取物抗氧化作用的测定
1.3.2.1 超氧阴离子的清除实验
采用Yang等[11]的方法并略做修改。取5 mL,0.05 mol/L Tris-HCl缓冲溶液(pH 8.2)于具塞试管中,25 ℃水浴中预热20 min,分别加入1 mL不同浓度(0.1,0.2,0.3,0.4,0.5 mg/mL)的样品溶液,再加入25 ℃预热的3 mmol/L的邻苯三酚溶液0.5 mL,混匀后于25 ℃水浴中反应5 min,加入1 mL,8 mmol/L的盐酸终止反应,在299 nm处测定溶液的吸光度,其值记为Ai;空白对照组以相同体积的蒸馏水代替样品溶液在紫外可见分光光度计下测定溶液的吸光度,其值记为A0;以0.5 mL的蒸馏水代替邻苯三酚溶液在299 nm处测定吸光度,其值记为Aj。按照公式(2)计算得出清除率SR(%)。
(2)
1.3.2.2 羟基自由基的清除活性测定[12]
取12支25 mL的具塞试管并编号,分别向1~5号具塞试管中加入1 mL 0.15 mg/mL的邻二氮菲溶液、2 mL pH 7.4的PBS缓冲溶液、1 mL 0.2 mg/mL的FeSO4溶液摇匀。将0.2 mg/mL的样品溶液以0.5,1.0,1.5,2.0,2.5 mL分别加入试管中,混匀。6号、7号试管分别标记为受损伤管和空白参照管,8~12号试管以蒸馏水代替样品作为样品参照。除空白参照管外,其余试管于37 ℃水浴中恒温1 h,于波长536 nm处测定吸光度值,按照公式(3)计算得出清除率SR(%)。以Vc和BHT为对照。
(3)
式中:A1为损伤管的吸光度值;A2为空白参照管的吸光度值;A3为样品管的吸光度值;A4为样品参照管的吸光度值。
1.3.2.3 DPPH+的清除活性测定
按照李铉军等[13]的试验方法并稍做修改。量取2 mL不同浓度(0.1,0.2,0.3,0.4,0.5 mg/mL)的样品溶液于具塞试管中,分别加入2 mL,70%的乙醇溶液混匀,避光静置60 min后在波长517 nm处测定其吸光度,其值记为Aj;分别量取样品溶液2 mL及2 mL DPPH溶液(浓度为2.0×10-4mol/L)于具塞试管中,混匀后避光静置60 min,在波长517 nm处测定其吸光度,其值记为Ai;最后再量取70%乙醇溶液2 mL,DPPH溶液2 mL置于具塞试管中,混匀避光静置60 min,在波长517 nm处测定其吸光度,其值记为A0,按照公式(4)计算得出清除率SR(%)。同时以Vc和BHT为阳性对照。
(4)
1.3.2.4 亚硝基离子的清除活性测定
制备0.2 mg/mL的样品溶液,将样品溶液按0.5,1.0,1.5,2.0,2.5 mL分别加入具塞试管中,混匀。以蒸馏水代替样品,作空白对照,同时以Vc和BHT为阳性对照。按钟方丽等[14]的试验方法并稍做改动,分别向其中加入5 μg/mL NaNO2溶液1 mL,37 ℃恒温30 min,加入浓度为0.4%的对氨基苯磺酸溶液1 mL,混匀,静置5 min,再加入0.5 mL浓度为0.2%的盐酸萘乙二胺溶液,混匀后加70%的乙醇定容,静置15 min后分别在540 nm处测其吸光度,测定的各浓度溶液的吸光度记为A1,用蒸馏水代替样品,操作方法同上,所测得的吸光度为A0,按照公式(5)计算得出清除率SR(%)。
(5)
1.3.2.5 ABTS+的清除活性测定
按Zhang等[15]的试验方法并稍做修改。制备浓度为2 mg/mL的样品溶液,以Vc和BHT为阳性对照。配制浓度为7 mmol/L的ABTS溶液,与等体积浓度为2.45 mmol/L的过硫酸钾溶液混合,避光、4 ℃条件下放置12~16 h[16]。用蒸馏水稀释ABTS溶液使其在734 nm下的吸光值在(0.7±0.02)之间,取ABTS溶液3.9 mL,加入0.1 mL不同浓度(0.1,0.2,0.3,0.4,0.5 mg/mL)的样品溶液,摇匀,室温放置6 min,于734 nm波长处测定吸光度。用蒸馏水代替样品作为空白对照,按照公式(6)计算得出清除率SR(%)。
(6)
式中:A0为空白管的吸光值;A1为样品的吸光值。
1.3.2.6 总还原能力的测定[17]
取1 mL样品(质量浓度分别为0.1,0.2,0.3,0.4,0.5 mg/mL)于具塞试管中,分别加入2.5 mL的0.2 mol/L磷酸钠缓冲液(pH 6.6)和1%铁氰化钾溶液2.5 mL,混匀后于50 ℃水浴中恒温20 min,分别加入浓度为10%的三氯醋酸溶液2.5 mL,于3000 r/min离心10 min后取上清液2.5 mL,加入蒸馏水2.5 mL和0.1%的FeCl3溶液1 mL,振荡混匀静置10 min,在波长700 nm处测定其吸光度。以Vc和BHT为阳性对照。
2 结果与讨论
2.1 枸杞叶提取物中总黄酮的含量
按照1.3.1.3的方法测定黄酮的含量,带入公式(1)计算得:枸杞叶黄酮提取物中的黄酮含量为277.7 mg/g。
2.2 枸杞叶黄酮提取物对超氧阴离子自由基的清除能力

图2 枸杞叶黄酮提取物对超氧阴离子自由基的清除能力Fig.2 Superoxide anion radical scavenging ability of flavonoids from Lycium barbarum leaves
超氧阴离子在ROS的形成中起重要作用,可诱导脂质、蛋白质及DNA中的氧化损伤,因此通过测定抗氧化剂对超氧阴离子的清除能力来判断抗氧化剂的抗氧化能力[18]。由图2可知,Vc、BHT、黄酮对超氧阴离子自由基的清除能力均随样品浓度的增大而增大。当样品浓度为0.5 mg/mL时,Vc的超氧阴离子自由基清除率达到70%,BHT和黄酮的清除率也达到60%。当样品浓度为0.3 mg/mL时,黄酮对超氧阴离子自由基的清除率将近60%,其清除效果优于Vc和BHT。结果表明:清除超氧阴离子自由基方面,黄酮、BHT、Vc的清除能力没有明显的差异。
2.3 枸杞叶黄酮提取物对羟自由基的清除能力
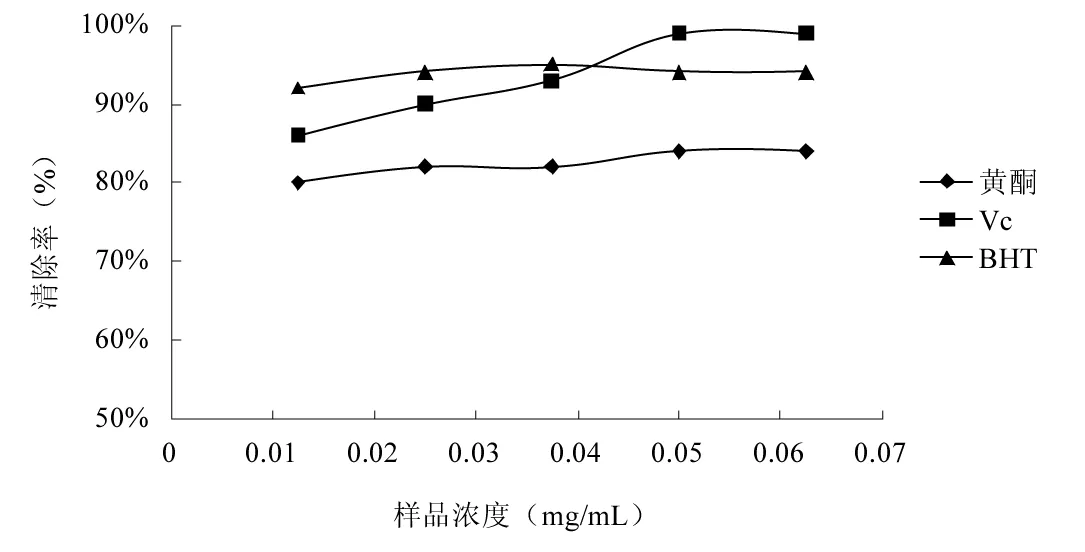
图3 枸杞叶黄酮提取物对羟自由基的清除能力Fig.3 Hydroxyl radical scavenging ability of flavonoids from Lycium barbarum leaves
羟自由基主要是由过氧化物负离子和过氧化氢反应生成的,能够杀死红细胞,降解DNA、蛋白质及脂质等化合物[19],已被公认为自由基病理学中的高度破坏物质。由图3可知,Vc对羟自由基的清除能力最佳,当样品浓度达到0.05 mg/mL时,清除率接近100%。BHT对羟基自由基的清除能力略次于Vc。黄酮对羟自由基的清除效果虽不如Vc和BHT,但其对羟自由基的清除率也达到了80%。结果表明:枸杞叶黄酮提取物对羟自由基具有一定的清除能力,其质量浓度对羟自由基清除率影响不明显。
2.4 枸杞叶黄酮提取物对DPPH+的清除能力
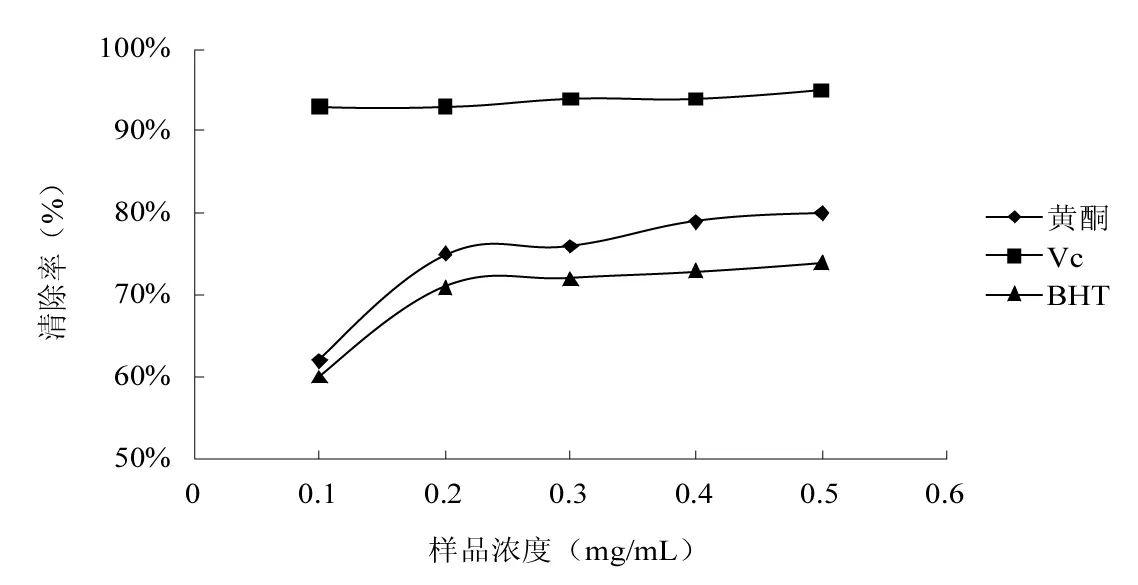
图4 枸杞叶黄酮提取物对DPPH+的清除能力Fig.4 DPPH+ scavenging ability of flavonoids from Lycium barbarum leaves
抗氧化剂能够清除自由基,对氧化损伤有很强的保护作用,而DPPH+法已被广泛用于抗氧化剂清除自由基活性的测定[20]。在DPPH+清除试验中,抗氧化剂将DPPH+还原为黄色化合物——二苯基联吡啶,且反应的程度取决于抗氧化剂的供氢能力[21]。由图4可知,对DPPH+清除能力依次是Vc>黄酮>BHT。黄酮和BHT的清除率均随样品浓度的增大而增大,且黄酮对DPPH+的清除能力优于BHT,当样品的浓度为0.4~0.5 mg/mL时,黄酮对DPPH+的清除率达到80%左右,而BHT对DPPH+的清除率在70%左右。结果表明:枸杞叶黄酮提取物对DPPH+具有一定的清除能力,且与其质量浓度呈正相关。
2.5 枸杞叶黄酮提取物对亚硝基离子的清除能力

图5 枸杞叶黄酮提取物对亚硝基离子的清除能力Fig.5 Nitroso ion scavenging ability of flavonoids from Lycium barbarum leaves
胡利等[22]研究指出,桑叶黄酮具有较强的清除亚硝酸盐作用,并且该清除作用随着反应时间、温度及黄酮浓度的增加而增大,提示其可用于添加亚硝酸钠作为发色剂的肉制品。由图5可知,在清除亚硝基自由基方面,清除能力依次是Vc>黄酮>BHT,Vc对亚硝基离子的清除能力明显强于黄酮和BHT,当样品的浓度达到0.08 mg/mL时,清除率达到80%。黄酮对亚硝基离子的清除率与其质量浓度呈正相关,当样品的浓度达到0.1 mg/mL时,其清除率为34%。BHT对亚硝基离子的清除率明显弱于Vc,也略弱于黄酮,当质量浓度为0.1 mg/mL时,对亚硝基的清除率只有27%左右。结果表明:枸杞叶黄酮提取物对亚硝基离子具有清除能力,但清除效果不如其对超氧阴离子自由基、羟自由基、DPPH自由基、ABTS自由基的清除效果。
2.6 枸杞叶黄酮提取物对ABTS+的清除能力
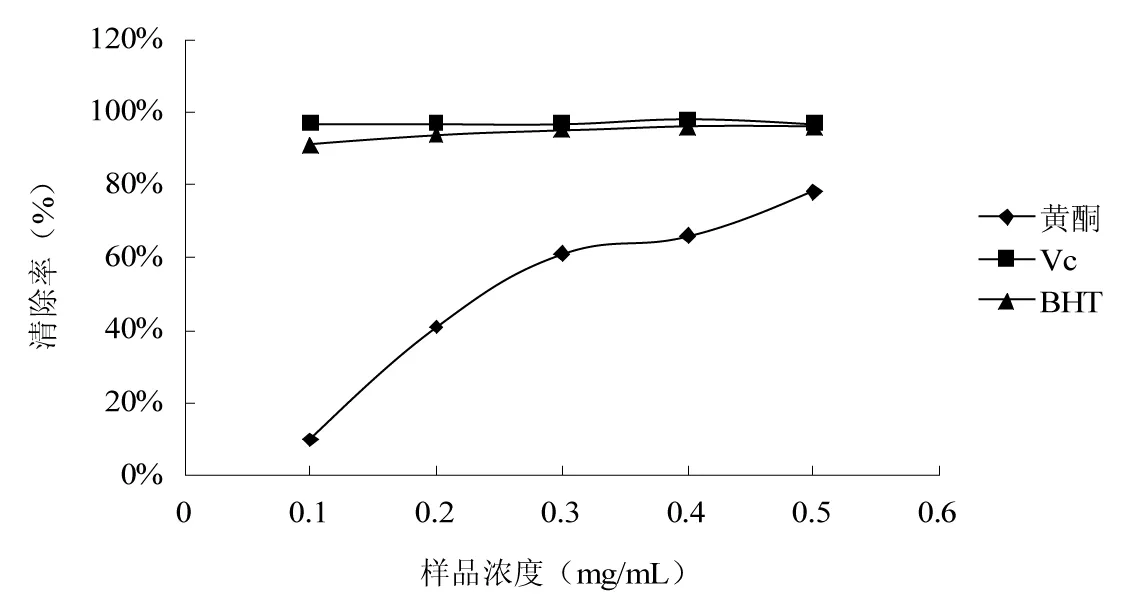
图6 枸杞叶黄酮提取物对ABTS+的清除能力Fig.6 ABTS+ scavenging ability of flavonoids from Lycium barbarum leaves
ABTS+清除实验基于评价抗氧化剂在体外清除稳定ABTS+的能力[23]。由图6可知,对ABTS+的清除能力依次是Vc>BHT>黄酮。当样品的浓度在0.1~0.5 mg/mL时,Vc和BHT对ABTS+的清除率均达到90%以上。样品的浓度为0.1 mg/mL时,黄酮对ABTS+的清除率不足10%,但是它的清除能力随着样品浓度的增大而明显升高,当样品浓度达到0.5 mg/mL时,其对ABTS+的清除率达到80%左右,接近BHT和Vc的清除率。结果表明:枸杞叶黄酮提取物能够有效地清除ABTS+,且与其质量浓度呈正相关。
2.7 枸杞叶黄酮提取物的还原能力

图7 枸杞叶黄酮提取物的还原能力Fig.7 Reducing ability of flavonoids from Lycium barbarum leaves
样品的还原能力能够反映一定的抗氧化性,抗氧化剂可将Fe3+络合物还原成绿色或蓝色的Fe2+络合物。试验通过显色反应可以测定出Fe3+被还原成Fe2+程度的高低,从而可以判断出黄酮类化合物还原能力的强弱。由图7可知,Vc、BHT、黄酮的还原能力均随样品浓度的增大而增大。样品浓度为0.1 mg/mL时,黄酮和Vc的还原能力相当,吸光度值均在0.3左右,而此浓度BHT的吸光度值达到0.6。当样品的浓度为0.5 mg/mL时,Vc和BHT的吸光度均达到1.0左右,而黄酮的吸光度为0.5左右,说明在还原能力方面,枸杞叶黄酮提取物弱于Vc和BHT,基本上达到了它们还原能力的50%。
3 结论
本研究采用有机溶剂浸提法,对枸杞叶中的黄酮类化合物进行提取,采用硝酸铝-亚硝酸钠比色法测得提取产物的黄酮含量为277.7 mg/g,提取物呈黄绿色的粉末状物质。以BHT和Vc为阳性对照,对枸杞叶黄酮提取物进行体外抗氧化活性研究,结果表明:在一定的浓度范围内,枸杞叶黄酮类化合物的还原能力是Vc和BHT还原能力的50%,其对超氧阴离子自由基、羟基自由基、DPPH+、亚硝基自由基、ABTS+具有显著的清除作用,其最大清除能力分别为62%,84%,80%,34%和78%。由此可知,枸杞叶黄酮提取物可以作为一种天然抗氧化剂或调味品应用于油脂及含油食品、肉制品或高档植物饮料,该研究结果为枸杞叶资源的综合利用提供了理论基础。
[1]郑国琦,包晗,杨涓,等.宁夏枸杞果实韧皮部及其周围细胞超微结构研究[J].西北植物学报,2015,35(11):2211-2218.
[2]马婷婷,张旭,饶建华,等.枸杞叶成分及药理作用研究进展[J].北方园艺,2011(13):194-196.
[3]崔振华,孟跃军,徐桂花,等.枸杞叶复合绿茶饮料的研制[J].食品工业,2013,34(7):39-42.
[4]Li J E,Fan S T,Qiu Z H,et al.Total flavonoids content,antioxidant and antimicrobial activities of extracts fromMoslachinensisMaxim.cv.Jiangxiangru[J].LWT-Food Science and Technology,2015,64(2):1022-1027.
[5]Miklós Poór,Zita Zrínyi,Tamás Kszegi.Structure related effects of flavonoid aglycones on cell cycle progression of HepG2 cells: metabolic activation of fisetin and quercetin by catechol-O-methyltransferase (COMT)[J].Biomedicine & Pharmacotherapy,2016,83:998-1005.
[6]Myungsuk Kim,Sun Young Kim,Ahmad Randy,et al.Inhibitory effect of theLarixsibiricaand its various flavonoids on the IgE-stimulated mast cell activation and anaphylaxis[J].Journal of Functional Foods,2016,27:631-644.
[7]Chen X M,Andrew R Tait,David D Kitts.Flavonoid composition of orange peel and its association with antioxidant and anti-inflammatory activities[J].Food Chemistry,2017,218:15-21.
[8]范艳丽,龚媛,梁飞,等.微波辅助法提取枸杞叶黄酮的工艺研究[J].中国食品添加剂,2013(4):83-89.
[9]韩丽娜,沈浩,田建文,等.枸杞叶黄酮提取物对复合羊肉糜冷藏期品质的影响[J/OL].食品科学,http://kns.cnki.net/kcms/detail/11.2206.TS.20170323.1441.078.html,2017-03-23.
[10]刘兰英,曹有龙,赵友谊.枸杞叶黄酮纯化工艺研究[J].食品科技,2009,34(8):134-135.
[11]Yang Rifu,Geng Linlin,Lu Haiqin,et al.Ultrasound-synergized electrostatic field extraction of total flavonoids fromHemerocalliscitrinabaroni[J].Ultrasonics Sonochemistry,2017,34:571-579.
[12]Wu P P,Ma G Z,Li N H,et al.Investigation of in vitro and in vivo antioxidant activities of flavonoids rich extract from the berries ofRhodomyrtustomentosa(Ait.)Hassk[J].Food Chemistry,2015,173:194-202.
[13]李铉军,崔胜云.抗坏血酸清除DPPH自由基的作用机理[J].食品科学,2011,32(1):86-90.
[14]钟方丽,王文姣,王晓林,等.猴腿蹄盖蕨、玉竹总黄酮的体外抗氧化活性研究[J].中国食品添加剂,2016(6):65-72.
[15]Zhang S L,Deng Peng,Xu Y C,et al.Quantification and analysis of anthocyanin and flavonoids compositions,and antioxidant activities in onions with three different colors[J].Journal of Integrative Agriculture,2016,15(9):2175-2181.
[16]Mohamed Ben Sghaier,Ines Skandrani,Nouha Nasr,et al.Flavonoids and sesquiterpenes fromTecuriumramosissimumpromote antiproliferation of human cancer cells and enhance antioxidant activity: a structure-activity relationship study[J].Environment Toxicology and Pharmacology,2011,32(3):336-348.
[17]李进,李淑珍,冯文娟,等.黑果枸杞叶黄酮的体外抗氧化活性研究[J].食品科学,2010,31(13):259-262.
[18]Sun L J,Zhang J B,Lu X Y,et al.Evaluation to the antioxidant activity of total flavonoids extract from persimmon (DiospyroskakiL.) leaves[J].Food and Chemical Toxicology,2011,49(10):2689-2696.
[19]Tan L H,Zhang D,Wang G,et al.Comparative analyses of flavonoids compositions and antioxidant activities of Hawk tea from six botanical origins[J].Industrial Crops and Products,2016,80:123-130.
[20]Jiao J,Gai Q Y,Lou M,et al.Comparison of main bioactive compounds in tea infusions with different seasonalForsythiasuspensaleaves by liquid chromatography-tandem mass spectrometry and evaluation of antioxidant activity[J].Food Research International,2013,53(2):857-863.
[21]Wan P F,Sheng Z L,Han Q,et al.Enrichment and purification of total flavonoids fromFlospopuliextracts with macroporous resins and evaluation of antioxidant activities in vitro[J].Journal of Chromatography B,2014,945-946:68-74.
[22]胡利,贾冬英,姚开,等.桑叶黄酮对亚硝酸盐的体外清除作用研究[J].中国调味品,2015,40(3):1-5.
[23]Hu Q H,Yu J,Yang W J,et al.Identification of flavonoids fromFlammulinavelutipesand its neuroprotective effect on pheochromocytoma-12 cells[J].Food Chemistry,2016,204:274-282.
StudyonFreeRadicalScavengingEffectofFlavonoidsfromLyciumbarbarumLeavesinVitro
FAN Yan-li1, HAN Li-na1, FU Li-xia1, MENG Xue-mei1, TIAN Jian-wen2
(1.College of Agriculture, Ningxia University, Yinchuan 750021, China;2.Ningxia Science and Technology Department, Yinchuan 750001, China)
The flavonoids fromLyciumbarbarumleaves are extracted by organic solvent extraction(70% ethanol).And the antioxidant activity of flavonoids fromLyciumbarbarumleaves is evaluated by radical scavenging experiments in vitro taking Vc and BHT as positive controls. The results show that the content of flavonoids in the extract is 277.7 mg/g. The flavonoids fromLyciumbarbarumleaves have significant scavenging ability on superoxide anion radical, hydroxyl radical, DPPH+, nitroso radical and ABTS+, and the maximum removal capacity is 62%, 84%, 80%, 34%, 78% respectively, meanwhile, the reducti on ability of the product on Fe3+reaches 50% of that of Vc and BHT. Conclusion:The flavonoids fromLyciumbarbarumleaves have high antioxidant activity in vitro, which can provide the basis for the development and utilization of flavonoids fromLyciumbarbarumleaves.
Lyciumbarbarumleaves;flavonoids;antioxidation
TS201.2
A
10.3969/j.issn.1000-9973.2017.12.007
1000-9973(2017)12-0032-06
2017-06-15
国家自然科学基金资助项目(31660438)
范艳丽(1980-),女,副教授,博士,研究方向:食品营养与特色农产品加工。
