青藏高原牦牛酸奶中具有抗氧化活性乳酸菌的体内外益生特性
2017-12-11柯文灿王丽娜丁武蓉
陈 明,柯文灿,张 娟,唐 京,王丽娜,丁武蓉*
(兰州大学生命科学学院,草地农业生态系统国家重点实验室,甘肃 兰州 730000)
青藏高原牦牛酸奶中具有抗氧化活性乳酸菌的体内外益生特性
陈 明,柯文灿,张 娟,唐 京,王丽娜,丁武蓉*
(兰州大学生命科学学院,草地农业生态系统国家重点实验室,甘肃 兰州 730000)
目的:筛选出性状优良的具有抗氧化性的益生乳酸菌并研究其对D-半乳糖致衰老模型大鼠的抗氧化作用。方法:以从青藏高原牦牛酸奶中初步筛选的3 株具高抗氧化活性乳酸菌为研究对象,通过耐受模拟胃肠道、耐胆盐和疏水能力实验评价3 株乳酸菌的体外益生特性,并将体外益生特性优良的菌株饲喂D-半乳糖致衰老模型大鼠。通过检测各处理组大鼠的脏器指数,肝脏、脑组织和血清中的谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)活力、总抗氧化能力(total antioxidant capacity,T-AOC)以及丙二醛(malondialdehyde,MDA)含量来评价乳酸菌的体内抗氧化益生特性。结果:植物乳杆菌(Lactobacillus plantarum)XM5具有较强的耐模拟胃肠液和耐胆盐能力,同时具有较强的疏水能力。植物乳杆菌XM5的摄入能有效缓解D-半乳糖对大鼠脑组织的氧化损伤;使衰老模型大鼠肝脏中的GSH-Px活力,血清中的GSHPx、T-SOD活力和T-AOC显著提高(p<0.05);同时使肝脏、脑组织和血清中的MDA含量显著降低(p<0.05)。结论:植物乳杆菌XM5是一株性能优良的抗氧化益生乳酸菌,具有潜在的应用价值。
青藏高原;牦牛酸奶;抗氧化;乳酸菌;益生特性
乳酸菌属于革兰氏阳性菌,在自然界中分布极其广泛,它们在工业、农牧业、食品和医药等与人类生活密切相关的重要领域都具有很重要的应用价值。乳酸菌对人体健康的益处包括调节免疫系统、调节肠道菌群平衡、降低血清胆固醇和降低肿瘤风险等[1-4]。近年来,一些乳酸菌被发现具有其他重要的生物学功能,如抗衰老和抗氧化活性[5-7],吸引了越来越多研究者的关注。
目前,已有较多关于筛选具抗氧化活性乳酸菌的研究报道[8-10]。然而,筛选出的功能乳酸菌除了具备独特的高抗氧化能力外,还应具备作为益生菌的必要条件。作为益生乳酸菌若要给宿主提供益生效应,则必须克服宿主体内的物理和化学障碍。这就意味着益生乳酸菌必须具备耐受胃肠道中酸和胆盐的能力[11],才能在体内发挥其应有的益生作用。同时,益生乳酸菌还需要有足够的能力黏附到肠上皮细胞,这是益生菌改善肠道微生物、发挥益生作用的先决条件[12]。
此外,目前有关乳酸菌抗氧化的研究主要停留在体外筛选具有抗氧化活性菌株上[13-15],很少将体外筛选出的抗氧化菌株进行动物体内验证实验及相关的安全性实验。D-半乳糖致衰老模型是我国学者基于衰老代谢学说而复制的衰老模型,近年来,不少国内外学者纷纷使用此衰老模型来研究体内抗氧化作用[16]。
本研究中,通过检测从青藏高原牦牛酸奶中筛选的3 株具高抗氧化活性乳酸菌的耐模拟胃肠液、耐胆盐和疏水能力来评价它们的体外益生特性。并用体外益生特性优良的菌株饲喂由D-半乳糖连续皮下注射诱导的亚急性衰老模型大鼠。通过检测大鼠肝脏、脑组织和血清中谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)活力、总抗氧化能力(total antioxidant capacity,T-AOC)和丙二醛(malondialdehyde,MDA)含量,较系统地研究乳酸菌对D-半乳糖致衰老模型大鼠体内抗氧化系统的影响,为筛选出的抗氧化益生乳酸菌的进一步开发利用提供科学依据。
1 材料与方法
1.1 菌株、动物、培养基与试剂
从青藏高原牦牛酸奶中分离筛选出的3株具抗氧化活性乳酸菌[17]:植物乳杆菌(Lactobacillus plantarum)BX62、植物乳杆菌XM5和乳酸片球菌(Pediococcus acidilactici)XS40,实验室-80℃保存。
雄性Sprague Dawley(SD)大鼠,6 周龄,体质量(200±20)g,购于甘肃中医学院实验动物中心。
MRS液体培养基(g/L):葡萄糖20.0、蛋白胨10.0、牛肉膏10.0、酵母粉5.0、无水乙酸钠5.0、柠檬酸二钠2.0、吐温-80 1.0、K2HPO42.0、MgSO40.58、MnSO40.17,pH 6.5,115 ℃灭菌30 min。
胃蛋白酶、胰蛋白酶、牛胆汁(均为分析纯)北京索莱宝科技有限公司;胆盐(分析纯) 北京奥博星生物技术有限责任公司;GSH-Px试剂盒、T-SOD试剂盒、T-AOC试剂盒、MDA试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
紫外分光光度计 日本日立公司;电热恒温水浴锅上海一恒科学仪器公司;高压灭菌锅 日本三洋公司;超净工作台 苏州净化设备有限公司。
1.3 方法
1.3.1 乳酸菌耐模拟胃肠液能力的测定
模拟胃液的配制:0.35 g胃蛋白酶溶于100 mL 0.2%的无菌生理盐水,用浓盐酸调节pH值到3.0,过0.45 μm滤膜除菌。模拟肠液的配制:0.1 g胰蛋白酶、1.8 g胆盐溶于无菌溶剂(1.1 g NaHCO3、0.2 g NaCl及100 mL蒸馏水),用0.5 mol/L的NaOH调整pH值到8.0。溶液过0.45 μm滤膜除菌。
将已活化好的菌液按10%的接种量接种到模拟胃液(pH 3.0),混匀,37 ℃厌氧培养,分别在0、3 h取样平板计数。在模拟胃液中培养3 h后,吸取1 mL培养液接种到9 mL模拟肠液(pH 8),37 ℃厌氧培养,分别在0、3、6、24 h取样计数。计数用MRS培养平板,生理盐水梯度稀释,取样涂布,37 ℃厌氧培养48 h,计数菌数在30~300个之间的平板,按式(1)计算乳酸菌存活率。

式中:N1为经过模拟胃、肠液培养后的乳酸菌数/(CFU/mL);N0为模拟胃、肠液培养前的乳酸菌数/(CFU/mL)。
1.3.2 乳酸菌耐胆盐能力的测定
无菌MRS-THIO培养基(含质量分数0.2%巯基乙酸钠)中添加0.3 g/100 mL的牛胆汁,然后接种1%的乳酸菌菌悬液(已活化3次),对照组为不含牛胆汁的MRS-THIO培养液。水浴37℃培养,每2 h取样,620 nm波长处测定吸光度,用不含乳酸菌的相对应的空白培养基调零。记录A620nm变化0.3 个单位的时间。推迟时间(lag time,LT)为乳酸菌生长到A620nm变化0.3个单位的时间。LT越小耐胆盐能力越强[18]。
1.3.3 乳酸菌疏水能力的测定
将活化好的乳酸菌接种于液体MRS培养基,37 ℃培养16~18 h,将菌液10 000 r/min离心1 min,用0.1 mol/L KNO3(pH 6.2)洗涤2 次后,用该溶液悬浮菌液,在600 nm波长处测量其初始吸光度A0。再吸取菌悬液3 mL,加入1 mL二甲苯,室温预培养10 min,涡流快速混合2 min,室温静止放置15 min,使之分层,吸取下层水相,以缓冲液为空白对照,在600 nm波长处测量吸光度A并进行记录。按式(2)计算乳酸菌的疏水能力。
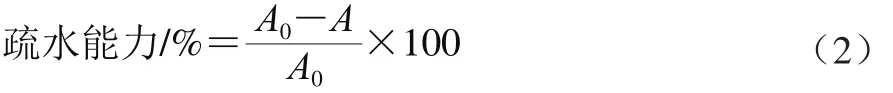
1.3.4 动物分组与饲养
经7 d预饲期后,将40 只SD大鼠随机分为4 组,每组10 只,这4 组分别命名为普通对照组、衰老模型组、阳性对照组和植物乳杆菌组。阳性对照组和植物乳杆菌组每日分别灌胃相应剂量VC溶液(50 mg/(kg·d))和植物乳杆菌XM5活菌液(1010CFU/d),普通对照组和衰老模型组则每日灌胃等量的无菌生理盐水。衰老模型组、阳性对照组和植物乳杆菌组每日接受皮下注射质量分数5% D-半乳糖(500 mg/(kg·d)),普通对照组每日注射等量的生理盐水。每天固定时间灌胃和注射,饲喂普通饲料,喂养于单独隔离的鼠笼,自由采食和饮水,室温维持在(23±2)℃,相对湿度为(55±5)%,定时12 h光照和12 h黑暗,并定期更换饮水和垫料。连续8 周。
1.3.5 抗氧化指标的测定
最后一次灌胃和注射D-半乳糖后,停止进食12 h,不限制饮水,测量大鼠体质量。用乙醚将大鼠昏迷,解剖大鼠,分离肝脏、脑组织、肾脏、脾脏,在心脏取血。用预冷的生理盐水冲洗表面血迹,医用纱布拭干。按式(3)计算脏器指数。
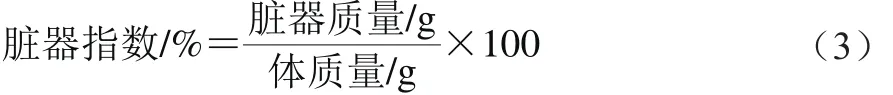
称质量后,将脑和肝脏组织用碾磨器碾成匀浆,并加入9 倍体积预冷的生理盐水,混匀。将制备好的10%匀浆用低温离心机4 000×g离心10 min。取上清液,-80 ℃保存,待测。
利用试剂盒测定大鼠肝脏、脑组织和血清中的GSH-Px、T-SOD活力和T-AOC以及MDA含量,具体操作方法严格按照南京建成试剂盒中的说明书进行。
1.4 数据分析
所有数据均以 ±s表示,SPSS 19.0软件进行数据分析与处理,组内采用Duncan’s多重比较法进行方差分析。
2 结果与分析
2.1 乳酸菌在模拟胃液中的存活率
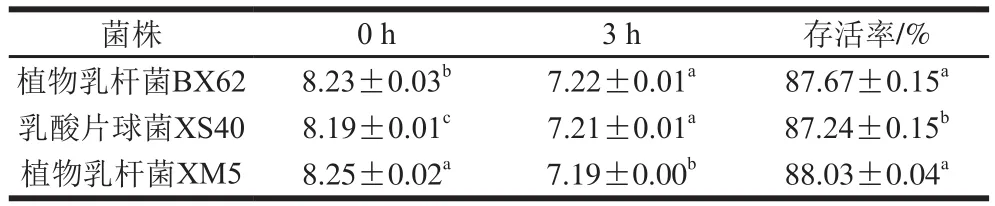
表1 乳酸菌在模拟胃液中消化3 h后的存活率Table 1 Survival rates of LAB strains in simulated gastric juice after 3 h
如表1所示,3 株乳酸菌在pH 3的模拟胃液中消化3 h后存活率都在87%以上。其中菌株XM5存活率最高,为88.03%,与菌株BX62之间没有显著差别(P>0.05),二者均显著高于菌株XS40(p<0.05)。
2.2 乳酸菌在模拟肠液中的存活率
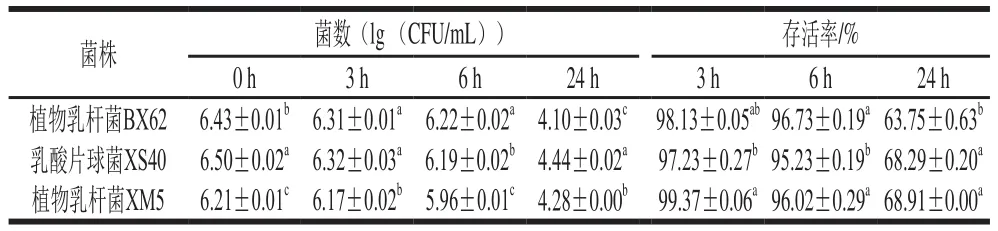
表2 乳酸菌在模拟肠液中消化不同时间的存活率Table 2 Survival rates of LAB strains in simulated intestinal fl uid at different times
如表2所示,在模拟肠液中消化3、6 h后,菌株XM5的存活率分别为99.37%和96.02%,与菌株BX62没有显著差别(P>0.05),显著高于菌株XS40(p<0.05)。在模拟肠液中消化24 h后,菌株XM5的存活率为68.91%,与菌株XS40没有显著差别(P>0.05),显著高于菌株BX62(p<0.05)。
2.3 乳酸菌的耐胆盐能力

表3 乳酸菌的耐胆盐能力Table 3 Bile salt tolerance of LAB strains
3 株乳酸菌在普通MRS和含0.3%胆盐的MRS培养液中在620 nm波长处到达0.3单位的时间差(迟滞期)如表3所示,其中菌株XM5的耐胆盐能力最强,迟滞期仅为2.38 h,显著低于其余两株乳酸菌(p<0.05)。
2.4 乳酸菌的疏水能力
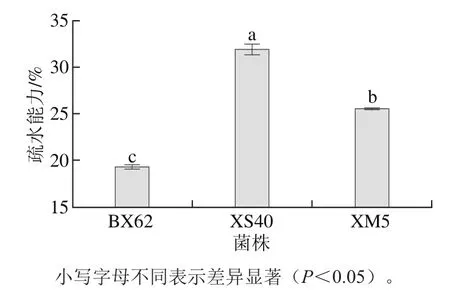
图1 乳酸菌的疏水能力Fig. 1 Hydrophobic ability of LAB strains
3 株乳酸菌的疏水能力由图1可知,菌株XS40的疏水能力为31.92%,显著高于其余两株植物乳杆菌(p<0.05)。菌株XM5的疏水能力为25.5%,而菌株BX62的疏水能力最差,仅为19.27%。由此可知,菌株XM5具有很强的耐模拟胃肠液和耐胆盐能力,同时具有较强的疏水能力。因此选用菌株XM5进行下一步的体内实验。
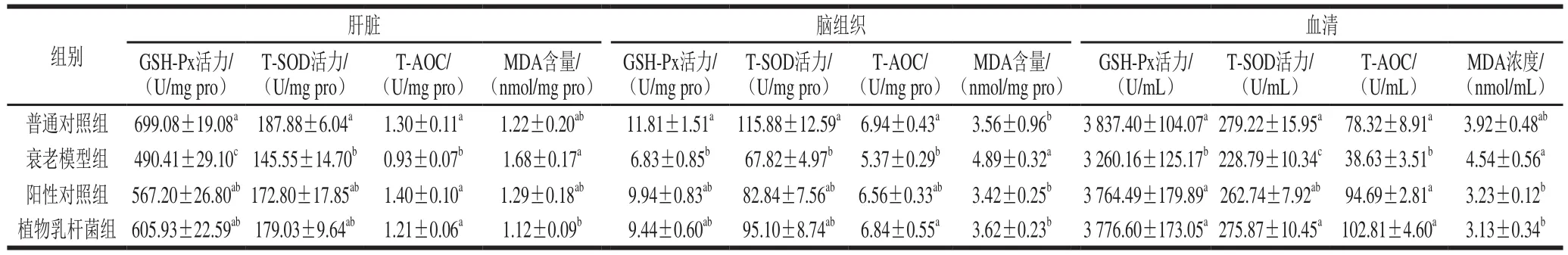
表5 各处理组大鼠肝脏、脑组织和血清中的GSH-Px、T-SOD活力、T-AOC和MDA含量(n=10)Table 5 GSH-Px and T-SOD activities, and T-AOC and MDA contents in liver, brain tissue and serum of rats from each treatment group (n= 10)
2.5 植物乳杆菌XM5对衰老模型大鼠脏器指数的影响
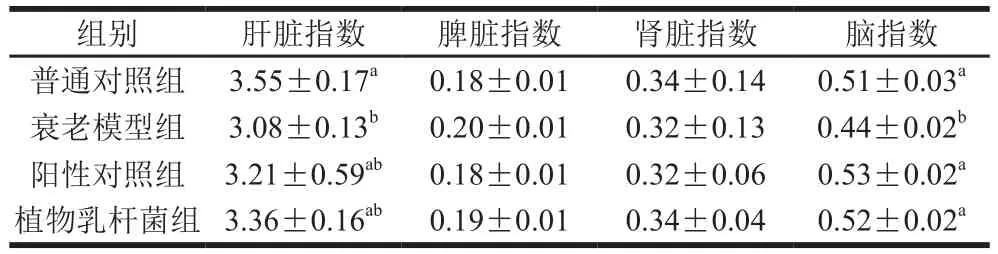
表4 植物乳杆菌XM5对大鼠脏器指数的影响Table 4 Effects of L. plantarum XM5 strains on organ indexes in rats%
如表4所示,各处理对大鼠的脾脏和肾脏指数影响不大,不同处理组之间差异不显著(P>0.05)。与衰老模型组对比,植物乳杆菌组大鼠的肝脏指数有所增加,但差异不显著(P>0.05)。普通对照组、阳性对照组和植物乳杆菌组的脑指数显著高于衰老模型组(p<0.05)。
2.6 植物乳杆菌XM5对衰老模型大鼠体内抗氧化指标的影响
由表5可知,与衰老模型组对比,普通对照组、阳性对照组和植物乳杆菌组大鼠肝脏和血清中的GSH-Px活力都显著提高(p<0.05),而在脑组织中,植物乳杆菌组的GSH-Px活力高于衰老模型组,但并不显著(P>0.05)。与衰老模型组相比,阳性对照组、植物乳杆菌组大鼠肝脏和脑组织中的T-SOD活力都有所提高,但并不显著(P>0.05)。而在血清中,普通对照组、阳性对照组和植物乳杆菌大鼠的T-SOD活力都比衰老模型组显著提高(p<0.05)。在与衰老模型组的对比中,阳性对照组、植物乳杆菌组大鼠脑组织中的T-AOC有所提高,但并不显著(P>0.05)。而在肝脏和血清中,普通对照组、阳性对照组和植物乳杆菌组大鼠的T-AOC都比衰老模型组显著提高(p<0.05)。与衰老模型组对比,植物乳杆菌组大鼠肝脏、脑组织和血清的MDA含量都显著降低(p<0.05),甚至在肝脏和血清中,植物乳杆菌组的MDA含量比普通对照组还低。
3 讨 论
当人体摄入益生菌或含益生菌产品后,益生菌本身需要克服体内环境影响才能发挥其正常的益生作用。本实验中,植物乳杆菌XM5在pH 3的模拟胃液中消化3 h后和在pH 8的模拟肠液中消化24 h后的存活率分别为88.03%和68.91%,说明菌株XM5能以较高的存活率通过胃肠道。体内分泌的胆汁中胆盐对活细胞有一定的毒性,由于其能破坏细胞膜的结构。胆盐的耐受性作为植物乳杆菌在小肠中存活的必要特性之一[19],菌株XM5在含0.3%胆盐的培养基下生长迟滞期仅为2.38 h,说明菌株XM5能在小肠较好地存活。此外,研究表明细菌的疏水能力和细菌与宿主的黏附存在一定的关联,但其相关性尚需要进一步证实。本实验中,菌株XM5的疏水能力经测定为25.5%,说明菌株XM5可能会一定程度上黏附在人体肠道上皮细胞和黏膜表面上,发挥其益生功能。以上实验结果说明,植物乳杆菌XM5具有优良的体外益生特性。
D-半乳糖注射诱导氧化应激动物模型之前被用于研究和衰老相关的变化,主要是由于D-半乳糖能诱导体内产生自由基并降低抗氧化酶的活性[20]。选用在体外益生特性评价实验中表现最好的的植物乳杆菌XM5进行衰老模型大鼠实验。植物乳杆菌组和对照组大鼠的脾脏指数和肾脏指数并没有显著性差异(P>0.05),说明植物乳杆菌对大鼠脏器没有毒副作用。与衰老模型组对比,植物乳杆菌组大鼠肝脏和脑指数都有一定的增加,其中脑指数显著增加(p<0.05),说明D-半乳糖致衰老模型大鼠建立成功,植物乳杆菌XM5的摄入可以有效减少D-半乳糖对脑组织的损伤,还可能有促进大鼠脑组织增殖的作用。
机体内的抗氧化防御体系主要由酶,包括GSH-Px、T-SOD和过氧化氢酶,以及非酶成分(如谷胱甘肽等),通过这种体系防止机体氧化损伤[21-22]。体内广泛存在的催化H2O2的酶主要是GSH-Px,该酶具有特异性催化还原型GSH对H2O2的还原反应,发挥保护细胞膜结构和功能的完整作用,而早有研究报道植物乳杆菌具有增加体内GSH-Px的能力[23-25]。T-SOD能有效清除,减少自由基对体内细胞的损伤,在体内抗氧化平衡体系中发挥重要的作用[26]。体内脂质过氧化中间代谢产物MDA含量的变化是反应脂质过氧化程度的指标之一[27]。
目前,国内外有关植物乳杆菌抗氧化动物实验主要通过测定动物体内各种抗氧化酶的变化情况和MDA含量变化来反映其抗氧化水平[28]。Kullisaar等[29]围绕益生菌L. fermentum ME-3所做的一系列人体实验表明,饮用经L. fermentum发酵的山羊奶,可使血浆T-SOD水平明显提高,MDA水平降低。孟和毕力格等[8]报道了分离自酸马奶中的L. acidophilus MG2-1具有抗氧化活性。饲喂含L. acidophilus MG2-1的活菌制剂使大鼠肝脏组织匀浆中T-SOD和GSH-Px活力明显提高;同时,还能够显著降低大鼠血液和肝脏组织匀浆中MDA含量。张书文等[30]报道了经体外筛选具较强抗氧化活性的Lactobacillus casei subsp.casei SY13菌株能降低连续6 周注射D-半乳糖诱发的衰老小鼠血清和肝脏组织中的MDA含量,同时提高血清和肝脏组织中GSH-Px活力以及T-AOC,但T-SOD活力变化不明显。本实验研究了植物乳杆菌XM5的摄入对衰老模型大鼠肝脏、脑组织和血清中GSH-Px、T-SOD活力、T-AOC和MDA含量的影响。结果表明,与衰老模型组对比,植物乳杆菌组大鼠肝脏和血清的GSH-Px活力有了显著的提高(p<0.05)。另外,与衰老模型组对比,植物乳杆菌组大鼠血清中的T-SOD活力和T-AOC显著提高(p<0.05)。而在MDA含量上,植物乳杆菌组大鼠肝脏、脑组织和血清中MDA含量都显著降低(p<0.05),甚至在肝脏和血清中,植物乳杆菌组MDA含量比普通对照组还低。通过与其他研究结果对比,可以看出分离自青藏牦牛酸奶中的植物乳杆菌XM5具有较强的体内抗氧化益生能力,能有效缓解D-半乳糖给大鼠带来的氧化损伤。
4 结 论
本实验结果表明,植物乳杆菌XM5在通过胃肠道后能保持较高的存活率,并且具有一定的疏水能力。此外,植物乳杆菌XM5的摄入能有效缓解D-半乳糖对大鼠脑组织的氧化损伤;使衰老模型大鼠肝脏中的GSH-Px活力,血清中的GSH-Px、T-SOD活力和T-AOC显著提高;同时肝脏、脑组织和血清中MDA含量都显著降低。未来研究方向将主要集中在植物乳杆菌XM5对D-半乳糖致衰老模型大鼠的抗氧化作用机理,可对其他模式动物在不同剂量、时间下的抗氧化能力等进行进一步研究。
[1] LIN M Y, YEN C L. Antioxidative ability of lactic acid bacteria[J].Journal of Agricultural and Food Chemistry, 1999, 47(4): 1460-1466.DOI:10.1021/jf981149l.
[2] VAN DEN ENDE W, PESHEV D, DE GARA L. Disease prevention by natural antioxidants and prebiotics acting as ROS scavengers in the gastrointestinal tract[J]. Trends in Food Science and Technology,2011, 22(12): 689-697. DOI:10.1016/j.tifs.2011.07.005.
[3] MORADI H, PAHL M V, ELAHIMEHR R, et al. Impaired antioxidant activity of high-density lipoprotein in chronic kidney disease[J]. Translational Research, 2009, 153(2): 77- 85. DOI:10.1016/j.trsl.2008.11.007.
[4] SAIDE J A, GILLILAND S E. Antioxidative activity of lactobacilli measured by oxygen radical absorbance capacity[J]. Journal of Dairy Science, 2005, 88(4): 1352-1357. DOI:10.3168/jds.S0022-0302(05)72801-0.
[5] AYENI F A, SÁNCHEZ B, ADENIYI B A, et al. Evaluation of the functional potential of Weissella and Lactobacillus isolates obtained from Nigerian traditional fermented foods and cow’s intestine[J].International Journal of Food Microbiology, 2011, 147(2): 97-104.DOI:10.1016/j.ijfoodmicro.2011.03.014.
[6] KUDA T, KANEKO N, YANO T, et al. Induction of superoxide anion radical scavenging capacity in Japanese white radish juice and milk by Lactobacillus plantarum isolated from aji-narezushi and kaburazushi[J]. Food Chemistry, 2010, 120(2): 517-522. DOI:10.1016/j.foodchem.2009.10.046.
[7] LEE B, KIM J, KANG Y M, et al. Antioxidant activity and γ-aminobutyric acid (GABA) content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J]. Food Chemistry, 2010, 122(1): 271-276. DOI:10.1016/j.foodchem.2010.02.071.
[8] 孟和毕力格, 周雨霞, 张和平, 等. 酸马奶中乳杆菌MG2-1株的抗氧化作用研究[J]. 中国乳品工业, 2005, 33(9): 21-24. DOI:10.3969/j.issn.1001-2230.2005.09.005.
[9] LIN M Y, CHANG F J. Antioxidative effect of intestinal bacteria Bif i dobacterium longum ATCC 15708 and Lactobacillus acidophilus ATCC 4356[J]. Digestive Diseases and Sciences, 2000, 45(8): 1617-1622. DOI:10.1023/A:1005577330695.
[10] TALWALKAR A, KALLASPATHY K. Metabolic and biochemical responses of probiotic bacteria to oxygen[J]. Journal of Dairy Science,2003, 86(8): 2537-2546. DOI:10.3168/jds.S0022-0302(03)73848-X.
[11] BANSAL T, GARG S. Probiotics: from functional foods to pharmaceutical products[J]. Current Pharmaceutical Biotechnology,2008, 9(4): 267-287. DOI:10.2174/138920108785161587.
[12] BLUM S, RENIERO R, SCHIFFRIN E J, et al. Adhesion studies for probiotics need for vailidation and ref i nement[J]. Trends in Food Science and Technology, 1999, 10(12): 405-410. DOI:10.1016/S0924-2244(00)00028-5.
[13] LEE J, HWANG K, CHUNGM Y, et al. Resistance of Lactobacillus casei KCTC 3260 to reactive oxygen species (ROS): role for a metal ion chelating ef f ect[J]. Journal of Food Science, 2005, 70(8): 388-391.DOI:10.1111/j.1365-2621.2005.tb11524.x.
[14] KULLISAAR T, ZILMER M, MIKELSAAR M, et al. Two antioxidative Lactobacilli strains as promising probiotics[J].International Journal of Food Microbiology, 2002, 72(3): 215-224.DOI:10.1016/S0168-1605(01)00674-2.
[15] 张凤敏, 田丰伟, 陈卫, 等. 具抗氧化活性乳酸菌的筛选[J]. 中国乳品工业, 2007, 35(2): 4-7. DOI:10.3969/j.issn.1001-2230.2007.02.001.
[16] SERRANOA F, KLANN E. Reactive oxygen species and synaptic plasticity in the aging hippocampus[J]. Ageing Research Reviews,2004, 3(4): 431-443. DOI:10.1016/j.arr.2004.05.002.
[17] 陈明, 柯文灿, 保安安, 等. 青藏高原牦牛酸奶中具高抗氧化能力乳酸菌的筛选[J]. 食品工业科技, 2016, 37(8): 201-205. DOI:10.13386/j.issn1002-0306.2016.08.033.
[18] WALKER D K, GILLILAND S E. Relationship among bile tolerance, bile salt deconjugation, and assimilation of cholesterol by Lactobacillus acidophilus[J]. Journal of Dairy Science, 1993, 76(4):956-961. DOI:10.3168/jds.S0022-0302(93)77422-6.
[19] SUCCI M, TREMONTE P, REALE A, et al. Bile salt and acid tolerance of Lactobacillus rhamnosus isolated from Parmingiano Reggiano cheese[J]. FEMS Microbiology Letters, 2005, 244(1): 129-137. DOI:10.1016/j.femsle.2005.01.037.
[20] DAS N, LEVINE R L, ORR W C, et al. Selectivity of protein oxidative damage during aging in Drosophila melanogaster[J]. Biochemical Journal, 2001, 360(15): 209-216. DOI:10.1042/0264-6021:3600209.
[21] 李元锋, 石年, 李煌元, 等. 六氯苯对大鼠机体氧化损伤和抗氧化酶活性的影响[J]. 中华劳动卫生职业病杂志, 2006, 24(10): 601-604.DOI:10.3760/cma.j.issn.1001-9391.2006.10.008.
[22] ARAUJO F B, BARBOSA D S, HSIN C Y, et al. Evaluation of oxidative stress in patients with hyperlipidemia[J]. Atherosclerosis,1995, 117(1): 61-71. DOI:10.1016/0021-9150(94)05558-Z.
[23] WANG A N, YI X W, YU H F, et al. Free radical scavenging activity of Lactobacillus fermentum in vitro and its antioxidative effect on growing-finishing pigs[J]. Journal of Applied Microbiology, 2009,107(4): 1140-1148. DOI:10.1111/j.1365-2672.2009.04294.x.
[24] SON V M,CHANG C C, WU M C, et al. Dietary administration of the probiotic, Lactobacillus plantarum, enhanced the growth, innate immune responses, and disease resistance of the grouper Epinephelus coioides[J]. Fish and Shellfish Immunology, 2009, 26(5): 691-698.DOI:10.1016/j.fsi.2009.02.018.
[25] 王咏梅. 自由基与谷胱甘肽过氧化物酶[J]. 解放军药学学报, 2005,21(5): 369-371. DOI:10.3969/j.issn.1008-9926.2005.05.017.
[26] 董改宁, 熊正英. 槲皮素对运动训练大鼠肝组织自由基代谢及运动能力影响实验研究[J]. 陕西师范大学学报(自然科学版), 2005,33(1): 102-104. DOI:10.3321/j.issn:1672-4291.2005.01.029.
[27] 王钢花, 韩谷鸣. 脑血管病患者血浆异构前列腺素测定的临床意义[J]. 放射免疫学杂志, 2001, 14(3): 152-152. DOI:10.3969/j.issn.1008-9810.2001.03.02.
[28] 闫亚杰, 耿广琴, 李涛. 月季感染白粉病后叶片抗氧化酶活性与MDA含量的变化[J]. 甘肃科学学报, 2010, 22(3): 68-71.DOI:10.3969/j.issn.1004-0366.2010.03.017.
[29] KULLTSAAR T, SONGTSEPP E, MTKELSAAR M, et al.Antioxidative probiotic fermented goats’ milk decreases oxidative stress-mediated atherogenicity in human subjects[J]. The British Journal of Nutrition, 2003, 90: 449-456. DOI:10.1079/BJN2003896.
[30] 张书文, 吕加平, 孟和毕力格, 等. 干酪乳杆菌干酪亚种Lactobacillus casei subsp. casei SY13对衰老模型小鼠的抗氧化作[J]. 中国农业科学, 2010, 43(10): 2141-2146. DOI:10.3864/j.issn.0578-1752.2010.10.021.
Probiotic Properties in Vitro and in Vivo of Antioxidative Lactic Acid Bacteria from Yak Yogurt in Tibetan Plateau
CHEN Ming, KE Wencan, ZHANG Juan, TANG Jing, WANG Lina, DING Wurong*
(State Key Laboratory of Grassland and Agro-Ecosystems, School of Life Science, Lanzhou University, Lanzhou 730000, China)
Objective: To screen for lactic acid bacteria with excellent probiotic and antioxidant properties and to study their anti-aging ef f ect on D-galactose-induced aging mice. Methods: Three strains of lactic acid bacteria with high antioxidant activity were isolated from yak yogurt in the Tibetan Plateau, and their probiotic properties in vitro were evaluated in terms of tolerance to simulated gastrointestinal fl uid and bile salts and hydrophobic ability. The best strain was further selected and fed to the aging model mice. The probiotic properties in vivo were evaluated by organ indexes, glutathione peroxidase (GSH-Px)and total superoxide dismutase (T-SOD) activities, total antioxidant capacity (T-AOC) and malondialdehyde (MDA) content in brain tissue and serum of rats from each treatment group. Results: Lactobacillus plantarum XM5 had strong resistance to simulated gastrointestinal fl uid and bile salt, and also had high hydrophobic ability. Intake of L. plantarum XM5 could ef f ectively alleviate the oxidative damage in rat brain induced by D-galactose, signif i cantly increase GSH-Px activity in liver,GSH-Px and T-SOD activities and T-AOC in serum and signif i cantly reduce MDA content in liver, brain tissue and serum(P < 0.05). Conclusion: L. plantarum XM5 has great potential for application due to its excellent antioxidant properties.
Tibetan Plateau; yak yogurt; antioxidant; lactic acid bacteria; probiotic properties
10.7506/spkx1002-6630-201723028
Q939.96
A
1002-6630(2017)23-0178-06
陈明, 柯文灿, 张娟, 等. 青藏高原牦牛酸奶中具有抗氧化活性乳酸菌的体内外益生特性[J]. 食品科学, 2017, 38(23):178-183.
10.7506/spkx1002-6630-201723028. http://www.spkx.net.cn
CHEN Ming, KE Wencan, ZHANG Juan, et al. Probiotic properties in vitro and in vivo of antioxidative lactic acid bacteria from yak yogurt in Tibetan Plateau[J]. Food Science, 2017, 38(23): 178-183. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201723028. http://www.spkx.net.cn
2016-07-26
国家自然科学基金面上项目(31272486);兰州市人才创新创业项目(2016-RC-55);甘肃省中小企业创新基金项目(1608JCCA058)
陈明(1992—),男,硕士研究生,研究方向为乳酸菌种质资源的发掘、创新与利用。E-mail:chenm2014@lzu.edu.cn
*通信作者:丁武蓉(1982—),女,讲师,博士,研究方向为乳酸菌种质资源利用和功能乳酸菌发掘。E-mail:Dingwr@lzu.edu.cn
