蒲公英萜醇对乳腺癌细胞增殖及发生氧化应激反应的影响
2017-12-11丁米娜陈丽艳
朱 坤,丁米娜,李 月,陈丽艳
(延边大学医学院生物化学与分子生物学教研室,吉林 延吉 133000)
蒲公英萜醇对乳腺癌细胞增殖及发生氧化应激反应的影响
朱 坤,丁米娜,李 月,陈丽艳
(延边大学医学院生物化学与分子生物学教研室,吉林 延吉 133000)
目的:探究蒲公英萜醇(Taraxerol)对乳腺癌细胞(MCF-7细胞)增殖及发生氧化应激反应的影响。方法:将MCF-7 细胞接种于96孔板中,在其中4孔的MCF-7 细胞中分别加入12.5μmol/L、25 μmol/L、50 μmol/L、100 μmol/L 和200 μmol/L的蒲公英萜醇,对其中一孔的MCF-7 细胞不进行添加蒲公英萜的处理。将未经处理的MCF-7细胞设为对照组(Control组),将其他的MCF-7细胞设为用药组。采用细胞计数试剂盒(cell counting kit-8,CCK-8)检测加入不同浓度的蒲公英萜醇对各用药组细胞增殖的影响,采用探针DCFH-DA检测各组细胞中活性氧(ROS)的变化,采用分光光度法测定各组细胞中上清液乳酸脱氢酶(LDH)及细胞中丙二醛(MDA)、超氧化物歧化酶(SOD)含量。结果:进行CCK-8 检测的结果显示,在各用药组细胞中加入蒲公英萜醇后的第48 h和第72 h其增殖速度均明显下降,与对照组细胞相比差异有统计学意义,P<0.05。与对照组细胞相比,各用药组细胞中ROS、LDH、MDA的水平均明显上升(P<0.05),其中SOD的水平均明显下降(P<0.05),且在各用药组细胞中加入蒲公英萜醇的浓度越高,其ROS、LDH、MDA、SOD水平的变化幅度越大。结论:蒲公英萜醇可抑制乳腺癌细胞MCF-7细胞的增殖,其作用机制可能与其能够诱导该细胞发生氧化应激性损伤有关。
乳腺癌;蒲公英萜醇;氧化应激
乳腺癌是导致女性死亡的主要癌症之一。近年来,关于乳腺癌的临床研究虽然取得较大的进展,但其发病率仍逐渐上升[1]。开发治疗乳腺癌的新药已经迫在眉睫。蒲公英萜醇是从中药蒲公英中提取的五环三萜类化合物[2]。有研究表明,蒲公英萜醇可以抑制肿瘤细胞的增殖并促进肿瘤细胞的凋亡[3],但其作用机制尚不明确。本研究以人乳腺癌 MCF-7 细胞作为研究对象,通过检测不同浓度的蒲公英萜醇对 MCF-7 细胞增殖的影响和检测相关的氧化应激指标来探讨其药理作用中可能的分子机制。
1 材料
1.1 材料与试剂
乳腺癌细胞系 MCF-7 为延边大学肿瘤研究中心惠赠;蒲公英萜醇购自西安昊轩生物科技有限公司;DMEM 培养基和胎牛血清(fetal bovine serum,FBS)购自Hyclone公司;乳酸脱氢酶( lactatedehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、 丙 二 醛 ( malondialdelyde,MDA) 试剂盒购自南京建成科技有限公司。
2 方法
2.1 细胞培养
将MCF-7 细胞置于含10%胎牛血清的DMEM 培养液内,于37℃、5%CO2的恒温培养箱中进行培养。在细胞贴壁生长至70%~80%融合时,以0.25%的胰蛋白酶对其进行消化及传代处理。
2.2 CCK-8检测
以每孔1×10³个细胞的密度将MCF-7 细胞接种于96孔板中, 100 μL/孔。在将其培养过夜后分别在各孔中加入 12.5μmol/L、25 μmol/L、50 μmol/L、100 μmol/L 和200 μmol/L的蒲公英萜醇,对其中一孔MCF-7 细胞不进行添加蒲公英萜醇的处理。将未经处理的MCF-7细胞设为对照组(Control组),将其他的MCF-7细胞设为用药组。经培养24 h、48 h和72 h后,将各组细胞改用终浓度为10% 的细胞计数试剂盒(cell counting kit-8,CCK-8)培养基进行温育2 h,然后在酶标仪450 nm处读取吸光度(D)值。
2.3 细胞中MDA、SOD的检测
将各组细胞按上述方法处理后,用胰酶将其消化,对其进行收集和破碎处理,然后经离心操作取上清液,按试剂盒说明书的步骤测定细胞内 SOD、MDA的水平。
2.4 细胞外液中LDH的检测
将各组细胞按上述的方法处理后,收集培养液的上清液,按试剂盒说明书的步骤测定细胞培养液中 LDH的活性。
2.5 细胞中活性氧(ROS)的检测
用荧光探针DCFH-DA检测各组细胞内ROS的水平。用无血清培养液稀释DCFH-DA,制备终浓度为10μmol/L的DCFH-DA工作液。将处理后的各组细胞收集后使其悬浮于1 mL的DCFH-DA工作液中,在37℃的培养箱中避光孵育30 min,每隔3~5 min震荡混匀1次。将各组细胞用PBS洗涤3次,用1 mL的PBS重悬细胞,然后在1h内使用流式细胞仪对其进行检测。
2.6 统计学处理
采用SPSS 17.0 软件对本次研究中的数据进行统计学分析,P<0.05为差异有统计学意义。
3 结果
3.1 进行CCK-8检测的结果
进行CCK-8 检测的结果显示,在各用药组细胞中加入蒲公英萜醇后的第48 h和第72 h其增殖速度均明显下降,与对照组细胞相比,P<0.05。详情见图1。
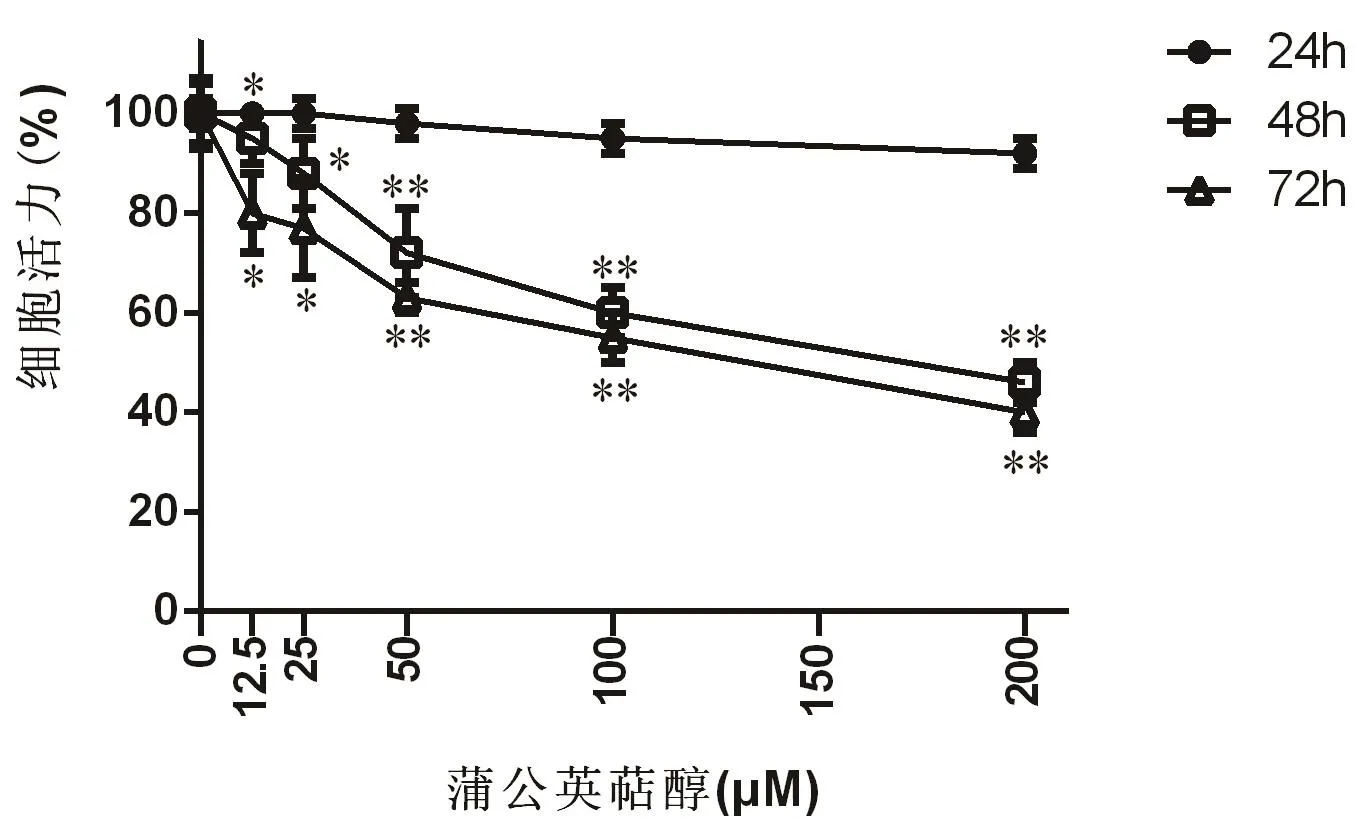
图1 蒲公英萜醇对MCF-7细胞增殖的影响
3.2 用蒲公英萜醇进行处理后各组细胞中ROS、SOD、MDA、LDH水平的变化
与对照组细胞相比,各用药组细胞中ROS、LDH、MDA的水平均明显上升(P<0.05),其中SOD的水平均明显下降(P<0.05),且在各用药组细胞中加入蒲公英萜醇的浓度越高,其ROS、LDH、MDA、SOD水平的变化幅度越大。详情见表2。
表2 蒲公英萜醇对MCF-7细胞中ROS、MDA、SOD、LDH水平的影响(±s,n=6)

表2 蒲公英萜醇对MCF-7细胞中ROS、MDA、SOD、LDH水平的影响(±s,n=6)
注:*与对照组相比,P<0.05。
0.53±0.04 458.4±15.3* 2.51±0.14* 214.5±7.6*0.65±0.05* 432.9±11.9* 2.75±0.12* 231.2±15.4*0.72±0.03* 372.1±10.2* 3.36±0.10* 259.2±11.7*0.83±0.06* 341.1±11.7* 3.97±0.13* 303.8±19.6*蒲公英萜醇(μmol/L) ROS水平 SOD(U/mg prot) MDA (nmol/mg prot) LDH对照组 0.51±0.01 492.1±21.2 2.03±0.25 186.3±10.2用药组(25 μmol/L)用药组(50 μmol/L用药组(100 μmol/L)用药组(200 μmol/L)
4 讨论
进行中药治疗是我国传统医学中重要的治疗手段之一。许多中药成分均被证实具有抗肿瘤的作用。蒲公英萜醇属于乌苏烷型五环三萜类化合物,主要存在于蒲公英、杜香、檀香叶、紫菀等中药中,其分子式是C30H50O[4]。有研究表明,蒲公英萜醇可抑制肿瘤细胞的增殖,并可通过线粒体途径诱导肿瘤细胞的凋亡,进而可发挥抗肿瘤的作用。本实验通过检测氧化应激指标的方法,进一步研究了蒲公英萜醇抗肿瘤作用中的分子机制。
氧化应激反应是正常人体不可避免发生的一种反应。在遭受各种有害刺激时,人体内的活性氧自由基(ROS)和活性氮自由基(RNS)等高活性分子会大量生成,从而会介导细胞凋亡和组织损伤。细胞凋亡的3条途径(线粒体通路、内质网通路和死亡受体通路)均与ROS的大量生成密切相关[5-6]。在本实验中,蒲公英萜醇高剂量组细胞中的ROS呈高表达且氧化损伤严重。当细胞受到损伤后,其中会生成大量的活性自由基,脂质过氧化终产物 MDA也会增多。SOD是普遍存在于动植物体内重要的抗氧化酶,其主要功能是消除自由基[7]。本研究的结果显示,用药组细胞中SOD的表达量显著减少,对细胞内ROS的清除率下降。当乳腺癌细胞受到氧化应激损伤时可释放LDH,分析其释放LDH的量可准确分析其受损的程度。
本次研究的结果证实,蒲公英萜醇可抑制乳腺癌细胞MCF-7细胞的增殖,其作用机制可能与其能够诱导该细胞发生氧化应激性损伤有关。
[1]Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65(2):87–108.
[2]Sharma K.,R.Zafar.Occurrence of taraxerol and taraxasterol in medicinal plants[J].Pharmacogn Rev,2015,9(17):19-23.
[3]谭宝,石海莲,季光,等.蒲公英萜醇和乙酰蒲公英萜醇对胃癌细胞株AGS细胞周期和凋亡的影响[J].中西医结合学报,2011(6):638-642.
[4]LI SA , SHI Y, SHANG XY, et al.Triter penoids from the roots of P terospermum heterophy llum Hance [J]..J Asian Nat Prod Res.2009 ;11(7):652-657 . DOI:10.1080/10286020902964248.
[5]DING Y, WANG H, NIU J, et al. Induction of ROS overload by al antolactone prompts oxidative DNA damage and apoptosis.in co lorectal cancer cells[J]. Int J Mol Sci, 2016, 17(4). pii: E558.doi: 10. 3390/ijms17040558.
[6]ZHU B, LI Y, LIN Z, et al. Silver nanoparticles induce HePG-2 cells apoptosis through ROS-mediated signaling pathways[J].Nanoscale Res Lett,2016, 11(1): 198.
[7]皇甫冰,高继萍,杨霞,等.氧化应激与肾脏细胞凋亡[J].中国比较医学杂志,2015,25(2):54-60.
Studies on oxidative damage and cytotoxicity of Taraxerol to Human Breast Cancer Cells
Objective: To investigate effect of Taraxerol to proliferation and oxidative stress of MCF-7 cells.Methods: Inoculate MCF-7 cells into 96-well plates,respectively drop concentration of 25 umol/L,50 umol/L,100 umol/L,200 umol/L of Taraxerol for each 4 wells on the plate, but leave one well without Taraxerol. Set the well of MCF-7 cells without Taraxerol to control group, set the wells of MCF-7 cells with Taraxerol to experimental group. Apply cell counting kit-8(CCK-8)to test effect of Taraxerol in different concentration to proliferation of each group of the cells, apply probe DCFH-DA to test ROS variation of each group of the cells, apply spectrophotometry to test LDH, MDA and SOD content of each group of the cells .Results: The result of CCK-8 shows that in 48th hour and 72th hour proliferation speed of MCF-7 cells in experimental significantly slower than control group(P<0.05).Compare with control group, ROS,LDH and MDA level of experimental group are significantly increased(P<0.05)but SOD level significantly decreased. The change range of ROS,LDH,MDA and SOD level of MCF-7 cells will become larger with concentration of Taraxerol increasing. Conclusion: Taraxerol have a inhibition effects of MCF-7 cells,the mode of action of Taraxerol may related with oxidative stress of MCF-7 cells.
breast cancer;Taraxerol;oxidative stress
R737.9
B
2095-7629-(2017)19-0010-03
