外源K-IBA对北美香柏扦插生根和内源激素含量变化的影响
2017-12-11王义强王启业华连滩彭牡丹
王义强 ,王启业 ,华连滩 ,彭牡丹 ,钟 洁 ,罗 浪
(1. 中南林业科技大学 经济林培育与保护教育部重点实验室, 湖南 长沙 410004; 2. 中南林业科技大学 生物技术实验室, 湖南 长沙 410004; 3. 国家林业局生物乙醇研究中心, 湖南 长沙 410004)
外源K-IBA对北美香柏扦插生根和内源激素含量变化的影响
王义强1,2,3,王启业2,华连滩2,彭牡丹2,钟 洁2,罗 浪2
(1. 中南林业科技大学 经济林培育与保护教育部重点实验室, 湖南 长沙 410004; 2. 中南林业科技大学 生物技术实验室, 湖南 长沙 410004; 3. 国家林业局生物乙醇研究中心, 湖南 长沙 410004)
以北美香柏Thuja occidentalsL. 2年生枝条为材料,采用3-吲哚丁酸钾盐(K-IBA)3个浓度(3 000、6 000、10 000 mg/L)处理扦插生根试验,清水处理为对照。扦插60天后统计插穗生根率、平均根长、最长根长、平均生根数。扦插后每隔15 d从 6 000 mg/L K-IBA 与对照处理插穗的基部取样,测定生根过程中内源激素吲哚乙酸(IAA)、赤霉素(GA)、脱落酸(ABA)和玉米素(ZT)含量的变化。结果表明:外源K-IBA 对北美香柏扦插生根有促进作用,其中6 000 mg/L K-IBA 的处理效果最好,其生根率为87.78%、生根数22.33根、平均根长12.33 mm、最长根长75.20 mm,显著高于对照。与对照相比,6 000 mg/L K-IBA 处理组的内源 IAA含量、GA 含量提高,而内源ABA、ZT含量下降,促使生根率提高。在北美香柏扦插生根过程中,K-IBA处理调节了内源激素IAA、GA、ABA和ZT含量的变化,而内源激素的动态变化,共同调控插穗不定根的形成。
北美香柏;扦插;不定根发育;内源激素
北美香柏Thuja occidentalsL.,别名美国侧柏,为柏科崖柏属,常绿乔木。原产于北美东部,我国辽宁、山东、湖南、北京等地有引进栽培[1]。北美香柏喜光,耐荫,能适应多种土壤,以肥沃的中性土及石灰岩发育的碱性土上生长为佳,抗寒力强,是石灰岩区困难地造林的首选树种之一,能尽快恢复石灰岩地区的植被,防止水土流失。木材的用处较多,可作为各类建筑材料。枝叶芳香,富含维生素、黄酮、萜类等多种活性成分,是抗坏血病、抗衰老、预防心脑血管疾病的良药。从枝叶中提取的精油芳香迷人、抑菌驱虫,是高级香水、香油、建筑清洁剂的优质原料[2]。树形优美,可作观赏树种。其生态效益、社会效益十分显著。北美香柏主要通过扦插途径繁殖,然而扦插生根机理尚不清楚。本试验研究了外源激素K-IBA处理对北美香柏扦插生根的影响及北美香柏生根过程中内源激素的变化,旨在探讨其扦插生根机理,为该树种的引种推广栽培提供无性繁殖理论依据。
1 材料与方法
1.1 材 料
插穗选择:于湖南湘西州森林生态研究试验站北美香柏实验基地选取生长健壮、无病虫害的北美香柏Thuja occidentalsGreen Giant品种,2年生8~12 cm枝条,插前剪去部分靠近基部老叶,扦插于中南林业科技大学苗圃。温度保持在20~30℃。
生长调节剂K-IBA (3-吲哚丁酸钾盐)购自Sigma-aldrich西格玛奥德里奇(上海)有限公司。
1.2 方 法
1.2.1 扦插试验设计
采用单因素完全随机区组设计,设置3个K-IBA浓度(3 000、6 000、10 000 mg/L)处理,清水对照,每个组重复3次,每组30个插穗。
1.2.2 扦插处理
按珍珠岩:泥炭土3∶1体积比配置混合扦插基质,装入7 cm×6 cm×7 cm无纺布网袋中,放入穴盘上。扦插前2 d,用0.5%高锰酸钾对基质消毒。将制备好的插穗每30条扎成 1 捆,然后用0.1%的高锰酸钾溶液消毒60~90 s。取出用超纯水冲洗干净。用3个不同浓度K-IBA 溶液浸泡插穗形态学下端2~3 cm处20 s,清水浸泡为对照,扦插深度3~4 cm。扦插后,及时浇水,用50%多菌灵可湿性粉剂 500 倍液消毒,每隔 7天于傍晚给插穗喷洒 1 次。相对湿度稳定于80%以上。
1.2.3 指标测定
1.2.3.1 生根测定
扦插后,每隔15天进行1次生根形态观测,分别记录愈伤组织出现期、不定根出现期和发生的部位以及根系的生长过程,扦插60 d后统计插穗生根率、平均根长、最长根长、平均生根数。
1.2.3.2 高效液相色谱(HPLC)测定内源激素(IAA、GA、ABA 、ZT)含量
扦插后,每隔 15天,从6 000 mg/L K-IBA 和对照处理中取样 1次,共计 5 次。从每个重复中随机抽取 10~12 条插穗,迅速用蒸馏水将基部冲洗干净,滤纸擦干,然后置于冰盒内带回实验室,迅速剥取穗条基部2~3 cm 韧皮部,剪碎混匀后用液氮速冻,放于-70 ℃冰箱中保存待测。
称取样品3 g用液氮研磨成粉于离心管中,加入40 ml 80%的预冷色谱甲醇,加入少量抗氧化剂,摇匀,4℃避光浸提12 h。将浸泡提取的北美香柏样品于4℃ 3 000 r/min离心20 min,收集上清液。残渣再次用20 mL 80%的预冷甲醇浸提12 h,3 500 r/min 4℃ 离心15 min,合并上清液。38℃旋转蒸发,除去甲醇。浓缩液用等体积的三氯甲烷萃取两次,加入适量PVP,离心3 000 r/min离心5 min,丢弃下层溶液,上层溶液合并,并且调节pH至2.8~3。乙酸乙酯萃取后干燥。残留物用3 mL甲醇∶0.8%冰醋酸=45∶55溶解,再用0.45 μm的微孔滤膜过滤,小玻璃杯收集滤液用于检测。用流速0.06 mL/min高效液相色谱法(HPLC)测定 IAA、GA、ABA 和ZT的含量。
1.3 数据分析
数据统计处理、图表制作运用Excel 2010。SPSS 22.0进行方差分析和多重比较。
2 结果与分析
2.1 K-IBA处理对北美香柏扦插生根效果的影响
从表1中可看出,在不同K-IBA 浓度处理下,插穗的生根率、平均根长、最长根长和平均生根数指标差异显著(p<0.05)。随 K-IBA 浓度的增加,插穗的生根率和最长根长都是先升高,当K-IBA浓度为6 000 mg/L时,生根率达最大值87.78%,而后随浓度的升高而降低,当K-IBA 处理浓度为10 000 mg/L时其生根率与3 000 mg/L K-IBA 浓度处理组差异不显著,3个K-IBA 浓度处理的生根率分别比清水处理对照组提高23.34%、33.34%和21.11%。3个K-IBA 浓度处理下的插穗的平均根长、最长根长和平均生根数也均显著高于对照处理组,随着浓度的不断升高平均根长是先升高后降低再升高的,最长根长在6 000 mg/L K-IBA 时达到最大值75.20 mm,平均生根数是在3 000 mg/L K-IBA浓度时最多,平均达25.67根。

表1 K-IBA浓度处理的扦插生根指标†Table 1 The rooting characters of cuttings by different K-IBA treatments
综合比较可以看出,在6 000 mg/L K-IBA 浓度处理下北美香柏扦插生根效果最好,其生根率为87.78%、生根数22.33根、平均根长12.33 mm、最长根长75.20 mm。
2.2 6 000 mg/L K-IBA 处理插穗生根进程形态观察
经生根过程插穗基部形态观察发现,K-IBA处理插穗生根情况较对照组提前。扦插后15天,K-IBA 处理插穗基部皮孔膨大外凸、呈开裂迹象,少量插穗愈伤组织开始出现(图1-A);第 30天,插穗皮部有小突起,形成少量不定根(图1-B),因此在扦插后第30天前已有少量根原基的形成与分化;扦插后第45天,插穗不定根开始大量形成,插穗成活率基本稳定(图1-C);扦插后第60天,插穗不定根大量出现,且生长迅速,已经成为小苗木(图1-D)。

图1 北美香柏扦插生根进程Fig. 1 Rooting process of cutting of Thuja occidental
2.3 K-IBA处理对扦插生根内源激素含量变化的影响
2.3.1 扦插生根过程中IAA的含量变化
图2-A表明,扦插后6 000 mg/L K-IBA 处理的插穗 IAA 含量呈现先上升后下降的单峰变化。扦插后15天内上升较慢,第15~30天时,迅速上升,最高达到峰值128.64 ng/(g·FW),而对照处理插穗的IAA 含量变化很小。插后30~60天,6 000 mg/L K-IBA 处理插穗的 IAA 含量逐渐下降,对照处理插穗的则开始上升,上升量不大,第45天时升到峰值59.25 ng/(g·FW)。扦插45天后,不定根逐渐伸长,6 000 mg/L K-IBA和对照处理插穗的 IAA含量都逐渐下降。
2.3.2 扦插生根过程中GA的含量变化
由图2-B可知,扦插后6 000 mg/L K-IBA 处理插穗GA含量为先升高后降,而对照组的GA含量先是略有下降后缓慢上升。扦插生根过程整体GA值 K-IBA处理组>清水对照组。扦插后6 000 mg/L K-IBA 处理插穗GA含量值逐步上升,至第45天为最高的7.45 ng/(g·FW),第45~60天逐渐下降至6.22 ng/(g·FW)。扦插后对照组GA含量值整体变幅很小,至第30天最低值3.97 ng/(g·FW),仅比起始含量值降低了0.12 ng/(g·FW),之后上升又缓慢下降,至60天为4.56 ng/(g·FW)。
2.3.3 扦插生根过程中ABA的含量变化
扦插后6 000 mg/L K-IBA 处理插穗的ABA含量呈现迅速降低,而对照处理插穗的 ABA 含量仅轻微下降;第15天时6 000 mg/L K-IBA处理插穗的 ABA 含量下降至77.56 ng/(g·FW),对照组仅降为 119.87 ng/(g·FW)。6 000 mg/L K-IBA处理插穗的根原基诱导和愈伤组织形成,与较低水平的 ABA 含量有关。扦插至30~60天,两组处理插穗的 ABA 含量均逐渐下降,6 000 mg/L K-IBA 处理插穗ABA含量下降幅度先小后大,而对照处理插穗的 ABA 含量下降幅度则由大到小。最后6 000 mg/L K-IBA 处理插穗的 ABA含量下降了59.48 ng/(g·FW),对照组只下降了0.256 ng/(g·FW)。
2.3.4 扦插生根过程中ZT的含量变化
如图2-D 所示,ZT值在整个扦插生根过程中,K-IBA 处理组<对照组。扦插后实验组和清水对照组处理插穗ZT含量都迅速下降, 6 000 mg/L K-IBA 处理组从14.71 ng/(g·FW)降至最低值9.54 ng/(g·FW),而扦插后15~45天一直上升至峰值19.18 ng/(g·FW),第45天后又急剧下降。对照处理扦插15天内,ZT含量从 14.71 ng/(g·FW) 持续下降到5.99 ng/(g·FW),而后又逐步上升,经过30天上升到峰值11.99 ng/(g·FW),而后也急剧下降。在整个扦插进程中,6 000 mg/L K-IBA 处理插穗 ZT含量始终低于对照。

图2 北美香柏扦插生根过程中内源激素( IAA、GA、ABA、ZT) 含量的变化Fig. 2 Endogenous hormones ( IAA、GA、ABA、ZT) content of Thuja occidental is cuttings in the course of adventitious root development
2.3.5 扦插生根过程中IAA/ABA值的变化
如图3-A 所示,6 000 mg/L K-IBA 处理插穗IAA/ABA 比值在扦插后30天内大幅度升高,达到1.30,此时正是插穗不定根原基形成和发育的时期,扦插后30~45天后急剧下降,继而上升。对照处理插穗的 IAA/ABA 比值扦插后30天内变化不大;第30~45天,IAA/ABA 比值微微升高,45~60 d逐步下降至扦插开始时数值,对照处理插穗的 IAA/ABA 比值扦插后总体变幅不大。
2.3.6 扦插生根过程中IAA/ZT值的变化
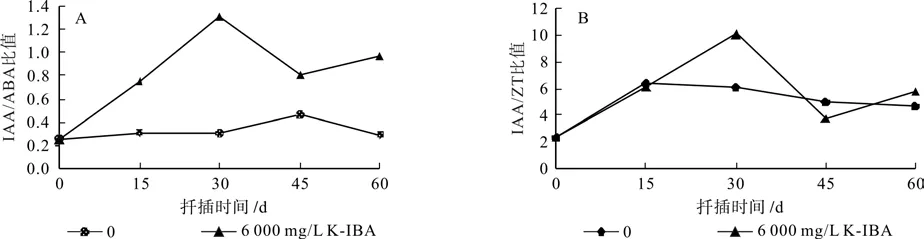
图3 北美香柏扦插生根过程中内源激素比值的变化Fig. 3 Change of the ratio of endogenous hormone of Thuja occidental cuttings in the course adventitious root dvelopment
如图3-B 所示,6 000 mg/L K-IBA 处理的IAA/ZT 比值在插穗生根过程中表现出明显的先上升、后下降、再升高的变化趋势,而对照处理组的 IAA/ZT 值的变化较平缓,呈现先缓慢上升后下降趋势。在两种不同处理扦插后第15~45天各处理的IAA/ZT 值差异最大,且大部分时间内6 000 mg/L K-IBA 处理的 IAA/ZT 比值大于对照处理组,扦插后30天时6 000 mg/L K-IBA 处理比对照组的插穗IAA/ZT 值高4.05。
3 讨 论
由北美香柏扦插生根的形态观察,扦插30 d愈伤组织全部形成,说明在扦插第30 d之前已有少量根原基的形成与分化。扦插后30~45天为插穗基部分化生根的高峰期,根原基的诱导形成,扦插45天之后生根数量变化较小,根不断伸长。
清水处理,生根率54.44%,表明北美香柏为较易扦插生根的树种。K-IBA 对香柏生根有促进作用,但高浓度的 K-IBA 会有一定的抑制作用。外源添加高的植物生长调节剂抑制了根内源生长素的含量,影响到细胞的分裂与分化[3]。不同物种K-IBA 的使用,结果存在着一定的差异。Griffin等[4]用K-IBA 对大叶紫茉莉处理,发现其对生根有明显的促进作用,随着浓度升高生根数量增加,但高浓度的 K-IBA 会有一定的抑制作用;张斌[5]利用K-IBA处理仿栗插穗,K-IBA能改善插穗的营养状况,提高抗逆境能力,进而提高生根效果,3 000 mg/L的处理效果最好。在本实验中,可以看出 K-IBA 处理浓度与生根率、平均根长、最长根长和平均生根数都具有显著性,K-IBA 处理插穗后随着浓度升高愈伤组织形成率、生根率、平均根长和平均生根数都明显提高。K-IBA能增强插穗内细胞的代谢过程,加快蛋白质和淀粉的分解,促进根原基的诱导和形成,进而促进生根[6-9]。其中6 000 mg/L K-IBA 的处理效果最为显著。
不定根的形成受许多因素影响,包括激素、水、温度和光照等[10]。此外还受扦插的处理方式,如留叶数、长度、切口等影响[11]。大量研究表明激素对植物生根非常重要[12]。在北美香柏扦插生根过程中,插穗基部 IAA 含量是随着生根阶段不同而发生变化的。图2-A显示6 000 mg/L K-IBA 处理的插穗在扦插第30天达到最高值,而后逐渐下降。据形态观察发现,第15~30天是北美香柏插穗根部膨大、诱导形成愈伤组织阶段。后 IAA含量下降,反而对北美香柏扦插不定根的伸长有促进作用。IAA 含量的变化和根原基出现的阶段与Blakesley[13],詹亚光[14],刘明国[15],欧阳芳群[16]等研究结果趋同。6 000 mg/L K-IBA 处理组始终高于对照组原因可能是6 000 mg/L K-IBA 处理影响了IAA的合成。GA通过改变根内皮层细胞分裂和伸长的速度,来影响根中其他细胞的分裂和伸长,继而调控根的生长[17-19]。如图2-B,对照组GA含量在愈伤组织形成期稍微下降,在根原基形成与不定根伸长阶段升高。6 000 mg/L K-IBA处理组GA含量始终高于对照组,且在根原基形成与不定根伸长阶段表现尤为明显,能够促进根的伸长。在北美香柏扦插生根过程中,6 000 mg/L K-IBA 处理组的内源 ABA 含量普遍低于对照组(图2-C),可能是因为K-IBA处理影响插穗内 ABA的合成,导致内源ABA 含量下降,而ABA 是生长抑制激素,其含量的下降提高了生根率。玉米素属细胞分裂素,利于植物的生长、分化。由图2-D,在北美香柏扦插过程中6 000 mg/L K-IBA处理组ZT值总体趋势与对照组一致,在愈伤组织出现与根原基形成初期的0~15天内,ZT含量下降;在不定根基本形成15~45天时,ZT 含量略有回升;在不定根形成后45~60天时又稍下降。6 000 mg/L K-IBA 处理组北美香柏插穗ZT值总体低于对照组,说明6 000 mg/L K-IBA 处理北美香柏插穗也引起插穗内部玉米素ZT 的下降反而有利于生根。
内源激素的作用不是单一的,而是互相作用,协同参与愈伤组织的形成、根原基的诱导和形成、不定根的形成与伸长。不同内源激素含量比值的大小对不定根形成能力的反应比单一内源激素的更具有说服力。IAA/ABA 和 IAA/ZT 比值常用作评判植物扦插生根难易的标准[20]。IAA/ABA比值变化与生根有关系。陈雪梅等[21],敖红等[22],周再知等[23]表明IAA/ABA比值大,生根率高,反之,生根率低。由图3-A可知,6 000 mg/L K-IBA 处理组的内源IAA/ABA比值普遍高于对照组,说明外源K-IBA处理北美香柏插穗促进生根;IAA/ABA比值在扦插后30 d内升幅大,利于根原基形成。IAA/ZT 比值表现出与IAA/ABA比值相似的变化趋势,且IAA/ZT 比值都是大于1,说明插穗内源激素IAA含量高于ZT含量,有利于不定根的形成。
4 结 论
外源K-IBA 对北美香柏扦插生根有促进作用,其中6 000 mg/L K-IBA 的处理效果最好,其生根率为87.78%、生根数22.33根、平均根长12.33 mm、最长根长75.20 mm,显著高于对照。与对照相比,6 000 mg/L K-IBA 处理组的内源 IAA含量、GA 含量提高,而内源ABA、ZT含量下降,促使生根率提高。在北美香柏扦插生根过程中,K-IBA处理调节了内源激素IAA、GA、ABA和ZT含量的变化,而内源激素的动态变化,共同调控插穗不定根的形成。
[1]潘志刚,游应天. 中国主要外来树种引种栽培[M]. 北京:北京科学技术出版社, 1994:241-243.
[2]江泽平,王豁然. 中国引种的柏科树种概况[J]. 林业科学研究, 1997, 10(3): 244-252.
[3]Grieneisen V A, Xu J, Marée A F M, et al. Auxin transport is sufficient to generate a maximum and gradient guiding root growth[J]. Nature, 2007, 449(7165): 1008-1013.
[4]Griffin J J,Lasseigne F T. Effects of K-IBA onthe rooting of stem cuttings of 15 taxa of snowbells(Styrax spp.)[J].Journal ofenvironmental horticulture, 2005, 23(4): 171-174.
[5]张 斌,刘延青,朱 玲,等.K-IBA 处理对仿栗插穗生理学特征的影响[J].中南林业科技大学学报, 2011, 31(3): 118-122.
[6]梁玉堂,龙庄如.树木营养繁殖原理和技术[M].北京:中国林业出版社,1993.
[7]宋金耀,何文林,李松波,等.毛白杨嵌合体扦插生根相关理化特性分析[J].林业科学,2001, 37(5): 4- 67.
[8]Gyana R R.Effects of auxins on adventitious root development from single node cuttings of Camellia simnsis(L.)Kuntze and associated biochemical changes[J]. Plant GrowthRegulation,2006,48:111- 117.
[9]黄卓烈,李 明,詹福建.不同生长素处理对按树无性系插条氧化氧化酶活性影响的比较研究[J].林业科学, 2002, 38(4):46- 52.
[10] Leakey R R B. Physiology of vegetative reproduction[J].Encyclopedia Forest Sciences. 2004: 1655-1668.
[11] 曾晶珏, 张 成, 李志辉, 等. 不同生根剂及处理枝条方式对钩栗扦插生根的影响[J]. 中南林业科技大学学报, 2016,36(6): 56-60.
[12] Nag S, Saha K, Choudhuri M A. Role of auxin and polyamines in adventitious root formation in relation to changes in compounds involved in rooting[J]. Journal of Plant Growth Regulation, 2001,20(2): 182-194.
[13] Blakesley D, Weston G D, Elliott M C. Endogeneous levels of indole -3 -acetic acid and abscisic acid during the rooting of Cornuscoggygria cuttings taken at different times of the year[J].Journal of Plant Growth Regulation, 1991, 10: 1-12.
[14] 詹亚光, 杨传平. 白桦插穗生根的内源激素和营养物质[J].东北林业大学学报, 2001, 29(4): 1-4.
[15] 刘明国,王 玲,董胜君,等. 北美香柏插穗生根过程中内源激素的变化[J]. 沈阳农业大学学报, 2010, 41(5): 555-559.
[16] 欧阳芳群, 付国赞, 王军辉, 等. 欧洲云杉扦插生根进程中内源激素和多酚类物质变化[J]. 林业科学,2015,51(3):155-162.
[17] Ubeda-Tomás S, Swarup R, Coates J, et al. Root growth in Arabidopsis requires gibberellin/DELLA signalling in the endodermis[J]. Nature Cell Biology, 2008, 10(5): 625-628.
[18] Ubeda-Tomás S, Federici F, Casimiro I, et al. Gibberellin signaling in the endodermis controls Arabidopsis root meristem size[J]. Current Biology, 2009, 19(14): 1194-1199.
[19] Heo J O, Chang K S, Kim I A, et al. Funneling of gibberellin signaling by the GRAS transcription regulator scarecrow-like 3 in the Arabidopsis root[J]. Proceedings of the National Academy of Sciences, 2011, 108(5): 2166-2171.
[20] 郑均宝, 刘玉军, 裴保华, 等. 几种木本植物插穗生根与内源IAA, ABA 的关系[J]. 植物生理学报, 1991, 17(3): 313-316.
[21] 陈雪梅, 高红兵. 三种杨树扦插生根期间内源激素水平的比较研究[J]. 林业科学, 1994, 30(1): 1-7.
[22] 敖 红, 王 崑, 冯玉龙. 长白落叶松插穗的内源激素水平及其与扦插生根的关系[J]. 植物研究, 2002, 22(2): 190-195.
[23] 周再知, 刘式超, 张金浩, 等. 外源 IBA 对裸花紫珠扦插生根和内源激素含量变化的影响[J]. 热带作物学报, 2016, 37(6):1075-1080.
[本文编校:吴 彬]
Effects of K-IBA treatments on adventitious rooting and endogenous hormones contents of shoot cuttings ofThuja occidentalsL.
WANG Yiqiang1,2,3, WANG Qiye2, HUA Liantan2, PENG Mudan2, ZHONG Jie2, LUO Lang2
(1. Key Lab of Non-wood Forest Nurturing and Protection of National Ministry of Education, Central South University of Forestry and Technology, Changsha 410004, Hunan, China; 2. Biotechnology Laboratory of Central South University of Forestry and Technology,Changsha 410004, Hunan, China; 3.Bio-ethanol Research Center of State Forestry Administration, Changsha 410004, Hunan, China)
The shoot cuttings ofThuja occidentalsL. were collected and treated with indole-3-butyric acid (K-IBA) (concentrations 3 000, 6 000 and 10 000 mg/L), Water treatment as a control. The rooting rate, average root length, the longest root length and average rooting number were recorded after cutting for 60 days; The endogenous hormones(IAA, GA,ABA, ZT) contents of cuttings of 6 000 mg/L K-IBA and control treatment were detected every 15 days interval.The significant difference was found among the four treatments. K-IBA promoted the rooting ofThuja occidentalsL, Among them, 6 000 mg/L K-IBA has the best treatment effect, which was significantly higher than that of CK. The rooting rate was 87.78%, the number of rooting was 22.33, the average root length was 12.33 mm, the longest root length was 75.20 mm. Compared with the control, the content of endogenous IAA and GA increased in 6 000 mg/L K-IBA treatment group, while the contents of endogenous ABA and ZT decreased, then promoted the rooting. K-IBA regulates the changes of endogenous hormones IAA, GA, ABA and ZT, and the dynamic changes of endogenous hormones regulate the formation of adventitious roots in the process of rooting.
shoot cuttings; rooting; plant growth regulator; endogenous hormones
S791.41 文献标志码:A 文章编号:1673-923X(2017)10-0007-06
10.14067/j.cnki.1673-923x.2017.10.002
http: //qks.csuft.edu.cn
2017-03-23
国家林业局“948”项目(2013-4-25)
王义强,教授,博士生导师;E-mail:wangyiqiang12@163.com
王义强,王启业,华连滩,等. 外源K-IBA对北美香柏扦插生根和内源激素含量变化的影响[J].中南林业科技大学学报,2017, 37(10): 7-12.
