氨基酸叶面肥对枣树花期光合作用的影响
2017-12-10邵凤侠
张 龙,王 森,刘 佳,邵凤侠,吴 毅
(中南林业科技大学,湖南 长沙 410004)
氨基酸叶面肥对枣树花期光合作用的影响
张 龙,王 森,刘 佳,邵凤侠,吴 毅
(中南林业科技大学,湖南 长沙 410004)
为了研究氨基酸叶面肥对枣树花期叶片光合作用的影响,通过设置4个处理组:T1组纯氨基酸肥,T2组氨基酸肥与磷、钾、硼混合配剂,T3组磷、钾、硼常用肥,CK组清水,对枣树萌芽期、花期进行叶面肥喷施,并利用Li-6400便携式光合测定仪对各处理组的光合参数进行测定。结果表明:(1)氨基酸叶面肥能促进枣树花期叶片的光合作用,且配合磷、钾、硼一起施用效果最佳,T3组磷、钾、硼常用肥效果不显著;T2组日均净光合速率、气孔导度、水分利用率、光能利用率相比CK组分别增加40.3%、42.9%、21.5%、40%;T1组日均水分利用率相比CK组增加19.2%;(2)光合作用增强的时间段主要在9:00、11:00、15:00、17:00;(3)T2组在强、弱光的条件下适应力最优,积累有机物的潜力最强。
枣树;中秋酥脆枣;氨基酸肥;花期;光合作用
枣树果实营养价值高,深受大众的喜爱,湖南是南方重要的枣树产地之一,但其鲜食枣坐果率低、花期营养缺少的问题非常突出[1]。围绕该问题,目前研究的主要方向大多集中在修剪、土壤改良、喷施激素与选育新品种上[2],但对其花期营养物质的重要来源及关键生理活动之一的光合作用,以及氨基酸叶面肥对此时光合作用影响的研究比较匮乏[3]。本试验设置包含氨基酸肥的多个叶面喷施配方,在枣树关键物候期进行叶面喷肥,通过测定、比较各光合参数的日变化来探究氨基酸叶面肥对其花期叶片光合作用的影响,旨在为高效生产、栽培提供新的思路与科学依据。
1 材料与方法
1.1 试验地概况
试验于2016年4—7月在湖南省长沙市岳麓区莲花镇枣树基地进行,其地理位置为北纬28°11′、东经 112°77′,属典型的亚热带季风气候,四季分明,降水充沛,雨热同期,年平均气温17.3 ℃,年平均降水量1 370.8 mm,雨季主要分布在4~6月,夏季高温少雨,有超过30 d的日平均气温达到30℃以上[4]。试验地土壤为水稻土,pH值为5.15,其含水量在65%左右。
采用长势优良且相同的4年生中秋酥脆枣作为样本株,其株行距250 cm×250 cm[5],试验均选取发育状况良好且一致的树冠外围中上部枝条自其顶端向下数第6~8片成熟健康的叶片作为样叶[6];供试肥料为台湾UP环球胜肽公司提供的胜肽氨基酸叶面肥(下称UP),市售农作物用磷酸二氢钾、硼。
1.2 试验方法
1.2.1 试验设计
试验设4个处理:T1、T2、T3、CK,具体内容见表1。每个处理组均使用电动喷壶对样本株进行全株叶面双面雾态喷施,以叶面出现汇聚小水滴为宜,喷施时间为晴朗的9:00[7]。

表1 喷施剂与喷施时期说明Table 1 Spraying agent and spraying period
1.2.2 光合作用日变化参数的测定
选用LI-COR公司生产的Li 6400便携式光合测定系统,每个试验组每株在东南西北四个方向各测定一片叶,每个叶片每次记录5个数据,取平均值,最后取5株树的平均值[8]。于2016年6月下旬,选择晴天进行光合日变化测定,7:00—19:00每2个小时测定1次。测定的指标包括:净光合速率(Pn)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)、气孔导度(Cond)、光强(PAR)。计算水分利用效率(WUE)=Pn/Tr,光能利用率(SUE)=Pn/PAR[9]。
1.2.3 光合—光响应曲线绘制
每个试验组每个梯度选取3片叶进行测定,每个叶片每次记录3个数据,取平均值,测定时间在2016年6月下旬的7:30至11:30,天气晴朗。光合有效辐射设定为:0、20、50、100、150、200、400、600、800、1 000、1 200、1 500、1 800 和 2 000 μmol·m-2s-1, 温 度 设 置 为 25 ℃,参比室二氧化碳浓度设置 400 μmol·mol-1。利用Prioul和Chartier建立的非直线双曲线模型[10],将测得净光合速率值代入公式 ,在SPSS中进行非线性回归分析,得到最大净光合速率(Pm)、表观光量子效率(b)、暗呼吸速率(Rd)。利用0 ~ 200 μmol·m-2s-1光照条件下的净光合速率值进行线性回归,得到光补偿点(LCP)、光饱和点(LSP)[11]。公式 如下:
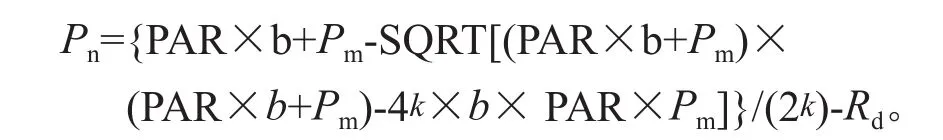
1.3 数据处理和分析
采用Of fi ce 2007、SPSS 19.0 对测量数据进行图表绘制和分析。在数据处理前对所有数据进行正态和齐性检验。
2 结果与分析
2.1 不同处理组光合日变化参数的比较
2.1.1 不同处理组净光合速率日变化比较
由图1可知,4个试验组的净光合速率呈现相似的日变化规律,但是在某些时间点或时间段具有差异性。T1、T2、T3、CK的净光合速率峰值均在13:00附近,其峰谷分别位于7:00和19:00附近,整体符合先增后减的趋势。
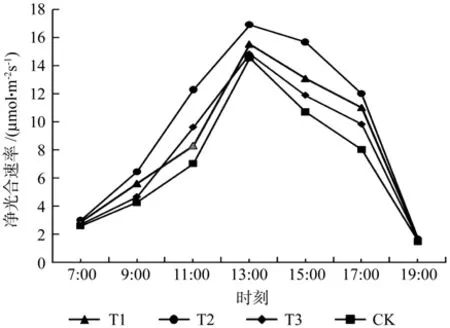
图1 不同处理组净光合速率日变化Fig.1 Different treatment groups of daily variation of net photosynthetic rate
结合表2可知,7:00净光合速率值组间无显著性差异;9:00净光合速率值T2>T1>T3>CK,T1、T2无显著性差异,但与T3、CK差异性显著,T3、CK无显著性差异,其中T1、T2相比CK分别增加32%、51.8%;11:00净光合速率值T2>T3>T1>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加75.6%;13:00净光合速率值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加16.5%;15:00净光合速率值T2>T1>T3>CK,T1、T2与T3、CK之间差异性显著,T1、T2之间以及T3、CK之间无显著性差异,其中T1、T2相对CK分别增加22.5%和46.8%;17:00净光合速率值T2>T1>T3>CK,T1、T2与T3、CK之间差异性显著,T1、T2之间以及T3、CK之间无显著性差异,其中T1、T2相对CK分别增加37.4%和49.9%;19:00净光合速率值组间无显著性差异。

表2 不同处理组日间净光合速率对比†Table 2 Different treatment groups net photosynthetic rate in the day μmol·m-2s-1
2.1.2 不同处理组气孔导度日变化比较
由图2可知,4个试验组的气孔导度值除T3外呈现相似的日变化规律,T1、T2、CK的峰值均在13:00附近,而T3的峰值在11:00附近,各个组的峰谷分别位于7:00和19:00附近,整体符合先增后减的趋势。
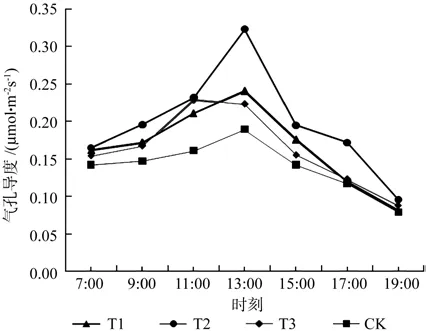
图2 不同处理组气孔导度日变化Fig.2 Different treatment groups spend stomatal conductivity changes
结合表3可知,7:00气孔导度值T组间无显著性差异;9:00气孔导度值T2>T1=T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加33.3%;11:00气孔导度值T2=T3>T1>CK,其它3组均与CK差异性显著,T2、T3、T1、 相 对 CK 分 别 增 加 43.8%、43.8%、31.2%;13:00气孔导度值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加68.4%;15:00气孔导度值T2>T1>T3>CK,T1、T2与T3、CK之间差异性显著,T1、T2之间以及T3、CK之间无显著性差异,其中T1、T2相对CK分别增加28.6%和42.9%;17:00气孔导度值T2>T1=T3=CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加41.7%;19:00气孔导度值组间无显著性差异。

表3 不同处理组日间气孔导度对比Table 3 Different treatment groups of stomatal conductance in the day μmol·m-2s-1
2.1.3 不同处理组胞间二氧化碳浓度日变化比较
由图3可知,4个试验组的胞间二氧化碳浓度值日变化除在某些时间段有差异性外,其它呈现相似的规律,其胞间二氧化碳浓度峰值位于7:00附近,峰谷位于13:00附近,之后增加并趋于稳定。
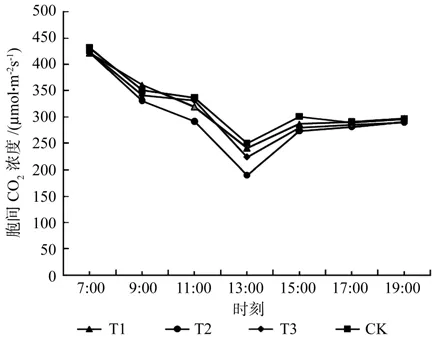
图3 不同处理组胞间二氧化碳浓度日变化Fig.3 Changes of Ci with different treatment groups
结合表4可知,7:00时、9:00时、15:00时、17:00、19:00胞间二氧化碳浓度值组间无显著性差异;11:00胞间二氧化碳浓度值CK>T3>T1>T2,仅T2与其它组分别具有显著差异性,其中T2相比CK减少13.5%;13:00胞间二氧化碳浓度值CK>T1>T3>T2,仅T2与其它组分别具有显著差异性,其中T2相比CK减少24.2%。
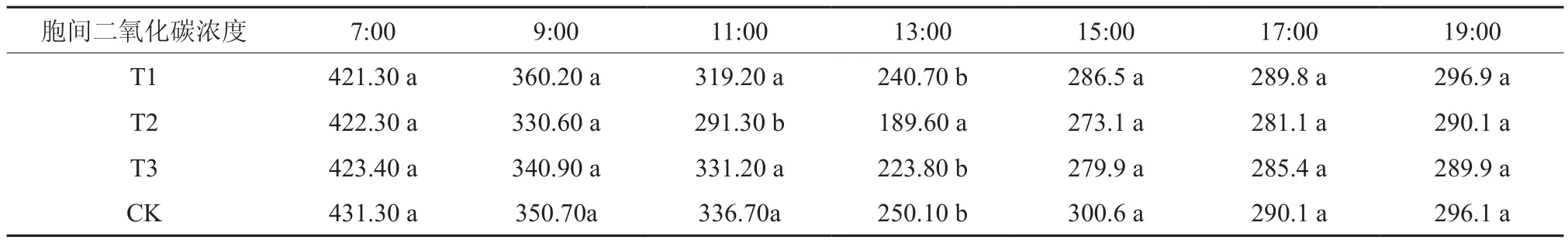
表4 不同处理组日间胞间二氧化碳浓度对比Table 4 Different processing groups Ci contrast in the day μmol·m-2s-1
2.1.4 不同处理组蒸腾速率日变化比较
由图4可知,4个试验组的蒸腾速率值日变化整体上符合先增后减的趋势,其峰值位于13:00附近,峰谷分别位于7:00和19:00附近,其中T3相对另外3组在7:00—11:00增速快,11:00—13:00增速缓慢。
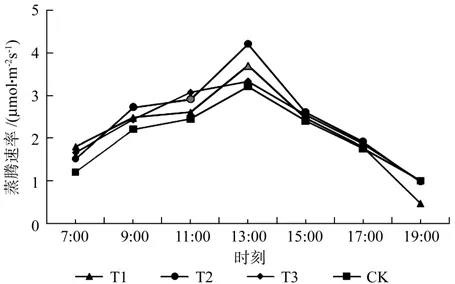
图4 不同处理组蒸腾速率日变化Fig.4 Different processing group of daily variation of transpiration rate
结合表5可知,7:00蒸腾速率值T1>T3>T2>CK,T1、T3与T2、CK之间差异性显著,T1、T3之间以及T2、CK之间无显著性差异,其中T1、T3相对CK分别增加50.4%和38.1%;9:00蒸腾速率值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加23.5%;11:00蒸腾速率值T3>T2>T1>CK,T3、T2与T1、CK之间差异性显著,T3、T2之间以及T1、CK之间无显著性差异,其中T3、T2相对CK分别增加25.2%和18.3%;13:00蒸腾速率值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加31.2%;15:00、17:00蒸腾速率值组间无显著性差异;19:00蒸腾速率值CK=T3>T2>T1,仅T1与其它组分别具有显著差异性,其中T1相比CK减少51.5%。
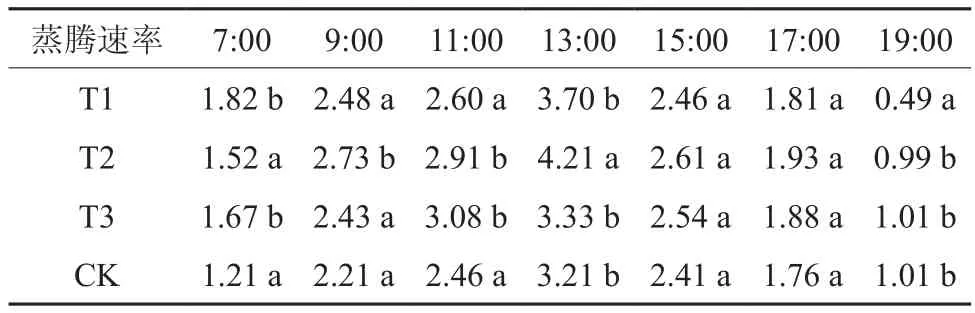
表5 不同处理组日间蒸腾速率比较Table 5 Daytime transpiration rate to compare different treatment groups μmol·m-2s-1
2.1.5 不同处理组水分利用效率日变化比较
由图5可知,4个试验组的水分利用效率值均在7:00与19:00附近处于低水平,在17:00出现峰值,其日变化总体符合先增后减的规律。T2在9:00—11:00相对其它组增速更快,T3、CK在13:00—17:00相对平稳,而T2在11:00—13:00相对平稳且有较小幅度的下降。
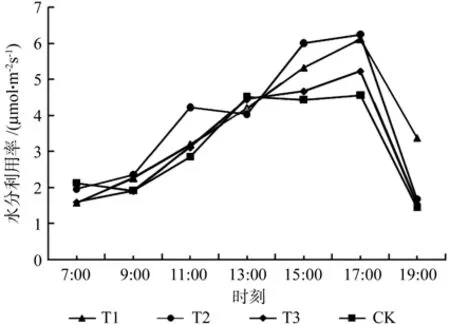
图5 不同处理组水分利用率日变化Fig.5 Different treatment groups of daily variation of water use ef fi ciency
结合表6可知,7:00水分利用效率值CK>T2>T3>T1,CK、T2与T1、T3之间差异性显著,CK、T2之间以及T1、T3之间无显著性差异,其中T3、T1相对CK分别减少24.9%和25.9%;9:00水分利用效率值T2>T1>CK>T3,T1、T2与CK、T3之间差异性显著,T1、T2之间以及CK、T3之间无显著性差异,其中T2、T1相对CK分别增加22.9%和17.7%;11:00水分利用效率值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加48.4%;13:00水分利用效率值组间无显著性差异;15:00水分利用效率值T2>T1>T3>CK,T1、T2与CK、T3之间差异性显著,T1、T2之间以及CK、T3之间无显著性差异,其中T2、T1相对CK分别增加35.4%和20.1%;17:00水分利用效率值T2>T1>T3>CK,T1、T2与CK、T3之间差异性显著,T1、T2之间以及CK、T3之间无显著性差异,其中T2、T1相对CK分别增加37.1%和34.5%;19:00水分利用效率值T1>T2>T3>CK,仅T1与其它组分别具有显著差异性,其中T1相比CK增加133.1%。
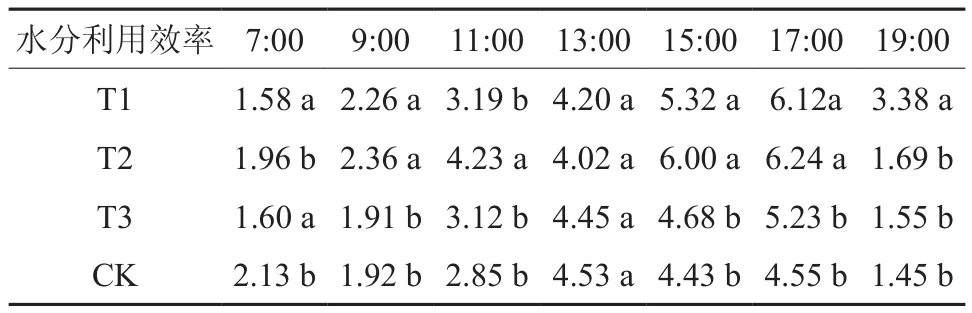
表6 不同处理组日间水分利用率对比Table 6 Between different treatment groups of water use efficiency in the day μmol·m-2s-1
2.1.6 不同处理组光能利用率日变化比较
由图6可知,4个试验组的光能利用率值日变化规律相似,7:00与17:00为2个峰值,9:00与19:00为两个峰谷,不同的是在9:00与11:00之间,只有T1是下降趋势。
结合表7可知,7:00、19:00、光能利用率值组间无显著性差异;9:00光能利用率值T2>T1>T3>CK,T1、T2与CK、T3之间差异性显著,T1、T2之间以及CK、T3之间无显著性差异,其中T2、T1相对CK分别增加60%和40%;11:00光能利用率值T2>T3>T1>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加120%;13:00光能利用率值T2>T1>T3=CK,组间无显著性差异;15:00光能利用率值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加46.2%;17:00光能利用率值T2>T1>T3>CK,T1、T2与CK、T3之间差异性显著,T1、T2之间以及CK、T3之间无显著性差异,其中T2、T1相对CK分别增加50%和37.5%。
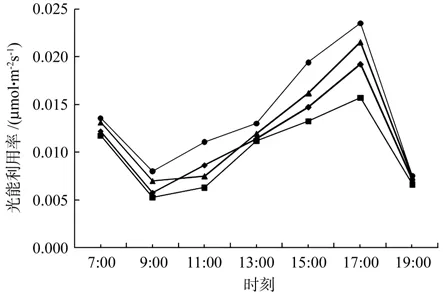
图6 不同处理组光能利用率日变化Fig.6 Changes with different treatment groups of light energy utilization
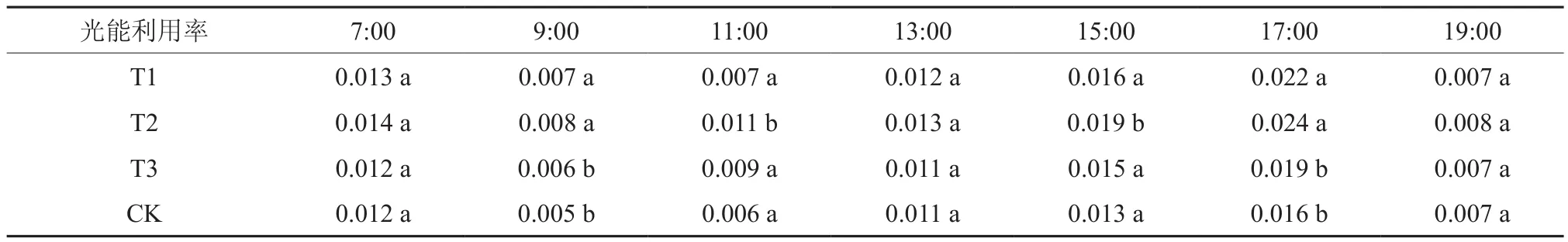
表7 不同处理组日间光能利用率对比Table 7 Different treatment groups of light energy utilization in the day μmol·m-2s-1
2.1.7 不同处理组光合参数日均值比较
由表8可知,4个试验组净光合速率日均值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加40.3%;气孔导度日均值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加42.9%;胞间二氧化碳浓度日均值T2<T3<T1<CK,仅T2与其它组分别具有显著差异性,其中T2相比CK减少7.9%;蒸腾速率日均值T2>T1>T3>CK,但组间差异性不明显;水分利用效率日均值T2>T1>T3>CK,T1、T2与CK、T3之间差异性显著,T1、T2之间以及CK、T3之间无显著性差异,其中T2、T1相对CK分别增加21.5%和19.2%;光能利用率日均值T2>T1>T3>CK,仅T2与其它组分别具有显著差异性,其中T2相比CK增加40%。
2.2 不同处理组光响应曲线比较
由表9可知,4个试验组的光合作用光补偿点LCP值T2<T3<T1<CK,说明对弱光的利用能力和对外界光照强度的敏感度上[12],T2>T3>T1>CK,其中T2相对CK提升28.3%;光合作用饱和点LSP值T2>T1>CK>T3,说明强光下的适应能力T2>T1>CK>T3[13];最大净光合速率Pm值T2>T1>T3>CK,说明在光合潜力上,T2>T1>T3>CK,其中T2相对CK提升31.3%;表光量子效率AQY是叶片光能利用率的一个重要的指标,反映了叶片对弱光的利用能力[14],AQY值T2>T3>T1>CK,其中T2、T3相对CK分别提升82.6%和43.5%;暗呼吸速率Rd绝对值CK>T1>T2>T3,说明同等条件下有机物的消耗量CK>T1>T2>T3。

表8 不同处理组光合参数日均值Table 8 Different treatment groups daily average photosynthetic parameters μmol·m-2s-1
结合图 2 可知,当光照达到 200 μmol·m-2s-1附近,各处理组净光合速率值迅速增加,增加速率 T2 > T3 > T1 > CK,然后在 800 μmol·m-2s-1附近增速放缓,并逐渐达到一个稳定值。

表9 不同处理组光响应特征参数Table 9 Different treatment groups light response characteristic parameters
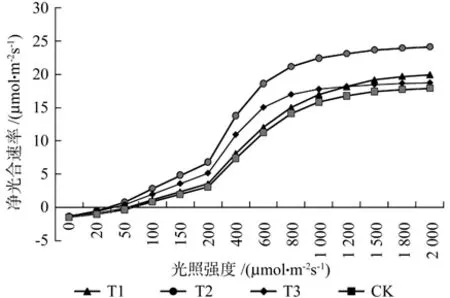
图7 不同处理组光响应曲线Fig.7 Different treatment groups light response curves
3 结论与讨论
(1)净光合速率表示植物有效积累有机物质的快慢,对果实中碳水化合物的形成至关重要[15]。在一天当中的大多数时间段,T2、T1、T3的净光合速率值都高于CK,其中T1相对CK在 9:00、15:00、17:00分 别 提 高 32%、22.5%、37.4%,T2相 对 CK 在 9:00、11:00、13:00、15:00、17:00分别提高51.8%、75.6%、16.5%、46.8%、49.9%,T3在各个时间段相对CK提高均不显著。净光合速率增值最明显的时间段集中在9:00、11:00、15:00、17:00,以上时间段光照充足且温度适宜,有利于植物进行光合等生理活动。同时,净光合速率日均值T2>T1>T3>CK,仅T2相对CK增加显著,提高40.3%。综上所述,对于增加净光合速率值,T2效果最佳,T1次之,T3基本无效果。
(2)气孔导度表示气孔的张开程度,对水分散失和气体交换都有显著的调控作用,且是反映植物抗旱性能的重要指标[16]。一天中气孔导度值,T2相 对 CK在 9:00、11:00、13:00、15:00、17:00分别提高33.3%、43.8%、68.4%、42.9%、41.7%,T1相 对CK在 11:00、15:00分 别 提 高31.2%、28.6%,T3相对CK在11:00提高43.8%。同时,气孔导度日均值T2>T1>T3>CK,仅T2相对CK增加显著,提高42.9%。综上所述,对于增加气孔导度值,T2效果最佳,T1次之,T3基本无效果。
(3)蒸腾作用的意义在于提供水分吸收的动力、运输营养物质以及维持植物体表面温度。蒸腾速率Tr又称为蒸腾强度或蒸腾率,指植物在单位时间、单位叶面积通过蒸腾作用散失的水量[17]。一天中蒸腾速率值,T2相对CK在 9:00、11:00、13:00分别提高23.5%、18.3%、31.2%,T3相对CK在7:00、11:00分别提高38.1%、25.2%,T1在7:00相对CK提高50.4%。同时,蒸腾速率日均值T2>T1>T3>CK,但组间差异性不明显。综上所述,对于增加蒸腾速率值,各处理组相对CK效果均不显著。
(4)胞间CO2浓度表示细胞内部CO2的含量,通常其值与净光合作用呈负相关性[18]。T2的胞间二氧化碳浓度日均值相比CK减少7.9%,同T1、T3比较,减少最多,但绝对差值并不显著,各处理组对该项因素的影响不大。
(5)水分利用效率、光能利用率分别表示水分利用效率与光能利用效率,其值越高说明植物对水分和光照的利用越彻底,同等条件下对干旱和低光照的适应性越强[19]。T2在这两个指标上均表现最好,T1次之,T3效果不显著。
(6)光补偿点LCP值T2<T3<T1<CK,光合作用饱和点LSP值T2>T1>CK>T3,最大净光合速率Pm值T2>T1>T3>CK,表光量子效率AQY值T2>T3>T1>CK,暗呼吸速率Rd绝对值CK>T1>T2>T3。综上所述,T2在一定程度的弱光、强光环境下,其光合作用的强度相比CK均有明显的优势,积累有机物的能力也最强。
[1]郭 盛,段金廒,唐于平,等.中国枣属药用植物资源化学研究进展[J].中国现代中药,2012,14(8):1-5.
[2]刘世平,李武军,黄小凤,等.3个台湾青枣品种与野生毛叶枣光合作用及叶绿素荧光特性的比较[J].广东农业科学,2007(7):7-10.
[3]王林云.3个鲜食枣品种叶片光合特性及其相关性状研究[D].临安:浙江农林大学,2010.
[4]吴思政,聂东伶,梁文斌,等.4个蓝莓品种光合特性的比较[J].经济林研究,2015,33(3):1-7.
[5]申晓晶,李王成.宁夏老压砂地枣树不同水分条件下的光合特性研究[J]. 节水灌溉,2015(5):12-15,19.
[6]程晓建,王林云,周顺元,等.3种鲜食枣品种光合作用日变化及光响应特征[J].安徽农业大学学报,2012,39(6):998-1002.
[7]曲泽洲.我国古代的枣树栽培[J].河北农业大学学报, 1963(2):1-18.
[8]陈启发.红枣的营养功效与枣树栽培技术[J].现代农业科技,2013(7):100-101.
[9]汪景彦,徐 锴,李 壮,等.国内外枣业现状与未来[J].果农之友,2009(3):3-5.
[10]赵天宏,王美玉,张巍巍,等.大气CO2浓度升高对光合作用的影响[J].生态环境,2006(5):1096-1100.
[11]李 阳,齐曼·尤努斯,祝 燕.水分胁迫对大果沙枣光合特性及生物量分配的影响[J].西北植物学报,2006(12):2493-2499.
[12]晏 巢,王 森,邵凤侠.南方鲜食枣木质化与非木质化枣吊叶片光合效率的比较[J].经济林研究,2013,31(2):113-117.
[13]李艳芳.拉枝对枣树结果、叶片营养和光合特性的影响[D].保定:河北农业大学,2010.
[14]王秀伟,毛子军.7个光响应曲线模型对不同植物种的实用性[J].植物研究,2009(1):43-48.
[15]李瑞海.不同配方叶面肥对作物生长的影响[D]. 南京:南京农业大学,2008.
[16]申 明,成学慧,谢 荔, 等.氨基酸叶面肥对砂梨叶片光合作用的促进效应[J].南京农业大学学报,2012,35(2):81-86.
[17]王洪荣,季 昀. 氨基酸的生物活性及其营养调控功能的研究进展[J]. 动物营养学报,2013,25(3):447-457.
[18]宋奇超,曹凤秋,巩元勇,等.高等植物氨基酸吸收与转运及生物学功能的研究进展[J]. 植物营养与肥料学报,2012,18(6):1507-1517.
[19]王 莹,史振声,王志斌,等.植物对氨基酸的吸收利用及氨基酸在农业中的应用[J]. 中国土壤与肥料,2008(1):6-11.
Amino acid foliar fertilizer effect on Zizyphus jujube flowering photosynthesis
ZHANG Long, WANG Sen, LIU Jia, SHAO Fengxia, WU Yi
(Central South University of Forestry & Technology, Changsha 410004, Hunan, China)
in order to study the amino acid foliar fertilizer in fluence on Chinese jujube flowering leaf photosynthesis, this test by setting the four treatment groups: pure amino acid fertilizer, T1 group T2 group of amino acid fertilizer mixed with phosphorus, potassium,boron dispensing, T3 group of phosphorus, potassium, boron fertilizer, commonly used water CK group, the jujube bud, flowering foliar fertilizer spraying, and use the Li - 6400 portable photosynthesis meter in each treatment group of photosynthetic parameters were determined. Results show that: (1) amino acid foliar fertilizer can promote Chinese jujube flowering of leaf photosynthesis, and together with phosphorus, potassium, boron fertilization effect best, T3 group of phosphorus, potassium, boron commonly used fertilizer effect is not signi fi cant; T2 group average daily net photosynthetic rate, stomatal conductance, water use ef fi ciency, light energy utilization compared with CK group increased by 40.3%, 42.9%, 21.5% and 40.3% respectively; T1 daily water use ef fi ciency compared with CK group increased by 19.2%; (2) the photosynthesis of growing period mainly at 9:00, 11:00, 15:00 17:00; (3) T2 group under the condition of strong, the weak light adaptability optimal, the strongest potential accumulation of organic matter.
Chinese jujube;Zizyphus jujubecv. Zhongqiusucai; amino acid fertilizer; flowering stage; photosynthesis
S718.43
A
1673-923X(2017)11-0069-07
10.14067/j.cnki.1673-923x.2017.11.012
2016-08-23
国家948项目“以色列鲜食枣品种及培育新技术引进”(2012-4-61);国家林业局标准项目“南方鲜食枣栽培技术规程”(2012-LY-197)
张 龙,硕士研究生
王 森,教授,博士;E-mail:csuftwangsen@163.com
张 龙,王 森,刘 佳,等.氨基酸叶面肥对枣树花期光合作用的影响[J].中南林业科技大学学报,2017, 37(11): 69-75.
[本文编校:吴 毅]
