断节参抑制α-葡萄糖苷酶活性成分研究
2017-12-09毛坤军张莉周慧云黄平
毛坤军,张莉,周慧云,黄平
(江西医学高等专科学校,江西 上饶 334000)
断节参抑制α-葡萄糖苷酶活性成分研究
毛坤军,张莉,周慧云,黄平*
(江西医学高等专科学校,江西 上饶 334000)
目的寻找断节参中具有抑制α-葡萄糖苷酶活性的成分。方法采用体外抑制α-葡萄糖苷酶活性模型进行追踪,用各种色谱法分离,根据理化性质和谱学数据鉴定结构,筛选出活性较强的单体化合物并进行酶活性抑制动力学研究。结果断节参乙醇提取物的乙酸乙酯溶性部位具有显著的抑制α-葡萄糖苷酶活性,从中分离出3个化合物,其中断节参苷H和青阳参苷B两个皂苷类化合物具有较强抑制α-葡萄糖苷酶活性,IC50分别为21.90、35.32 mg·L-1,明显高于阳性对照药阿卡波糖(IC50=1 017.41 mg·L-1)。酶活性抑制动力学反应结果表明,两个皂苷对α-葡萄糖苷酶的抑制类型均为非竞争性抑制剂。结论断节参苷H和青阳参苷B为首次报道对α-葡萄糖苷酶有抑制活性。
断节参;α-葡萄糖苷酶;断节参苷H;青阳参苷B;抑制类型
断节参系萝藦科鹅绒藤属植物昆明杯冠藤CynanchumwallichiiWight的根,又名对节参,青洋参,断节参主要分布于我国四川、贵州、云南以及广西等地。具有补肝肾、强筋骨之功效,主要用于治疗风湿关节炎及肾虚腰痛、病后体虚、跌打损伤[1]等。现代化学研究表明,断节参主要含有C21甾体皂苷、苯乙酮、甾醇等类化合物[2-3],现代药理活性研究发现其具有抗炎镇痛、抗氧化、抗肿瘤、抗抑郁等药理活性[4-6],但未见对α-葡萄糖苷酶抑制作用的研究报道。
α-葡萄糖苷酶抑制剂可竞争性抑制小肠内α-葡萄糖苷酶的活性,延缓或抑制葡萄糖在肠道的吸收,从而有效降低餐后高血糖。由于其独特的优势,目前已被广泛用于糖尿病及其并发症的防治。为进一步开发利用断节参资源,本实验采用体外抑制α-葡萄糖苷酶活性筛选模型,从断节参乙醇提取物的乙酸乙酯活性部位分离得到12个化合物,其中两个皂苷类化合物具有明显的抑制α-葡萄糖苷酶活性。
1 主要仪器和试剂
680型自动酶标仪(美国BIO-RAD公司);AY220电子分析天平(日本岛津分析仪器公司);雷磁PHSJ-3F型pH计(上海精密科学仪器有限公司),Costar 96孔细胞培养板。
对硝基苯酚(p-Nitrophenol,33920)购于上海阿拉丁有限公司;α-葡萄糖苷酶(α-glucosidase,SLBB7613V)、4-硝基苯-α-D-吡喃葡萄糖苷(4-ntrophenyl-α-D-glucopyranoside,PNPG,BCBG2931V)、阿卡波糖(acarbose,Lot16869)、DMSO均购自Sigma公司;乙醇、石油醚、二氯甲烷、乙酸乙酯、正丁醇、甲醇均为分析纯(广东华光科技股份有限公司)。
断节参药材采自云南昆明(批号:120914),经南京中医药大学陈建伟教授鉴定为萝藦科鹅绒藤属植物昆明杯冠藤CynanchumwallichiiWight的根。
2 方法
2.1 提取与分离
断节参药材20 kg,打成粗粉,以8倍量95%乙醇回流提取2 h,重复2次,再以50%乙醇回流提取提取1次,合并提取液滤液,浓缩至无醇味,再加水混悬依次用石油醚、乙酸乙酯、正丁醇萃取,得石油醚部位230 g、乙酸乙酯部位420 g、正丁醇部位480 g,剩余水部位950 g。
体外α-葡萄糖苷酶抑制活性研究发现,石油醚和乙酸乙酯溶性部位有较强活性。取乙酸乙酯部位经硅胶(200~300目)柱色谱(依次以石油醚-乙酸乙酯和二氯甲烷-甲醇系统梯度洗脱)分离得到不同极性段,再经过中压制备柱色谱、ODS 柱色谱(甲醇-水系统梯度洗脱)、Sephadex LH-20柱色谱(甲醇-水)反复分离和纯化。最终分离得到化合物1(128 mg)、2(79 mg)和3(37 mg)。
2.2 抑制α-葡萄糖苷酶活性成分的筛选方法
2.2.1 检测方法 本检测在96孔板上进行,反应体系参照康文艺等[7]的方法,按照公式(1)计算抑制率(I)。
I(%)=[1-(A样品-A样品空白)/(A阴性-A空白]×100%
(1)
并用Origin软件求出相应半数最大抑制浓度(IC50)值。同时设定阴性对照组(缓冲液+酶液+底物)、空白对照组(缓冲液)、样品测定组(样品+酶液+底物)、样品对照组(样品+缓冲液)。
2.2.2 标准曲线制作 根据反应体系,用磷酸缓冲液(pH 6.8)配制1000 μmol·L-1的PNP,稀释成 400、300、200、150、100、50、25、5、0 μmol·L-1。分别取7种不同浓度的PNP溶液各160 μL,加入0.2 moL·L-1Na2CO3溶液80 μL,混匀,在405 nm下测定A值,平行3次。以A值为纵坐标,对硝基苯酚浓度为横坐标,做出标准曲线。
2.2.3α-葡萄糖苷酶活力的测定 根据反应体系:[110 μL 磷酸钾缓冲液(pH 6.8),加入20 μL 0.2 U·mL-1α-葡萄糖苷酶,10 μL DMSO,37 ℃恒温15 min后加入2.5 mmoL·L-1PNPG 20 μL,37 ℃恒温反应15 min,再加入80 μL 0.2 moL·L-1Na2CO3溶液],于405 nm波长下测定A值。
酶活力单位定义:37 ℃、pH 6.8条件下,每分钟水解底物所产生1 μmoL对硝基苯酚的酶量,规定为1个酶活力单位(U)。
3 结果与讨论
3.1 结构鉴定
化合物1:白色无定型粉末(甲醇),Liebermann-Burchard和Keller-Kiliani反应阳性,UV光谱在220nm有最大吸收,推测其可能为甾体2-去氧糖苷类化合物。1H-NMR(DMSO-d6,300 MHz)δ:1.04(3H,s,19-CH3),1.53(3H,s,18-CH3),2.03(3H,s,21-CH3),3.72(3H,s,3″′-OCH3),3.79(3H,s,3″″-OCH3),4.05(1H,brs,3α-H),4.55(1H,dd,J=12,4.5 Hz,12α-H),4.70(1H,d,J=9.3 Hz,1″″-H),4.74(1H,d,J=9.3 Hz,1″′-H),4.86(1H,d,J=8.7 Hz,1″-H),5.28(1H,brs,6-CH),5.56(1H,s,2′-CH),6.81(2H,d,J=8.7 Hz,4′,6′-H),7.72(2H,d,J=8.7 Hz,3′,7′-H),10.26(1H,s,5′-OH);13C-NMR(DMSO-d6,300 MHz)δ:38.2(C-1),28.8(C-2),76.3(C-3),38.0(C-4),137.9(C-5),118.7(C-6),33.7(C-7),73.0(C-8),42.9(C-9),36.2(C-10),23.8(C-11),72.1(C-12),57.0(C-13),88.4(C-14),33.0(C-15),32.9(C-16),91.1(C-17),10.1(C-18),17.5(C-19),209.1(C-20),27.2(C-21),163.8(C-1′),120.4(C-2′),131.2(C-3′,7′),115.1(C-4′,6′),161.7(C-5′)。此外,100.8(C-1″)、36.1(C-2″)、79.8(C-3″)、74.9(C-4″)、71.5(C-5″)、18.0(C-6″)、56.4(OCH3);98.8(C-1″′)、35.2(C-2″′)、76.4(C-3″′)、81.7(C-4″′)、68.0(C-5″′)、17.9(C-6″′)、57.8(OCH3);95.0(C-1″″)、37.9(C-2″″)、66.1(C-3″″)、81.9(C-4″″)、67.4(C-5″″)、18.0(C-6″″)分别为β-D-Ole、β-D-Cym、β-D-Dgt碳信号。以上数据与文献[4]报道的断节参苷H基本一致,故化合物1鉴定为断节参苷H。
化合物2:白色无定型粉末(甲醇),Liebermann-Burchard和Keller-Kiliani反应阳性,UV光谱在220nm有最大吸收,推测其可能为甾体2-去氧糖苷类化合物。1H-NMR(DMSO-d6,300 MHz)δ:0.99,1.02(6H,d,J=6.9 Hz,5′,6′-CH3),1.04(3H,s,19-CH3),1.40(3H,s,18-CH3),2.03(3H,s,7′-CH3),2.09(3H,s,21-CH3),3.31(3H,s,3″-OCH3),3.33(3H,s,3′″-OCH3),3.34(3H,s,3″″-OCH3),3.69(1H,m,3α-H),4.33(1H,dd,J=11.7,4.5 Hz,12α-H),4.52(1H,d,J=9.3 Hz,1″″-H),4.67(1H,d,J=9.0 Hz,1″′-H),4.76(1H,d,J=8.7 Hz,1″-H),5.27(1H,brs,6-CH),5.43(1H,s,2′-CH);13C-NMR(DMSO-d6,300 MHz)δ:38.6(C-1),28.7(C-2),75.0(C-3),37.0(C-4),137.9(C-5),118.7(C-6),33.7(C-7),73.0(C-8),43.0(C-9),36.2(C-10),23.7(C-11),71.4(C-12),56.6(C-13),88.3(C-14),33.0(C-15),31.6(C-16),90.9(C-17),9.9(C-18),17.5(C-19),208.7(C-20),26.8(C-21),164.6(C-1′),113.0(C-2′),164.5(C-3′),36.2(C-4′),20.5(C-5′)20.7(C-6′)15.9(C-7′)。此外,100.8(C-1″)、35.5(C-2″)、79.8(C-3″)、75.0(C-4″)、71.5(C-5″)、17.9(C-6″)、56.4(OCH3);99.3(C-1″′)、35.5(C-2″′)、76.6(C-3″′)、81.8(C-4″′)、67.8(C-5″′)、17.9(C-6″′)、56.4(OCH3);95.0(C-1″″)、37.9(C-2″″)、76.5(C-3″″)、82.0(C-4″″)、67.9(C-5″″)、18.0(C-6″″)、57.8(OCH3)分别为β-D-Ole、β-D-Cym、β-D-Cym碳信号。以上数据与文献[4]报道的青阳参苷B基本一致,故化合物2鉴定为青阳参苷B。
化合物3:白色针状结晶,mp 215~220 ℃,1H-NMR(C5D5N,300 MHz)δ:1.46(3H,s,19-CH3),2.00(3H,s,18-CH3),2.64(3H,s,21-CH3),3.88~3.99(2H,m,3α和12α-H),5.38(1H,brs,6-H);13C-NMR(C5D5N,300 MHz)δ:39.3(C-1),32.1(C-2),71.6(C-3),43.5(C-4),140.4(C-5),118.8(C-6),34.3(C-7),74.4(C-8),45.0(C-9),37.4(C-10),29.5(C-11),69.0(C-12),60.5(C-13),89.3(C-14),35.1(C-15),32.8(C-16),92.6(C-17),9.4(C-18),18.6(C-19),209.6(C-20),27.9(C-21)。以上数据与文献[2]报道的去酰基萝藦苷元基本一致,故鉴定化合物3为去酰基萝藦苷元。
3.2 提取部位对α-葡萄糖苷酶活性抑制成分的筛选
断节参提取物不同极性部位及阳性药阿卡波糖的α-葡萄糖苷酶活性抑制作用见图1,石油醚、乙酸乙酯、总皂苷部位的抑制活性较好,其抑制率明显高于其他部位以及阳性对照药,所以可采用活性追踪方式对乙酸乙酯部位继续分离。
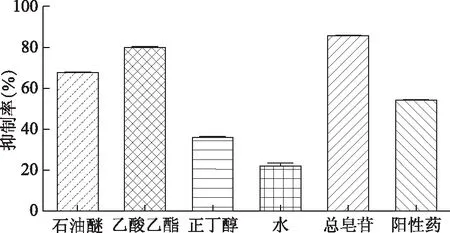
注:各提取物初筛质量浓度均为1.5 g·L-1。图1 不同提取物对α-葡萄糖苷酶抑制活性的比较
3.3 对α-葡萄糖苷酶活性抑制作用化合物的筛选
对分离得到的化合物进行初步α-葡萄糖苷酶活性抑制筛选,结果见表1。皂苷类化合物具有明显的α-葡萄糖苷酶活性抑制作用,而苷元对α-葡萄糖苷酶活性基本没有抑制作用。

表1 单体化合物体外抑制α-葡萄糖苷酶活性
3.4 活性化合物IC50实验
不同质量浓度(200、100、50、25、12.5、6.25 μg·mL-1)下断节参苷H和青阳参苷B抑制α-葡萄糖苷酶活性见图2。根据图2并用Origin软件得断节参苷H和青阳参苷B的IC50分别为21.90、35.32 mg·L-1,远小于阳性对照药阿卡波糖的IC50值(IC50=1 017.41 mg·L-1),且两个化合物对α-葡萄糖苷酶活性抑制作用均与浓度呈正量效关系。
3.5 受试化合物抑制类型的确定
化合物1和2分别取适宜的两个不同质量浓度,PNPG取4个不同质量浓度,分别测定反应速度。按Lineweave-Burk作图法,以1/[S](L·mmol-1)为横坐标,1/V为纵坐标,分别绘制两个化合物的抑制作用动力学曲线(见图3和4)。图3和4显示化合物1和2对α-葡萄糖苷酶活性抑制作用均属于非竞争性抑制剂,反应速度Vmax随受试化合物浓度增大而减小,米氏常数Km值保持不变。
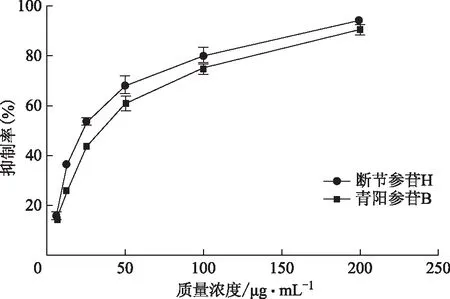
图2 受试化合物不同质量浓度下对α-葡萄糖苷酶抑制曲线
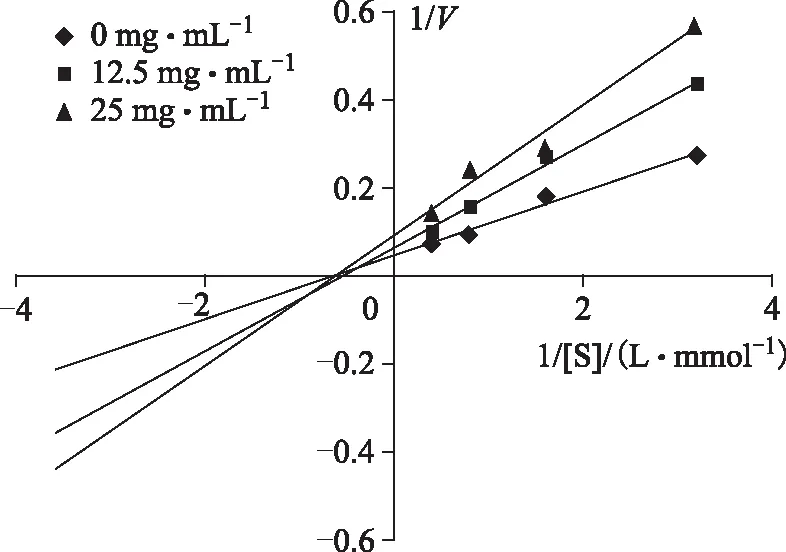
图3 化合物1的Lineweave-Burk双倒数曲线
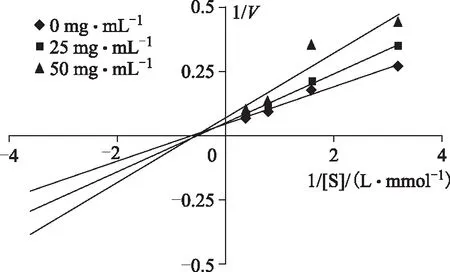
图4 化合物2的Lineweave-Burk双倒数曲线
4 讨论
近年来,鉴于皂苷类化合物毒副作用小、作用温和、性质稳定的优点[7],其降血糖作用研究进展迅速,如苦瓜皂苷、大豆皂苷、人参皂苷等三萜皂苷以及藠头皂苷、玉竹皂苷、三七皂苷等甾体皂苷均具有显著的降血糖作用[8-10]。C21甾体皂苷是断节参中主要化学成分,其是否有降血糖功效笔者未见相关文献报道,本实验首次利用体外抑制α-糖苷酶活性筛选模型对断节参提取物抑制α-葡萄糖苷酶活性进行了初步筛选,结果表明乙酸乙酯部分有较高的抑制活性,采用活性追踪方法从断节参中分离得到12个以皂苷和二苯酮类为主的活性化合物,并对其进行体外抑制α-葡萄糖苷酶活性筛选,结果表明皂苷类化合物具有显著活性,而皂苷苷元及二苯酮基本没有活性。
为了验证实验结果,本实验还通过D-101大孔树脂富集得到总皂苷部位,结果发现在同等质量浓度下其抑制α-葡萄糖苷酶活性又明显高于乙酸乙酯部位,进一步证明了断节参降血糖主要活性成分是皂苷类成分。本课题组将继续对乙酸乙酯部位进行分离,以期得到更多皂苷类化合物,为皂苷类化合物降血糖作用机制、构效关系以及体内降血糖效果的研究奠定基础。
[1] 云南省食品药品监督管理局.云南省中药材标准[S].昆明:云南科学技术出版社,2005:489.
[2] 张壮鑫,周俊.断节参苷的结构[J].化学学报,1983,41(11):1058.
[3] 张壮鑫,周俊.昆明杯冠藤的化学成分[J].云南植物研究所,1982,4(4):413.
[4] 陈刚,裴月湖.昆明杯冠藤和Pfaffia glomerate的化学成分研究[D].沈阳:沈阳药科大学,2009:16.
[5] 康文艺,张丽,宋艳丽.滇丁香中抑制α-葡萄糖苷酶活性成分研究[J].中国中药杂志,2009,34(4):406.
[6] 张壮鑫,周俊.昆明杯冠藤的化学成分[J].云南植物研究所,1982,4(4):413.
[7] 张晟,陈祥贵.降血糖植物皂苷研究进展[J].中药材,2007,30(5):616.
[8] 刘剑青,肖小年.藠头皂苷的分离纯化及其活性研究[D].南昌:南昌大学,2013:50.
[9] 王谦,张璐,边晓丽,等.α-葡萄糖苷酶抑制剂及构效关系的研究进展[J].中国新药杂志,2014,23(2):189.
[10] 季芳,肖国春,董莉,等.药用植物来源的α-葡萄糖苷酶抑制剂研究进展[J].中国中药杂志,2010,35(12):1633.
StudyonActiveComponentInhibitingα-GlucosidaseInhibitofromCynanchumwallichii
MAOKunjun,ZHANGLi,ZHOUHuiyun,HUANGPing*
(Departmentofpharmacy,JiangxiMedicalCollege,Shangrao334000,China)
Objective:To findα-glucosidase inhibitors fromCynanchumwallichii.MethodsThe α-glucosidase inhibitor was isolated and purified by the bioactivity-guided methodinvitro,which was used to analyze the inhibitory activity against α-glucosidase.The inhibitory kinetic of the isolations was also investigated.ResultsThe ethyl acetate extract ofCynanchumwallichiishowed strong inhibitory activity and three compounds were isolated and identified,only wallicoside H(IC50=21.90 mg·L-1)and otophylloside B showed strong inhibitory activity(IC50=35.32 mg·L-1)which was higher than that of acarbose(IC50=1 017.41 mg·L-1).Both of them showed noncompetitive type on α-glucosidase.ConclusionIt was reported that wallicoside H and otophylloside B have α-glucosidase Inhibitors active for the first time.
Cynanchumwallichii;α-glucosidase;wallicoside H;otophylloside B;inhibition type
*
黄平,讲师,研究方向:药效物质基础研究;E-mail:737259639@qq.com
10.13313/j.issn.1673-4890.2017.11.009
2017-03-06)
