带电蛋白质对α-淀粉酶活性及酶促反应的影响
2017-12-08刘荣娜,江国金,陈瑞华,赵长新
刘 荣 娜, 江 国 金, 陈 瑞 华, 赵 长 新
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.中粮麦芽(大连)有限公司, 辽宁 大连 116200 )
带电蛋白质对α-淀粉酶活性及酶促反应的影响
刘 荣 娜1, 江 国 金2, 陈 瑞 华1, 赵 长 新1
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.中粮麦芽(大连)有限公司, 辽宁 大连 116200 )
利用Zeta电位仪对带电蛋白质表面的Zeta电位进行测量,在不同浓度梯度的还原型谷胱甘肽、牛血清蛋白和两种蛋白的混合溶液中分别加入α-淀粉酶,测定目标酶系的活性、米氏常数、活化能等参数。结果表明,分别加入浓度为0.6 mmol/L还原型谷胱甘肽、牛血清蛋白和两种蛋白的混合溶液的酶活力分别提高7.9%、8.7%、11.1%,米氏常数从129.7 g/L分别降低至116.0、104.2、85.1 g/L,最大反应速率从32 g/(L·min)分别降至30.50、28.10、23.79 g/(L·min),活化能从13.91 kJ/mol分别降至10.00、9.91、9.88 kJ/mol。这种改变与蛋白质的浓度呈正相关,线性关系良好。说明不同带电蛋白质的加入使α-淀粉酶的活性增大,酶与底物的亲和力增加,反应速率加快,效率更高。
α-淀粉酶;带电蛋白;活化能;Zeta电位
0 引 言
α-淀粉酶(1,4-α-D葡聚糖葡聚糖水解酶;E.C.3.2.1.1) 可以水解淀粉内部的α-1,4-糖苷键,水解产物为糊精、低聚糖和单糖[1]。酶作为一种高效、专一的催化剂,在很多领域都得到了广泛的应用,比如医学、食品和饮料、洗涤、皮革等行业[2-3]。在磁场和电场方面的研究已经有诸多报道[4],包括脉动场和静电场,这些研究大多以酶的活性、米氏参数和酶的二级结构为研究对象,结果显示场的存在使酶促反应过程中酶活、米氏参数和二级结构均发生了改变,但是对于反应所需活化能的研究未有涉及,并且对于这种变化都没有合理地解释[5]。YE等[6]研究发现,在胰蛋白酶的消化过程中,不同蛋白质被消化的先后顺序与蛋白浓度无关,而与切割位点附近的氨基酸残基种类有关,在中性氨基酸残基附近的位点切割速度很快,而在带电氨基酸残基附近的位点切割速度很慢,甚至不切割。
本研究中,蛋白质的Zeta电位由Zetasizer Nano ZS电位仪测定,用于表征蛋白质的表面电势。对加入不同带电荷的蛋白质后酶的活性、米氏参数和活化能进行分析,以期在提高酶活、多酶系统中各种酶的协同作用、酶和蛋白质等生物大分子之间的相互作用方面提供理论基础。
1 材料与方法
1.1 材 料
α-淀粉酶(A4551),地衣芽孢杆菌种属,Sigma 公司,纯度为99%,4 ℃保存,质量浓度为1 mg/mL;还原型谷胱甘肽(GSH)、牛血清蛋白(BSA),北京索莱宝科技有限公司;其他试剂均为分析纯。可溶性淀粉溶液现用现配,0 ℃保存,质量浓度为20 g/L。所有的实验用水均为超纯水。试剂制备的缓冲液均为pH 6.9、浓度20 mmol/L 的PBS缓冲液。
Nano-ZS90 Zeta 电位仪,英国Malvern公司。
1.2 方 法
1.2.1 Zeta电位的测量
选取不同大小、不同分子质量的标准蛋白进行电位测量,根据Zeta电位仪的测量条件,选择无色、无毒、常用的标准蛋白BSA和GSH,由于BSA的溶解性问题,BSA最高浓度选择0.6 mmol/L,GSH及混合液浓度与其保持一致。
把100、200、300、400 mg的BSA固体分别溶于10 mL的PBS缓冲液中,制得浓度分别为0.15、0.30、0.45、0.60 mmol/L的BSA溶液;按同种方法配得相同浓度的GSH溶液;把相同质量的BSA溶解在10 mL对应浓度的GSH中得到两种蛋白的混合溶液。所有的待测样品经10 000 r/min 室温离心20 min,上清液经0.2 μm膜过滤得待测样品。
Zeta电位的测量温度选择40 ℃,Zeta电位通过测量颗粒的电泳迁移率,由Henry方程计算得到。

(1)
式中:UE为电泳迁移率,m2/s;ε为40 ℃下溶液的电解质常数,F/m,由系统设为73.15 F/m;ζ为Zeta电位,mV;f(ka)是Henry方程,近似值为1.5;η为溶液的黏度,在测定温度下设定为0.728×10-3Pa·s。用注射器吸取1 mL待测溶液,注射到一次性样品池(DTS1061,马尔文)进行Zeta电位的测量。
1.2.2 不同浓度不同带电荷的蛋白质处理酶液
把酶固体粉末溶解在20 mmol/L,pH 6.9的PBS溶液中制得α-淀粉酶溶液,不同浓度的3种蛋白质分别加入到酶液中,放置相同时间。用缓冲液代替蛋白质作为空白对照。
1.2.3 α-淀粉酶活性的测定
酶活力单位定义为40 ℃、pH 6.9条件下,1 min 从淀粉中水解产生1.0 mg的葡萄糖所需要的酶量。α-淀粉酶活力计算公式为

(2)
式中:m为标准曲线上对应的葡萄糖质量,mg;V为反应所用淀粉酶原液体积,mL;t为反应时间,min;n为原液稀释倍数。
利用DNS法测定还原糖的生成量。
1.2.4 米氏参数的测量
测得还原糖的生成量,根据不同底物浓度和反应速率的关系建立L-B方程,由斜率计算出米氏常数和最大反应速率,实验重复3次取平均值。
1.2.5 活化能的计算
根据蛋白质和酶的一般性质,在其变性以前,酶的活力随温度升高而升高。其定量规律可由Arrhenius公式描述,即
K=Aexp(-Ea/RT)
(3)
式中:K为反应的速率常数;A为指前因子;Ea为活化能,kJ/mol;R为摩尔气体常数;T为热力学温度,K。
测出不同温度(T1=303 K,T2=313 K)下的K,公式为

(4)
2 结果与讨论
2.1 Zeta电位
测得BSA、GSH的电位分别为-10.7和-5.5 mV,α-淀粉酶溶液的电位为-14.3 mV,在酶促反应过程中酶表面电位变化曲线如图1所示。

图1 酶在反应过程中的Zeta电位变化
对曲线进行拟合得到满足的函数关系为
f(x)=aebx+cedx
式中:a=-7.97(-8.359,-7.581);b=4.154×10-3(4.278×10-4,7.879×10-3);c=5 524(-3.107×104,4.212×104);d=-6.053(-11.33,-0.776 1);R2=0.969,拟合效果良好。
由图1可知,在酶和底物接触瞬间,Zeta电位急剧下降,后慢慢回复,但不能回到最初状态。因此,随着酶使用次数的增加,酶活性降低,与酶表面带电氨基酸的个数变化有关。
2.2 蛋白质对酶活性的影响
于40 ℃添加不同浓度的GSH、BSA、混合蛋白对酶液进行处理,测定活性并与空白对照(无蛋白)对比,得到不同浓度的蛋白质与α-淀粉酶活性的关系,如图2所示。由图2可知,与原酶液相比,与酶带同性电荷、不同Zeta电位的蛋白质的加入不同程度地促进了酶活,并且与蛋白质浓度呈正相关,0.2、0.4、0.6、0.8 mol/L的GSH、BSA、混合蛋白酶活分别提高了2.0%、3.9%、5.9%、7.9%,2.15%、4.2%、6.2%、8.7%和3.2%、6.0%、8.4%、11.1%。
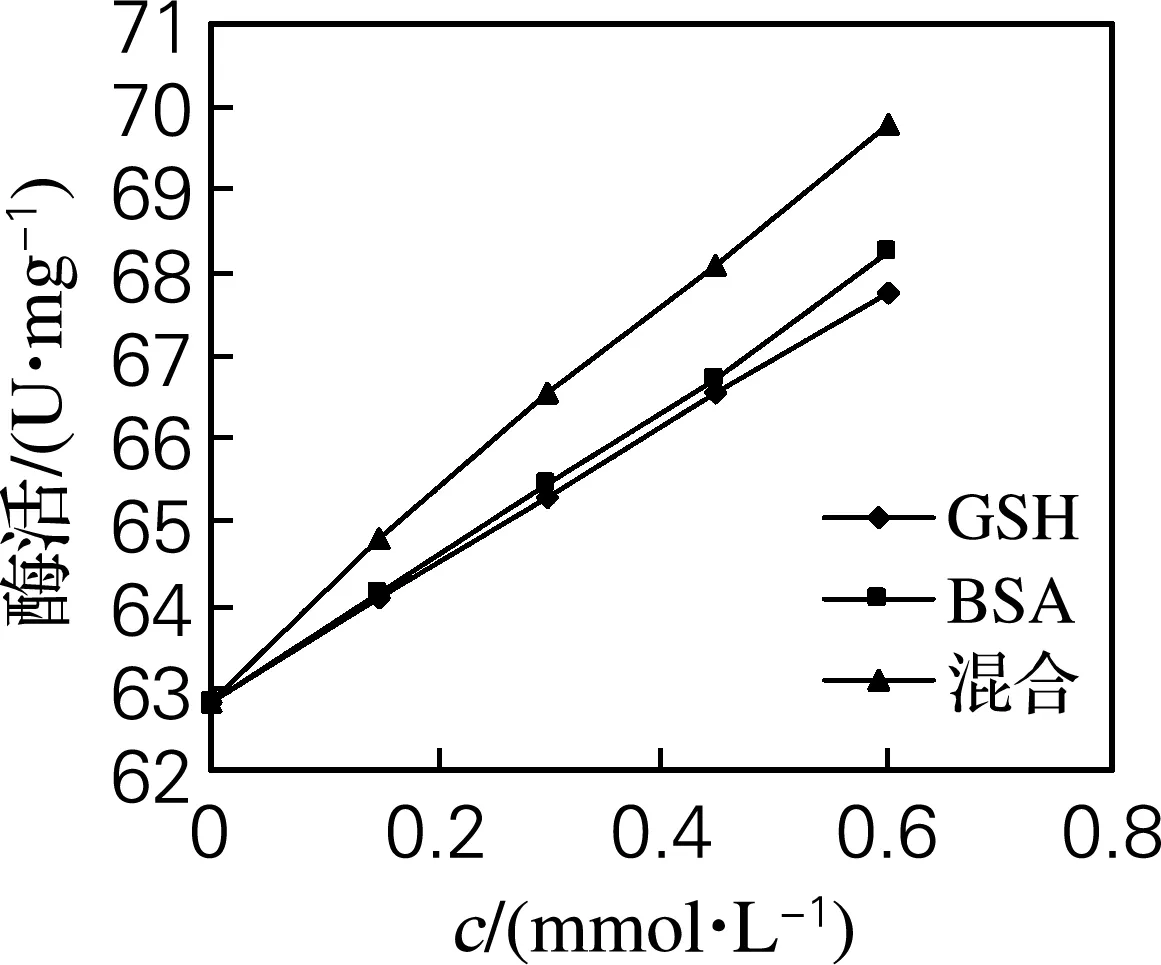
图2 蛋白质浓度对α-淀粉酶活性的影响
为了更直观地比较Zeta电位对α-淀粉酶活性的影响,选择浓度均为0.6 mmol/L的3种带电蛋白质,对酶活性的影响如图3所示,同浓度、带不同表面电荷的蛋白质对酶活影响效果不同,表面电荷量越多对酶活促进作用越强。
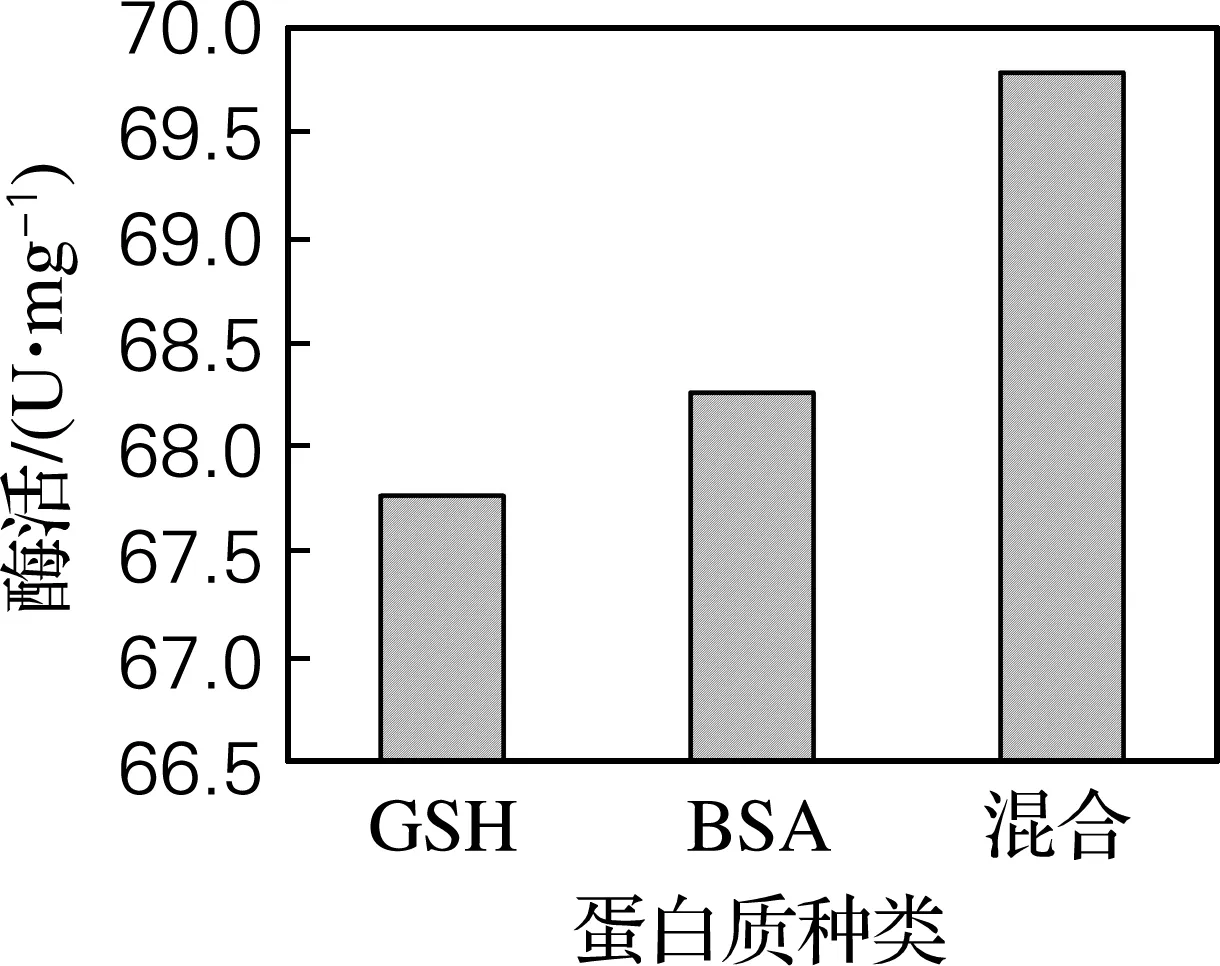
图3 同浓度不同蛋白对α-淀粉酶活性的影响
2.3 α-淀粉酶米氏常数的测定结果
根据不同底物浓度下产生的还原糖求得反应速率,按照双倒数作图法,作出加入不同蛋白质后α-淀粉酶的米氏方程曲线,如图4所示。由图4可得,不同带电荷的蛋白质加入,α-淀粉酶的米氏方程分别为

(5)
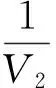
(6)

(7)

(8)
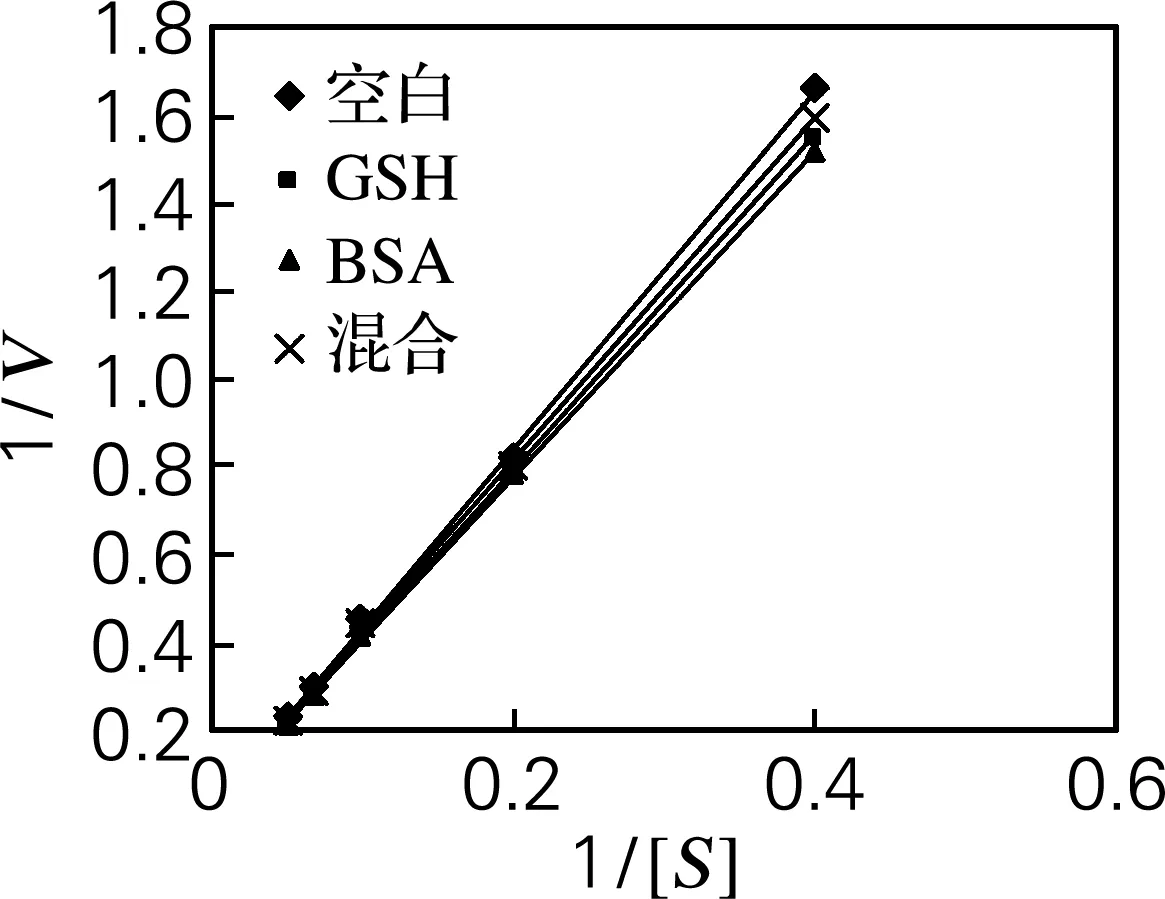
图4 不同浓度的蛋白质下的α-淀粉酶的米氏方程曲线
Fig.4 Michaelis-Menton curves of α-amylase at different concentration of protein
式(5)~(8)分别为空白、GSH、BSA和混合蛋白的米氏方程。得到的α-淀粉酶的反应动力学参数见表1。

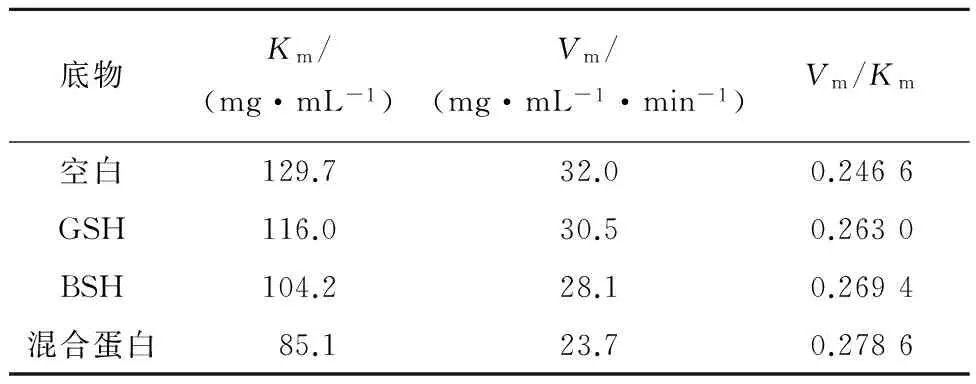
表1 加入不同蛋白质的α-淀粉酶动力学参数
酶与底物亲和力用Km和Vm/Km表示,由表1可知,Km降低,Vm/Km增加,故不同带电蛋白质的加入使酶与底物的亲和力增加,增加程度由高到低依次为混合液、BSA、GSH,即Zeta电位高的蛋白质对酶及酶促反应的影响程度大。
2.4 不同Zeta电位的蛋白质对α-淀粉酶活化能的影响
根据单位时间产生的还原糖量,求得反应速率常数和不同浓度的GSH、BSA、两者混合液的活化能,得到不同浓度、不同带电荷的3种蛋白质对α-淀粉酶活化能的影响如图5所示。由图5可知,加入不同浓度的GSH活化能分别降低2.66%、14.40%、23%、28%;加入不同浓度的BSA活化能分别降低3.88%、15.97%、23.80%、28.90%;加入不同浓度的混合蛋白活化能分别降低5.96%、16.15%、24.30%、29.10%。蛋白质与酶分子之间的距离随着酶促反应过程中酶表面电荷的降低而减小,静电斥力增加,酶在分子中更趋向于稳定,催化效率更高,反应更易进行。
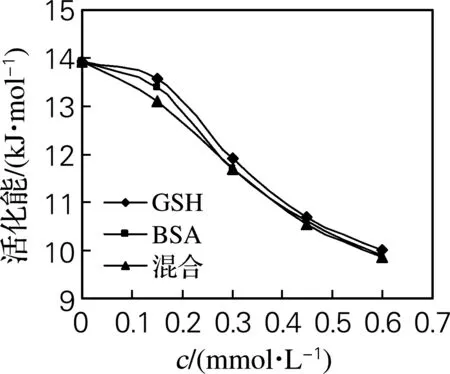
图5 不同浓度的蛋白质与α-淀粉酶活化能的关系
Fig.5 Activation energies of α-amylase at different concentration of protein
3 结 论
带电蛋白质对α-淀粉酶活性、Km、Vm/Km和活化能有很大影响。在实验条件下,蛋白质大小、分子质量和浓度都对α-淀粉酶的活性和酶促反应有很大影响,酶活性增强,Km减小、Vm/Km增加,并且随着蛋白质浓度的增加,效果更加明显,与蛋白质浓度成正相关,说明蛋白质的加入使酶与底物的亲和力增加,反应速率加快,效率更高,原因可能是带同种电荷的蛋白质和酶之间相互排斥,蛋白质带电荷量越高,排斥作用力越大,且随酶在酶促反应过程中电荷的变化规律,酶与蛋白质之间的距离先急剧减小,之后增加,酶和蛋白质之间的排斥力增大,酶在溶液中趋于稳定,更好地发挥作用。
[1] GUPTA R, MOHAPATRA G H, GOSWAMI V K, et al. Microbial α-amylases: a biotechnological perspective[J]. Process Biochemistry, 2003, 38(11): 1599-1616.
[2] MARC J E C, MAAREL V D, BART V D, et al. Properties and applications of starch-converting enzymes of the alpha-amylase family[J]. Journal of Biotechnology, 2002, 94(2): 137-155.
[3] RAO J L, SATYANARAYANA T. Improving production of hyperthermostable and high maltose-forming α-amylase by an extreme thermophileGeobacillusthermoleovoransusing response surface methodology and its applications[J]. Bioresource Technology, 2007, 98(2): 1692-1695.
[4] BECK E, BECK B, DRZAZGA Z. Influence of extremely low frequency magnetic field on alkaline phosphatase and gamma-glutamyl transpeptidase activity[J]. Physica Medica, 2003, 19(2): 171-176.
[5] NAZAR A S M I, PAUL A, DUTTA S K. Frequency-dependent alteration of enolase activity by ELF fields[J]. Bioelectrochemistry and Bioenergetics, 1996, 39(2): 259-262.
[6] YE M L, PAN Y B, CHENG K, et al. Protein digestion priority is independent of protein abundances[J]. Nature Methods, 2014, 11: 220-222.
Effectofchargedproteinonenzymaticactivityofα-amylaseandenzymaticreaction
LIURongna1,JIANGGuojin2,CHENRuihua1,ZHAOChangxin1
( 1.SchoolofBiologicalEngineering,DalianPolytechnicUniversity,Dalian116034,China;2.COFCOMalt(Dalian)CompanyLimited,Dalian116200,China)
Zeta potential was measured to study the effect of charged proteins on α-amylase and its enzymatic reaction. α-amylase solution was added into reduced glutathione (GSH), bovine serum albumin (BSA) and the mixture of two proteins with different concentrations. The activities, kinetic parameters and activation energies were determined. The results showed that the activities were increased by 7.9%, 8.7% and 11.1% respectively at the concentration of 0.6 mmol/L. The kinetic parameters ofKmdecreased from 129.7 g/L to 116.0, 104.2, 85.1 g/L, whileVmdecreased from 32 g/(L·min) to 30.5, 28.1, 23.7 g/(L·min), respectively. The activation energies decreased from 13.91 kJ/mol to 10.00, 9.91 and 9.88 kJ/mol. The change in α-amylase is positively correlated with the protein concentration and has a good linear relationship. The results indicated that the activity of α-amylase and the affinity of enzyme and substrate increased, the reaction rate was accelerated and the efficiency was improved.
α-amylase; charged proteins; activation energy; Zeta potential
刘荣娜,江国金,陈瑞华,赵长新.带电蛋白质对α-淀粉酶活性及酶促反应的影响[J].大连工业大学学报,2017,36(6):402-405.
LIU Rongna, JIANG Guojin, CHEN Ruihua, ZHAO Changxin. Effect of charged protein on enzymatic activity of α-amylase and enzymatic reaction[J]. Journal of Dalian Polytechnic University, 2017, 36(6): 402-405.
2016-03-23.
刘荣娜(1989-),女,硕士研究生;通信作者:赵长新(1955-),男,教授.
TS201.2;Q556.2
A
1674-1404(2017)06-0402-04
