神经酸对小肠隐窝细胞IEC-6紫杉醇损伤的保护机制研究
2017-12-08赵优雅周卫东付婷婷赵晓山丘伟中闵存云王昌俊
谭 为,马 柯,赵优雅,周卫东,付婷婷,赵晓山,丘伟中,闵存云,王昌俊
1.广东省人民医院 (广东省医学科学院)中医科 广东省老年医学研究所,广东 广州 510080;2.南方医科大学附属南方医院中医科; 3.南方医科大学中医药学院中西医结合基础教研室;4.广东省人民医院 (广东省医学科学院)急危重症医学部;5.江西省新余市人民医院中医科
神经酸对小肠隐窝细胞IEC-6紫杉醇损伤的保护机制研究
谭 为1,马 柯2,3,赵优雅4,周卫东5,付婷婷1,赵晓山3,丘伟中1,闵存云1,王昌俊1
1.广东省人民医院 (广东省医学科学院)中医科 广东省老年医学研究所,广东 广州 510080;2.南方医科大学附属南方医院中医科; 3.南方医科大学中医药学院中西医结合基础教研室;4.广东省人民医院 (广东省医学科学院)急危重症医学部;5.江西省新余市人民医院中医科
目的探讨神经酸(nervonic acid,NA)对紫杉醇损伤的小肠隐窝细胞的保护机制。方法采用紫杉醇处理IEC-6细胞,检测紫杉醇IC50浓度。MTS法检测不同浓度NA(5 μmol/L、10 μmol/L、20 μmol/L)对紫杉醇(IC50浓度)干预后的IEC-6细胞的相对增殖率。原位缺口末端检测法(TUNEL法)检测DNA断裂情况。蛋白质印迹法检测相关蛋白表达。结果紫杉醇促进正常IEC-6细胞凋亡。NA对维持细胞形态、保持细胞活力有一定作用。TUNEL法显示,与空白对照相比较,紫杉醇组细胞凋亡明显增加;与紫杉醇组细胞比较,NA组细胞凋亡明显减少。与紫杉醇组比较,NA组A-FABP、p-p38、Bax、CytC、cl-Caspase-3降低(P<0.01),Bcl-2、Bcl-2/Bax升高(P<0.01)。p38无明显变化(P>0.05)。结论NA可通过调节p38通路、Bcl-2/Bax等减轻紫杉醇诱导的小肠隐窝细胞的凋亡损伤。
神经酸;紫杉醇;小肠隐窝细胞;凋亡
神经酸(nervonic acid,NA)相对分子量为366.6,分子式为C24H46O2,属长链单不饱和脂肪酸,是大脑白质细胞膜的重要组成部分,能有效地促进神经组织的修复和再生,具有促进神经元生长发育、防止神经纤维萎缩和延缓脑细胞衰老的功效。本课题组前期研究[1]发现,乳腺癌小鼠中,较紫杉醇模型组生存期显著延长的实验组的NA水平显著升高(P<0.01)。NA在体内合成代谢主要涉及脂肪酸代谢等通路。脂肪主要在小肠上段经各种酶及胆汁酸盐的作用水解为甘油、脂肪酸等。其主要发生场所在肠黏膜细胞。小肠黏膜细胞平均5 d自我更新1次。黏膜自我更新的动力源于隐窝内肠道干细胞。提示NA与肠隐窝细胞密切相关。目前NA对化疗导致的隐窝细胞损伤研究尚少。本课题组体外试验观察NA对紫杉醇导致的肠隐窝细胞IEC-6脂质代谢及凋亡作用的影响,为化疗性胃肠道黏膜炎的治疗提供线索。
1 材料与方法
1.1一般材料紫杉醇注射液(30 mg/5 ml,哈尔滨三联药业有限公司,批号100302C03)。NA(纯度≥99%)购自美国Sigma公司。胎牛血清(fetal bovine serum,FBS)和RPMI 1640培养液购自美国Gibco公司;中等裂解强度RIPA裂解液、BCA蛋白定量试剂盒、蛋白质印迹法检测体系、一步法TUNEL细胞凋亡检测试剂盒购自碧云天生物技术研究所;兔抗鼠A-FABP、NF200、Bcl-2、Bax、CytC、活性Caspase-3、p38 MAPK多克隆抗体,GAPDH单克隆抗体购自美国Santa Cruz公司。图像分析软件购自惠州赛特电子公司。IEC-6细胞(大鼠小肠隐窝细胞)购自中国科学院上海生科院细胞资源中心。
1.2方法
1.2.1 IEC-6细胞培养:培养于含质量浓度为100 g/L的胎牛血清的RPMI 1640培养液中,置于37 ℃、体积分数为5%的CO2恒温培养箱中,2~3 d换液1次,当细胞长至铺满培养瓶底80%时,加入质量浓度为2.5 g/L胰酶溶液消化细胞,进行传代,取对数生长期细胞用于实验。
1.2.2 紫杉醇及NA量选择:MTS法检测不同浓度的紫杉醇作用于IEC-6细胞24 h的吸光度值(OD)。CompuSyn软件分析紫杉醇IC50的浓度。IEC-6细胞计数后,调整细胞浓度为1×105ml-1,分到96孔板,每孔100 μl,即每孔细胞为1×104个,每个实验组3个孔。过夜贴壁,加入紫杉醇浓度分别为0、1、4、16、64、256 μmol/L处理24 h。检测时加入比例为1∶10的MTS试剂,即100 μl培养液加入10 ml检测液。37 ℃孵育30 min后,酶标仪检测490 nmOD值。
MTS法检测不同浓度NA作用于紫杉醇(IC50)引起的IEC-6细胞损伤的OD值。37 ℃摇动水浴中将NA溶于甲醇,制成1.0 mmol/L的使用液。根据本室研究结果,NA分别予5 μmol/L、10 μmol/L、20 μmol/L作用于IEC-6 细胞24 h,以MTT比色法检测细胞增殖能力。选择490 nm的波长,在酶联免疫检测仪上以空白组调零,测定各孔OD值,计算平均OD值。
1.2.3 实验分组:空白对照组的溶液中加入和其他实验组相同终浓度的等体积溶媒)、紫杉醇组(空白对照组+IC50浓度的紫杉醇)、NA组(1、2、3,紫杉醇组+NA分别为5 μmol/L、10 μmol/L、20 μmol/L),每次实验需保证各试剂的效应。各组培养液中甲醇终浓度≤0.5 g/L。
1.2.4 原位缺口末端标记技术(TUNEL)检测细胞凋亡:根据紫杉醇的终浓度和NA终浓度结果,检测NA对IEC-6细胞凋亡的影响。培养24 h后收集细胞,PBS洗3次;质量浓度为40 g/L的多聚甲醛固定细胞30 min,PBS洗3次;用质量浓度为1g/L的 TritonX-100的PBS(TPBS)重悬细胞,冰浴孵育2 min。2 min后PBS洗3次,避光加入50 μl 进行TUNEL检测(10 μl TdT酶+240 μl 荧光标记液),37 ℃避光孵育60 min。PBS洗3 次后,用300 μl PBS悬浮细胞,激光共聚焦扫描显微镜观察,激发波长488 nm,发射波长513~523 nm。
1.2.5 检测NA对凋亡相关蛋白的影响:蛋白质印迹法检测NA对IEC-6细胞脂肪型脂肪酸结合蛋白(A-FABP)、p38、p-P38、Bcl-2、Bax和CytC、cl-Caspase-3表达的影响。收集各组经过处理的细胞,以中等裂解强度的RIPA裂解液提取细胞总蛋白,采用BCA试剂盒进行蛋白定量,取60~80 μg/孔蛋白质进行质量浓度为100 g/L的 SDS-PAGE,将电泳分离后的蛋白电转移到聚偏二氟乙烯膜上;质量浓度为50 g/L的脱脂牛奶25 ℃封闭1 h,加入1∶1 000稀释的相关抗体及1∶400稀释的抗GAPDH抗体(内参照),4 ℃反应过夜;TBST洗膜3次,加入1∶3 000稀释的相应二抗,室温反应1 h;TBST洗膜3次,增强化学发光试剂显色。以Image J图像分析软件对结果进行分析,以目的蛋白条带的灰度值与GAPDH蛋白条带的灰度值的比值表示目的蛋白的相对表达量。实验重复3次。

2 结果
2.1紫杉醇及NA剂量选择与空白对照组相比,紫杉醇不同浓度处理组OD值均有明显下降(P<0.01,见图1)。用CompuSyn软件分析得到紫衫醇IC50为12 μmol/L。与空白对照组相比,紫杉醇组、NA1组OD值显著下降(P<0.01),NA2、NA3组OD值无明显变化(P>0.05)。与紫杉醇组相比,NA1组OD值无变化(P>0.05),NA2、NA3组OD值显著上升(P<0.01)。NA2组与NA3组比较,OD值无变化(P>0.05,见图2)。根据以上结果,选取NA 10 μmol/L研究紫杉醇(12 μmol/L)引起IEC-6细胞损伤的保护作用。

注:与空白对照组比较,*P<0.01。
2.2细胞形态学变化光镜下,空白对照组IEC-6细胞大小一致,轮廓清晰,无飘浮的细胞,透亮,无空泡;紫杉醇组细胞变小,部分细胞轮廓模糊,细胞飘浮较多;NA组细胞大小与空白对照组相比无明显变化,细胞轮廓基本清晰,飘浮的细胞与细胞内空泡数较空白对照组增加,较紫杉醇组减少。

注:与空白对照组比较,*P<0.01;与紫杉醇组比较,#P<0.01。
图2不同浓度NA对紫杉醇引起的IEC-6细胞损伤的OD值的影响
Fig2TheODvalueofpaclitaxel-injuredIEC-6cellsafterdifferentconcentrationsofNAtreated
2.3TUNEL检测NA对IEC-6细胞的影响空白对照组和NA组的IEC细胞无明显凋亡;与空白对照组相比,紫杉醇组细胞凋亡明显增加;与紫杉醇组相比,NA组细胞凋亡明显减少(见图3)。

图3 不同处理组IEC-6细胞凋亡检测(200×)Fig 3 The apoptosis of IEC-6 cells in different treatment groups (200×)
2.4NA对凋亡相关蛋白的影响与空白对照组相比,紫杉醇组A-FABP、p-p38、Bax、CytC、cl-Caspase3表达显著上调(P<0.01),Bcl-2、Bcl-2/Bax表达下调(P<0.01)。
与紫杉醇组相比,NA组A-FABP、p-p38、Bax、CytC、cl-Caspase3表达下调(P<0.01),Bcl-2、Bcl-2/Bax表达上调(P<0.01),p38无明显变化(P>0.05,见图4~5)。
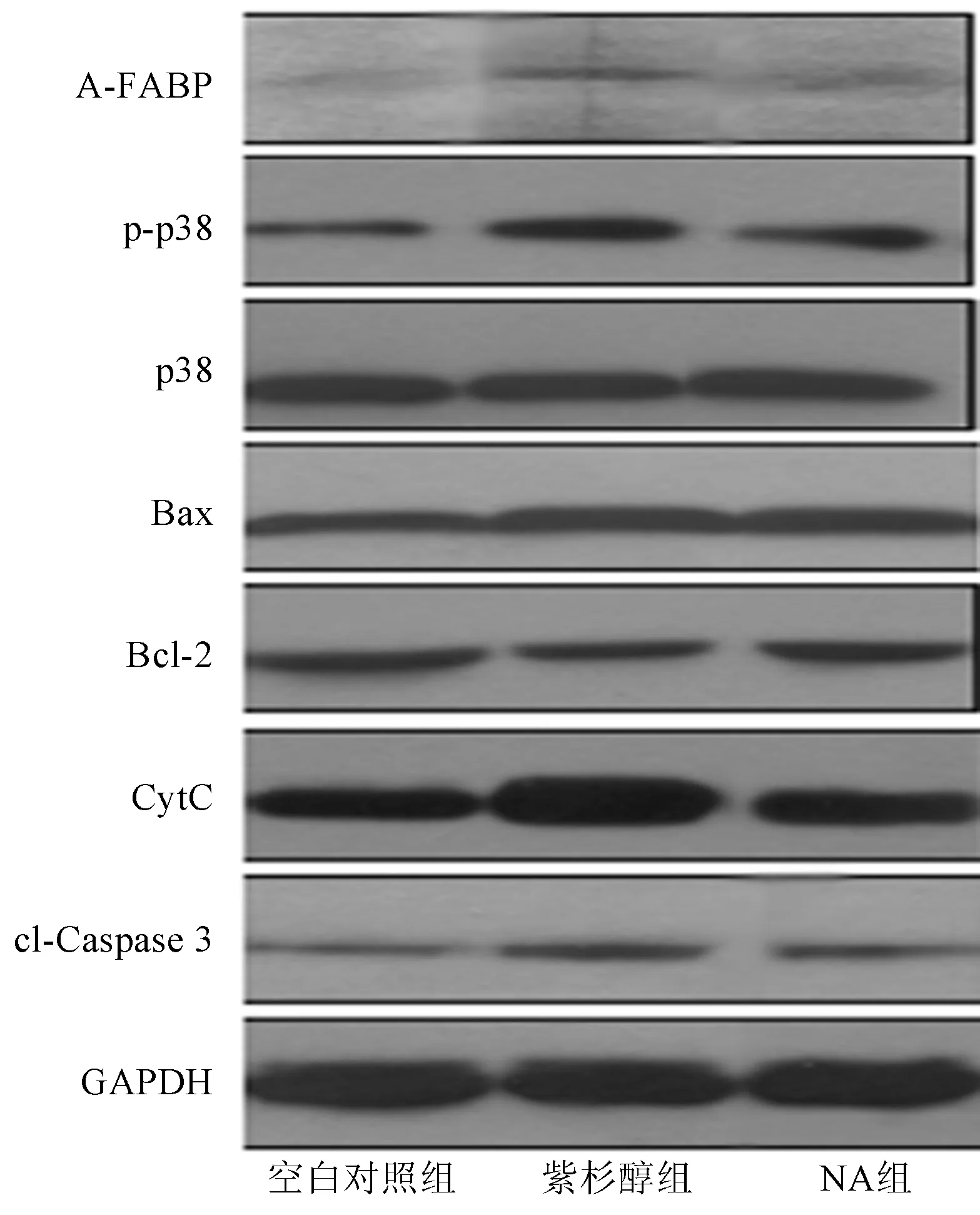
图4 凋亡相关蛋白的表达Fig 4 The expressions of apoptosis related proteins in different groups
3 讨论
NA是大脑中神经细胞生长、再发育及维持的神经营养素,具有促进神经元生长发育、防止神经纤维萎缩和延缓脑细胞衰老的功效。研究[2]证实,NA是幼儿脑部发育所必需的营养成分,足月小样儿的NA浓度低于正常足月儿,NA浓度与婴幼儿心理与行为发展呈正相关。摄入NA同样可改善Zellweger综合征的症状,可调节和改善脑细胞膜的组成、结构、功能,使细胞间信息传递更加迅速、准确,改善大脑功能,增强记忆力[3]。NA与肠隐窝细胞密切相关,目前NA对于胃肠损伤的作用研究尚少。NA在体内合成代谢多涉及氨基酸代谢、脂肪酸代谢等多个代谢通路。A-FABP是细胞内脂肪酸结合蛋白家族中最具特征和最显著生物学活性的亚型,在机体代谢、炎症及免疫等方面均具有调节作用。多项研究[4-6]发现,脂质代谢性疾病如肥胖、动脉粥样硬化和糖尿病都有血清FABP水平的升高。本研究发现,NA对紫杉醇损伤的神经细胞IEC-6的A-FABP有降低作用,提示NA在保护紫杉醇对隐窝细胞脂质代谢方面有显著保护作用。

注:##P<0.01;1.空白对照组;2.紫杉醇组;3.NA组。
图5IEC-6细胞相关目的蛋白的相对表达量A:A-FABP;B:p38;C:p-p38;D:Bcl-2;E:Bax;F:Bcl-2/Bax;G:CytC;H:cl-Caspase3
Fig5TheexpressionsofrelativeproteinsinIEC-6cellsA: A-FABP; B: p38; C: p-p38; D: Bcl-2; E: Bax; F: Bcl-2/Bax; G: CytC; H: cl-Caspase3
细胞调亡是细胞的一种基本生物学现象,是一个多基因严格控制的过程。凋亡的发生既是调亡相关基因表达的结果,又受到各种内外因素的调节。p38 MAPK信号传导通路在细胞凋亡中发挥着重要作用,p38 MAPK可被磷酸化激活后调节基因转录,诱导一些特定基因的表达,引起Bcl-2、Caspase-3介导的凋亡通路[7-9]。本研究发现,紫杉醇可显著升高神经细胞IEC-6的p-p38,从而引发Bcl-2-Caspase-3凋亡程序,NA可以抑制其反应。Bcl-2和Caspase-3分别是调节细胞凋亡两个分子家族中的重要成员,特别是调节细胞凋亡中的作用已得到广泛证实[10-11]。Caspase-3为Bcl-2的下游调控蛋白,是引起凋亡的始发因子,Bcl-2过量表达能有效地抑制Caspase-3激活和细胞凋亡。Bcl-2的裂解产物主要定位于线粒体区,从而导致CytC释放入胞装,调亡诱导因素和CytC可激活导致DNA损伤,最后导致细胞凋亡的Caspase家族的级联激活,从而不可避免地导致细胞凋亡。NA抑制神经元凋亡可能是多途径多靶点的,可通过抑制p-p38、间接或直接升高Bcl-2、抑制Caspase-3等依赖的蛋白水解级联反应,从而抑制线粒体释放细胞色素C,减少细胞调亡的发生。
本研究采用MTS法、TUNEL、Western blotting等方法,印证了NA对肠隐窝细胞IEC-6脂质代谢A-FABP的影响及活力和凋亡相关蛋白p-p38、Bcl-2、CytC、Caspase-3和Bcl-2/Bax的影响。结果表明,NA通过下调细胞内A-FABP、CytC、cl-Caspase3,上调Bcl-2、Bcl-2/Bax对化疗导致的肠隐窝细胞IEC-6损伤起到保护作用,为NA临床应用提供依据,为化疗性胃肠道黏膜炎的治疗提供线索。
[1] 谭为. 五子衍宗丸对肿瘤相关性疲劳小鼠的影响及作用机制研究[D]. 南方医科大学, 2012.
Tan W. The influence and mechanism of Wu-Zi-Yan-Zong pill on cancer related fatigue in mice [D]. Southern Medical University, 2012.
[2] Strandvik B, Ntoumani E, Lundqvist-Persson C, et al. Long-chain saturated and monounsaturated fatty acids associate with development of premature infants up to 18 months of age [J]. Prostaglandins Leukot Essent Fatty Acids, 2016, 107: 43-49.
[3] Tanaka K, Shimizu T, Ohtsuka Y, et al. Early dietary treatments with Lorenzo’s oil and docosahexaenoic acid for neurological development in a case with Zellweger syndrome [J]. Brain Dev, 2007, 29(9): 586-589.
[4] Xu A, Tso AW, Cheung BM, et al. Circulating adipocyte-fatty acid binding protein levels predict the development of the metabolic syndrome: a 5-year prospective study [J]. Circulation, 2007, 115(12): 1537-1543.
[5] Yeung DC, Wang Y, Xu A, et al. Epidermal fatty-acid-binding protein: a new circulating biomarker associated with cardio-metabolic risk factors and carotid atherosclerosis [J]. Eur Heart J, 2008, 29(17): 2156-2163.
[6] Hoo RL, Lee IP, Zhou M, et al. Pharmacological inhibition of adipocyte fatty acid binding protein alleviates both acute liver injury and non-alcoholic steatohepatitis in mice [J]. J Hepatol, 2013, 58(2): 358-364.
[7] 杨申. P38MAPK抑制剂对血管性痴呆大鼠海马细胞凋亡、Bcl-2、Caspase-3表达及其学习记忆能力的影响[D]. 山东大学, 2013.
[8] 徐霞, 李睿, 任嫱, 等. 硫化氢在p38MAPK信号通路对大鼠肝星状细胞凋亡中的作用[J]. 胃肠病学和肝病学杂志, 2014, 23(7): 798-802.
Xu X, Li R, Ren Q, et al. Influence of hydrogen sulfide in p38MAPK signaling pathway on rat hepatic stellate cell apoptosis [J]. Chin J Gastroenterol Hepatol, 2014, 23(7): 798-802.
[9] 朱玉侠, 赵明星, 姜登鸽, 等. 抑癌基因p53、凋亡抑制基因Bcl-2、促凋亡基因Bax在胃癌及癌前病变中的表达[J]. 胃肠病学和肝病学杂志, 2016, 25(9): 1040-1043.
Zhu YX, Zhao MX, Jiang DG, et al. Expression of tumor suppressor gene p53, apoptosis-suppressing gene Bcl-2, proapoptotic gene Bax in gastric cancer and precancerous lesions [J]. Chin J Gastroenterol Hepatol, 2016, 25(9): 1040-1043.
[10] Hua F, Cornejo MG, Cardone MH, et al. Effects of Bcl-2 levels on Fas signaling-induced caspase-3 activation: molecular genetic tests of computational model predictions [J]. J Immunol, 2005, 175(2): 985-995.
[11] Gross A. BCL-2 family proteins as regulators of mitochondria metabolism [J]. Biochim Biophys Acta, 2016, 1857(8): 1243-1246.
(责任编辑:陈香宇)
Theprotectionmechanismofnervonicacidonpaclitaxel-inducedIEC-6cellinjury
TAN Wei1, MA Ke2,3, ZHAO Youya4, ZHOU Weidong5, FU Tingting1, ZHAO Xiaoshan3, QIU Weizhong1, MIN Cunyun1, WANG Changjun1
1.Department of Traditional Chinese Medicine, Guangdong General Hospital & Guangdong Academy of Medical Sciences; Guangdong Geriatric Institute, Guangzhou 510080; 2.Department of Traditional Chinese Medicine, Nanfang Hospital of Southern Medical University; 3.Department of Combined Traditional Chinese and Western Medicine School of Traditional Chinese Medicine, Southern Medical University; 4.Department of Emergency & Critical Care Medicine, Guangdong General Hospital & Guangdong Academy of Medical Sciences; 5.Department of Traditional Chinese Medicine, Xinyu General Hospital, China
ObjectiveTo investigate the effect of nervonic acid (NA) on IEC-6 cell induced by paclitaxel (PTX) , including mechanism and vitality.MethodsIEC-6 cell treated with PTX to detective PTX IC50. IEC-6 cells’ relative proliferative rates of NA in different levels (5 μmol/L, 10 μmol/L, 20 μmol/L) were detected by MTS assay, the expression levels of A-FABP, p38, Bcl-2, Bax, Bcl-2/Bax, CytC and cl-Caspase-3 were detected by Western blotting, and apoptotic cells of IEC-6 were detected by TUNEL.ResultsPTX could encourage normal cells apoptosis. NA was characterized with biological functions such as maintenance of cell shape and vitality. TUNEL showed that PTX could promote cells apoptosis, and NA had a protective effect on IEC-6 apoptosis induced by PTX. The expressions of A-FABP, p-p38, Bax, CytC, cl-Caspase-3 were reduced and Bcl-2, Bcl-2/Bax expression were increased in NA group compared with PTX group (P<0.01). There was no significant difference of p38 in two groups (P>0.05).ConclusionNA can reduce paclitaxel-induced apoptosis of IEC-6 cells by regulating p38 pathway and Bcl-2/Bax.
Nervonic acid; Paclitaxel; IEC-6 cell; Apoptosis
国家自然科学基金资助项目(81302958,81373582);广东省中医药局建设中医药强省课题资助(20131102,20151019,20151018)
谭为,主治医师,博士,研究方向:肿瘤的临床与基础。E-mail:tanweioy@163.com
王昌俊,主任医师,博士,研究方向:肿瘤的临床与基础。E-mail:gzwchj@126.com
10.3969/j.issn.1006-5709.2017.11.018
R574.5
A
1006-5709(2017)11-1268-05
2017-01-27
