以内脏高敏感为靶点的肠易激综合征大鼠模型评价研究
2017-12-08任晓阳刘亚萍卢桂芳和水祥
殷 燕, 任晓阳, 刘亚萍, 卢桂芳, 和水祥
西安交通大学第一附属医院消化内科,陕西 西安 710061
以内脏高敏感为靶点的肠易激综合征大鼠模型评价研究
殷 燕, 任晓阳, 刘亚萍, 卢桂芳, 和水祥
西安交通大学第一附属医院消化内科,陕西 西安 710061
目的以内脏敏感性为靶点,评价比较慢性母婴分离和急性冷束缚应激肠易激综合征(irritable bowel syndrome,IBS)动物模型。方法分别采用慢性母婴分离和急性冷束缚应激方法建立动物模型,通过腹壁撤退反射(abdominal withdrawal reflex,AWR)、结肠黏膜超微特征、肥大细胞活化程度及结肠促肾上腺皮质激素释放激素(corticotropin-releasing factor,CRF)表达评价内脏敏感性及致敏因素。结果慢性母婴分离和急性冷束缚应激方法均能模拟IBS内脏高敏感和结肠动力特征,而慢性母婴分离应激组在高容量AWR评分、结肠黏膜超微特征改变、肥大细胞活化及结肠CRF表达中较急性冷束缚应激组更具有显著性差异。结论在以内脏敏感性为靶点研究的IBS动物模型中,慢性母婴分离造模方法更具有优势。
内脏敏感性;母婴分离;冷束缚;肠易激综合征
肠易激综合征(irritable bowel syndrome, IBS)是以反复发作的腹痛不适伴排便频繁或粪便性状改变的一种肠道疾病[1]。IBS发病机制目前仍未完全阐明,与内脏敏感性增加、肠道动力异常、神经内分泌改变、肠道感染、遗传因素、微生态异常及精神心理应激等多种因素相关[2]。
内脏高敏感是内脏对生理性刺激感受阈值降低或对伤害性刺激反应增强而引起疼痛不适的表现,是IBS的核心特征[3],因此,内脏敏感性增加是评价IBS动物模型是否成功的重要标准,建立客观、公认、符合临床特征的内脏高敏感动物模型对研究IBS发病机理具有重要意义。目前认为,精神心理应激在内脏高敏感的发生、发展中起关键作用[4],新生期反复多次母婴分离作为一种生命早期负性生活事件,可能引起成年后的应激反应受损[5];冷束缚应激作为经典的一种急性应激,在短时间内形成精神创伤可诱发机体反应过度,因此在本研究中,通过比较急慢性精神心理应激对内脏敏感性的作用及致敏因素,评价不同应激方式的造模效力,获得以内脏敏感性为靶点进行研究的IBS动物模型优势方案。
1 材料与方法
1.1实验动物SPF级新生SD大鼠10只,SPF级SD成年大鼠20只,雌雄不拘,2个月龄,体质量(190±50)g,由西安交通大学医学院动物中心提供,饲养于西安交通大学医学院动物中心屏障环境(SPF级)中。环境温度为20~25 ℃,相对湿度50%~70%,12 h光照-黑暗时间交替,自由进食、饮水,按照实验动物使用的3R原则给予人道关怀,所有操作措施获得西安交通大学动物伦理委员会许可。
1.2试剂与仪器逆转录试剂盒购自Thermo公司,目的因子引物由北京三博远志生物技术有限责任公司设计并合成,其余试剂均为国产分析纯。
1.3实验方法
1.3.1 动物模型制备:(1)慢性母婴分离动物模型:随机选择新生SD大鼠以出生第1天作为起点,与母鼠共同饲养在同一鼠笼,从出生第2天起至第21天,每天9∶00~12∶00与母鼠分离3 h,分离时与母鼠处在同一房间不同笼中,不能看到母鼠,自出生第22天起彻底分离,单笼饲养,2个月龄即可用于实验。(2)急性冷束缚应激动物模型: 随机选择正常2个月龄SD大鼠,给予寒冷-束缚应激,即用胶带束缚大鼠前肩、上肢和胸部,限制其前肢搔抓头部,但不限制其他活动,并置于4 ℃冰水中2 h,2 h后将大鼠随机单笼饲养,自由饮水进食。正常对照大鼠仅予单笼饲养,自由饮水进食。
1.3.2 结肠动力评估:对直肠内玻璃小球排出时间和粪便颗粒、质量测定进行结肠动力评估。玻璃小球排出时间:实验前禁食24 h,自由饮水,乙醚麻醉后,取直径3 mm的玻璃小球放入距肛门约3 cm的直肠内,并将大鼠迅速移至代谢笼中,待苏醒后开始喂水,同时计时,记录每只大鼠直肠内玻璃小球的排出时间。粪便颗粒和质量测定:实验前将大鼠移入代谢笼,充分适应环境后,在代谢笼下垫干净白纸一张,并开始计时,测定每只大鼠72 h的粪便颗粒和质量,在整个测定过程中自由进食饮水。
1.3.3 内脏敏感性评估:通过观察大鼠腹壁撤退反射进行内脏敏感性评估。实验前禁食24 h,自由饮水,乙醚麻醉后放入自制的圆柱形大鼠固定器中,使大鼠只能上下运动,无法前后活动及转身,并用球囊进行直肠扩张,球囊和导管外涂石蜡油润滑,使球囊末端距肛门约1 cm,并用胶带将导管与鼠尾根部固定。待大鼠清醒并能适应环境后,向球囊中分别注入1 ml、2 ml和3 ml生理盐水(26~28 ℃)扩张球囊。腹壁撤退反射的评分标准[4]: 0分:给予扩张刺激时大鼠的情绪基本稳定;1分:给予扩张刺激时大鼠变得相对不稳定,偶尔扭动头部;2分:腹背部肌肉轻微收缩但腹部未抬离地面;3分:腹背部肌肉强烈收缩并把腹部抬离地面;4分:腹部肌肉强烈收缩,腹部呈弓形并把腹部、会阴部抬离地面。
1.3.4 结肠组织病理评估:大鼠以质量浓度为100 g/L水合氯醛按体质量300 mg/kg经腹腔麻醉后迅速断颈处死,提取大鼠远端结肠组织,用PBS冲洗后依次行固定、脱水、透明、浸蜡、包埋、切片处理,行HE染色在显微镜下观察结肠黏膜的形态。
1.3.5 结肠黏膜超微结构评估:大鼠麻醉处死后,提取大鼠远端结肠组织以戊二醛进行固定,依次脱水、浸透、包埋、超薄切片处理,采用透射电镜观察大鼠结肠黏膜超微结构特征。
1.3.6 结肠促肾上腺皮质激素释放激素(corticotropin-releasing factor,CRF)表达评估:取大鼠结肠组织,按RNA提取试剂盒说明提取总RNA,按逆转录试剂盒逆转录成cDNA。据NCBI Genebank中大鼠基因序列进行引物设计,上游:5′-CCAGCAACCTCAGCCGATTC-3′,下游:5′-GCCATTTCCAAGACTTCCCTCAG-3′。β-actin引物:上游:5′-CTATCGGCAATGAGCGGTTCC-3′,下游:5′-TGTGTTGGCATAGAGGTCTTTACG-3′。进行PCR反应,PCR循环结束后,分别通过溶解曲线与琼脂糖凝胶电泳检测产物的特异性与一致性。读取Ct值,采用2-△△Ct计CRF mRNA的表达。

2 结果
2.1一般情况实验期间,急性冷束缚应激组大鼠死亡1只,慢性母婴分离应激组幼鼠死亡2只,正常对照组死亡1只,存活大鼠生长、发育情况良好。
2.2肠道动力评估
2.2.1 直肠内玻璃小球排出时间评估:采用直肠内玻璃小球排出时间进行结肠蠕动功能评估,与正常对照组大鼠相比,急性冷束缚组大鼠及慢性母婴分离组大鼠置入直肠的小球排出时间明显缩短,差异有统计学意义(P<0.05,见图1)。

注:与正常对照组比较,*P<0.05。
2.2.2 粪便颗粒和质量评估:从粪便形状上观察,急性冷束缚组及慢性母婴分离组较正常对照组粪便颗粒体积减小,但未见明显的稀糊或稀水样便。从粪便颗粒计数上观察,急性冷束缚组及慢性母婴分离组较正常对照组粪便颗粒数明显增加(P<0.05),但慢性母婴分离组与急性冷束缚组比较,差异无统计学意义(P>0.05,见图2A)。从粪便质量上观察,急性冷束缚组及慢性母婴分离组与正常对照组相比,差异无统计学意义(P>0.05,见图2B)。
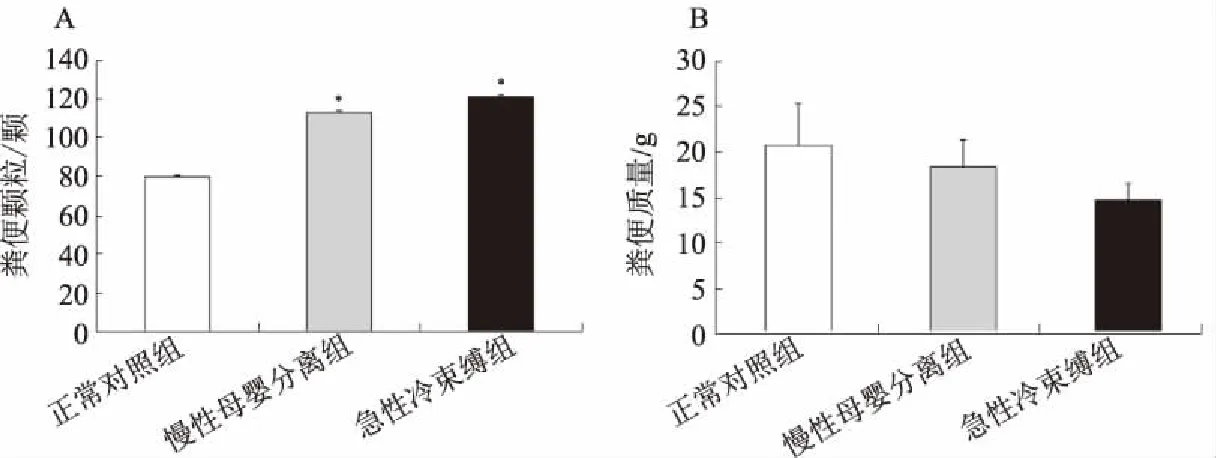
注:与正常对照组相比,*P<0.05图2 大鼠粪便颗粒和质量比较Fig 2 Comparison of fecal particle size and weight in rats
2.3内脏敏感性评估随着扩张球囊注入生理盐水容量增加,AWR评分逐渐增加,当给予2 ml容量扩张时,急性冷束缚组及慢性母婴分离组较正常对照组评分明显升高(P<0.05),当予3 ml容量扩张时,慢性母婴分离组较急性冷束缚组评分升高,差异有统计学意义(P<0.05,见表1)。
2.4结肠组织病理评估大鼠结肠组织行HE染色,显微镜下各组大鼠的结肠黏膜组织结构完整,仅有少量的中性粒细胞浸润,均未见明显充血、水肿、糜烂、溃疡等改变,各组间比较无显著性差异(见图3)。

表1 各组大鼠在不同扩张容量下AWR评分比较Tab 1 Comparison of the AWR score of rats in different expansion capacity (±s)
注:与正常对照组相比, *P<0.05;与急性冷束缚组相比, #P<0.05。

图3 大鼠结肠组织病理(200×) A: 正常对照组;B: 慢性母婴分离组;C:急性冷束缚组
2.5结肠黏膜超微结构评估大鼠结肠组织行透射电镜检查,正常对照组大鼠结肠黏膜上皮细胞和微绒毛排列整齐,形态正常,胞膜完整,细胞间隙紧密。与正常对照组相比,慢性母婴分离组大鼠结肠微绒毛分布不规整,可见断裂而呈锯齿样改变,杯状细胞包膜完整,游离面开口于管腔方向,细胞内的黏液泡及其分泌明显增加,呈分泌旺盛状态。与母婴分离组相比,急性冷束缚应激组大鼠结肠黏膜肠微绒毛分布规整,较少见断裂,杯状细胞完整,其中分泌颗粒排列相对整齐,少量黏液泡形成(见图4)。
肥大细胞作为肠道黏膜免疫细胞,活化后可以释放大量炎症介质导致内脏敏感性升高。正常对照组大鼠结肠黏膜中肥大细胞胞质中高密度的分泌颗粒较少,未见空泡形成,而慢性母婴分离组大鼠结肠黏膜肥大细胞胞质中充满了高密度的分泌颗粒,可见空泡形成,呈活跃的脱颗粒状态或处于脱颗粒前期的激活状态。与慢性母婴分离组相比,急性冷束缚组大鼠结肠黏膜中肥大细胞可见较多分泌颗粒,但无明显空泡形成(见图5)。
2.6结肠CRF表达改变CRF作为机体应对应激反应重要的脑-肠肽,参与内脏高敏感的形成。与正常对照组相比,慢性母婴分离组和急性冷束缚组大鼠结肠CRF表达均明显升高,且慢性母婴分离组大鼠结肠CRF的表达较急性冷束缚组升高更为显著(P<0.05,见图6)。
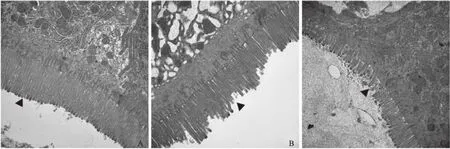
注:▲示结肠黏膜微绒毛改变。图4 大鼠结肠黏膜超微结构特征(20 000×) A: 正常对照组;B: 慢性母婴分离组;C:急性冷束缚组 Fig 4 Ultrastructural features of colonic mucosa in rats (20 000×) A: normal control group; B: chronic maternal separation group; C: acute cold restraint stress group

注:↑示肥大细胞胞质中的分泌颗粒。图5 大鼠结肠黏膜肥大细胞(15 000×) A: 正常对照组;B: 慢性母婴分离组;C:急性冷束缚组Fig 5 Colonic mucosal mast cells in rats (15 000×) A: normal control group; B: chronic maternal separation group; C: acute cold restraint stress group
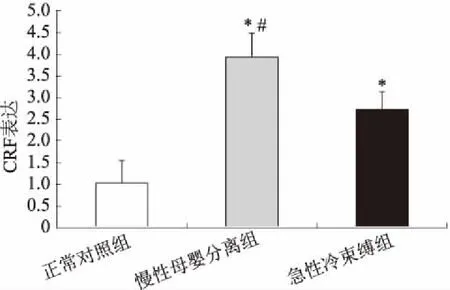
注:与正常对照组相比,*P<0.05;
3 讨论
目前普遍认为,IBS患者与正常人比较,内脏敏感性增加,表现为胃肠道疼痛阈值降低,对结肠球囊扩张等各种刺激更敏感,是腹痛或腹部不适症状的主要原因[6]。精神心理应激是诱发或加重内脏高敏感的重要因素,研究[7]提示,与正常人对比,IBS患者发病时常伴随紧张、焦虑、抑郁等精神症状,早期的负性生活事件对成年后的应激反应有着深刻的影响,因此采用精神心理应激的造模方式成为IBS动物模型常用造模方法[8-9]。在本研究中以内脏敏感性改变为靶向,比较慢性母婴分离和急性冷束缚两种不同应激方式的造模效力。本研究中发现,慢性母婴分离组与急性冷束缚应激组较正常对照组大鼠AWR评分均明显升高,随着球囊扩张容积的增加,慢性母婴分离组较急性冷束缚组评分差异具有显著性,提示急慢性心理应激均能引起大鼠内脏敏感性升高,且慢性母婴分离应激作用更显著。本研究中同时观察到急慢性应激可以引起大鼠直肠内玻璃小球排出时间延长,粪便颗粒计数增加,提示精神心理应激促进了结肠蠕动,符合腹泻型IBS的结肠动力特征,且各组大鼠结肠组织病理染色均未发现溃疡、水肿、出血等病变。综合大鼠内脏敏感性、结肠动力特征和结肠病理分析,慢性母婴分离和急性冷束缚两种应激方式均能成功进行IBS大鼠造模,且慢性母婴分离应激造模方法对内脏敏感性改变更显著。
临床研究[10]发现,IBS患者肠镜下光学表现和结肠组织病理学表现与健康对照相比并无显著异常,而结肠黏膜超微结构却发生改变,表现为肠黏膜微绒毛不规整、长短不一、杯状细胞增加、上皮细胞间隙增宽等,这种肠道黏膜屏障损伤和通透性增加促进了内脏高敏感的发生。在本研究中采用急慢性心理应激造模大鼠结肠HE染色均无水肿、溃疡、出血等改变,但采用透射电镜观察可见微绒毛断裂和杯状细胞分泌旺盛表现,且以慢性母婴分离组表现更为显著,与临床IBS患者的结肠黏膜的超微结构特征相似。
肥大细胞是肠道中广泛存在的炎症免疫细胞,内含大量内分泌颗粒,激活后脱颗粒释放五羟色胺、组胺、前列腺素、白三烯等介质,作用于外周神经,从而参与内脏敏感性增加[11]。肥大细胞与IBS的关系密切,D-IBS患者结肠黏膜中肥大细胞数量较正常对照明显增加,La等[12]发现,IBS患者内脏敏感性增加伴随着结肠黏膜肥大细胞脱颗粒现象增加,且在有效抑制肥大细胞脱颗粒后,内脏敏感性较前有明显下降。本研究发现,与对照组相比,慢性母婴分离应激和急性冷束缚应激大鼠结肠黏膜均可见充满分泌颗粒的肥大细胞,且在慢性母婴分离组大鼠结肠黏膜肥大细胞中可见较多的空泡形成,提示慢性母婴分离应激更易引起肥大细胞的活化,从而参与内脏敏感性增加。
CRF广泛分布于下丘脑室旁核等中枢神经核团和外周肠神经系统中[13-14],机体面对应激时,CRF通过激活下丘脑-垂体-肾上腺轴或是直接作用于肠神经系统调控机体产生应答,产生包括结肠动力和内脏敏感性的改变[15]。既往研究[16-17]发现,束缚应激可以引起下丘脑室旁核CRF表达升高和内脏敏感性增加,给予CRF受体拮抗剂后可以减轻LPS引起内脏敏感性,这可能是通过抑制肥大细胞活化释放炎症因子和减轻肠道通透性实现的,提示CRF促进内脏敏感性增加。在本研究中发现,与对照组相比,慢性母婴分离应激和急性冷束缚应激均能引起大鼠结肠CRF表达升高,但在慢性母婴分离组中,CRF表达升高更为显著,提示慢性母婴分离可能通过影响结肠中CRF变化而引起肠神经慢性致敏,促进内脏敏感性增加。
综上所述,慢性母婴分离与急性冷束缚应激均能模拟IBS病理生理学特征,包括结肠动力紊乱和内脏高敏感,但在内脏敏感性评价中,慢性母婴分离在高容量AWR评分、结肠黏膜完整性、肥大细胞活化程度及结肠CRF表达上均较急性冷束缚应激改变更显著,造模效力更高,且造模过程符合临床IBS特征,因此在以内脏敏感性为靶点进行研究的IBS动物模型制作中更具优势。
[1] Drossman DA, Hasler WL. Rome Ⅳ-functional GI disorders: disorders of gut-brain interaction [J]. Gastroenterology, 2016, 150(6): 1257-1261.
[2] Drossman DA. What does the future hold for irritable bowel syndrome and the functional gastrointestinal disorders?[J]. J Clin Gastroenterol, 2005, 39 (5 Suppl 3): S251-S256.
[3] Ceuleers H, Van Spaendonk H, Hanning N, et al. Visceral hypersensitivity in inflammatory bowel diseases and irritable bowel syndrome: The role of proteases [J]. World J Gastroenterol, 2016, 22(47): 10275-10286.
[4] Burke NN, Finn DP, McGuire BE, et al. Psychological stress in early life as a predisposing factor for the development of chronic pain: clinical and preclinical evidence and neurobiological mechanisms [J]. J Neurosci Res, 2017, 95 (6): 1257-1270.
[5] Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development [J]. Gastroenterology, 2000, 119(5): 1276-1285.
[6] 刘雁冰, 袁耀宗. 肠易激综合征与内脏高敏感性关系研究[J]. 国外医学内科学分册, 2002, 29(5): 188-199.
[7] 张茹, 钱家鸣. 肠易激综合征心理状态与去甲肾上腺素、酪氨酸羟化酶[J]. 胃肠病学和肝病学杂志, 2009, 18(3): 207-209.
Zhang R, Qian JM. Mental status of irritable bowel syndrome patients and norepinephrine, tyrosine hydroxylase [J]. Chin J Gastroenterol Hepatol, 2009, 18(3): 207-209.
[8] 曾威, 奚庆华, 吴至久男. 肠易激综合征动物模型的研制现状和进展[J]. 现代医药卫生, 2016, 32(17): 2658-2661.
[9] 林泽斯, 王洪琦. 肠易激综合征母婴分离模型应用进展[J]. 中国实验动物学报, 2015, 23(4): 434-439.
Lin ZS, Wang HQ. Review of the application of neonatal maternal separation model in irritable bowel syndrome (IBS) studies [J]. Acta Lab Anim Sci Sin, 2015, 23(4): 434-439.
[10] 孔武明, 龚均, 陈明霞, 等. 肠易激综合征患者肠黏膜超微结构改变的电镜观察[J]. 西安交通大学学报(医学版), 2008, 29(3): 318-320.
Kong WM, Gong J, Chen MX, et al. Ultrastructural changes in the intestinal mucosa of patients with irritable bowel syndrome [J]. Journal of Xi’an Jiaotong University (Medical Sciences), 2008, 29(3): 318-320.
[11] Lee KN, Lee OY. The role of mast cells in irritable bowel syndrome [J]. Gastroenterol Res Pract, 2016, 2016: 2031480.
[12] La JH, Sung TS, Kim HJ, et al. Peripheral corticotropin releasing hormone mediates post-inflammatory visceral hypersensitivity in rats [J]. World J Gastroenterol, 2008, 14(5): 731-736.
[13] Kageyama K, Suda T. Role and action in the pituitary corticotroph of corticotropin-releasing factor (CRF) in the hypothalamus [J]. Peptides, 2009, 30(4): 810-816.
[14] Buckinx R, Adriaensen D, Nassauw LV, et al. Corticotrophin-releasing factor, related peptides, and receptors in the normal and inflamed gastrointestinal tract [J]. Front Neurosci, 2010, 5: 54.
[15] Smith SM, Vale WW. The role of the hypothalamic-pituitary-adrenal axis in neuroendocrine responses to stress [J]. Dialogues Clin Neurosci, 2006, 8(4): 383-395.
[16] Nozu T, Miyagishi S, Nozu R, et al. Lipopolysaccharide induces visceral hypersensitivity: role of interleukin-1, interleukin-6, and peripheral corticotropin-releasing factor in rats [J]. J Gastroenterol, 2017, 52(1): 72-80.
[17] 张琴, 贺国斌. 促肾上腺激素释放因子信号在肠易激综合征中的作用[J]. 胃肠病学和肝病学杂志, 2015, 24(6): 641-644.
Zhang Q, He GB. Role of corticotropin-releasing factor signaling in irritable bowel syndrome [J]. Chin J Gastroenterol Hepatol, 2015, 24(6): 641-644.
(责任编辑:陈香宇)
Researchofirritablebowelsyndromeratmodeltargetingonvisceralhypersensitivity
YIN Yan, REN Xiaoyang, LIU Yaping, LU Guifang, HE Shuixiang
Department of Gastroenterology, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China
ObjectiveTo evaluate the superiority to establish the irritable bowel syndrome (IBS) rat model between chronic maternal separation and acute cold restraint stress based on the visceral hypersensitivity.MethodsThe chronic maternal separation or acute cold restraint stress method were used to establish rat model. The visceral sensitivity and sensitization factors were evaluated by abdominal withdrawal reflex (AWR), colonic mucosal ultrastructure, mast cell activation, and colonic corticotropin-releasing factor (CRF) expression.ResultsBoth chronic maternal separation and acute cold restraint stress method could mimic the visceral hypersensitivity and colonic motility characteristics of IBS. There were significant differences of the high dosage AWR score, colonic mucosal ultrastructure changes, mast cell activation and CRF expression in chronic maternal separation group and acute cold restraint stress group.ConclusionChronic maternal separation stress has more advantages in establish IBS rat model targeting on visceral hypersensitivity.
Visceral sensitivity; Maternal separation; Cold restraint stress; Irritable bowel syndrome
10.3969/j.issn.1006-5709.2017.11.017
中央高校基本科研业务费专项资金资助(2015gjhz22)
殷燕,博士,主治医师,研究方向:胃肠激素和胃肠功能性疾病。E-mail:doctoryinyan@126.com
和水祥,博士,主任医师,研究方向:胃肠功能性疾病、肝脏肿瘤机制的研究。 E-mail: hesx123@126.com
R574.4
A
1006-5709(2017)11-1263-05
2017-03-07
