基于细胞高内涵分析表征氮芥HN-3的细胞毒性
2017-12-08魏爱丽王莉莉
魏爱丽*,龙 隆*,李 微,丁 锐,陈 伟,王莉莉
(1.抗毒药物与毒理学国家重点实验室,北京 100850;2.军事医学科学院毒物药物研究所,北京 100850)
基于细胞高内涵分析表征氮芥HN-3的细胞毒性
魏爱丽1,2*,龙 隆1,2*,李 微1,2,丁 锐1,2,陈 伟1,2,王莉莉1,2
(1.抗毒药物与毒理学国家重点实验室,北京 100850;2.军事医学科学院毒物药物研究所,北京 100850)
目的研究氮芥HN-3对不同来源细胞的毒性表型特征。方法HN-3 100,300和450 μmol·L-1分别作用于原代人胚表皮角质细胞(HEKf),原代成人皮肤成纤维细胞(HDFa)和人肺成纤维细胞(HLF)0.5,2,4,6,8,24和48 h后,采用基于细胞成像的多参数分析技术,检测HN-3对细胞存活、细胞核、细胞骨架(微丝和微管)、线粒体膜电位(MMP)、氧化应激、核膜通透性(NMP)、磷酸化组蛋白、溶酶体、自噬、细胞周期和凋亡等参数的影响。结果HN-3引起不可逆性的细胞损伤,表现为存活细胞数量显著减少(P<0.01)。在存活细胞数量显著减少前,从0.5 h开始,细胞内活性氧和磷酸化组蛋白水平即显著升高,谷胱甘肽含量显著降低(P<0.01)。HEKf细胞内溶酶体在0.5 h时减少,而HDFa和HLF细胞内溶酶体则分别在0.5和2 h升高,并伴有微管相关蛋白1轻链3B(LC3B)蛋白表达升高。伴随存活细胞数量减少,HEKf细胞核亮度升高,核面积减少,微丝、微管亮度和面积减少,MMP显著降低(P<0.01),溶酶体亮度有增加趋势;与此相反,HDFa和HLF细胞表现为核面积增加,微丝、微管亮度和面积增加,MMP显著升高(P<0.01),但溶酶体亮度增加,且HLF细胞LC3B的含量显著升高(P<0.01);同时,3种细胞均有NMP增高和锰超氧化物歧化酶含量增加,G2期阻滞。此外,HEKf细胞出现早期和晚期凋亡,HDFa细胞出现早期凋亡。结论HN-3诱发早期的细胞损伤效应包括DNA损伤、氧化胁迫和溶酶体损伤,晚期导致MMP失衡、NMP增加、G2期细胞周期阻滞;此外,HN-3特异性地诱导HEKf细胞核固缩、细胞骨架蛋白核聚集和细胞凋亡;诱导HDFa和HLF细胞核肿胀和细胞骨架松散,并最终导致HDFa细胞早凋和HLF细胞自噬性死亡。
氮芥;细胞毒表型;DNA损伤;氧化应激;高通量筛选分析
硫芥是一战中被广泛使用并造成惨重伤亡的强杀伤力化学武器,是一种以皮肤糜烂为主兼具全身中毒为特点的毒剂[1]。因为硫芥具有芥末气味,故又被称为芥子气,其沸点高,挥发度小,易溶于有机溶剂和脂肪类组织,极易渗入皮肤造成人体严重损伤,同时具有病程长、痊愈慢、后遗症多等病理特点[2-4]。关于硫芥的损伤机制已有大量的研究报道[4-8],其毒性损伤的本质在于其强烷化性,能与特定细胞大分子共价交联结合,致使细胞大分子结构、功能、相关信号通路和细胞结构变化以及最终的亚细胞器、细胞功能紊乱和结构损伤[2,7]。这些不同阶段的细胞损伤事件与硫芥诱发皮肤组织损伤的整个病理生理过程密切相关。氮芥是用氮原子代替了硫芥中的硫原子合成的系列化合物,分为N,N-二(2-氯乙基)乙胺(HN-1)、N,N-二(2-氯乙基)甲胺(HN-2)和三(2-氯乙基)乙基胺(HN-3)3种类型[9-10],为硫芥的类似物,具有和硫芥相似的结构和化学性质以及毒性作用,其中HN-3的毒性最强。随着氮芥抗癌作用的发现,对氮芥的研究越来越偏向于癌症治疗及化合物系列结构改造,而忽略了其作为化学战剂具有与硫芥同等的危险性[1,9,11]。另一方面,迄今尚无针对两者的有效防治药物,故研究氮芥的毒性效应具有重要的意义。近年研究报道,HN-2作用小鼠皮肤诱导DNA损伤、氧化应激和丝裂原活化蛋白激酶/蛋白激酶B-转录因子AP1(mitogen-activated protein kinases/protein kinase B-AP1,MAPK/Akt-AP1)途径的活化,导致炎症和蛋白水解介质释放[11];抑制过度炎症反应可对抗氮芥引起的损伤[12];在小鼠皮肤角质细胞JB6上,HN-2也能诱导DNA损伤并介导相关的修复损伤反应,阻滞细胞周期[11,13]。为更好地了解氮芥的细胞毒性效应,本研究在探索硫芥细胞毒性表型谱研究的基础上,采用高内涵细胞表型分析技术平台,选择2种原代皮肤细胞和1种永生化正常人肺细胞,系统地测定HN-3损伤细胞表型特征,以期为寻找损伤防治药物提供线索和思路。
1 材料与方法
1.1 药物和试剂
HN-3(纯度≥94%)由军事医学科学院毒物药物研究所提供。RPMI 1640培养基和胎牛血清(fetal bovine serum,FBS)购自美国Thermo Scientific HyClone公司;牛血清白蛋白(bovine serum albumin,BSA)购自美国Sigma-Aldrich公司;线粒体膜电位染料Mito Tracker Red CMXRos、溶酶体、pH染料Lyso Tracker Red、微丝染料Alexa Flour 488标记的鬼笔环肽、凋亡检测染料、死细胞染料TOTO-3 iodide、全细胞染料Cell Mask Deep Red、细胞核染料Hoechst33342、谷胱甘肽染料mBCI、活性氧染料CM-H2DCFDA、兔抗微管相关蛋白1轻链3B(microtubule-associated protein 1 light chain 3B,LC3B)单克隆抗体、小鼠抗α-微管蛋白单克隆抗体、小鼠抗锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)单克隆抗体、小鼠抗磷酸化组蛋白(phospho-histone H2AX,pH2AX)单克隆抗体、Alexa Fluor 488标记的驴抗小鼠IgG二抗、Alexa Fluor 549标记的驴抗小鼠IgG二抗、Alexa Fluor 549标记的驴抗兔IgG二抗均购自购自美国Life Technologies公司;甲醛溶液、TritonX-100、青霉素、链霉素及其他常规化学试剂为国产试剂。
1.2 细胞和培养
原代人胚表皮角质细胞(human epidermal keratinocytes-fetal,HEKf)和原代成人皮肤成纤维细胞(human dermal fibroblasts-adult,HDFa)购自美国ScienCell公司,按照产品说明书进行培养和使用。人肺成纤维细胞(human lung fibroblasts,HLF)系为本实验室自存,用RPMI 1640完全培养基培养,培养液中含10%FBS,100 kU·L-1的青霉素、链霉素和氨苄青霉素。细胞置于37℃,5%CO2培养箱中培养。
1.3 细胞染毒方案
HN-3即配即用。将HN-3溶解于DMSO配成150 mmol·L-1母液,再用含DMSO的细胞培养液稀释成3×(100,300和450 μmol·L-1)的工作液,其中DMSO终浓度为0.3%,同时采用含0.3%DMSO培养液作为空白对照。HEKf,HDFa和HLF细胞以每孔6×103接种于96孔板(黑边底透),37℃,5%CO2培养箱中过夜,然后按每孔50 μL分别加入不同浓度HN-3溶液,按实验方案处理细胞不同时间(表1)。
1.4 细胞表型多参数检测
按照细胞表型分析组合(表1)所示,分别进行6个分析组合的参数标记,检测参数组合和暴露时间均参照文献[14],每组实验单独进行,均设置细胞对照组,每组设3个平行孔。
1.4.1 细胞核、微丝和微管检测
细胞暴露HN-3处理结束后,每孔加入75 μL固定液(含12%甲醛的PBS溶液),室温避光固定20 min;弃液,每孔加入 200 μL透膜液(含 0.1%Triton X-100的PBS溶液),室温避光孵育30 min;弃液,每孔使用200 μL PBS洗1 次,再加入50 μL Alexa Flour 488标记鬼笔环肽微丝染料和细胞核染料,室温避光孵育1 h;弃液,每孔使用200 μL PBS洗3次,再加入200 μL封闭液(含5%BSA的PBS溶液)室温孵育1 h;弃液,每孔加入40 μL小鼠抗微管蛋白单克隆抗体(1∶500稀释)工作液,4℃避光孵育过夜;弃液,每孔用100 μL封闭液洗3次,再加入50 μL Alexa Flour 549标记的驴抗小鼠IgG二抗(1∶500稀释)工作液,室温避光孵育1 h;弃液,每孔用200 μL PBS洗3次,最后加入200 μL PBS溶液,上机检测。
1.4.2 细胞核和线粒体膜电位(mitochondrial membrane potential,MMP),MnSOD和核膜通透性(nuclear membrane permeability,NMP)检测
细胞在HN-3暴露处理细胞结束前0.5 h,每孔加入50 μL细胞核染料、MMP染料和死细胞核染料,37℃孵育0.5 h;每孔加入100 μL固定液,室温避光固定20 min;弃液,每孔加入200 μL透膜液,室温避光孵育30 min;弃液,每孔使用200 μL PBS洗1次,再加入200 μL封闭液室温孵育1 h;弃液,每孔加入40 μL小鼠抗MnSOD单克隆抗体(1∶500稀释)工作液,4℃避光孵育过夜;弃液,每孔用100 μL封闭液洗3次,再加入50 μL Alexa Fluor 488标记的驴抗小鼠IgG二抗(1∶500稀释)工作液,室温避光孵育1 h;弃液,每孔用200 μL PBS洗3次,最后加入200 μL PBS溶液,上机检测。
1.4.3 细胞核、LC3B蛋白、溶酶体和pH2AX检测
细胞在HN-3暴露处理结束前0.5 h,每孔加入50 μL细胞核染料和溶酶体染料,37℃孵育0.5 h;每孔加入100 μL固定液,室温避光固定20 min;弃液,每孔加入200 μL透膜液,室温避光孵育30 min;弃液,每孔使用200 μL PBS洗1次,再加入200 μL封闭液室温孵育1 h;弃液,每孔加入40 μL小鼠抗pH2AX单克隆抗体(1∶1000)工作液,4℃避光孵育过夜;弃液,每孔用100 μL封闭液洗3次,每孔加入40 μL兔抗LC3B单克隆抗体工作液,室温孵育1 h;弃液,再加入50 μL Alexa Flour 488标记的驴抗小鼠IgG二抗(1∶500)和Alexa Flour 549标记的驴抗兔IgG二抗(1∶500)工作液,室温避光孵育1 h;弃液,每孔用200 μL PBS洗3次,最后加入200 μL PBS溶液,上机检测。
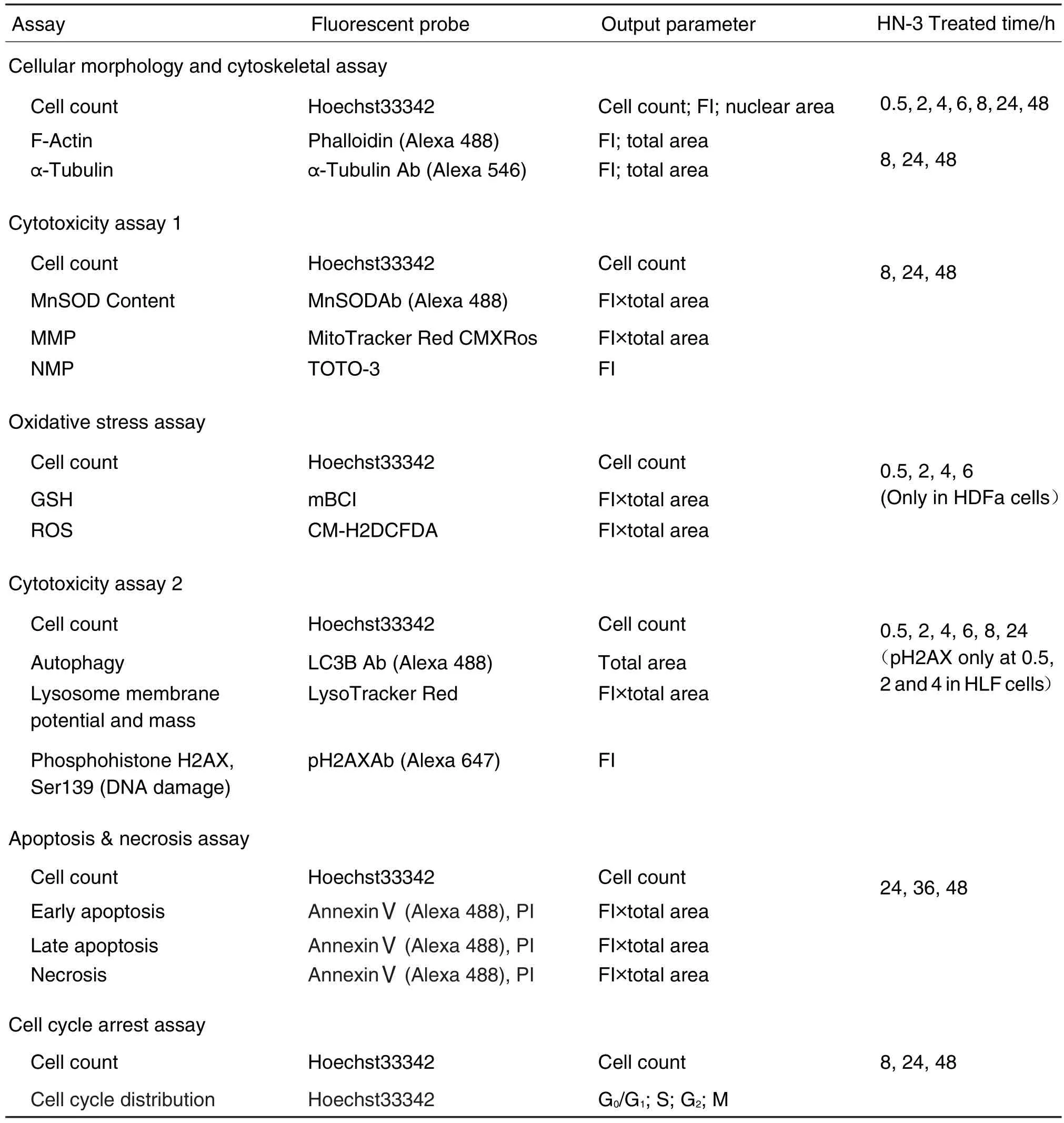
Tab.1 Multi-parametric cellular phenotypic assay panel and HN-3 treated protocol time
1.4.4 HDFa细胞活性氧和谷胱甘肽检测
取活性氧染料CM-H2DCFDA母液(50 mg CM-H2DCFDA溶于86.5 μL DMSO)10 μL加入至0.5 mL HBSS中,取谷胱甘肽染料mBCI母液(5 mg mBCI溶于 220 μL DMSO)10 μL 加入至 0.5 mL HBSS中,混匀;再分别将上述溶液和1 μL的核染料加入到9 mL预温至37℃的HBSS溶液中,混匀,得染色工作液(根据实际情况按比例配置所需体积溶液);染毒处理后细胞用HBSS洗1次,每孔加入100 μL染色工作液,37℃染色45 min;细胞换预温至37℃的完全培养液孵育5 min;每孔细胞用100 μL HBSS洗1次,再换200 μL HBSS上机检测。
1.4.5 细胞凋亡的检测
细胞染毒处理后,弃液,每孔100 μL结合缓冲液(mmol·L-1:NaCl 140,HEPES 10,CaCl22.5,pH 7.4)洗1次,加入40 μL凋亡检测染料(磷脂酰丝氨酸-Alexa Fluor 488膜联蛋白(Annexin)Ⅴ用含PI 3 μmol·L-1和 Hoechst33342 1 μmol·L-1的结合缓冲液1∶500稀释),室温避光染色30 min,补加160 μL结合缓冲液;每孔加入100 μL含有12%甲醛的结合缓冲液固定,室温避光固定20 min弃液,每孔加入200 μL PBS溶液,上机检测。
1.5 图像采集及分析
完成标记的细胞,使用IN Cell Analyzer 2000活细胞成像系统(美国GE公司)进行细胞图像采集,选择20倍物镜,根据标记的特定荧光标记分子的特性采用相应的激发和发射波长检测通道进行检测,DIPI通道(激发/发射光波长360 nm/460 nm)检测Hoechst33342染色;FITC通道(激发/发射光波长475 nm/535 nm)检测Alexa Fluor 488染色;Cy3通道(激发/发射光波长535 nm/620 nm)检测Mito Tracker Red,Lyso Tracker Red,PI,Alexa Fluor 546染色;Cy5通道(激发/发射光波长360 nm/460 nm)检测Cell Mask Deep Red,TOTO-3 iodid,Alexa Fluor 64染色。每孔采集9个视野,细胞数总量不少于200个,采集图像储存于数据库。使用IN Cell Analyzer Workstation图像分析软件(GE公司)中的Multi Target Analysis分析模块,对获得图像进行分析,表1为各指标输出参数。除了细胞凋亡和周期外,参数均通过细胞中靶目标标记的荧光来直接表征。细胞凋亡分析以AnnexinⅤ和PI染色的荧光强度分别为横、纵坐标进行细胞分类,包括存活、早期凋亡、晚期凋亡和细胞死亡4类。细胞周期分析是根据Hoechst3342标记细胞核的面积、核染色平均荧光强度及总强度参数,使用Analyzer Workstation分析软件、Multi Target Analysis模块中的Decision Tree Filter将细胞周期分为G0/G1,S,G2和M期,后2个分析方法原理与流式细胞仪分类方法相同。
1.6 统计学分析
采用Excel软件进行数据处理,计算3复孔数据的平均值及标准差。以0.3%DMSO处理组为细胞对照组,进行数据归一化处理,并计算HN-3处理组的变化率:细胞数变化率(%)=(细胞对照组参数值-HN-3处理组参数值)/细胞对照组参数值×100%;HN-3处理组参数变化率(%)=(HN-3处理组参数值-细胞对照组参数值)/细胞对照组参数值×100%。凋亡和细胞周期的数据由IN Cell Analyzer Workstation图像分析软件直接得出。数据用±s表示。采用Graphpad 6.0作图统计软件,使用One-way ANOVA进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 HN-3对HEKf,HDFa和HLF细胞核形态和骨架的影响
图1A~3A所示,HN-3 300 μmol·L-1作用细胞48 h,细胞核数量明显减少(P<0.01),HEKf(图1A)细胞核缩小,微丝和微管面积减少;HDFa(图2A)和HLF(图3A)细胞由长梭状排列,变为松散片状分布,微管以核为中心聚集,微丝松散分布。对采集的图片进行分析,以参数的变化率的百分值作图。图1B~3B显示,3类细胞随HN-3作用浓度的增加,细胞抑制率逐渐增加。细胞核形态、微丝和微管也随浓度的增加,变化程度随之增加。HN-3作用HEKf细胞(图1B)核面积减少,形态参数增大,亮度增加,均匀程度降低;微丝和微管的亮度和面积降低(P<0.01);HDFa细胞(图2B)核面积增加,均匀程度降低(P<0.01),微丝和微管的亮度和面积增加(P<0.01);HLF细胞(图3B)核面积增加,形态参数增大,亮度降低,均匀程度降低,微丝和微管的亮度和面积增加(P<0.01)。由时间效应曲线图可见,HEKf细胞(图1C)自6 h后,HDFa(图2C)和HLF(图3C)细胞自8 h后细胞增殖抑制率显著升高并具有时间相关性(r=0.99,P<0.01),且细胞核和骨架的各参数随细胞数量的显著减少发生明显改变(P<0.01)。可见,细胞核形态和骨架的改变是HN-3导致细胞毒性损伤的晚期事件。HEKf与HDFa和HLF细胞在胞核和骨架参数上具有不同的变化趋势,后两种细胞的变化趋势基本一致。
2.2 HN-3对HEKf,HDFa和HLF细胞周期的影响

Fig.1 Effect of HN-3 on nuclear morphology and cytoskeleton of HEKf cells by high content analysis.A:the typical images of the cells treated with HN-3 300 μmol·L-1for 48 h.B:the cells were treated for 48 h with different concentrations.C:the cells were treated with HN-3 300 μmol·L-1for 0.5-48 h.Nuc:nuclear;1/FF:1/(form factor);Int:staining intensity;Int CV:coefficient of variation of staining intensity;TA:total area.The change rate of cell count(%)=(parameter value of control group-parameter value of HN-3 treatment group)/parameter value of control group×100%;the change rate of other eight parameters(%)=(parameter value of HN-3 treatment group-parameter value of control group)/parameter value of control group×100%.x±s,n=3.*P<0.05,**P<0.01,compared with control group.
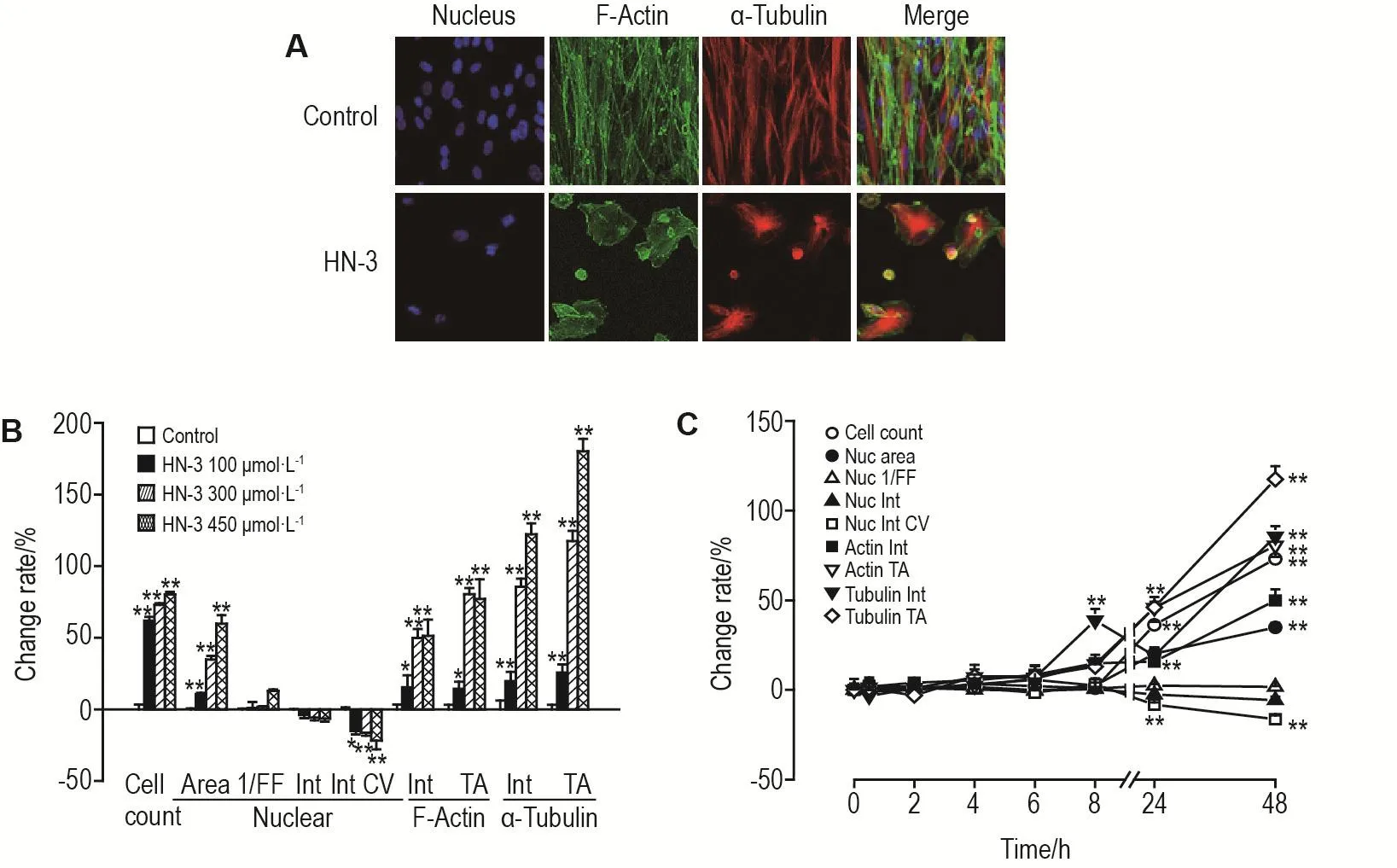
Fig.2 Effect of HN-3 on nuclear morphology and cytoskeleton of HDFa cells by high content analysis.See Fig.1 for the cell treatment.±s,n=3.*P<0.05,**P<0.01,compared with control group.
HN-3处理细胞8 h,HEKf和HDFa细胞有G2和M期阻滞,HLF细胞有G0/G1阻滞;HN-3处理细胞24和48 h,3种细胞均表现为G2期阻滞(图4)。可见,HN-3主要将细胞周期阻滞在G2期,使之不能顺利进入细胞分裂期。
2.3 HN-3诱导HEKf,HDFa和HLF细胞凋亡
HN-3 450 μmol·L-1处理 HEKf 细胞 48 h,AnnexinⅤ染色明显,PI染色不明显(图5A),表示HN-3可诱导细胞早期凋亡;处理HDFa细胞48 h,AnnexinⅤ和PI染色均明显(图5B),说明诱导细胞晚期凋亡。HEKf细胞(图5C)在24和36 h即有明确的细胞早凋现象(P<0.01),48 h随HN-3浓度增加,发生早晚凋亡现象的细胞比率逐渐增加;在HDFa细胞(图5D)上,仅在36 h后有细胞早凋现象(P<0.01);而HLF细胞(图5E)未出现明显的细胞凋亡。随给药时间和HN-3浓度的增加,坏死细胞所占的比例也增加。结果表明,HN-3在不同细胞背景上诱导细胞凋亡的能力不同,3种细胞HN-3中毒后的细胞死亡机制有所不同。
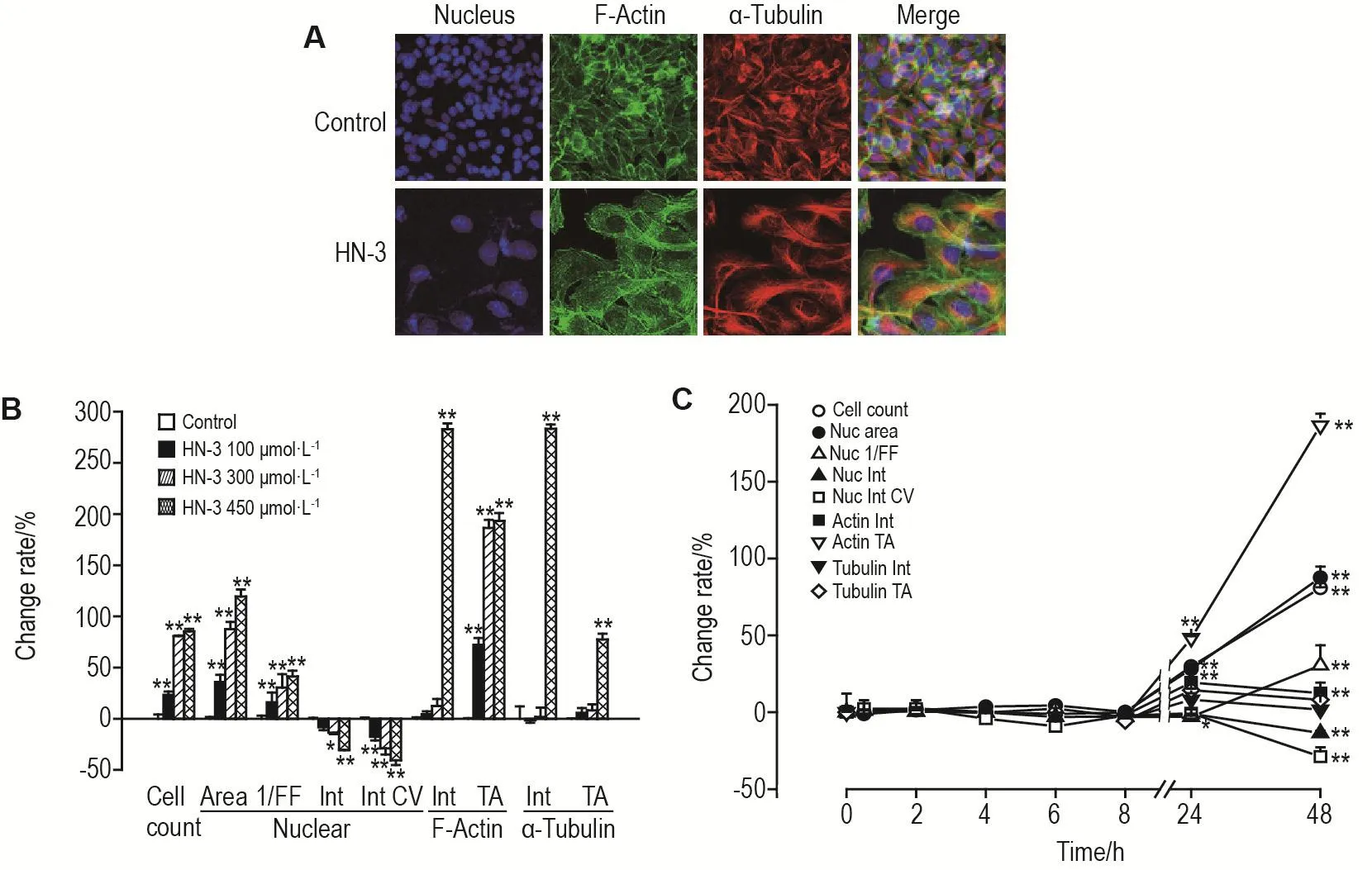
Fig.3 Effect of HN-3 on nuclear morphology and cytoskeleton of HLF cells by high content analysis.See Fig.1 for the cell treatment and legend.±s,n=3.*P<0.05,**P<0.01,compared with control group.
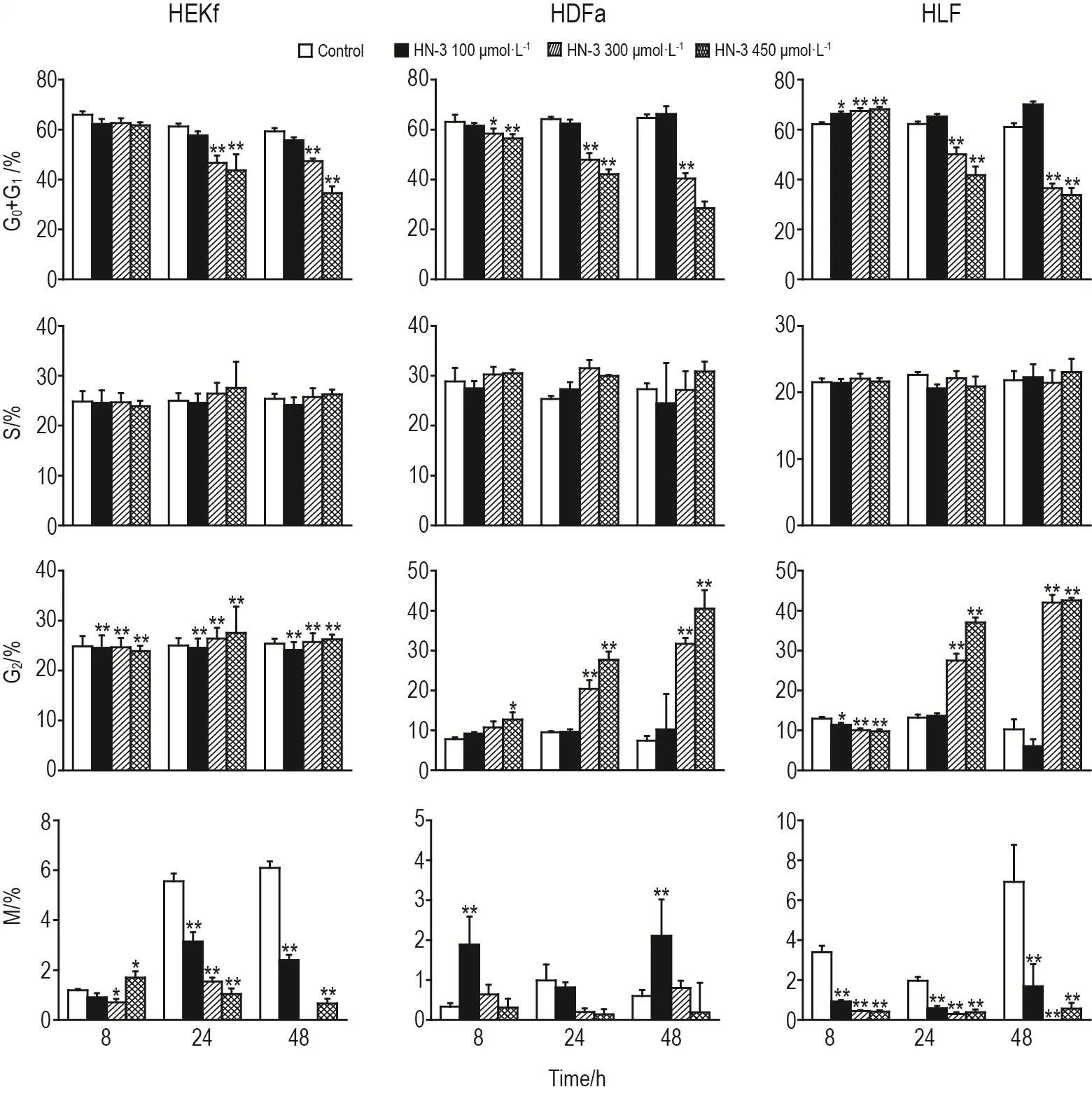
Fig.4 Effect of HN-3 on cell cycle of HEKf,HDFa and HLF cells.See Fig.1 for the cell treatment.±s,n=3.*P<0.05,**P<0.01,compared with control group.
2.4 HN-3对HEKf,HDFa和HLF细胞线粒体膜电位、氧化应激和核膜通透性的影响
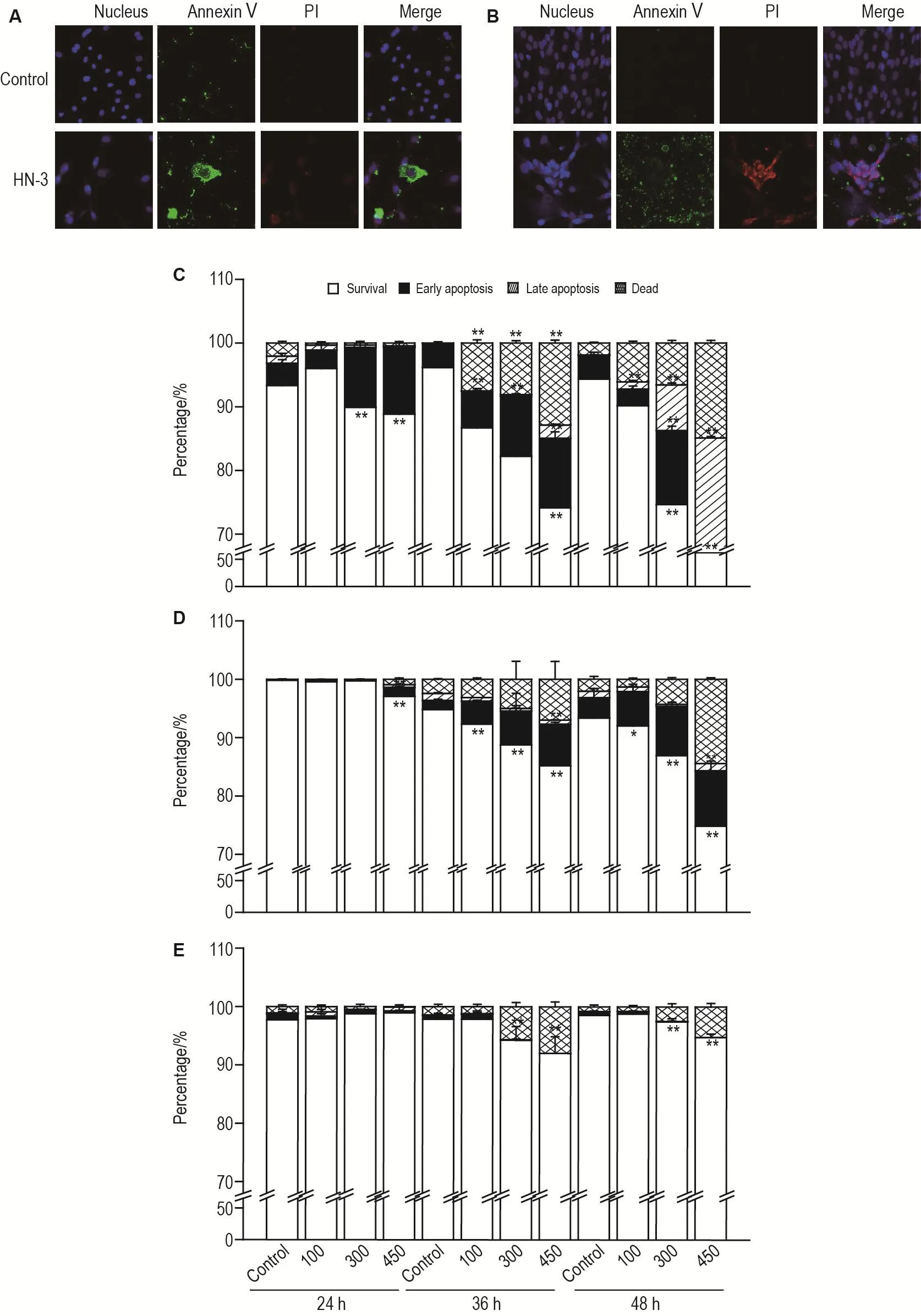
Fig.5 Effect of HN-3 on cell apoptosis in HEKf,HDFa and HLF cells.A and B:HEKf and HDFa cells were treated with HN-3 450 μmol·L-1for 48 h ,respectively;C,D and E:the quantitative analysis results of different concentrations of HN-3 treated for 24,36 and 48 h in HEKf(C),HDFa(D)and HLF(E)cells,respectively.±s,n=3.*P<0.05,**P<0.01,compared with control group.
HN-3 300 μmol·L-1处理细胞48 h,HEKf细胞(图6A1)MMP降低,HDFa(图6B1)和HLF(图6C1)细胞MMP升高,3类细胞的MnSOD和NMP均增加。对采集的图片进行分析,以参数的变化率的百分值为纵坐标,浓度或时间为横坐标作图。如图6A2-C2表示,参数的变化程度随浓度的增大依次增加,HEKf细胞(图6A2)MMP先升高(P<0.01)再随浓度的增加有逐渐降低的趋势(P<0.01),说明浓度越大,对线粒体的损伤越严重,而HDFa(图6B2)和HLF(图6C2)细胞的MMP则呈现逐渐升高的趋势(P<0.01)。说明HN-3对HEKf细胞与HDFa,HLF细胞线粒体损伤类型不同,HEKf更为严重。而MnSOD和NMP随浓度的增加而持续增加(P<0.01),其中HEKf和HLF细胞的MnSOD和HDFa细胞的NMP的增加最为显著。鉴于MnSOD水平的升高既反映细胞的氧化胁迫水平也反映细胞的氧化应激能力,推测HDFa细胞氧化胁迫或应激修复的能力相对较弱。HN-3暴露的时间效应曲线显示,HN-3 300 μmol·L-1处理 HDFa(图6B3)和HLF(图6C3)细胞,上述3个参数在24h时才发生明显的变化(P<0.01),而HEKf细胞(图6A3)则是在48 h才有明显的变化(P<0.01)。这些变化晚于细胞数量开始显著减少的时间。除此之外,本研究还检测了HN-3对HDFa细胞内ROS和GSH的影响,如时间效应曲线(图6B2)所示,在0.5 h时GSH含量迅速降低(P<0.01),约降至总含量的20%,之后一直持续到6 h,而ROS含量呈逐渐增加趋势(P<0.01),同样至6 h基本达到最大值,约75%增加。表明HN-3能快速诱发HDFa细胞ROS释放和GSH耗竭导致细胞氧化应激损伤,推测HN-3对另2个细胞的氧化应激损伤能力更强。
2.5 HN-3对HEKf,HDFa和HLF细胞pH2AX,LC3B和溶酶体的影响
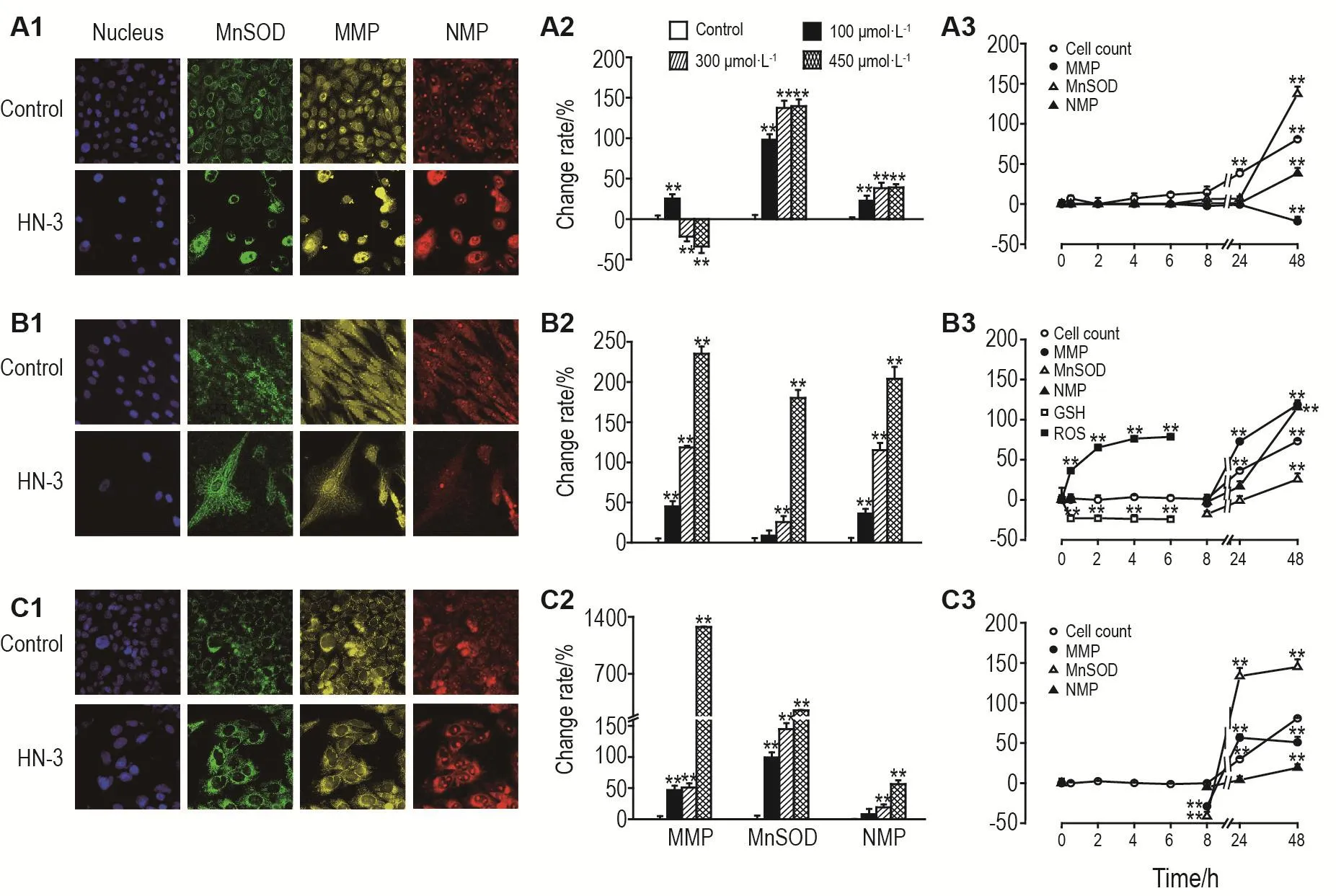
Fig.6 Effect of HN-3 on MnSOD,MMP,NMP,GSH and ROS in HEKf(A1-A3),HDFa(B1-B3)and HLF(C1-C3)cells.A1,B1 and C1:typical images of nucleus,MnSOD,MMP and NMP in HEKf(A),HDFa(B)and HLF(C)cells treated with HN-3 300 μmol·L-1for 48 h;A2,B2 and C2:the cells were treated with NH-3 100,300 and 450 μmol·L-1for 48 h;A3,B3 and C3:the cells were treated with HN-3 300 μmol·L-1for 0.5-48 h.±s,n=3.*P<0.05,**P<0.01,compared with control group.

Fig.7 Effect of HN-3 on pH2AX,Lyso and LC3B in HEKf(A1-A3),HDFa(B1-B3)and HLF(C1-C3)cells.A1,B1 and C1 :typical images of nucleus,pH2AX,lysosome and LC3B in HEKf,HDFa and HLF cells were treated with HN-3 300 μmol·L-1 for 24 ,except that pH2AX was measured in HLF cells for 4 h;A2,B2,C2:the cells were treated with HN-3 100,300 and 450 μmol·L-1 for 24 h,except that pH2AX was measured in HLF cells for 4 h;A3,B3 and C3:the cells were treated with HN-3 300 μmol·L-1for 0.5-48 h.x±s,n=3.*P<0.05,**P<0.01,compared with control group.
HN-3 300 μmol·L-1处理细胞24 h,HEKf细胞(图7A1)LC3B蛋白亮度轻度增加,溶酶体亮度增加,HDFa细胞(图7B1)LC3B蛋白亮度基本无变化,溶酶体亮度增加,HLF细胞(图7C1)LC3B蛋白亮度明显增加,溶酶体亮度轻度增加,3类细胞的pH2AX荧光亮度均有明显的增加。LC3B、溶酶体和pH2AX的变化程度随浓度的增大依次增加(图7A2-C2)。在3类细胞中,pH2AX的亮度增加均很显著(P<0.01),另HEKf细胞(图7A2)溶酶体亮度增加最明显(P<0.01),HLF细胞(图7C2)LC3B蛋白亮度增加最明显(P<0.01),意味着3类细胞的DNA损伤均很强,HEKf细胞溶酶体损伤最严重,HLF细胞有很强的自噬能力。由时间效应曲线所示(图7A3-C3),3类细胞自0.5 h起,pH2AX含量就开始增加(P<0.01),至4 h时,pH2AX含量增加>1倍(P<0.01);在HEKf和HDFa细胞上的持续测定显示,至 24 h,pH2AX含量增加至 3~4倍(P<0.01)。表明HN-3具有较强和持续的DNA损伤作用。在HEKf细胞(图7A3)上,LC3B的表达含量与细胞数量曲线基本一致,即LC3B蛋白是伴随细胞死亡发生变化的;而HN-3暴露0.5 h,溶酶体减少(P<0.05),之后恢复并持续增大(P<0.01)。提示HN-3作用HEKf细胞出现的自噬可能是死亡性自噬,且在早期产生了一过性溶酶体损伤作用。在HDFa细胞(图7B3)上,0.5 h时LC3B增加约25%(P<0.01),之后回复。相应的溶酶体在2 h时有一过性增加(P<0.01),之后回复,并在6 h 减少(P<0.01),8 h后,伴随细胞数量的减少而逐渐增加(P<0.01)。提示HDFa细胞存在一过性自噬修复现象,但修复能力较弱。在HLF细胞(图7C3)上,0.5 h时溶酶体和LC3B有一轻度的增加(P<0.05),之后LC3B随着时间的延长含量显著上升(P<0.01),至细胞出现死亡后出现降低的趋势,而溶酶体只有早期应激性和细胞死亡后升高(P<0.05),提示HLF细胞具有较强的自噬修复作用。以上结果表明,HN-3在3种不同类型的细胞中诱发的细胞自噬反应不同,永生化HLF细胞自噬能力最强。
3 讨论
本研究结果显示,DNA损伤、氧化胁迫和溶酶体损伤是HN-3损伤细胞的早期事件,MMP失衡、NMP增加、G2期细胞周期阻滞和细胞凋亡是细胞损伤晚期事件。pH2AX含量增加、G2期阻滞、MnSOD和NMP增加及溶酶体亮度增加是HN-3损伤3类细胞共有的特征。HN-3作用3类不同来源的细胞系,会产生不完全相同的毒性特征。在细胞核和骨架的变化上,HN-3会造成HEKf细胞核、微丝和微管皱缩;造成HDFa和HLF细胞出现核面积增加,微丝和微管的亮度和面积增加,表现为细胞呈片状分布。在线粒体损伤上,HEKf细胞MMP降低,HDFa和HLF细胞MMP升高,说明HEKf细胞有更严重的线粒体损伤。在氧化应激上,HDFa细胞在HN-3处理0.5 h时,ROS含量迅速升高,谷胱甘肽降低,出现氧化应激反应,但是只有在高浓度HN-3处理时才有明显的MnSOD增加,而HEKf和HLF细胞的MnSOD在低浓度HN-3处理时有显著的增加。在细胞死亡方式上,HN-3作用HEKf,HDFa和HLF细胞出现细胞数量明显降低的时间分别是8,24及24 h,出现凋亡的时间是24及48 h或不出现凋亡,且HEKf细胞出现早期凋亡和晚期凋亡,自6 h后有LC3B的增加,HDFa只有出现早凋,LC3B的含量基本无变化,而HLF自0.5 h后LC3B的含量显著上升,随着浓度和时间增加,具有增加的趋势,说明HEKf细胞对HN-3的毒性作用最敏感,且HLF细胞具有强自噬修复作用,随后是HEKf细胞,其产生的自噬作用很有可能是自噬性死亡。HN-3作用细胞0.5 h,即产生pH2AX和活性氧的升高,谷胱甘肽和溶酶体亮度降低,说明DNA、谷胱甘肽和溶酶体可能是HN-3损伤细胞的重要靶标,HN-3损伤细胞的毒性表型和文献中报道的毒性机制一致。
永生化细胞易于操作,获得性强,是化学品细胞毒性评价的主要实验材料,然而长期体外传代培养导致细胞在体的诸多生物学特性丢失。为了更准确反映化学品的人体危害,开发有效的对抗手段,更接近人体生理状态的原代人源细胞成为现代毒理学研究倡导使用的实验材料[15]。HN-3具有非特异性损伤机制,其在不同类型细胞上的毒性作用尚无系统性的比较研究。本研究选择不同来源或类型的细胞,其中HEKf和HDFa是皮肤重要的组成细胞。其中角质细胞由角质形成细胞演变而来,具较强的增殖能力,有保护机体免受侵害作用;成纤维细胞由胚胎时期的间充质细胞分化而来,在创伤修复中表现出重要的作用。HLF是永生化正常人肺成纤维细胞,也由间充质细胞分化而来,是细胞毒研究首选细胞系。本研究发现,相同浓度HN-3在上述3种细胞上的细胞毒表型谱,在烷化剂损伤机制最为相关的3个参数,即DNA损伤、氧化应激和G2期阻滞,3种细胞变化特征一致。在细胞核形态、细胞骨架和MMP参数上,HDFa和HLF细胞具有相同的变化特征,而HEKf细胞的变化特征与2种成纤维细胞不一致,如HEKf细胞核皱缩、MMP下降、细胞骨架以核为中心聚集,而2种成纤维细胞多是核轻度肿胀、MMP升高、细胞骨架松散。值得注意的是,3种细胞的死亡方式表现不同,从HEKf,HDFa到HLF细胞,凋亡能力由强至弱,早期自噬活性由弱至强。结果说明,即使是永生化细胞HLF也可较好地反映HN-3类烷化剂的主要损伤机制;HEKf细胞较成纤维细胞对于HN-3的损伤作用更为敏感。鉴于早期自噬对抗细胞凋亡[16],提示永生化细胞在传代过程中获得了更强的自噬修复能力,而致凋亡能力丧失,这一发现仍需要进一步证明。但也提示,基于死亡调控机制的抗芥子气保护策略的筛选可能不适于选用永生化细胞。
结合本实验室已发表的SM的细胞表型谱结果[14]发现,HN-3和硫芥在2种原代培养人皮肤细胞的表型谱特征,HN-3与硫芥具有类似的细胞表型特征,如DNA损伤、谷胱甘肽耗竭、活性氧释放、溶酶体损毁、氧化应激,线粒体损伤、核膜通透性、细胞周期阻滞、凋亡和自噬等细胞毒现象;并在2种类型细胞上,HN-3与硫芥具有一致的表现。然而,在特定细胞表型上HN-3与硫芥也呈现出不同程度的作用,如HN-3具有更强更持久的诱导DNA损伤能力,而硫芥则表现为更强谷胱甘肽耗竭、谷胱甘肽释放、氧化应激,溶酶体损伤的作用。说明硫芥急性毒性更强,HN-3潜伏期长,提示应更关注NH3长期的致突变效应。
总之,通过不同来源和不同类型细胞上,对HN-3的时间和浓度细胞表型特征的定量测定,更加明确了HN-3烷基化试剂本质的细胞损伤效应和机制,也发现HN-3较硫芥具有更强的DNA损伤作用和更弱的氧化损伤、溶酶体破坏效应,其毒性的长期效应和毒性机制有待进一步研究,以期为其中毒的临床防治提供思路。
[1] Evison D,Hinsley D,Rice P.Chemical weapons[J].BMJ,2002,324(7333):332-335.
[2] Shakarjian MP,Heck DE,Gray JP,Sinko PJ,Gordon MK,Casillas RP,et al.Mechanisms mediating the vesicant actions of sulfur mustard after cutaneous exposure[J].Toxicol Sci,2010,114(1):5-19.
[3] Poursaleh Z,Ghanei M,Babamahmoodi F,Izadi M,Harandi AA,Emadi SE.Pathogenesis and treatment of skin lesions caused by sulfur mustard[J].Cutan Ocul Toxicol,2012,31(3):241-249.
[4]Ghanei M,Poursaleh Z,Harandi AA,Emadi SE,Emadi SN.Acute and chronic effects of sulfur mustard on the skin:a comprehensive review[J].Cutan Ocul Toxicol,2010,29(4):269-277.
[5]BlochW, ElischerA, SchriekM, Böhm K,Moghbeli F,Kehe K,et al.Comparison of sulfur mustard induced mechanism of cell damage in dependency of time course and cell type[J].Toxicology,2007,233(1):223.
[6]Ghabili K,Agutter PS,Ghanei M,Ansarin K,Panahi Y,Shoja MM.Sulfur mustard toxicity:history,chemistry, pharmacokinetics, and pharmacodynamics[J].Crit Rev Toxicol,2011,41(5):384-403.
[7] Kehe K,Balszuweit F,Steinritz D,Thiermann H.Molecular toxicology of sulfur mustard-induced cutaneous inflammation and blistering[J].Toxicology,2009,263(1):12-19.
[8] Moser J,Meier HL.Comparison of cell size in sulfur mustard-induced death of keratinocytes and lymphocytes[J].J Appl Toxicol,2000,20(Suppl 1):S23-S30.
[9] Zhang X,Zhang Z,Chen S,Zhao D,Zhang F,Hu Z,et al.Nitrogen mustard hydrochlorideinduced acute respiratory failure and myelosuppression:a case report[J].Exp Ther Med,2015,10(4):1293-1296.
[10] Young RA,Bast CD.Mus Tards and vesicants[M]//Aupta RC.Handbook of ToxIcology of Chemical Warfa Agent.Vol 4.London:Academsc Press,2009:94-108.
[11] Inturi S,Tewari-Singh N,Agarwal C,White CW,Agarwal R.Activation of DNA damage repair pathways in response to nitrogen mustard-induced DNA damage and toxicity in skin keratinocytes[J].MutatRes,2014,763-764:53-63.
[12] Au L,Meisch JP,Das LM,Binko AM,Boxer RS,Wen AM,et al.Suppression of hyperactive immune responses protects against nitrogen mustard Injury[J].J Invest Dermatol,2015,135(12):2971-2981.
[13] Kumar D,Tewari-Singh N,Agarwal C,Jain AK,Inturi S,Kant R,et al.Nitrogen mustard exposure of murine skin induces DNA damage,oxidative stress and activation of MAPK/Akt-AP1 pathway leading to induction of inflammatory and proteolytic mediators[J].Toxicol Lett,2015,235(3):161-171.
[14] Long L,Li W,Chen W,Li FF,Li H,Wang LL.Dynamic cytotoxic pro fi les of sulfur mustard in human dermal cells determined by multiparametric highcontent analysis[J].Toxicol Res,2016,5(2):583-593.
[15] Wilding JL,Bodmer WF.Cancer cell lines for drug discoveryanddevelopment[J].CancerRes,2014,74(9):2377-2384.
[16] Zeng R,He J,Peng J,Chen Y,Yi S,Zhao F,et al.The time-dependent autophagy protects against apoptosis with possible involvement of Sirt1 protein in multiple myeloma under nutrient depletion[J].Ann Hematol,2012,91(3):407-417.
*Co-first author.
2016-12-25 接受日期:2017-06-08)
(本文编辑:乔 虹)
Charaterizing cytotoxicity of nitrogen mustard HN-3 based on cellular high content analysis
WEI Ai-li1,2*,LONG Long1,2*,LI Wei1,2,DING Rui1,2,CHEN Wei1,2,WANG Li-li1,2
(1.State Key Laboratory of Toxicology and Medical Countermeasures,Beijing 100850,China;2.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTIVETo study the cytotoxic characteristics of nitrogen mustard HN-3 in different cell.METHODSHuman epidermal keratinocytes-fetal(HEKf),human dermal fibroblasts-adult(HDFa)and human lung fibroblasts(HLF)cell lines were treated with HN-3 100,300 and 450 μmol·L-1for 0.5,2,4,6,12,24 and 48 h,respectively.Multi-parameter analysis technology based on cell imaging was used to examine the effects of HN-3 on cell survival,cell cycle arrest,apoptosis,autophagy and oxidative stress,along with parameters concerning nucleus,cytoskeleton(actin and tubulin),lysosome,nuclear membrane permeability(NMP),mitochondrial membrane potential(MMP)and phosphohistone H2AX(pH2AX).RESULTSHN-3 caused irreversible cellular damage by significantly decreasing the number of HEKf,HDFa and HLF cells in a time-dependent manner(P<0.01).Before the cell number was reduced robustly,the content of reactive oxygen species and pH2AX significantly increased,but the glutathione content decreased after cells were exposed to HN-3 for 0.5 h(P<0.01).In addition,the content of lysosome was reduced in HEKf cells at 0.5 h,but increased in HDFa and HLF cells at 0.5 and 2 h respectively,accompanied by the increase in microtubule-associated protein 1 light chain 3B(LC3B)puncta.With the significant reduction of the cell number in HEKf cell line,the nuclear intensity increased,nuclear area decreased,the intensity and area of F-actin and α-tubulin decreased,MMP decreased(P<0.01)and lysosomal intensity increased.But the effects of HN-3 on HDFa and HLF cell lines were quite different.The nuclear area increased,the intensity and area of F-actin and a-tubulin increased,MMP increased(P<0.01)and the intensity of lysosome increased.In HLF cells,there was an increase in LC3B puncta(P<0.01).In all the three cell lines,NMP and manganese superoxide dismutase content were increased,and cell cycle arrested at G2phase.HN-3 Induced early apoptosis in HDFa cells but late apoptosis in HEKf cells.CONCLUSIONHN-3 causes DNA damage,oxidative stress and lysosome damage at an early stage,whereas at the late stage,the imbalance of MMP,increase in NMP,and G2phage arrest are the major cytotoxic effects.Moreover,HN-3 specifically induces nuclear condensation,cytoskeleton protein aggregation and apoptosis in HEKf cell.HN-3 Induces nuclear swelling,and loose cytoskeleton in HDFa cells and HLF cells,eventually inducing early apoptosis in HDFa cells and autophagic death in HLF cells.
nitrogen mustard;cytotoxic phenotype;DNA injury;oxidative stress;high-throughput screening assays
The project supported by National Natural Science Foundation of China(81430090);the Key Technologies of Comprehensive New Drug Research and Development(2012ZX09301003-001);and the Key Technologies of Comprehensive New Drug Research and Development(2012ZX09301003-003)
WANG Li-li,E-mail:wangll63@126.com,Tel:(010)66932674
R99
A
1000-3002-(2017)07-0742-12
10.3867/j.issn.1000-3002.2017.07.007
国家自然科学基金(81430090);综合性新药研究开发关键技术(2012ZX09301003-001);综合性新药研究开发关键技术(2012ZX09301003-003)
魏爱丽,女,硕士研究生,主要从事毒理学和药物筛选研究;龙 隆,女,实验师,主要从事药物筛选工作。
王莉莉,E-mail:wangll63@126.com,Tel:(010)66932674
*共同第一作者。
