血清miR-122作为药物肝损伤生物标志物的敏感性和特异性比较
2017-12-08汤纳平梅其炳
汤纳平,陈 洁,王 雁,葛 帅,马 璟,梅其炳
(1.西北工业大学生命学院,陕西西安710072;2.中国医药工业研究总院国家上海新药安全评价研究中心,上海 201203)
·论 著·
血清miR-122作为药物肝损伤生物标志物的敏感性和特异性比较
汤纳平1,2,陈 洁2,王 雁2,葛 帅2,马 璟2,梅其炳1
(1.西北工业大学生命学院,陕西西安710072;2.中国医药工业研究总院国家上海新药安全评价研究中心,上海 201203)
目的比较研究血清微RNA-122(miR-122)作为药物肝损伤生物标志物的敏感性和特异性,为miR-122用于早期药物肝毒性评价提供依据。方法采用对乙酰氨基酚(APAP,1250 mg·kg-1,ig)、α-萘异硫氰酸酯(ANIT,150 mg·kg-1,ig)、蛋氨酸-胆碱缺乏饮食(MCDD,自由摄食)以及四氯化碳(CCl4,50%,ip)分别制备大鼠肝细胞损伤模型、胆汁淤积模型、脂肪肝模型以及肝纤维化模型,用于评价miR-122作为药物肝损伤生物标志物的敏感性。采用盐酸异丙肾上腺素(IH,2.5 mg·kg-1,iv)和庆大霉素(GM,80 mg·kg-1,im)分别制备大鼠心肌损伤模型和肾损伤模型,用于评价miR-122作为药物肝损伤生物标志物的特异性。于不同时间点采集大鼠血清和肝组织,采用全自动生化仪检测血清谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性及总胆红素(TBIL)浓度,采用实时定量PCR检测血清miR-122,并采用HE染色对肝组织进行组织病理检查。结果与溶媒对照组相比,肝细胞损伤模型、胆汁淤积模型、脂肪肝模型和肝纤维化模型组血清miR-122明显升高(>2倍)的时间分别为给药后1.5 h,3 h,2周和4周,均早于传统生物标志物GPT,GOT和TBIL〔给药后6 h,12 h,3周和6周均未见明显升高(<2倍)〕,同时其升高幅度(最大升高倍数分别为235.8,202.7,73.8和600.3倍)也高于传统生物标志物GPT,GOT和TBIL(GPT最大升高倍数分别为9.5,3.9,2.5和6.6倍,GOT为6.0,2.4,1.4和3.5倍,TBIL为2.6,2.3,1.2和1.8倍)。在心肌损伤模型中,GOT活性明显升高(2.1倍),而血清miR-122无明显改变;在肾损伤模型中,血清miR-122无明显改变。结论血清miR-122可作为药物肝损伤生物标志物,且与传统肝损伤生物标志物如GPT,GOT和TBIL相比有更高的敏感性和特异性。
肝损伤;生物标志物;miR-122;敏感性;特异性
药物诱导性肝损伤(drug-induced liver injury,DILI)是导致药物研发终止和撤市的主要原因之一[1]。谷丙转氨酶(glutamic-pyruvic transaminase,GPT)和谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)作为目前肝损伤评价的经典指标,在临床前和临床工作中广泛应用,但它们的灵敏度和特异性尚不甚理想。最近几十年,虽然大量研究都在致力于寻找可靠灵敏的肝损伤生物标志物,然而迄今仍未明确比GPT和GOT更具有特异性和敏感性的生物标志物。
微RNA(microRNA,miRNA)miR-122最早由Lagos-Quintana等[2]在2002年从小鼠肝组织中成功鉴定,随后发现也存在于人肝、原代肝细胞和肝癌细胞Huh7中[3]。miR-122在肝发育过程中持续表达,是一个调节肝发育的“肝特异性miRNA”,占所克隆的肝miRNA总量的72%,而在其他组织中几乎检测不到[2]。通过对不同物种之间miR-122序列比对分析发现,miR-122从鱼类到人类物种之间的序列高度保守[4]。动物实验和临床试验均表明,血液循环miR-122与肝损伤关系密切。肝损伤后,血液循环miR-122的升高与血清GPT的峰值有很好的相关性,并且与肝组织病理改变一致[5-6]。本研究拟通过制备不同类型的大鼠肝损伤模型以及心肌损伤和肾损伤模型,比较研究miR-122作为药物肝损伤生物标志物的敏感性和特异性,为其应用于临床前药物肝毒性评价提供依据。
1 材料与方法
1.1 主要试剂和仪器
对乙酰氨基酚(acetaminophen,APAP)(批号:20160512)、α-萘异硫氰酸酯(α-naphthyl isothiocyanate,ANIT)(批号:STBG2348V)和焦碳酸二乙酯(diethylpyrocarbonate,DEPC)(批号:BCBN2300V)购自美国Sigma-Aldrich公司;蛋氨酸-胆碱缺乏饲料(methionine choline-deficient diet,MCDD)(批号:16072109)购自北京科澳协力饲料有限公司;盐酸异丙肾上腺素(isoprenaline hydrochloride,IH)(批号:41150101)注射液购自上海禾丰制药有限公司;庆大霉素(gentamicin,GM)(批号:20110406)购自湖北制药有限公司;四氯化碳(carbon tetrachloride,CCl4)(批号:20160321)和羧甲纤维素钠(sodium carboxyl methyl cellulose,CMC-Na)(批号:20150210)购自国药集团化学试剂有限公司;玉米油购自金龙鱼集团股份有限公司;橄榄油购自西班牙法伊吉斯有限公司;GPT、GOT、总胆红素(total bilirubin,TBIL)和肌酐(creatinine,CREA)测定试剂盒购自日本和光纯药工业株式会社;血尿素氮(blood urea nitrogen,BUN)测定试剂盒购自德国罗氏诊断有限公司;大鼠肾损伤分子-1(kidney injury molecule-1,Kim-1)免疫试剂盒购自美国R&D Systems公司;心肌肌钙蛋白I(cardiac troponin-I,cTn I)检测试剂盒购自美国贝克曼库尔特有限公司;mirVanaTMmiRNA分离试剂盒购自美国Ambion公司;miScriptSYBR®Green PCR试剂盒和miScript逆转录试剂盒购自德国Qiagen公司;miRNA特异引物(miR-103-F:5′-AGCAGCATTGTACAGGGCT-3′;miR-122-F:5′-TGGAGTGTGACAATGGTGTTTG-3′)和Trizol LS购自美国Invitrogen公司。Hitachi 7060全自动生化分析仪(日本Hitachi集团);Excelsior ES组织脱水机、Histocentre 3型组织包埋机、NanoDrop 1000分光光度仪和台式高速低温离心机(美国Thermo公司);RM2135型旋转石蜡切片机和ST5020HE染色仪(美国Leica公司);PHY-III病理组织漂烘仪(常州市中威电子仪器有限公司);Axioscope A1荧光显微镜(德国Zeiss公司);实时定量PCR仪(美国Applied Biosystems公司);SpectraMax 340PC酶标仪(美国Molecular Devices公司);Access 2免疫化学发光仪(美国贝克曼库尔特有限公司)。
1.2 动物
雄性SD大鼠,6~8周龄,SPF级,140只,体质量180~220 g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2012-0001。大鼠饲养温度20~26℃,相对湿度40%~70%,12/12 h明暗交替,SPF环境自由进食、饮水。动物适应约5 d后开始实验,实验前至少禁食12 h(MCDD组除外,该组大鼠自由摄食),不禁水,给药后正常进食和进水。
1.3 动物分组、给药和样本采集
肝细胞损伤模型:SD大鼠ig给予APAP 1250 mg·kg-1[4](n=25),分别于给药后1.5,3,6,12和24 h各取5只大鼠采集血清和肝组织用于指标检测。溶媒对照组(n=5)给予0.5%CMC-Na,在给药后24 h解剖采集样品用于检测。
肝内胆汁淤积模型:SD大鼠ig给予ANIT 150 mg·kg-1[4](n=25),分别于给药后1.5,3,6,12和24 h各取5只大鼠采集血清和肝组织用于指标检测。溶媒对照组(n=5)给予玉米油,在给药后24 h解剖采集样品用于检测。
脂肪肝模型:SD 大鼠喂食 MCDD[4,7](n=25),分别于开始喂食后3 d,1周,2周,3周和4周各取5只大鼠采集血清和肝组织用于指标检测。正常饲料对照组(n=5)喂食含蛋氨酸-胆碱的饲料(除蛋氨酸-胆碱外,其余成分与MCDD相同),在喂食4周后解剖采集样品用于检测。
肝纤维化模型:SD大鼠ip给予50%CCl4(橄榄油稀释)[4]〔(n=25),1 mL·kg-1,每周给药2次(每周的第1天和第4天给药)〕,连续给药8周;分别于给药后第2,4,6,7和8周各取5只大鼠采集血清和肝组织用于指标检测。溶媒对照组(n=5)给予橄榄油,给药方式同CCl4,在给药第8周末解剖采集样品用于检测。
心肌损伤模型:SD大鼠尾静脉单次iv给予IH 2.5 mg·kg-1[8](n=5),10 mL·kg-1,给药后4 h采集血清用于指标检测。溶媒对照组(n=5)给予0.9%氯化钠注射液,给药方式同IH。
肾损伤模型:SD大鼠im给予GM 80 mg·kg-1[9],2 mL·kg-1,每天1次,每次每只大鼠左右后肢各注射1 mL·kg-1(n=5),连续给药14 d,给药后第15天采集血清用于指标检测。溶媒对照组(n=5)给予0.9%氯化钠注射液,给药方式同GM。
1.4 肝组织病理检查
经ip给予3%戊巴比妥钠(40~50 mg·kg-1)麻醉大鼠,经腹主动脉采血后放血处死,解剖取肝,用生理盐水洗涤,4%甲醛固定,随后修样、脱水、石蜡包埋,制成5 μm的切片,HE染色后光镜下观察肝组织病理变化。
1.5 血清生化指标检测
根据试剂盒说明书使用Hitachi 7060全自动生化分析仪检测大鼠血清GPT,GOT,TBIL,CREA和BUN水平;采用SpectraMax 340PC酶标仪检测大鼠血清Kim-1水平;采用Access 2免疫化学发光仪检测大鼠血清cTn I水平。
1.6 血清RNA提取
参考Zhang等[5]方法,将全血凝集后经1600×g,4℃离心10 min收集血清,随后将收集到的血清于16 000×g,4℃再次离心10 min,取上清500 μL置于无RNA和DNA酶的离心管中,加入Trizol LS 625 μL,混匀,室温静置5 min;在上述混合液中加入氯仿 167 μL,混匀,室温放置 10 min,随后在12 000×g,4℃离心15 min,使水相和有机相分离,并小心取上层水相液体,移至新的EP管中。之后参照miRNA提取试剂盒说明书提取RNA,并采用NanoDrop 1000分光光度仪测定RNA的吸光度(absorbance,A),以A260nm/A280nm及A260nm/A230nm评估所提取RNA的浓度和质量。只有A260nm/A280nm在1.7~2.0之间,A260nm/A230nm接近2.0的样品用于逆转录qPCR定量分析。
1.7 逆转录及实时定量PCR检测
采用miScript逆转录试剂盒进行逆转录。在20 μL逆转录体系中包括5×逆转录缓冲液4 μL,逆转录混合液1 μL,DEPC水5 μL,RNA模板10 μL,混匀后置于37℃60 min,95℃ 5 min,得到的产物(cDNA)于-80℃保存或用于下一步反应。逆转录合成的cDNA用于实时定量PCR,其20 μL反应体系包括2×SYBR Green Mix 10 μL,反向引物0.5 μL(试剂盒中提供),正向引物1 μL,DEPC水7.5 μL,cDNA模板1 μL。反应条件:95℃酶化15 min;95℃变性15 s,60℃退火延伸1 min,共40个循环。以内源性miR-103为内参[10],并参考文献[11]方法用2-ΔΔCt表示miR-122的相对表达水平。
1.8 统计学分析
实验结果数据以±s表示,采用SPSS 21.0软件进行统计分析。组间比较采用t检验、单因素方差分析或Kruskal-Wallis检验,多重比较采用Dunnettt检验。P<0.05为差异具有统计学意义。
2 结果
2.1 4种肝损伤模型大鼠肝功能和组织形态改变及miR-122敏感性比较
2.1.1 肝细胞损伤模型肝功能和组织形态改变
ig给予APAP 1250 mg·kg-1后24 h,大鼠血清GPT,GOT和TBIL水平显著高于溶媒对照组(P<0.01),分别是溶媒对照组的9.5,6.0和2.6倍(表1)。组织病理学观察(图1A)发现,溶媒对照组大鼠肝小叶结构正常,肝板呈放射状排列,肝细胞形态正常;模型组大鼠肝板排列紊乱,并见肝细胞肥大和坏死,提示肝细胞损伤模型制备成功。
2.1.2 肝内胆汁淤积模型肝功能和组织形态改变
ig给予ANIT 150 mg·kg-1后24 h,大鼠血清GPT,GOT及TBIL显著高于溶媒对照组,分别是溶媒对照组的3.9,2.4和2.3倍(P<0.01)(表1)。组织病理学观察(图1B)发现,溶媒对照组大鼠肝小叶结构正常,肝细胞形态正常;模型组大鼠肝内胆管增生,提示大鼠肝内胆汁淤积模型制备成功。另外,本模型TBIL水平与APAP诱导的肝细胞损伤模型接近,主要是由于除了在胆汁淤积时TBIL明显升高外,在肝细胞肿胀、坏死等肝实质性损伤中TBIL也可显著升高。
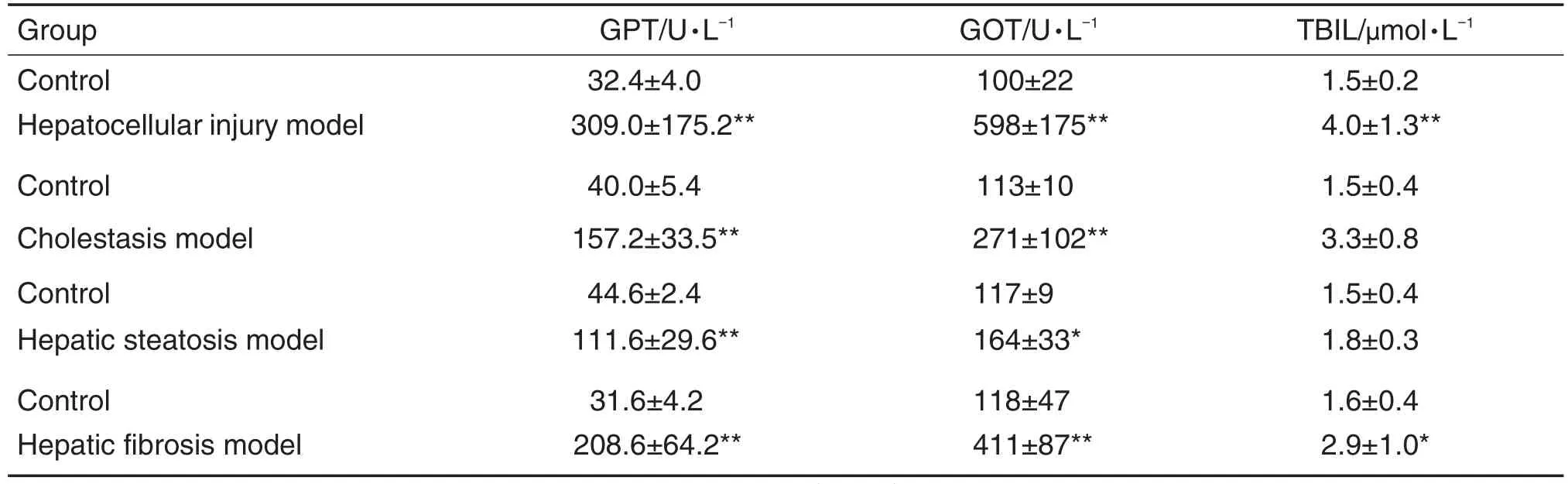
Tab.1 Changes of glutamic pyruvic transaminase(GPT),glutamic oxaloacetic transaminase(GOT)and total bilirubin(TBlL)in different liver injury models in rats
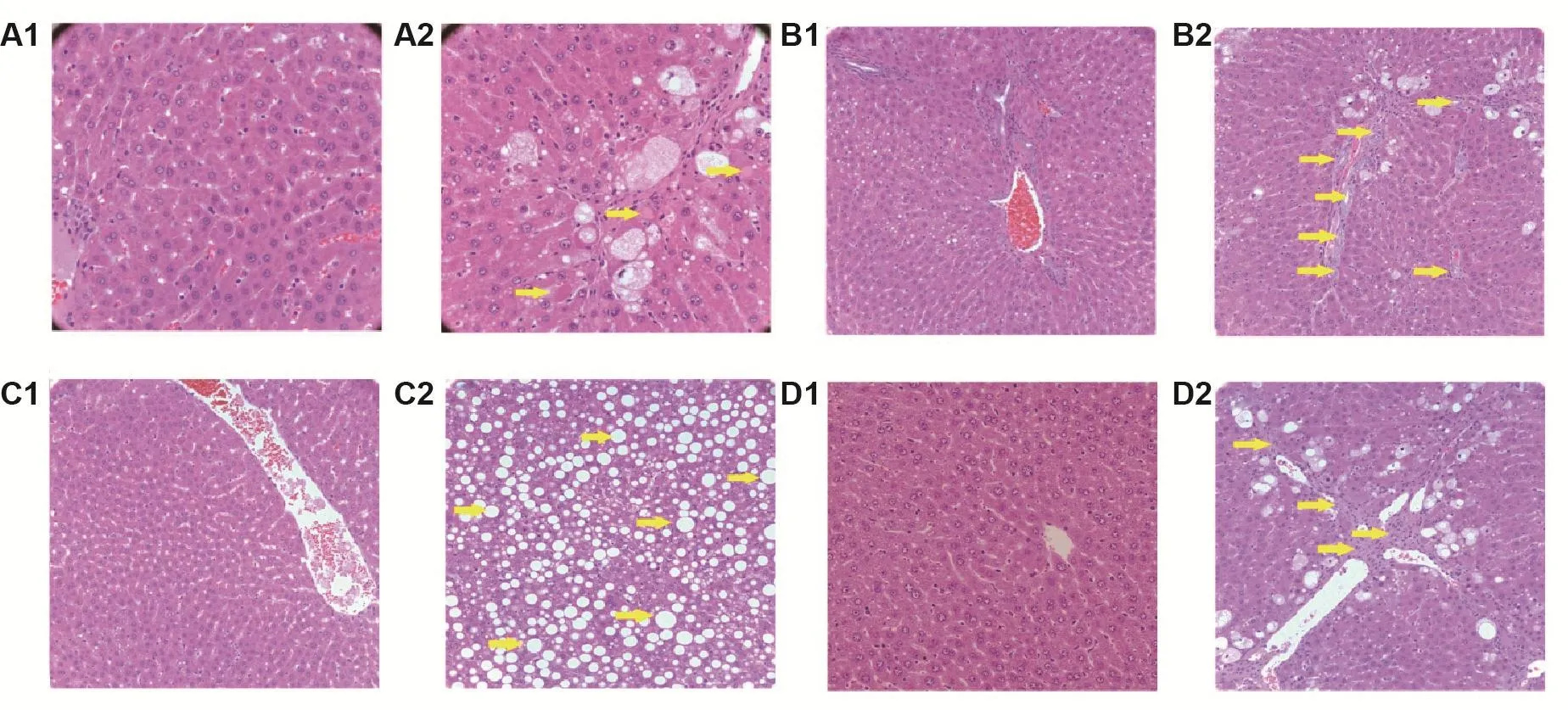
Fig.1 Liver histopathological changes in different liver injury models in rats(HE staining).See Tab.1 for the rat treatment.1:vehicle or normal diet control;2:liver injury model.A:hepatocellular injury model(×400),yellow arrows show centrilobular hepatocellular hypertrophy and necrosis with inflammatory reaction;B:cholestasis model(×200),yellow arrows show intrahepatic bile duct hyperplasia;C:hepatic steatosis model(×200),yellow arrows show steatosis(vacuolization);D:hepatic fibrosis model(×200),yellow arrows show hepatocellular necrosis and fibrosis.
2.1.3 脂肪肝模型肝功能和组织形态改变
MCDD饲料喂食4周后,大鼠GPT和GOT活性显著高于正常饲料对照组(含蛋氨酸-胆碱饲料组),分别是对照组的2.5和1.4倍(P<0.01,P<0.05)(表1)。组织病理学观察(图1C)发现,对照组大鼠肝小叶结构正常,肝细胞形态正常;模型组大鼠肝组织可见大量空泡变性,提示大鼠脂肪肝模型制备成功。
2.1.4 肝纤维化模型肝功能和组织形态改变
ip给予50%CCl48周后,大鼠GPT,GOT及TBIL显著高于溶媒对照组,分别是溶媒对照组的6.6,3.5和1.8倍(P<0.01,P<0.01,P<0.05)(表1)。组织病理学观察(图1D)发现,溶媒对照组大鼠肝小叶结构正常,肝细胞形态正常;模型组大鼠可见散在肝细胞坏死和纤维化,提示大鼠肝纤维化模型制备成功。
2.1.5 miR-122与传统肝损伤生化指标敏感性比较
肝细胞损伤模型、肝内胆汁淤积模型、脂肪肝模型以及肝纤维化模型中,不同时间点血清miR-122和传统生物标志物GPT,GOT以及TBIL水平的变化见图2。
在肝细胞损伤模型中,在给药后1.5~6 h,GPT,GOT以及TBIL的改变均<2倍。而血清miR-122在给药后1.5 h即升高到溶媒对照组的3.6倍;随后逐渐升高,至给药后12 h达高峰,是溶媒对照组的235.8倍;给药后24 h开始下降,为溶媒对照组的67.3倍(图2A)。由此可见,在APAP诱导的肝细胞损伤模型中,血清miR-122升高的时间早于传统指标,且升高倍数也明显高于传统指标。
在肝内胆汁淤积模型中,ANIT给药后12 h内,GPT,GOT和TBIL开始逐渐升高,但在12 h内各时间点与溶媒对照组相比的升高倍数均<2倍。而血清miR-122在给药后3 h即升高到溶媒对照组的3.9倍,随后逐渐升高,至给药后24 h达高峰,为溶媒对照组的202.7倍(图2B)。由此可见,在ANIT诱导的肝内胆汁淤积模型中,血清miR-122出现升高的时间早于传统指标,且升高倍数也明显高于传统指标。
在大鼠脂肪肝模型中,与正常饲料对照组相比,GPT在MCDD处理3周后出现升高,但至第3周升高倍数仍<2倍(为1.7倍);在MCDD喂食过程中,GOT和TBIL升高倍数均<2倍。而血清miR-122在喂食第2周起即逐渐升高,达对照组的4倍;至第4周达高峰,为正常饲料对照组的73.8倍(图2C)。由此可见,在MCDD诱导的大鼠脂肪肝模型中,血清miR-122出现升高的时间和倍数均早于或高于传统指标。
在大鼠肝纤维化模型中,GPT和GOT在给药第6周开始逐渐升高,但6周内升高倍数均<2倍。TBIL在给药第7和8周与溶媒对照组相比有升高,但均<2倍。而血清miR-122在给药第4周即升高到溶媒对照组的2.2倍;随后逐渐升高,至第8周达高峰,为溶媒对照组的600.3倍(图2D)。由此可见,在CCl4诱导的大鼠肝纤维化模型中,血清miR-122出现升高的时间和倍数均早于或高于传统指标。

Fig.2 Fold changes of GPT,GOT,TBlL and microRNA-122(miR-122)in different liver injury models in rats.See Tab.1 for the rat treatment.A:hepatocellular injury model,serum was collected at 1.5,3,6,12 and 24 h after APAP administration.B:cholestasis model,serum was collected at 1.5,3,6,12 and 24 h after ANIT administration.C:hepatic steatosis model,serum was collected at 3,7,14,21 and 28 d after MCDD feeding.D:hepatic fibrosis model,serum was collected at 2,4,6,7 and 8 week after CCl4administration.±s,n=5.
2.2 心肌和肾损伤模型大鼠脏器功能和形态的改变及miR-122特异性比较
2.2.1 心肌损伤模型大鼠心肌GOT,cTn l和形态表现
模型组大鼠给药后4 h GOT和cTn I均显著高于溶媒对照组(P<0.01,P<0.05)(表2)。组织病理学观察(图3A)发现,溶媒对照组大鼠心肌细胞形态正常,IH组大鼠心肌细胞出现变性坏死,提示大鼠心肌损伤模型制备成功。

Tab.2 Changes of GOT and cardiac troponin-l(cTn l)in isoprenaline hydrochloride(lH)-induced myocardial injury model in rats
2.2.2 肾损伤模型大鼠肾功能及形态表现
模型组大鼠给药后15 d,BUN,CREA和Kim-1显著高于溶媒对照组(P<0.01)(表3)。组织病理学观察(图3B)发现,溶媒对照组大鼠肾小球和肾小管形态正常,GM组大鼠肾小管出现变性坏死,提示肾损伤模型建立成功。
2.2.3 miR-122作为肝损伤生物标志物的特异性比较
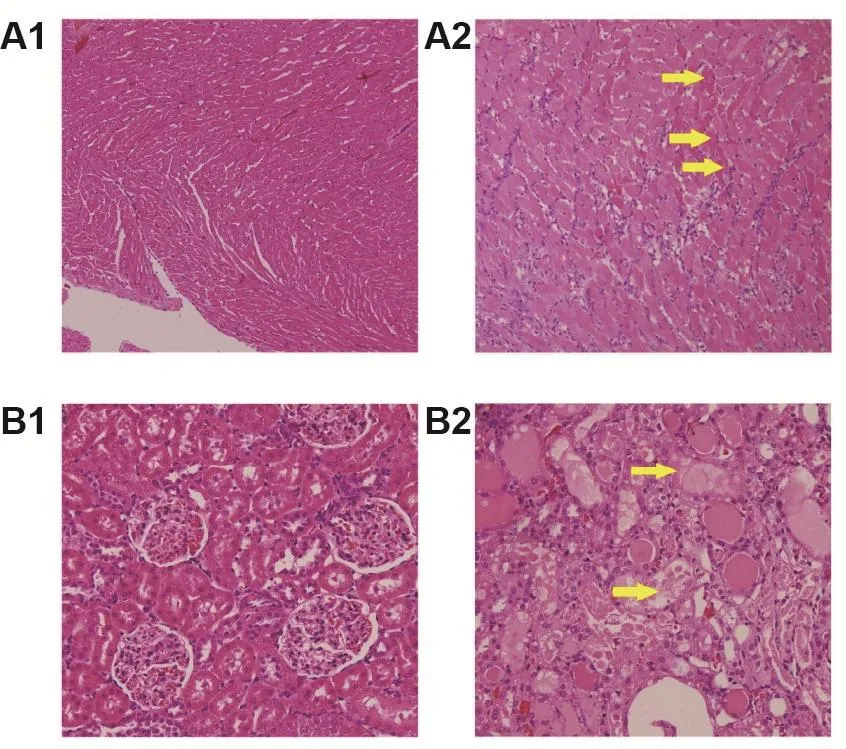
Fig.3 Myocardial and renal histopathological changes in lH-induced myocardial injury model rats(A)and in GM-induced renal injury model rats(B)(HE staining).See Tab.2 and Tab.3 for the rat treatment.1:vehicle control;2:model.A:yellow arrows show myocardial degeneration and necrosis(×100);B:yellow arrows show tubular degeneration and necrosis(×200).

Tab.3 Changes of creatinine(CREA),blood urea nitrogen(BUN)and kidney injury molecule-1(Kim-1)in gentamicin(GM)-induced renal injury model rats
由表4可见,在IH诱导的大鼠心肌损伤模型中,可见GOT明显升高,是溶媒对照组的2.1倍。另外,尽管心肌损伤模型组GPT与溶媒对照组相比无统计学差异,但仍可见GPT有升高趋势。但血清miR-122在模型组和溶媒对照组间无差异,提示在心肌损伤模型中,miR-122的特异性优于传统指标。在GM诱导的大鼠肾损伤模型中,GPT和GOT与溶媒对照组相比无明显差异,同时miR-122在模型组和溶媒对照组间也无明显差异,提示在无肝损伤模型中,miR-122未出现假阳性改变。
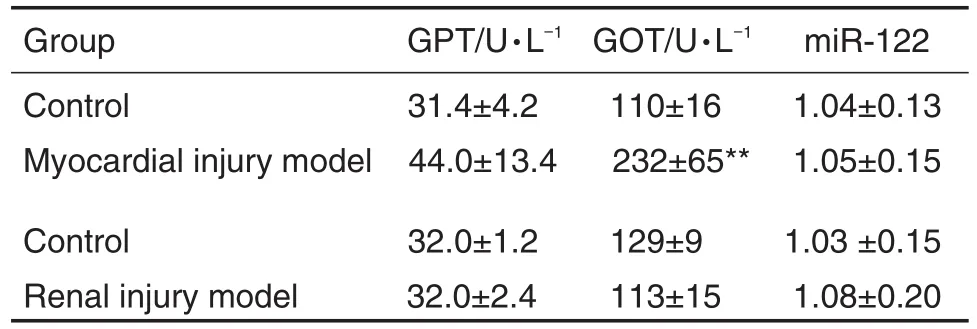
Tab.4 Changes of GPT,GOT and miR-122 in lH-induced myocardial model and GM-induced renal injury model in rats
3 讨论
无论在临床前还是临床试验中,药物诱导的肝损伤是目前导致药物开发失败的主要原因之一。本研究采用国内外公认的方式[4,7]成功制备了不同类型的大鼠肝损伤模型,包括急性肝损伤模型(如APAP诱导的肝细胞损伤模型和ANIT诱导的肝内胆汁淤积模型)以及慢性肝损伤模型(如MCDD诱导的脂肪肝模型和CCl4诱导的肝纤维化模型)。在这些模型中,血清miR-122出现升高的时间均早于传统生物标志物GPT,GOT和TBIL。另外,在出现改变的同一时间点,血清miR-122的升高程度均显著高于GPT,GOT和TBIL,提示血清miR-122作为肝损伤生物标志物的敏感性高于传统指标。
上述情况的出现可能与miRNA的特性相关。miRNA主要通过与靶mRNA的3’-或5’-非翻译区以及编码区的碱基互补配对调整靶mRNA的稳定性,在转录后水平调控靶基因的表达[12-13]。因此,在miRNA水平的改变通常会早于蛋白水平的改变。另外,miRNA除了可以通过组织、细胞损伤进而导致其被动漏出的方式(与传统生物标志物进入血循环相似)进入血液循环[14]外,还可以通过微泡(包括外泌体和脱落的囊泡等膜性结构)主动分泌[15-16],以RNA结合蛋白形式主动分泌入血液循环[17]。因此,在未出现细胞损伤进而被动漏出的情况下,高表达的miR-122可能会通过其他途径提前进入血循环中。肝损伤发生时,血清miR-122的升高水平要显著高于传统肝损伤生物标志物,这可能与miRNA检测方法(实时定量PCR)的高敏感和高特异相关。
在急性肝损伤模型中,给药后12和24 h,血清miR-122均有明显升高,但在APAP诱导的肝细胞损伤模型中,给药后24 h血清miR-122水平开始逐渐下降,提示对于急性肝损伤,血清miR-122的检测可以考虑在给药后12~24 h内进行。而在慢性肝损伤模型中,血清miR-122一直呈现升高态势,定期检测将有助于慢性肝损伤的确定。
在采用IH制备的心肌损伤模型中,传统指标GOT也出现显著升高,这与GOT在心肌中的活性较高密切相关。而在心肌损伤模型中血清miR-122水平与对照组水平相当,这与miR-122的肝组织特异性分布相关。据报道,在小鼠、大鼠和人肝组织中miR-122高度表达,在其他组织表达很低甚至检测不到,而且miR-122表达量占肝中所有miRNA的70% 以上[2-3,18]。
在肾损伤模型中,血清miR-122与传统肝损伤生物标志物一样均未见明显改变,提示在无肝损伤情况下,血清miR-122不会出现假阳性改变,这也进一步体现miR-122表达的肝组织特异性。
综上所述,血清miR-122无论是敏感性还是特异性均优于传统肝损伤生物标志物。在急性肝损伤中,血清miR-122的检测可以考虑在给药后12~24 h内进行;而在慢性肝损伤模型中,定期检测血清miR-122将有助于慢性肝损伤的诊断。
[1] Watkins PB.Drug safety sciences and the bottleneck in drug development[J].Clin Pharmacol Ther,2011,89(6):788-790.
[2] Lagos-Quintana M,Rauhut R,Yalcin A,Meyer J,Lendeckel W,Tuschl T.Identification of tissue-specific microRNAs from mouse[J].Curr Biol,2002,12(9):735-739.
[3] Chang J,Nicolas E,Marks D,Sander C,Lerro A,Buendia MA,et al.miR-122,a mammalian liverspecific microRNA,is processed from hcr mRNA and may downregulate the high affinity cationic amino acid transporter CAT-1[J].RNA Biol,2004,1(2):106-113.
[4] Yamaura Y,Nakajima M,Takagi S,Fukami T,Tsuneyama K,Yokoi T.Plasma microRNA profiles in rat models of hepatocellular injury,cholestasis,and steatosis[J].PLoS One,2012,7(2):e30250.
[5]Zhang Y,Jia Y,Zheng R,Guo Y,Wang Y,Guo H,et al.Plasma microRNA-122 as a biomarker for viral-,alcohol-,and chemical-related hepatic diseases[J].Clin Chem,2010,56(12):1830-1838.
[6] Starkey Lewis PJ,Dear J,Platt V,Simpson KJ,Craig DG,Antoine DJ,et al.Circulating microRNAs as potential markers of human drug-induced liver injury[J].Hepatology,2011,54(5):1767-1776.
[7]Lee GS,Yan JS,Ng RK,Kakar S,Maher JJ.Polyunsaturated fat in the methionine-choline-deficient diet influences hepatic inflammation but not hepatocellular injury[J].J Lipid Res,2007,48(8):1885-1896.
[8]Wei LP,Wang Y,Qiu YL,Huang HX,Li H,Ma J.Kinetic characterization of serum cardiac troponin I in the rats with acute myocardial injury induced by isoproterenol[J].World Clin Drugs(世 界 临 床 药物),2015,36(11):739-742,766.
[9]Qiu YL,Hong M,Fu X,Huang HX,Ma J.Urine biomarkers after acute kidney injury in rats induced by gentamycin[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2014,28(2):248-254.
[10]Wang Y,Tang N,Hui T,Wang S,Zeng X,Li H,et al.Identification of endogenous reference genes for RT-qPCR analysis of plasma microRNAs levels in rats with acetaminophen-induced hepatotoxicity[J].J Appl Toxicol,2013,33(11):1330-1336.
[11] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[12]Carthew RW,Sontheimer EJ.Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136(4):642-655.
[13] Williams AE.Functional aspects of animal microRNAs[J].Cell Mol Life Sci,2008,65(4):545-562.
[14] Chen X,Liang H,Zhang J,Zen K,Zhang CY.Secreted microRNAs:a new form of intercellular communication[J].Trends Cell Biol,2012,22(3):125-132.
[15]Hunter MP,Ismail N,Zhang X,Aguda BD,Lee EJ,Yu L,et al.Detection of microRNA expression in human peripheral blood microvesicles[J].PLoS One,2008,3(11):e3694.
[16]Taylor DD,Gercel-Taylor C.MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer[J].Gynecol Oncol,2008,110(1):13-21.
[17] Arroyo JD,Chevillet JR,Kroh EM,Ruf IK,Pritchard CC, Gibson DF,et al.Argonaute2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma[J].Proc Natl Acad Sci USA,2011,108(12):5003-5008.
[18]Baskerville S,Bartel DP.Microarray profiling of microRNAsrevealsfrequentcoexpressionwith neighboring miRNAs and host genes[J].RNA,2005,11(3):241-247.
2017-04-20 接受日期:2017-07-19)
(本文编辑:齐春会)
Comparison on sensitivity and specificity of serum miR-122 as biomarkers of drug-induced liver injury
TANG Na-ping1,2,CHEN Jie2,WANG Yan2,GE Shuai2,MA Jing2,MEI Qi-bing1
(1.School of Life Sciences,Northwestern Polytechnical University,Xi′an 710071,China;2.China National Shanghai Center for New Drug Safety Evaluation and Research,China State Institute of Pharmaceutical Industry,Shanghai 201203,China)
OBJECTlVETo make a comparison of sensitivity and specificity between serum miR-122 and traditional biomarkers of drug-induced liver injury.METHODSAcetaminophen(APAP,1250 mg·kg-1,ig),α-naphthylisothiocyanate(ANIT,150 mg·kg-1,ig),methionine-choline deficient diet(MCDD,free feeding)and carbon tetrachloride(CCl4,50%,ip)were used to establish hepatocellular injury,cholestasis,steatosis and fibrosis models,respectively,which were used to evaluate the sensitivity of serum miR-122 as a biomarker of drug-induced liver injury,when compared with the traditional biomarkers.Isoprenaline hydrochloride(IH)and gentamicin(GM)were used to establish myocardial and renal injury models,respectively,which were used to evaluate the specificity of serum miR-122,when compared with the traditional biomarkers.Serum and liver tissues were collected at different time points during the study.Traditional biomarkers such as glutamic-pyruvic transaminase(GPT),glutamic-oxaloacetic transaminase(GOT)and total bilirubin(TBIL)were measured with an automatic biochemistry analyzer.MiR-122 was detected with real-time quantitative PCR.Histopathological examination with HE staining was performed for liver tissues.RESULTSSerum miR-122 increased significantly earlier[miR-122 was significantly increased(>2 fold)at 1.5 h,3 h,2 weeks and 4 weeks after treatment in the four models respectively,while no significant increase(<2 fold)was observed for GPT,GOT and TBIL at 6 h,12 h,3 weeks and 6 weeks after treatment in the four models respectively]and more signficantly(the maximum fold change for miR-122 was 235.8,202.7,73.8 and 600.3 for the four models,respectively.For the GPT,the maximum fold change was 9.5,3.9,2.5 and 6.6,respectively;6.0,2.4,1.4 and 3.5 respectively for GOT;2.6,2.3,1.2 and 1.8 respectively for TBIL)than that of traditional biomarkers in hepatocellular injury,cholestasis,steatosis and fibrosis models,when compared with the control group.In the myocardial injury model,a significant increase of GOT was observed after IH treatment(2.1 fold),while no change was observed for serum miR-122.In the renal injury model,no false positive results were observed for serum miR-122.CONCLUSlONSerum miR-122 can be used as a biomarker of drug-induced liver injury and serum miR-122 is more sensitive and specific than traditional biomarkers(such as GPT,GOT and TBIL).
liver injury;biomarkers;miR-122;sensitivity;specificity
The project supported by National Natural Science Foundation of China(81273603);Shanghai Rising-Star Program(14QB1400400);and Specified Fund of Laboratory Animal Study of the Science and Technology Commission of Shanghai Municipality(14140900900)
TANG Na-ping,E-mail:nptang@ncdser.com,Tel:(021)60211999
R963
A
1000-3002-(2017)07-0714-08
DOl:10.3867/j.issn.1000-3002.2017.07.003
国家自然科学基金(81273603);上海市青年科技启明星计划(14QB1400400);上海科委实验动物专项基金(14140900900)
汤纳平,男,博士研究生,主要从事微RNA相关作用研究。
汤纳平,E-mail:nptang@ncdser.com,Tel:(021)60211999
