陕北石油污染区土壤细菌群落结构解析*
2017-12-07赵玲侠孙晓宇路鹏鹏沈卫荣
陈 锐 赵玲侠 孙晓宇 瞿 佳 路鹏鹏 沈卫荣
(陕西省微生物研究所,陕西 西安 710043)
陕北石油污染区土壤细菌群落结构解析*
陈 锐 赵玲侠 孙晓宇 瞿 佳 路鹏鹏 沈卫荣
(陕西省微生物研究所,陕西 西安 710043)
为了解陕北地区石油污染对土壤微生物群落结构的影响,采用高通量测序对石油污染土壤中细菌群落结构进行研究,考察了石油污染土样的理化性质、可培养微生物数量及细菌群落结构,探讨石油污染程度与细菌群落结构间的关系。结果表明,石油污染土样中残油量为28.7~870.0 mg/kg,相对于未污染土样,石油污染土样的总碳随残油量的增加呈增加趋势。石油污染土样中可培养细菌数量大于未污染土样,而可培养放线菌数量则相反。细菌群落结构分析表明,石油污染土样中细菌群落数量显著低于未污染土样,操作分类单元(OTU)数从未污染土样的7 707个最低下降到2 034个,且物种丰富度显著降低,其中厚壁菌门、放线菌门及变形菌门为优势菌群,随土壤残油量增加,厚壁菌门、变形菌门及拟杆菌门比例显著上升,而酸杆菌门、芽单胞菌门等比例则显著降低。
石油污染 微生物群落结构 微生物多样性
地处毛乌素沙地南缘与陕北黄土丘陵沟壑区接壤地带的陕北油气开采区,土壤中矿物盐含量高,有机质含量低、土壤贫瘠[1],土壤微生物种群和数量少。受石油开发的影响,部分土壤被石油污染,给当地生态环境带来极大威胁[2]。土壤微生物作为土壤微生态的重要组成部分,会随环境变更发生群落结构变化及种群消长[3],由于土壤微生物对环境变化的感知灵敏、响应及时,可作为土壤质量的生物学监测指标。目前,对土壤微生物多样性的研究已从传统的微生物平板计数法发展出代谢图谱、磷脂脂肪酸生物标记、单链构象多态性分析(SSCP)、限制性片段长度多态性分析(RFLP)和末端限制性片段长度多样性分析(T-RFLP)、荧光原位杂交、基因芯片技术及高通量测序技术等[4]。高通量测序技术通过提取土样中微生物的DNA组,扩增特定的基因片段,一次可对几十万到几百万条DNA分子进行序列测序,使得对土壤微生物转录组和基因组进行全面分析成为可能[5-6]。本研究采用高通量测序技术对石油污染土样中细菌群落结构的变化进行研究,探讨细菌群落结构变化与不同程度的石油污染之间的关系,及石油污染对陕北脆弱生态环境带来的影响。
1 材料与方法
1.1 实验材料
供试土样采集于陕西省延长油田杏子川采油厂63号井场(36°52′N,109°18′E,海拔1 461 m)。将距石油采出井井架周围0、1、5 m以及远离污染地区的土样进行采样,采用5点采样法采集表层(深度2~10 cm)的土样作为研究样本,采样时样品随机编号,最终选取高水平石油残留土样(9#、3#、8#)、中水平石油残留土样(1#、11#)及未污染土样(16#)进行分析。
1.2 实验方法
土样残油量分析:取部分土样风干,过2 mm筛,采用紫外分光光度法测定土样中残油量[7]。方法如下:将1 g风干土样移入250 mL分液漏斗中,加入5 mL质量分数为50%的硫酸,按混合液质量的2%加入氯化钠,将20 mL石油醚移入分液漏斗,萃取,油层移入100 mL容量瓶中。重复至萃取完全后,用石油醚稀释至标线,以石油醚为空白试样,在选定波长(254 nm)处测量吸光度,根据标准曲线计算残油量。
可培养微生物计数:取新鲜土样5 g,加入到45 mL无菌生理盐水中,振荡30 min后梯度稀释至10-5倍,细菌平板取10-3、10-4、10-5倍3个稀释度,放线菌平板选择10-2、10-3、10-4倍3个稀释度,共涂布3组作为平行对照。细菌在35 ℃下培养24 h,放线菌在28 ℃下培养168 h,菌落基本成形即停止培养并计数。
基因组测序分析:取50 g土样风干后过2 mm筛,取20 g进行土样微生物基因组提取及高通量测序。测序后首先将优质序列进行操作分类单元(OTU)注释,OTU数可以反映出样品中的微生物多样性和不同微生物的丰度。
多样性指数分析:通过统计各土样OTU数及各OTU中包含的序列数,利用Mothur软件计算微生物的丰富度指数(Chao指数、Ace指数)以及多样性指数(Simpson指数、Shannon指数)。Chao指数与Ace指数常用来估计物种总数,可以反映物种数量的差异。Simpson指数用来定量描述一个区域的生物多样性,Simpson指数越大,说明群落多样性越高。Shannon指数是估算样品中微生物均一性的常用指数之一,Shannon指数越大,说明群落均一性越高。
Bata多样性分析:利用各样品序列间的进化及丰度信息来计算样品间距离,进行Bata多样性分析以反映样品之间是否有显著的微生物群落差异。
细菌群落分类:将土样中的细菌群落按照门水平分别进行整理,计算各类群细菌所占比例,进行细菌群落组成分析,可进一步了解受石油污染影响,细菌群落组成的变化[8]。
2 结果与分析
2.1 土样理化性质
各土样理化性质如表1所示。由表1可见,总体看来,5个石油污染土样(1#、3#、8#、9#、11#)含水率差异不大,均高于未污染土样(16#)。pH、总磷、总钾在各土样间无显著差异,石油污染土样与未污染土样间总碳差异显著,表现为随着石油污染程度(残油量)的加重,总碳含量有升高趋势。

表1 土样的理化指标
2.2 可培养微生物分析
通过梯度稀释平板培养计数法,统计土样中可培养细菌及放线菌总数,结果见表2。

表2 土样中可培养微生物计数1)
注:1)同列数据后字母相同表示差异不显著,字母不同表示差异显著。
由表2可见,16#未污染土样中可培养细菌总数为9.40×106cfu/g,其余石油污染土样中除1#土样外,其余4个土样中可培养细菌总数均大于16#土样,最高的8#土样可培养细菌总数达到25.50×106cfu/g,说明受石油污染影响使可培养细菌数量普遍增加。16#未污染土样中可培养放线菌总数为36.00×105cfu/g,5个石油污染土样中可培养放线菌数量均远小于16#土样,最低的9#土样中可培养放线菌数量降至4.40×105cfu/g,石油污染土样与未污染土样间的可培养细菌数、放线菌数差异均达到显著水平。
2.3 细菌菌群多样性
2.3.1 石油污染与细菌OTU数的关系
高通量测序后,对土样微生物基因组中优质序列进行OTU标记,共检出18 618个OTU,各土样的OTU数见表3。将各土样的OTU数与土样残油量作图,结果见图1。由图1可见,总体看来,随着土样残油量增加,土样中OTU数急剧降低,说明石油污染对土壤细菌数量影响显著,说明石油污染与土壤细菌数量显著负相关。11#土样的残油量为28.7 mg/kg,而OTU数与16#土样相比下降了45%,说明即使少量污染也会造成与未污染土样间OTU数的巨大差异。
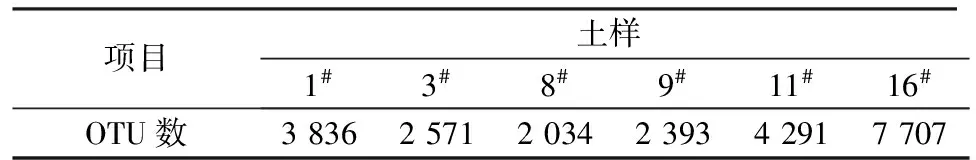
表3 各土样的细菌OTU数

图1 土样残油量与细菌OTU数的关系Fig.1 Relationship between OTU number and residual oil amount in soil samples
2.3.2 各指数与污染程度之间的关系
4个多样性指数与土样残油量作图,结果见图2。由图2可见,总体看来,Chao指数及Ace指数随着残油量的增加而降低,说明物种丰富度显著降低。Simpson指数随着残油量的增加而升高,说明随着石油污染程度加重,细菌群落的多样性增高。Shannon指数随着残油量的增加而降低,说明随着石油污染程度加重,细菌群落样本的均一性降低。在陕北脆弱生态区,石油污染为土壤微生物带来了特定的碳源,有利于可利用石油作为碳源的微生物多样性的增加,因而显示出细菌群落多样性的增加而均一性降低。

图2 各指数与土样残油量之间的关系Fig.2 Relationship between each index and residual oil amount in soil samples
2.3.3 Beta多样性
采用主成分分析法分解Beta多样性,分解出PC1、PC2两个主成分,其中PC1、PC2分别解释了26.4%、23.1%的变异。Bata多样性分析可反映出土样间是否有显著的细菌群落差异,距离越近的土样细菌群落差异越小。由图3可见,9#、3#、8#土样距离接近,1#、11#土样距离接近,16#土样距离其他样本较远。这种群落差异分组恰好与污染程度一致,说明细菌群落差异的产生与石油污染程度高度相关,9#、3#、8#之间细菌群落差异较小,1#与11#之间细菌群落差异较小,这两组与未污染的16#土样细菌群落差异较大。

图3 土样的Beta多样性分析Fig.3 Beta analysis of soil sample
2.3.4 门及科水平的细菌群落组成
将各土样细菌群落OTU依照门水平进行分类整理,计算出各门类细菌占样本总检出数量的比例,结果如表4所示。可见,厚壁菌门、放线菌门及变形菌门占总量的69%~94%,为所有样本中的绝对优势菌群。在高水平石油残留的9#、3#及8#土样中,3大优势菌群占80%以上,在中水平石油残留的1#、11#及无污染的16#土样中则相对较低,占到69%~76%,受石油污染影响,酸杆菌门、芽单胞菌门等比例显著降低,细菌群落的丰富度显著降低,这一结果与大庆油田土样的分析结果总体一致[9]。

表4 门水平的细菌群落组成
进一步将各土样细菌群落OTU依照科水平进行分类整理,计算出各科细菌占样本总检出数量的比例,种群丰富度最高的为未被污染的16#土样,检出368个科,其他石油污染土样中,9#土样检出210个科、3#土样检出271个科、8#土样检出309个科、1#土样检出274个科、11#土样检出247个科。其中链球菌科菌群在各土样中占有主导地位,占总微生物菌群的20%~30%。另有研究表明,乳球菌在石油废水处理中起重要作用[10]。在石油污染土样中,纤维素单胞菌科、克里斯滕森菌科、Anaerolinaceae科、黏土杆菌科、瘤胃球菌科、明串珠菌科及盐硫杆状菌科随石油污染程度增加而比例增加,其中部分菌群据文献报道与盐碱、有机质降解及石油降解有关[11-15]。
在未污染土样中检出的特有菌科为变形菌门的Kouleothrixaceae科、Entotheonellaceae科、多囊粘菌科、侏囊菌科、腐螺旋菌科及放线菌门的红色杆菌科、束丝放线菌科、高温单孢菌科,受石油污染影响该类菌群种类多样性显著降低。
3 结 论
(1) 5个受石油污染的土样(1#、3#、8#、9#、11#)之间含水率总体差异不显著,但均高于未污染的16#土样。受石油污染影响,土样pH、总磷、总钾在各土样间无显著差异,石油污染土样与未污染土样间总碳差异显著,表现为随着石油污染程度的加重,总碳含量呈升高趋势。
(2) 对陕北地区石油开采区土样的可培养细菌、放线菌进行计数,证实受石油污染影响,土样细菌数量增加,放线菌数量则急剧降低,石油污染土样与未污染土样的可培养细菌、放线菌的差异达到显著水平。
(3) 6个土样共检出18 618个OTU,随着土壤中残油量的增加,土样OTU数急剧降低,说明石油污染对土壤细菌数量影响显著,即使少量污染也会造成与未污染土样之间的巨大差异。随着石油污染程度增加,物种丰富度显著降低、群落多样性增强但均一性降低,呈现出种群单一的趋势。通过Beta多样性分析可知,高水平石油残留土样及中水平石油残留土样间细菌群落差异较小,污染土样与未污染土样之间细菌群落差异较大。受石油污染影响,厚壁菌门、变形菌门及拟杆菌门比例显著增加,酸杆菌门、芽单胞菌门等比例显著降低。
[1] 韩磊,李锐,朱会利,等.安塞县农田土壤养分现状分析[J].西北农林科技大学学报(自然科学版),2011,39(5):91-97.
[2] 李小利,刘国彬,许明祥.陕北油田土壤和地表水石油污染特征[J].水土保持研究,2009,16(5):145-148.
[3] 宋长青,吴金水,陆雅海,等.中国土壤微生物学研究10年回顾[J].地球科学进展,2013,28(10):1087-1105.
[4] 李洁,李睿玉,杨红,等.土壤微生物多样性的研究方法[J].山西农业科学,2016,44(11):1738-1742.
[5] 楼骏,柳勇,李延.高通量测序技术在土壤微生物多样性研究中的研究进展[J].中国农学通报,2014,30(15):256-260.
[6] LIGI T,OOPKAUP K,TRUU M,et al.Characterization of bacterial communities in soil and sediment of a created riverine wetland complex using high-throughput 16S rRNA amplicon sequencing[J].Ecological Engineering,2014,72:56-66.
[7] 周林红,吴燕.紫外分光光度法测定炼油废水中的石油类含量[J].石化技术与应用,2004,22(6):456-458.
[8] YANG S Z,WEN X,JIN H J,et al.Pyrosequencing investigation into the bacterial community in permafrost soils along the China-Russia Crude Oil Pipeline (CRCOP)[J].Plos One,2012,7(12):e52730.
[9] 贾洪柏.石油污染土壤的微生物修复及对相关土壤细菌群落多样性的影响[D].哈尔滨:东北林业大学,2009.
[10] YANG Q P,XIONG P Y,DING P,et al.Treatment of petrochemical wastewater by microaerobic hydrolysis and anoxic/oxic processes and analysis of bacterial diversity[J].Bioresoure Technology,2015,196:169-175.
[11] 胡婷,谷洁,甄丽莎,等.石油污染土壤中苯酚降解菌ad049的鉴定及降解特性[J].生态学报,2014,34(5):1140-1148.
[12] 李海云,牛世全,孔维宝,等.河西走廊石羊河下游地区盐碱土中放线菌多样性——以民勤县为例[J].中国环境科学,2015,35(6):1805-1813.
[13] 党岩.垃圾焚烧厂渗沥液中富里酸对厌氧生物处理的影响及其降解和转化研究[D].北京:北京林业大学,2016.
[14] 陈凯丽,吴蔓莉,叶茜琼.生物修复对石油污染土壤微生物活性的影响[J].农业环境科学学报,2017,36(2):279-285.
[15] 李广贺,张旭,卢晓霞.土壤残油生物降解性与微生物活性[J].地球科学,2002,27(2):181-185.
MicrobialcommunitystructureinpetroleumpollutedsoilatnorthofShaanxi
CHENRui,ZHAOLingxia,SUNXiaoyu,QUJia,LUPengpeng,SHENWeirong.
(ShaanxiInstituteofMicrobiology,Xi’anShaanxi710043)
In order to investigate the change of soil microbial community structure cause by petroleum pollution at north of Shaanxi,high-throughput sequencing was used to analyze the soil microbial community structure in soil samples. Some physical and chemical properties and culturable microbial amount of soil samples were investigated,and the relationship between microbial community structure and petroleum polluted level was studied. Results showed that the contents of petroleum hydrocarbons in the petroleum polluted soil samples ranged from 28.7 to 870.0 mg/kg. Total carbon in petroleum-polluted soil samples increased significantly. The abundance of culturable bacteria was increased in petroleum-polluted soil,while abundance of actinomycetes was decrease significantly. High-throughput sequencing data showed that microbial diversity was decreased correlated with petroleum hydrocarbons content. The number of operational taxonomic units (OTU) decreased from 7 707 (unpolluted soil sample) to the lowest of 2 034,the community richness was also decreased significantly. Firmicutes,Actinobacteria and Proteobacteria were the most dominant populations in all of soil samples,whereas the Firmicutes,Bacteroidetes and Proteobacteria community content shifted up,and Acidobacteria and Gemmatimonadetes community content decreased with the increasing of petroleum hydrocarbon content.
petroleum pollution; microbial community structure; microbial diversity
陈 锐,女,1977年生,博士,副研究员,主要从事微生物多样性及生物修复研究。
*西部之光人才培养项目(No.K2012-02);陕西省科学技术研究发展计划项目(No.2011K08-31);陕西省科学院人才培养专项(No.2014k-27)。
10.15985/j.cnki.1001-3865.2017.11.004
2017-03-06)
