超声波技术探测后备母牛乳腺发育的研究进展
2017-12-07刁其玉
文/李 媛 刁其玉 屠 焰*
超声波技术探测后备母牛乳腺发育的研究进展
文/李 媛 刁其玉 屠 焰*
(中国农业科学院饲料研究所;农业部饲料生物技术重点实验室)
后备母牛的乳腺发育是决定后期泌乳量的基础,直接关系到牛场的收益。目前有关后备母牛乳腺发育的研究多通过屠宰试验采集乳腺进行测定,导致不能分析乳腺发育与后期产奶量间的关系,研究一直处于空白。因此,采用无创技术长期观测后备母牛乳腺发育成为有待研究的重点。超声波仪目前已经广泛用于牛场妊娠检测,就如何利用现有的超声波仪探测后备母牛乳腺发育做一综述,为后期超声波探测乳腺发育技术的发展提供依据。
超声波技术;后备母牛;乳腺发育;研究进展
后备母牛的乳腺发育是奶牛整个乳腺发育过程的关键时期,后备母牛乳腺发育的好坏直接关系着后期泌乳量的多少。目前围绕后备母牛的研究很多,而乳腺发育作为决定后备母牛后期泌乳量的关键因素,经常被忽视。乳腺发育的研究一般通过屠宰试验获取整个乳腺组织来观测,而且多数研究集中于乳腺实质组织的研究[1],但乳腺实质与泌乳组织有明显的不同,屠宰后不能观测后备母牛乳腺实质的组成与后期产奶量的关系,就目前研究结果来看,不能确定乳腺实质的发育一定与泌乳性能相关[2],所以通过屠宰试验观测后备母牛乳腺发育有一定风险。不同于屠宰试验,超声波技术作为一种无创性方法可以实现将体内难以接触到的部位以成像的形式观测,做到长期观测乳腺实质的发育,从而探究乳腺发育情况与泌乳量的关系,对筛选高产后备母牛及提升牛场效益具有重大意义。本文对后备母牛乳腺发育及乳腺发育的研究方法做一综述,旨在为后期采用新型超声波技术探测乳腺发育,为预测产奶量提供参考。
1 后备母牛乳腺发育特点
后备母牛的后期泌乳量更多地取决于早期组织的发育程度,而不是后期的饲喂管理[3],后期营养不能弥补先天缺陷。奶牛的泌乳量是指从第一次泌乳到最后一次泌乳的整个泌乳生理过程的产奶量。但是乳腺的发育只在奶牛生命早期进行,所以后备母牛的乳腺发育是奶牛整个泌乳周期的基础。牛奶中体细胞的数量是决定牛奶质量好坏的一个重要因素[4],牛奶中体细胞数量越多,质量越差,而牛奶中的体细胞数量直接与乳腺上皮细胞的凋亡有关。随着泌乳的进行,细胞的程序性死亡和凋亡增加,上皮细胞的数量越来越少,泌乳量逐渐下降[5]。所以乳腺上皮细胞数量而不是乳房的大小是决定奶牛泌乳性能的关键因素。
奶牛乳腺从胚胎期开始发育,出生时乳腺的基本结构和形状已经发育完全,上皮细胞开始增殖,乳腺导管开始发育[6]。乳腺导管系统从乳头池开始经过乳池,最后在上皮导管组织汇集[7]。上皮组织和其周边的组织组成了乳腺的实质;基质是与实质紧连的不含上皮细胞的组织,主要为连接组织、神经组织、淋巴组织及血管,由于基质内脂肪含量较多,因此又被称为脂肪垫[8]。乳腺的基本结构见图1。不同阶段生长母牛的乳腺实质的发育变化很大,根据其发育情况大致可以分为5 个阶段:断奶前(0~2 月龄)、初情期前(3~9 月龄)、妊娠前、怀孕期、泌乳期[9,10]。在0~2 月龄后备母牛的乳腺与体重处于等速生长状态,2 月龄~初情期前后备母牛的乳腺发育处于异速生长状态,此时乳腺实质的发育速度要快于牛体其它部位。乳腺发育最快的时期在3~9 月龄,体重90~230 kg。进入初情期后,发情周期会刺激乳腺实质进一步发育[11],此时,乳腺DNA浓度与发情周期遵循回归生长模型,乳腺实质发育仍为异速发育阶段。奶牛的乳腺发育主要集中在妊娠期,受母体激素的影响,乳腺上皮细胞开始大量的增殖分化,脂肪垫慢慢退化,脂肪组织逐渐被导管替代。
出生到初情期是后备母牛乳腺发育的关键时期,乳腺上皮细胞迅速增殖[12],但此阶段乳腺发育易受日粮因素影响,研究表明,日粮营养水平,尤其是能量、蛋白水平是后备母牛乳腺发育的主要因素,其主要影响乳腺脂肪垫的发育,但对乳腺实质的影响较小[13~15]。此外,乳腺的发育受到机体内激素和各类作用因子的调控,研究表明,生长激素、催乳素、雌激素、胰岛素生长因子等都能促进犊牛的乳腺发育。初情期前后备母牛乳头的生长与雌激素水平密切相关。雌激素会刺激细胞分裂,促进导管分支及延长,这些都是初情期后备母牛乳腺发育的基础[12]。Heinrichs等[16]在1999年指出,雌激素会促进乳头的生长;Capuco等[17]在2012年也指出,雌激素可促进乳腺干细胞的增殖。

图1 奶牛乳腺的基本结构
2 后备母牛乳腺发育的评价方法
2.1 乳房外观
乳房外观及血液生化指标能够间接反映首次发情前乳腺的发育程度。犊牛乳房外观指标与成年后产奶量有较强的相关性。刘正伦等[18]试验结果表明,犊牛乳腺前宽和长度值与产奶量呈极显著正相关,体高、体长与产奶量的相关性较为显著。Capuco等[17]在2012年也指出,雌激素可促进乳腺干细胞的增殖,因此雌激素对乳头长度的影响可用来间接观测乳腺上皮细胞的发育。长期以来,乳头长度一直作为一个被用来评价后备母牛乳腺发育程度的表观指标。罗汉鹏等[19]在2016年研究表明,乳头长度对测定日产奶量有显著影响。但Whitlock等[20]在2002年研究表明乳头长度与分泌组织没有直接关系。乳头长度是否决定后期泌乳量的研究结果不一,乳头长度与泌乳量的关系有待进一步验证。图2为5~6 月龄后备母牛乳头。
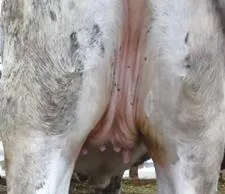
图2 5~6 月龄后备母牛乳头
2.2 触诊法
触诊法是利用触觉及视觉结合的检查法,通常用检查者的手或者是借助工具去实施。触诊内容主要分为体表状态检查、组织器官检查、腹部触诊,既可对动物浅表组织进行触诊,也可检查动物腹壁紧张度、有无压痛和反跳痛、腹部包块、液波感及肝脾等腹内脏器情况。一手平放于被检部位(检查中、小动物时,用另一手放于对侧做衬托),轻轻按压,以感知其内容物的性状与敏感性(图3)。此外,也可以利用掌指运动,上下左右滑动触摸触及的部位,了解其形态、大小及硬度等。触诊法是最早期研究乳腺发育的方法,即通过触摸感觉乳腺实质发育情况。Donoho等[21]在1955年的研究表明,触诊法和卡尺测量法是观测乳腺发育的一种可行手段,但后期研究证明触诊法检测奶牛乳腺实质的发育很困难而且不精确,所以此方法已经逐渐被淘汰。

图3 触诊法
2.3 超声波技术
超声波成像技术作为一种无创性、可长期观测的技术在动物疾病诊断及繁殖方面已应用多年[22]。早期学者成功应用X射线断层摄影技术[16]及山羊乳腺核磁共振成像技术[23]探测动物的乳腺发育情况。但由于核磁共振技术成本很高,奶牛体型大,耗资多,所以核磁共振技术后期未应用于奶牛乳腺发育的观测。X射线断层摄影技术的成本也很高,并且数据可靠性不大,目前已很少使用。Caruolo等[9]在1967年开始应用超声波技术(A超、振幅超声波技术)探索乳腺的结构和泌乳导管的发育情况。Ruberte等[24]在1994年,提升技术,使用B超探测山羊的乳腺形态,并通过屠宰试验和成像技术的对比,证实采用B超技术探测乳腺结构的结果是可靠的。
乳腺发育是决定奶牛泌乳量和乳品质的基础。B超成像可明显地区分乳腺的微观结构,例如乳腺实质、腺体、乳头池、乳头壁、乳头管等[25]。超声波检测反刍动物乳腺实质及腺体和乳头发育时一般采用低频(5~8MHZ)的凸面线型或扇型传感器测定[26,27],分为直接探测法、隔离探测法和水浴法。直接探测法是指将乳腺浸用酒精擦拭后抹上传感胶,传感器直接接触乳腺,探针直接横向或纵向扫描,从而探测乳腺的横向和纵向结构[28];隔离探测法是将乳头浸入充满乳液的胶套中,探针通过接触胶套探测乳腺发育情况[29];水浴法是指将乳头放入装满30~35 ℃温水的塑料杯中[30],用探测器在杯子外进行测定。相较于前2 种方法,水浴法在测定过程中能维持乳头或乳腺的原有形状,不受探针挤压,测定结果更准确(图4)。
超声波检测法利用超声波可穿透组织探测体内结构的特点,通过探针发出不同频率的声波,声波反射使探针内的晶体产生共鸣,最后把晶体的共鸣结果以图像形式呈现,所以超声波仪可以根据回声反射的时间实时成像[31]。在B超方法中,不同反射波的振幅会被传感器转化为不同亮度[31],图像会以不同灰度的形式呈现。B超技术已经应用于探测乳头厚度,用于检测乳腺炎或其它因素引起的泌乳障碍症。Franz 等[25]通过对比超声波图像与屠宰结构,发现乳头管的回声特点。Ayadi等[32]在2003年利用超声波技术发现了泌乳牛的乳池,泌乳区与实质区紧邻,泌乳区为低反射区成像较暗,实质区为高反射区成像较亮。Nishimura等[33]在2011年应用超声波技术探测了2.2~25.2月龄的后备母牛的乳腺发育情况,结果表明,2月龄的后备母牛乳腺实质已经可观测到,成像图为一个椭圆形的低回声区,5 月龄时椭圆形回声区域消失,超声波图呈现均一的回声区,中间伴随不规则的低回声区;初情期前乳腺超声波图中低回声区由表皮向中间呈辐射状扩散;怀孕期的成像图中,低回声区扩散的更深入,表明随着后备母牛的生长,乳腺导管逐渐延伸分支;怀孕后期超声波图像中只有小部分低回声的导管区域。随着后备母牛的生长,超声波成像图中高回声区逐渐增减增加。但是随着后备母牛日龄的增长,由于上皮导管的发育和分支渗入脂肪垫,导管区域增加(图5)。此外,Nishimura[33]还指出,随着日龄的增加,无回声的导管区更难辨别。通过对比后备母牛乳腺的超声波成像图和解剖结构,发现成像图与解剖面的结构相一致,表明超声波检测技术探测后备母牛乳腺结构有极高的准确性,所以超声波技术可以作为探测后备母牛乳腺发育的有效手段。

图4 超声波探测山羊乳腺发育扫描方法图[30]
超声波成像图可以根据不同的亮度区分为脂肪组织和分泌组织。Nishimura等[33]只观测了不同生长阶段后备母牛乳腺的发育情况,并没有把超声波图谱中的回声区量化,如果能将图谱量化,计算不同发育阶段后备母牛乳腺实质及导管结构的含量,超声波技术会成为一种优于屠宰试验的监测断奶前后备母牛乳腺发育的手段。Strzetelski等[34]在2004年尝试量化初产牛成像中乳腺实质的含量,他们的目的是通过分析得到乳腺各组织的含量和泌乳量间的关系,但是现在超声波检测结果与屠宰后的对照试验较少,未得到准确的分析结果,组织含量的准确性有待进一步验证。

图5 后备母牛乳腺外观、超声波成像图、解剖面图的对比[33]
3 小结
通过活体观测初情期奶牛乳腺实质发育与后期泌乳量的相关性是最完美的方法。现在犊牛乳腺发育的指标评定多为活体采样或屠宰采样,不能实现长期追踪观察。如果超声波技术可以用于追踪乳腺实质的发育,就可以避免屠宰,降低成本。目前超声波技术已广泛用于探测母牛的怀孕或发情情况,如果其可以发展为一种监测断奶前后备母牛乳腺实质发育的有效手段,就可以用牛场现有设备确定后期奶牛的生产潜能,大大降低成本。目前没有准确定量分析奶牛乳腺发育及泌乳量关系的方法。如果通过超声波技术探测断奶前乳腺实质的发育,并用于后期乳腺发育的检测,并且分析其与后期泌乳量的相关性,牛场可以在断奶前筛选出优质母牛,大大降低饲养成本,增加收益。所以如何利用超声波技术探测后备母牛乳腺发育情况,并量化乳腺实质发育与后期泌乳量的关系,是未来筛选优质后备牛降低饲养成本的有效手段。C
[1] Meyer M J,Capuco A V,Ross D A,et al.Developmental and nutritional regulation of the prepubertal bovine mammary gland:II.epithelial cell proliferation,parenchymal accretion rate,and allometric growth[J].Journal of Dairy Science. 2006, 89(11): 4298-4304.
[2] Albino R L, Guimarães S E, Daniels K M,et al. Technical note:mammary gland ultrasonography to evaluate mammary parenchymal composition in prepubertal heifers[J]. Journal of Dairy Science,2017,100(2):1588-1591.
[3] Daniels K M,Advisor C,Moeller S J,et al. Ultrasonographic monitoring of mammary parenchyma growth in preweaned Holstein Heifers[D]. Ohio:The Ohio State University,2012.
[4] Boutinaud M,Shand J H,Park M A,et al.A quantitative RT-PCR study of the mRNA expression profile of the IGF axis during mammary gland development[J]. Journal of Molecular Endocrinology,2004,33(1):195.
[5] Berry S D K,Jobst P M,Ellis S E,et al. Mammary epithelial proliferation and estrogen receptor alpha expression in prepubertal heifers:effects of ovariectomy and growth hormone[J]. Journal of Dairy Science,2003,86(6): 2098-2105.
[6] Rowson A R, Daniels K M, Ellis S E,et al. Growth and development of the mammary glands of livestock: a veritable barnyard of opportunities[J]. Seminars in Cell & Developmental Biology,2012,23(5):557.
[7] 李庆章. 奶牛乳腺发育与泌乳生物学[M]. 科学出版社,2014.
[8] Esselburn K M,O'Diam K M,Hill T M,et al. Intake of specific fatty acids and fat alters growth,health,and titers following vaccination in dairy calves[J]. Journal of Dairy Science,2013,96(9):5826-5835.
[9] Caruolo E V, Mochrie R D. Ultrasonograms of Lactating Mammary Glands 1,2[J].Journal of Dairy Science,1967,50(2):225-230.
[10] Sejrsen K, Foldager J. Mammary growth and milk production capacity of replacement Heifers in relation to diet energy concentration and plasma hormone levels[J]. Acta Agriculturae Scandinavica,2009,42(2):99-105.
[11] Sinha Y N, Tucker H A. Mammary development and pituitary prolactin level of Heifers from birth through puberty and during the Estrous Cycle[J]. Journal of Dairy Science,1969,52(4): 507-512.
[12] Purup S,Sejrsen K,Foldager J,et al. Effect of exogenous bovine growth hormone and ovariectomy on prepubertal mammary growth,serum hormones and acute invitro proliferative response of mammary explants from Holstein heifers[J]. Journal of Endocrinology,1993,139(1):19-26.
[13] Meyer M J,Capuco A V,Boisclair Y R,et al. Estrogen-dependent responses of the mammary fat pad in prepubertal dairy heifers[J]. Journal of Endocrinology,2006,190(3):819.
[14] Brown E G,Vandehaar M J,Daniels K M,et al. Effect of increasing energy and protein intake on mammary development in Heifer calves[J]. Journal of Dairy Science,2005,88(2):595-603.
[15] Daniels K M,Capuco A V,Mcgilliard M L,et al. Effects of milk replacer formulation on measures of mammary growth and composition in Holstein heifers[J]. Journal of Dairy Science,2009,92(12):5937-5950.
[16] Heinrichs A J,Buckmaster D R,Lammers B P. Processing,mixing,and particle size reduction of forages for dairy cattle[J]. Journal of Animal Science,1999,77(1):180-186.
[17] Capuco A V,Choudhary R K,Daniels K M, et al. Bovine mammary stem cells: cell biology meets production agriculture[J].Animal,2012,6(3): 382-393.
[18] 刘正伦,唐宗南,蒋炯琳. 犊牛乳腺生长发育和外貌性状与产乳量的相关研究[J]. 中国奶牛,1984(1):8-14.
[19] 罗汉鹏,武俊达,邱文卿,等. 奶牛乳头长度与泌乳性能相关性的初步探究[J]. 畜牧与兽医,2016,48(6):67-69.
[20] Whitlock B K,Vandehaar M J,Silva L F P,et al. Effect of dietary protein on prepubertal mammary development in rapidly growing dairy Heifers[J]. Journal of Dairy Science,2002,85(6):1516-1525.
[21] Donoho H R. Association of immature bovine udder evaluations and subsequent milk and butterfat production[D]. Ohio:The Ohio State University,1955.
[22] Franz S,Floek M,Hofmannparisot M,et al. Ultrasonography of the bovine udder and teat[J]. Veterinary Clinics of North America Food Animal Practice, 2009,25(3):669-685.
[23] Nudda A,Pulina G,Vallebella R,et al.Ultrasound technique for measuring mammary cistern size of dairy ewes[J].Journal of Dairy Research,2000,67(1): 101.
[24] Ruberte J,Carretero A,Fernández M,et al. Ultrasound mammography in the lactating ewe and its correspondence to anatomical section[J]. Small Ruminant Research,1994,13(2):199-204.
[25] Franz S,Hofmannparisot M,Baumgartner W,et al. Ultrasonography of the teat canal in cows and sheep[J]. Veterinary Record,2001,149(4):109-112.
[26] Flöck M,Winter P. Diagnostic ultrasonography in cattle with diseases of the mammary gland[J]. Veterinary Journal,2006,171(2):314-321.
[27] Szymanowska A,Szymanowski M. Application cistern size measurement in dairy goats(short communication)[J]. Archiv Fur Tierzucht Archives of Animal Breeding,2006,49(4):382-388.
[28] Franz S,Hofmannparisot M,Gutler S,et al. Clinical and ultrasonographic findings in the mammary gland of sheep[J]. New Zealand Veterinary Journal,2003, 51(5):238-243.
[29] Rambabu K,Sreenu M,Kumar R V S,et al. Ultrasonography of the udder and teat in buffaloes[J]. Buffalo Bulletin,2009,28(1):5-10.
[30] Fasulkov,Yotov,Atanasov,et al.Evaluation of different techniques of teat ultrasonography in goat[J]. Istanbul Universitesi Veteriner Fakultesi Dergisi,2013,39(1):33-39.
[31] Robinson P A, Rennie C J, Wright J J.Propagation and stability of waves of electrical activity in the cerebral cortex[J].Physical Review E Statistical Physics Plasmas Fluids & Related Interdisciplinary Topics,1997,56(1):826-840.
[32] Ayadi M,Caja G,Such X,et al. Use of ultrasonography to estimate cistern size and milk storage at different milking intervals in the udder of dairy cows[J].Journal of Dairy Research,2003,70(1):1-7.
[33] Nishimura M,Yoshida T,El-Khodery S,et al. Ultrasound imaging of mammary glands in dairy heifers at different stages of growth[J]. Journal of Veterinary Medical Science,2011,73(1):19-24.
[34] Strzetelski J,Bilik K,Niwinska B,et al.Ultrasound evaluation of the mammary gland tissue structure in preparturient heifers vs performance of first calvers[J].Journal of Animal Feed Science,2004,13:7-10.
奶牛产业技术体系北京市创新团队(BAIC06-2017)]
李媛(1993-),女,河北唐山人,在读硕士,研究方向为动物营养与饲料科学。
*通信作者:屠焰,研究员,博士生导师,研究方向为动物营养与饲料科学。
2017-09-20)
