黄色肉芽肿性胆囊炎的CT与MR影像分析
2017-12-07李伟伟余日胜
李伟伟,余日胜,崔 凤
(1.杭州市中医院放射科,浙江 杭州 310007;2.浙江大学医学院附属第二医院放射科,浙江 杭州 310009)
黄色肉芽肿性胆囊炎的CT与MR影像分析
李伟伟1,余日胜2,崔 凤1
(1.杭州市中医院放射科,浙江 杭州 310007;2.浙江大学医学院附属第二医院放射科,浙江 杭州 310009)
目的:探讨黄色肉芽肿性胆囊炎的CT、MR影像特征。方法:收集28例经手术和病理证实的黄色肉芽肿性胆囊炎,回顾性分析其CT、MR影像表现。结果:28例患者中,胆囊壁增厚28例,其中弥漫性增厚22例(78.57%),胆囊/胆管结石21例(75%),胆囊壁内结节 10 例(35.71%),增强后黏膜线连续 25 例(89.29%),邻近结构浸润 24 例(85.71%)。结论:黄色肉芽肿性胆囊炎的主要特点是胆囊壁弥漫性增厚、增强后黏膜线连续、胆囊壁内结节及胆囊/胆管结石。
胆囊炎;肉芽肿;体层摄影术,螺旋计算机;磁共振成像
黄色肉芽肿性胆囊炎(XGC)是一种少见的慢性胆囊炎症,以胆囊壁增厚及壁内泡沫状组织细胞为特点。其临床表现缺乏特异性,影像学特征常不典型,因此易被误诊为胆囊癌。本研究回顾性分析其临床特点及CT、MR影像学特征,旨在更好地掌握该疾病,从而术前明确诊断,为临床医生选择手术方式提供指导帮助。
1 资料与方法
1.1 一般资料
收集2013年1月—2016年7月经手术及病理证实的XGC患者共28例,年龄23~81岁,平均(62.89±12.32)岁,其中男 13 例,女 15 例。临床表现急性上腹痛者13例,伴或不伴恶心、呕吐、发热;无症状者5例;反复上腹痛者8例;黄疸5例。查体:部分患者右上腹轻压痛,Murphy’s征阴性或阳性。28例患者中,CA19-9 升高者 14 例 (58.3%),CA19-9正常者 10 例(41.7%),另外 4 例患者未做 CA19-9检测。
1.2 检查方法
CT检查:28例患者中,行CT增强检查者27例,CT机型为 Siemens DEFMITION40及Brilliance iCT 256层螺旋CT,扫描层厚均为5 mm,层间距为5 mm,螺距1.0。患者检查前均禁食8 h(急诊患者除外),扫描前半小时饮水500 mL左右充盈胃肠道,扫描范围从膈顶至肾脏下缘,CT对比剂为欧乃派克(碘海醇注射液 350 mgI/mL),注射速度 2.5~3.0 mL/s,剂量90 mL。
MR 检查:28例患者中,14例采用 GE 3.0T磁共振扫描仪(型号750)检查,上腹部常规扫描范围,32通道相控阵体线圈,FSE序列,采集平扫横断面T1WI、横断面压脂 T2WI、冠状面 T2WI及 DWI,T1WI(TR 3~4 ms,TE 1.5~2.0 ms),横断面压脂 T2WI(TR 4600~6000ms,TE 94~96ms)。横断面扫描层厚 6mm,间距2 mm,冠状面扫描层厚4 mm,间距1 mm。快速扰相GRE T1WI(LAVA)动态增强扫描获得横断面及冠状面T1WI。对比剂是钆喷酸葡胺注射液(0.2mL/kg,2.5~3.0 mL/s), 注射对比剂后 20 s、60 s、120 s 分别进行动脉期、门静脉期及延迟期扫描,层厚6 mm,间距1 mm。
1.3 资料分析
收集28例患者的CT、MR影像资料,由两名影像科医师归纳分析。阅片要点包括以下方面:①胆囊壁是否增厚,弥漫性增厚(胆囊壁增厚范围≥50%胆囊周长)还是局限性增厚(胆囊壁增厚范围<50%胆囊周长);②增强后黏膜线是否连续;③邻近肝实质及脂肪、肠道有无浸润,有无肿大淋巴结;④胆囊壁内是否存在脂质成分;⑤是否合并胆囊结石或胆管结石。
2 结果
2.1 手术所见
28例患者均行手术治疗,其中20例行开腹胆囊切除,2例因胆囊与周围结构粘连严重由腹腔镜转为开腹探查,6例行腹腔镜下胆囊切除术。术中发现XGC粘连明显,多数囊壁弥漫性增厚,部分胆囊壁内可见结节,切面为黄色,质软。病变多累及邻近肝脏、肠道及脂肪组织。其中,4例胆囊穿孔(胆囊穿孔被网膜组织包裹1例,胆囊-结肠瘘2例,胆囊-十二指肠瘘1例),予胆囊及邻近坏死肠管组织切除,并行复杂肠粘连松解术;3例患者胆囊与邻近肝组织粘连严重,可见多发肿大淋巴结,予胆囊及邻近肝脏切除,并肝门淋巴结清扫;2例患者初入院时感染严重,予抗感染等对症处理后再次入院手术。28例患者术后恢复良好。
2.2 CT 及 MR 表现
28例患者的CT及MR影像表现如下:①所有患者均可见胆囊壁增厚,其中弥漫性增厚22例(78.57%),局限性增厚 6 例(21.43%),增厚的胆囊壁呈稍低密度,T2WI稍高信号,T1WI等信号(图1);②增强后黏膜强化,黏膜线连续者25例(89.29%),中断者 3 例(10.71%)(图2);③邻近结构浸润 24 例(85.71%),包括累及邻近肝实质、肠道及脂肪组织,其中胆囊穿孔被网膜组织包裹1例,胆囊-结肠瘘2例,胆囊-十二指肠瘘1例,边界清晰者4例(14.29%)(图3); ④胆囊壁内结节 10 例 (35.71%)(图4),该征象为XGC的典型表现,CT显示低密度,T2WI脂肪抑制序列呈低信号,脂肪像呈高信号,同相位呈高信号,反相位呈低信号,上述表现证实该结节为脂肪成分;⑤胆囊/胆管结石21例(75%),CT显示高密度结节,T2WI呈低信号(图4),部分胆囊结石与胆管结石并存。
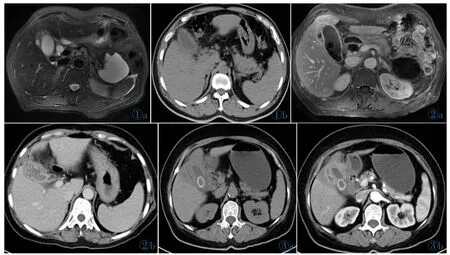
图1 XGC患者胆囊壁增厚。图1a:T2WI胆囊壁局限性增厚(箭头);图1b:CT平扫,胆囊壁弥漫性增厚。图2a MR增强门脉期显示胆囊黏膜线连续。图2b CT增强扫描动脉期显示胆囊黏膜局部中断(箭头)。图3 邻近结构浸润。图3a,3b分别是CT平扫及增强动脉期,显示邻近肝实质受累及,增强后强化程度低于正常肝实质。Figure 1. Gallbladder wall thickening.Figure 1a:T2WI shows localized thickening of gallbladder wall(arrow);Figure 1b:CT shows diffuse thickening of gallbladder wall. Figure 2a. Mucosa is enhanced continuously on MR. Figure 2b. Mucosa is enhanced incontinuously on CT. Figure 3. Adjacent structure infiltration.Figure 3a,3b show the adjacent liver of XGC is invaded and its density decreases after enhancement.

图4 胆囊壁内结节。图4a:CT平扫示壁内结节低密度(箭头)。图4b:T2WI脂肪抑制序列示壁内结节呈低信号(箭头)。图4c:T1WI示同相位高信号(箭头)。图4d:T1WI示反相位低信号(箭头)。图4e:脂肪序列呈高信号(箭头)。图4f:T2WI序列,胆囊内多发结石,表现为低信号(箭头)。Figure 4. Nodules in gallbladder.Figure 4a~4e show nodules in gallbladder in different sequences(arrows);Figure 4f:stones of gallbladder on T2WI(arrow).
3 讨论
XGC是一种特殊类型的胆囊慢性炎症,占胆囊炎性病变的 0.7%~13.2%[1-2],60~70 岁女性好发,男女发病率比2∶1[3],80%的患者合并胆囊结石,诊断金标准是病理发现泡沫细胞、炎性细胞及纤维母细胞。该病临床表现无特异性,呈浸润性生长,累及邻近结构,引起穿孔、脓肿、瘘管形成,有时与胆囊癌很难鉴别。由于二者手术方式不同,一般胆囊癌需扩大胆囊切除范围并进行周围淋巴结清扫,而XGC只需切除胆囊,所以术前明确诊断至关重要[4]。
3.1 XGC的病因与发病机制
关于XGC的病因与发病机制,目前尚未达成一致[5]。多数学者认同的观点是:急性胆囊炎及胆囊结石所致的梗阻导致胆囊黏膜溃疡、罗-阿窦破裂,胆汁渗入胆囊壁刺激T淋巴细胞发生免疫反应,胆汁被降解为胆固醇与脂质,经过巨噬细胞吞噬形成富含脂质的泡沫样细胞,病程进展,大量成纤维细胞形成黄色肉芽肿。另有学者认为,XGC多合并高脂血症,高脂血症引起血粘度增高,所以该病与代谢系统紊乱有关[6]。
3.2 胆囊壁增厚
XGC患者胆囊壁弥漫性或局限性增厚,前者居多[2-3],本研究结果与其一致,胆囊壁弥漫性增厚22例,占78.57%。对于胆囊壁弥漫性或局限性增厚的判断标准,目前尚无定论,部分文献以胆囊周长的50%为标准[5,7],另有文献以 60%为标准[8]。鉴于 60%标准难以权衡,故本文定义胆囊壁增厚大于胆囊周长的50%为弥漫性增厚。胆囊壁弥漫性增厚是XGC的影像学特点之一。
3.3 胆囊壁内结节
胆囊壁内结节,即黄色肉芽肿,是由泡沫状组织细胞、肉芽肿性炎性细胞及淋巴细胞等组成,CT上显示为低密度,MR表现不同,T1WI低或高信号,T2WI高信号,依结节成分而异。新鲜病灶炎症、坏死为主,陈旧病灶纤维组织及泡沫细胞为主,因此强化程度各异。很多文献[4-5]显示,胆囊壁内低密度结节是XGC的特征表现,但是本研究结果显示胆囊壁内结节10例,占35.71%,而且笔者工作中发现XGC典型的壁内结节并不多见,因此很难将其与胆囊癌鉴别。究其原因,可能是对该结节认识不足及影像学显示欠佳。笔者认为,MR化学位移梯度回波序列有助于发现胆囊壁内结节,T1WI同相位结节为高信号,反相位低信号,脂肪相显示高信号,与Zhao等[7,9]观点一致。其特异性高,但是敏感性不够。
3.4 胆囊/胆管结石
XGC常可见胆囊结石和/或胆管结石[2,7],结石所致梗阻可能是XGC的病因之一,本组资料中胆囊/胆管结石21例,占75%,但是,该征象不是XGC特有表现。
3.5 胆囊壁强化特点及黏膜线是否连续
多数研究[1,4-5]显示,XGC 增厚的胆囊壁呈“三明治”样强化特点,即胆囊壁的浆膜层、黏膜层强化,中间的肌层不强化,而且胆囊黏膜线多连续,该征象对鉴别XGC与胆囊癌有价值,因为后者起源于胆囊上皮,癌细胞过度增生破坏胆囊黏膜层导致粘膜线不连续。本研究中黏膜线连续者25例,占89.29%,与既往研究相符。其中,黏膜线不连续者可能是因为炎症进展,其黏膜层出现溃疡,导致部分黏膜剥脱,增强检查时显示黏膜线中断[5]。
3.6 邻近结构浸润
XGC因其浸润性生长的特点常累及周围组织,以致于部分腹腔镜手术受视野限制而改为开放式手术[10],本组资料中有2例因为粘连严重改变术式。肝脏组织受累表现为强化程度比正常肝实质低,可能是因为肝实质充血或胆囊静脉血流增加直接回流至肝实质所致[4]。值得注意的是,胆囊癌也会累及邻近肝实质,增强后可见强化。笔者认为二者区别点在于MR弥散加权序列,胆囊炎所致肝实质病变表现为水肿,因此弥散不受限,而胆囊癌的肝实质因肿瘤侵犯弥散受限。
3.7 XGC与胆囊癌的鉴别
XGC虽有其特征性,但是仍难与厚壁型胆囊癌鉴别。有文献[5]认为胆囊壁最厚与最薄处比值>2且黏膜线消失、内壁凹凸不平时,胆囊癌的可能大。也有文献[11]指出,XGC患者肝内胆管一般不扩张,都有淋巴结肿大,胆囊癌患者淋巴结肿大只占41%;XGC和胆囊癌可并存,原因不明。CA19-9升高患者不能轻易诊断为胆囊癌,本组28例患者中,24例患者检查了CA19-9指标,其中14例患者CA19-9高于正常值,占58.3%,另外10例患者处于正常水平。在24例患者中,有3例患者在XGC急性发作时CA19-9 明显升高(最高者>12 000 U/mL),感染控制后降至正常。对于确诊困难的患者,术前超声或CT引导下穿刺活检及术中冰冻可能避免误诊[2]。但是,其存在不足,如细针穿刺部位不准确,穿刺针道及穿刺出血可引起癌细胞转移等,所以临床医生需权衡利弊,慎重决定。
3.8 本研究的局限性
本研究属于回顾性研究,病例选择存在偏倚,因为相关病例都是手术和病理证实的,所以结果不能反映黄色肉芽肿性胆囊炎的整个疾病谱;由于图像解读具有一定的主观性,图像质量的同一性和客观性不能完全保证。病例样本数有限。
综上,典型的XGC特点明确,包括胆囊壁弥漫性增厚、增强后黏膜线连续、胆囊壁内结节及胆囊/胆管结石等,但是实际工作中所见病例多不具备典型征象,影像诊断关系到临床手术方式,仍需结合临床资料仔细观察鉴别。此外,本研究样本量有限,需要进一步大样本资料证实。
[1]Han SH,Chen YL.Diagnosis and treatment of xanthogranulomatouscholecystitis:a report of 39 cases[J].Cell Biochem Biophys,2012,64(2):131-135.
[2]张维,邱伟,范国华.黄色肉芽肿性胆囊炎的CT表现与临床病理分析[J].实用放射学杂志,2014,30(10):1680-1682.
[3]Singh VP,Rajesh S,Bihari C,et al.Xanthogranulomatouscholecystitis:what every radiologist should know[J].World J Radiol,2016,8(2):183-191.
[4]王建美,杨宏远,纪建美,等.黄色肉芽肿性胆囊炎的诊断及鉴别诊断[J].医学影像学杂志,2013,23(11):1729-1732.
[5]马黎斌,夏进东,林江,等.黄色肉芽肿性胆囊炎影像学表现及其病理学基础[J].临床放射学杂志,2013,32(7):991-995.
[6]张旭日,崔乃强,赵二鹏,等.45例黄色肉芽肿性胆囊炎临床治疗分析[J].中国中西医结合外科杂志,2011,17(4):352-354.
[7]Zhao F,Lu X,Yan SX,et al.CT and MR features of xanthogranulomatouscholecystitis:an analysis of consecutive 49 cases[J].Eur J Radiol,2013,82(12):1391-1397.
[8]王建良,朱玉春,邢伟,等.黄色肉芽肿性胆囊炎与厚壁型胆囊癌的螺旋 CT 鉴别诊断[J].临床放射学杂志,2015,34(1):74-78.
[9]Lee ES,Kim JH,Joo I,et al.Xanthogranulomatous cholecystitis:diagnostic performance of US,CT,and MRI for differentiation from gallbladder carcinoma[J].Abdom Imaging,2015,40(12):2281-2292.
[10]Memon AA,Abro AH,Pathan AH,et al.Xanthogranulomatous cholecystitis(XGC)—a diagnostic dilemma[J].J Liaquat Uni Med Health Sci,2015,14(3):115-119.
[11]吴晔,王震侠,宝力道,等.黄色肉芽肿性胆囊炎误诊为胆囊癌的临床分析 (附2例报道)[J].中国普外基础与临床杂志,2013,20(2):206-208.
CT/MR features of granulomatous cholecystitis
LI Wei-wei1,YU Ri-sheng2,CUI Feng1
(1.Department of Radiology,Hangzhou Hospital of Traditional Chinese Medicine,Hangzhou 310007,China;2.Department of Radiology,the Second Affiliated Hospital of Zhejiang University School of Medicine,Hangzhou 310009,China)
Objective:The purpose of this study is to discuss the features of xanthogranulomatouscholecystitis(XGC)on CT/MR.Methods:Twenty-eight patients were proven XGC by surgery and pathology,and CT/MR manifestations were analyzed.Results:On CT or MRI,gallbladder wall thickening was shown in all 28 cases(100%),diffuse thickening was in 22cases(78.57%),and stones of gallbladder/bile duct were shown in 21cases(75%),with nodules in gallbladder in 10 cases(35.71%),continuous mucosal line enhancement in 25 cases(89.29%),and adjacent structure infiltration in 24 cases(85.71%),respectively.Conclusion:The co-existence of gallbladder wall diffuse thickening,continuous mucosal line enhancement,nodules in gallbladder and stones of gallbladder/bile duct are characteristics of XGC.
Cholecystitis;Granuloma;Tomography,spiral computed;Magnetic resonance imaging
R575.61;R814.42;R445.2
A
1008-1062(2017)08-0564-04
2016-10-19;
2017-02-14
李伟伟(1986-),女,河北衡水人,住院医师。E-mail:mosuoruoma@163.com
崔凤,杭州市中医院放射科,310007。E-mail:feng6812@163.com
