丙酮酸激酶M2蛋白表达与各期胃癌临床病理特征及预后的相关性分析
2017-12-06陈光侠何晓华吴倩倩高立永吴传楠陈卓
陈光侠 何晓华 吴倩倩 高立永 吴传楠 陈卓
·论著·
丙酮酸激酶M2蛋白表达与各期胃癌临床病理特征及预后的相关性分析
陈光侠 何晓华 吴倩倩 高立永 吴传楠 陈卓
目的观察丙酮酸激酶M2(PKM2)蛋白在胃癌组织表达及其与胃癌临床病理特征及预后的相关性。方法浅表性胃炎病人20例(对照组),早期胃癌组32例,进展期胃癌组40例。应用免疫组化技术检测PKM2蛋白在上述组织中表达情况,并统计分析其表达强度与临床病理特征和预后的关系。结果对照组和早期胃癌组中PKM2阳性表达率分别为5%(1/20)和61.8%(21/34),差异有统计学意义(P<0.05)。进展期胃癌组织中PKM2蛋白表达水平与TNM分期、病理分级相关,差异有统计学意义(P<0.05)。早期胃癌PKM2表达强度越高,预后越差(P<0.05);TNM分期是进展期胃癌预后的独立影响因素(P<0.05)。结论PKM2蛋白在胃癌组织中表达升高,促进胃癌的发生发展,并影响病人预后。PKM2蛋白表达与进展期胃癌TNM分期、病理分级相关。
胃癌; 丙酮酸脱氢酶2; 临床病理特征; 预后
有研究表明,丙酮酸激酶M2(pyruvate kinase M2,PKM2)的高表达可促进肝癌的转移,并可作为预后不良的指标,但对非小细胞肺癌的预后评估却毫无价值[1-2]。PKM2可通过调控转录水平Bcl-xL表达从而促进胃癌细胞生长[3]。我们应用免疫组化技术检测20例浅表性胃炎,32例早期胃癌及40例不同分期的进展期胃癌PKM2蛋白的表达,并分析其表达与胃癌临床病理特征及预后的关系。
对象与方法
一、对象
2006年1月~2013年12月,我院行胃癌切除的胃癌组织标本40例(进展期胃癌组),行早期胃癌外科切除的早期胃癌标本32例(早期胃癌组),内镜下活检浅表性胃炎组织标本20例(对照组),术前均未行放疗、化疗及免疫治疗。共92例,其中男性45例,女性47例。年龄21~80岁,平均年龄55.39岁。胃癌的诊断标准及临床分期参照文献[4],早期胃癌诊断标准参照文献[5]。
二、方法
20例浅表性胃炎、32例早期胃癌及40例进展期胃癌组织蜡块连续切片,采用免疫组化SP法,按照烤片、水化、抗原修复、封闭,1∶1000比例稀释PKM2一抗,过夜后加入二抗,DAB显色、苏木素衬染、酒精分化,脱水,透明、中性树胶封片、显微镜观察等步骤进行。兔抗人PKM2抗体均购自Abcam公司,SP检测试剂盒及DAB显色液均购自北京中杉金桥生物技术有限公司。PKM2以胞浆出现棕黄色颗粒为阳性,每张切片由2位资深病理专家读片,于400倍视野下随机选取5个不同视野,每个视野得分由阳性细胞比例或显色强度决定。阳性细胞比例≤25%为0分,26~50%为1分,51~75%为2分,≥76%为3分;显色强度未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。
三、统计学处理
应用SPSS 22.0软件对数据进行分析,多组间比较采用单因素方差分析,PKM2表达强度与临床病理因素之间的关系应用Chi-square test或确切概率法,与生存时间的关系采用Kaplan-Meier生存率曲线,运用COX回归模型进行多因素比例风险分析。P<0.05为差异有统计学意义。

结 果
1.PKM2在对照组、早期胃癌组和进展期胃癌组中表达:均值分别为0.05、1.067、1.316,早期胃癌组及进展期胃癌组中PKM2表达水平与对照组比较,差异有统计学意义(P<0.05)。PKM2的表达水平在早期胃癌组即明显升高,当肿瘤继续发展至进展期,虽然其表达水平继续升高,但在进展期胃癌组与早期胃癌组相比,差异无统计学意义(P>0.05)(图1)。
2.PKM2表达与临床病理参数的关系:早期胃癌组织中PKM2表达阳性21例,阴性11例。PKM2表达与病人年龄、性别、病理分级无明显相关,差异无统计学意义(P>0.05),见表1。进展期胃癌组织中PKM2表达阳性28例,阴性12例。PKM2表达与TNM分期、病理分级相关,差异有统计学意义(P<0.05),与年龄、性别无明显相关,差异无统计学意义。见表2。

表1 早期胃癌中PKM2表达与临床病理参数的关系(例)
注:统计方法为确切概率法
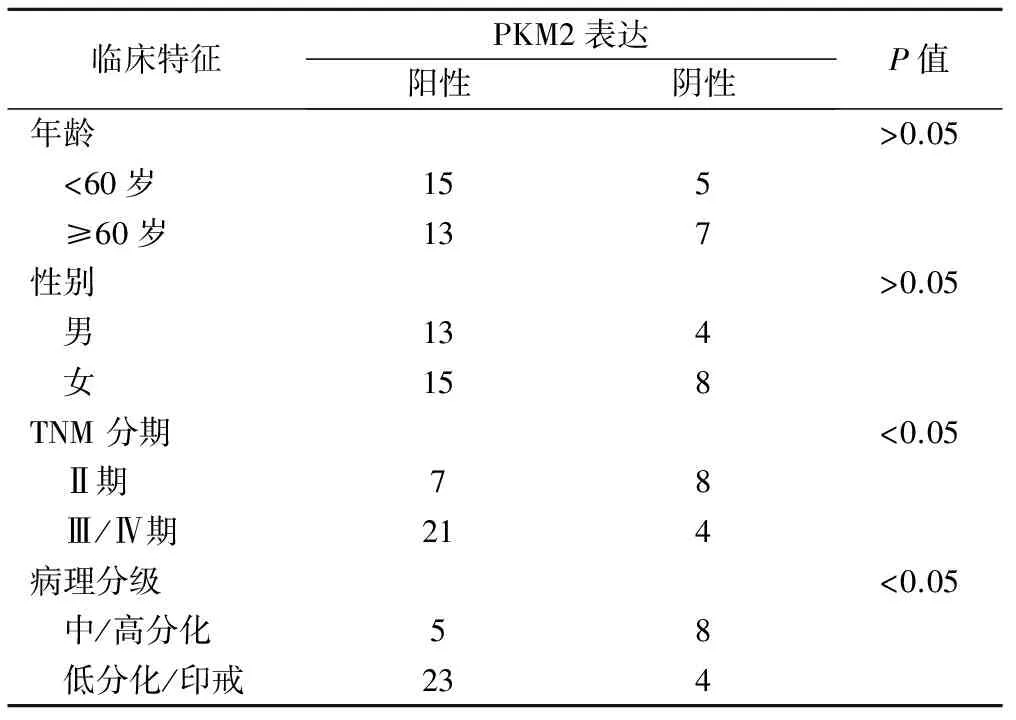
表2 进展期胃癌中PKM2表达与临床病理参数的关系(例)
注:统计方法为Chi-square test
3.PKM2表达与病人预后的关系:所有病例随访时间48~94个月,平均72.9个月。20例浅表性胃炎组病人全部完成随访,无死亡,存活率100%。32例早期胃癌组病人全部随访完成,随访率100%,因病死亡3例,采用Kaplan-Meier法对PKM2表达进行累积生存时间分析;PKM2表达强度越高,预后越差(P<0.05)。见图2A。40例进展期癌病人,失访23例,失访率57.5%,存活10例,死亡7例,死亡率17.5%,同样采用Kaplan-Meier法对PKM2表达进行累积生存时间分析,PKM2表达与预后无明显相关(P>0.05)。见图2B。

(A)早期胃癌PKM2表达强度越高,预后越差(χ2=11.677,P=0.009);(B)进展期胃癌PKM2表达强度与预后无关。图2 不同分期胃癌PKM2表达强度与病人预后的关系
4.胃癌病人生存时间的多因素分析:运用COX回归多因素模型分别对早期胃癌及进展期胃癌各因素进行分析,各变量赋值如下:年龄:<60岁赋值为0,≥60岁赋值为1;性别:女赋值为0,男赋值为1;TNM分期:Ⅰ/Ⅱ期赋值为0,Ⅲ/Ⅳ期赋值为1;病理类型:中高分化赋值为0,低分化/印戒细胞癌赋值为1;PKM2表达:无表达赋值为0,有表达赋值为1;T表示病人生存时间,单位为月;Y表示病人结局:死亡赋值为0,截尾赋值为1(早期胃癌组无TNM分期,病理类型:中高分化及瘤变赋值为0,低分化/印戒细胞癌赋值为1)。结果发现:早期胃癌COX回归多因素模型分析,各协变量对病人生存时间的影响差异无统计学意义(P>0.05)。进展期胃癌COX回归多因素模型(P<0.05),此检验模型具有统计学意义,TNM分期是进展期胃癌预后的独立影响因素(P<0.05)。在进展期胃癌中各协变量在均值时的生存曲线见图3。

图3 进展期胃癌中各协变量在均值时的生存曲线
讨 论
全球范围内,胃癌是第3位癌症相关的死亡原因[6]。我国胃癌的发病率处于恶性肿瘤的第2位。肿瘤的增殖、浸润、转移等生物学行为是引起死亡的重要原因。肿瘤维持其恶性生物学行为需要充足的能量供给,糖代谢是肿瘤最主要的供能方式。根据“Warburg效应”,肿瘤细胞在缺氧或不缺氧条件下,都优先进行糖酵解[7],PKM2是糖酵解的关键酶[8]。有研究表明,在食管鳞癌组织中,PKM2表达升高,且与病人预后不良有关。PKM2亦可促进胃癌细胞增殖,影响病人预后[9-10]。因此,靶向PKM2信号通路成为一种重要的抗肿瘤治疗策略[11]。
我们通过免疫组化发现,PKM2的表达水平在对照组仅有1例呈阳性表达,早期胃癌组即明显升高,与对照组比较差异有统计学意义。说明在早期胃癌,肿瘤就开始依靠着高水平的糖酵解提供生长代谢的能量来源,而当胃癌继续发展至进展期,其表达水平继续升高,但与早期胃癌组比较,差异无统计学意义,说明糖酵解的供能方式贯穿在整个胃癌的进展过程中。行Kaplan-Meier法进行累积生存分析发现,在早期胃癌组织中,PKM2表达强度越高,预后越差。进展期胃癌预后差,5年生存率低,失访率高。通过COX回归多因素模型分析,在进展期胃癌组织中,TNM分期的相对危险度是8.925,是预后的独立影响因素。TNM分期能够较好的反映肿瘤进展的程度,TNM分期越高,病人预后越差。Angelov等[12]回顾性研究统计分析155例胃癌病人预后与临床病理参数(包括年龄,性别,血型,肿瘤分化程度,肿瘤位置,手术类型和辅助治疗)之间的关系,结果发现,TNM分期是影响病人预后的唯一因素。在进展期胃癌组织中,PKM2表达与TNM分期和病理分级有相关性,但在进一步的COX多因素模型分析中,却无统计学意义,可能与各协变量之间相互作用及病例样本量较少有关。
PKM2在胃癌的发生和发展中起到重要作用,阻断其信号通路,有可能成为肿瘤治疗的靶点。有研究表明,二甲双胍可通过抑制HIF1α/PKM2信号通路,从而抑制肿瘤糖代谢,进一步抑制肿瘤恶性生物学行为[13]。对内镜下活组织检查或术后组织切片免疫组化检测,PKM2可作为判断早期胃癌病人预后的有用指标。
[1] Liu WR,Tian MX,Yang LX,et al.PKM2 promotes metastasis by recruiting myeloid-derived suppressor cells and indicates poor prognosis for hepatocellular carcinoma[J].Oncotarget,2015,6(2):846-861.
[2] Kobierzycki C,Pula B,Werynska B,et al.The lack of evidence for correlation of pyruvate kinase M2 expression with tumor grade in non-small cell lung cancer[J].Anticancer Res,2014,34(7):3811-3817.
[3] Kwon OH,Kang TW,Kim JH,et al.Pyruvate kinase M2 promotes the growth of gastric cancer cells via regulation of Bcl-xL expression at transcriptional level[J].Biochem Biophys Res Commun,2012,423(1):38-44.
[4] 胡祥.胃癌的临床分期及其重要意义[J].中国实用外科杂志,2011,31(8):652-656.
[5] 廖专,孙涛,吴浩,等.中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)[J].中华消化杂志,2014,34(7):433-448.
[6] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[7] Warburg O.On the origin of cancer cells[J].Science,1956,123(3191):309-314.
[8] Chaneton B,Gottlieb E.Rocking cell metabolism:revised functions of the key glycolytic regulator PKM2 in cancer[J].Trends Biochem Sci,2012,37(8):309-316.
[9] Zhang X,He C,He C,et al.Nuclear PKM2 expression predicts poor prognosis in patients with esophageal squamous cell carcinoma[J].Pathol Res Pract,2013,209(8):510-515.
[10] Kwon OH,Kang TW,Kim JH,et al.Pyruvate kinase M2 promotes the growth of gastric cancer cells via regulation of Bcl-xL expression at transcriptional level[J].Biochem Biophys Res Commun,2012,423(1):38-44.
[11] Gupta V,Wellen KE,Mazurek S,et al.Pyruvate Kinase M2:Regulatory Circuits and Potential for Therapeutic Intervention[J].Curr Pharm Des,2014,20(15):2595-2606.
[12] Angelov KG,Vasileva MB,Grozdev KS,et al .Clinical and pathological characteristics,and prognostic factors for gastric cancer survival in 155 patients in Bulgaria[J].Hepatogastroenterology,2014,61(136):2421-2424.
[13] Chen G,Feng W,Zhang S,et al.Metformin inhibits gastric cancer via the inhibition of HIF1α/PKM2 signaling[J].Am J Cancer Res,2015,5(4):1423-1434.
AcorrelationanalysisoftheexpressionofpyruvatekinaseM2andthepathologyandprognosisingastriccancer
CHENGuangxia,HEXiaohua,WUQianqian,etal.
(DepartmentofGastroenterology,DepartmentofPathology,FirstPeople'sHospitalofXuzhou,Xuzhou221000,China)
ObjectiveTo observe the expression of pyruvate kinase(PK)M2 in gastric cancer(GC)and analyze its relation with the clinicopathological features and prognosis and of GC.MethodsTwenty cases with superficial gastritis were made as control group,32 cases with early gastric carcinoma and 40 cases with advanced GC were made as experiment groups.Immunohistochemistry were used to detect the protein expression of PKM2 in GC tissues from the three groups.And the correlation between the expression level of PKM2 and clinicopathological characteristics and prognosis was analyzed.ResultsThe expression of PKM2 in the control group and early GC group was 5.0%(1/20)and 61.8%(21/34),respectively,the difference was significant(P<0.05).The expression level of PKM2 was associated with TNM stage(P<0.05)and pathological grade(P<0.01)in the advanced GC group.The higher expression of PKM2 in early GC suggested its poorer prognosis(χ2=11.677,P=0.009).And TNM staging was an independent factor affecting the prognosis of advanced GC(P<0.05).ConclusionThe expression of PKM2 in GC tissue promotes the occurrence,development of GC and impacts on its prognosis.It is associated with TNM stage and pathological grade in advanced GC.
gastric cancer; pyruvate kinase M2; clinicopathological features; prognosis
10.3969/j.issn.1005-6483.2017.11.019
国家自然科学基金青年项目(81602101);江苏省333工程科研项目资助(BRA2016277);江苏大学医学临床科技发展基金(JLY20160145);江苏省卫生厅科技计划基金(Q201413);徐州市科技计划项目(社会发展- KC14SH007),徐州市卫计委青年后备人才资助(2014002)
221002 江苏省徐州市第一人民医院消化科(陈光侠、何晓华、吴倩倩、吴传楠、陈卓);病理科(高立永)
何晓华,Email:hexiaohua00@126.com
2017-04-12)
杨泽平)