高效液相色谱内标法测定三叶青块根中槲皮素和β-谷甾醇的含量
2017-12-06何丽针姜文娟徐国茂吴金刚
何丽针,夏 骏,姜文娟,徐国茂,李 勇,吴金刚
(1.江西医学高等专科学校,江西上饶 334000;2.江西省兽药饲料监察所,江西南昌330096)
高效液相色谱内标法测定三叶青块根中槲皮素和β-谷甾醇的含量
何丽针1,夏 骏2,姜文娟2,徐国茂2,李 勇2,吴金刚2
(1.江西医学高等专科学校,江西上饶 334000;2.江西省兽药饲料监察所,江西南昌330096)
为了准确测定三叶青块根中槲皮素和β-谷甾醇的含量,本实验以甲醇-盐酸水为提取溶剂,利用回流法对不同产地的三叶青块根中有效成份进行了提取,建立并采用高效液相色谱-内标法对提取物中槲皮素和β-谷甾醇含量进行了测定。结果表明:槲皮素和β-谷甾醇之间分离度大于1.5,两者的线性范围为0.5~50μg/mL,相关系数均大于0.999。槲皮素、β-谷甾醇的检测限分别为0.2mg/kg和0.5mg/kg,回收率分别为88.3-108.3%及80.1-103.3%,RSD分别为2.8~4.3%和5.5~7.2%。该方法具有良好的回收率和重复性,能够对三叶青块根中的槲皮素和β-谷甾醇实现准确、快速的测定。
高效液相色谱法;内标法;三叶青;槲皮素;β-谷甾醇
三叶青为葡萄科崖爬藤属植物三叶崖爬藤的块根或全草,其具有抗肿瘤、清热解毒、祛风化痰、活血止痛作用,可用于治疗小儿高热惊厥、肺炎及各类肿瘤的辅助治疗[1]三叶青的主要活性成份包括黄酮类、甾体类化合物和氨基酸[2]等,其中有实验表明,槲皮素和β-谷甾醇在三叶青中含量较高,且具有特定药理作用[3]。目前国内对于三叶青中该两种活性成份的含量测定方法有一定的研究,许文[4[5]利用高效液相色谱法同时测定三叶青中槲皮素和β-谷甾醇的方法未见报道。本实验采用了高效液相色谱结合内标物定量方法应用于三叶青块根中槲皮素和β-谷甾醇的同时测定,并对不同产地的三叶青含量进行了测定。
1 材料与方法
1.1 仪器与试剂
三叶青块根,人工栽培品种,于2015年4月分别购自于湖南省长沙市,湖北省武汉市及浙江省杭州市。
槲皮素标准品(纯度大于99.0%)、大黄素甲醚内标物(纯度大于99.0%)和β-谷甾醇标准品(纯度不低于99.1%),中国食品药品检定研究院;盐酸(分析纯)、三氯甲烷(分析纯),西陇化工股份有限公司;甲醇(色谱纯),霍尼韦尔试剂有限公司(韩国);
1260高效液相色谱仪,美国安捷伦公司;BS224S电子天平,北京赛多利斯仪器系统有限公司;RE52CS1旋转蒸发仪,上海亚荣生化仪器厂;实验室纯水系统,法国威立雅有限公司。
1.2 标准溶液配制
(1)标准储备液:分别准确称取标准品槲皮素、β-谷甾醇及内标大黄素甲醚各10.00mg,置于10mL容量瓶中,用甲醇溶解并稀释到刻度,摇匀,制成1000.0μg/mL标准储备液。
(2)标准工作液:分别准确量取槲皮素、β-谷甾醇标准储备液、大黄素甲醚内标标准储备液0.1mL,置于10mL容量瓶中,用甲醇溶解并稀释到刻度,摇匀,制成10.0μg/mL标准工作液。
1.3 提取
取三叶青块根,粉碎,过三号筛。取本品约0.5g,精密称定,置100mL圆底烧瓶中,加大黄素甲醚标准储备液0.05mL,混匀。加甲醇-25%盐酸(1∶4,v/v)溶液 25mL,回流提取 1 h,滤过。将滤纸上残渣洗入圆底烧瓶后,重复上述步骤提取2次。合并提取液,55℃下旋转蒸干。用三氯甲烷20mL复溶,旋转蒸干。用甲醇5mL复溶,经0.45μm微孔滤膜过滤,上机测定。
1.4 色谱条件
色谱柱为Agilent Paroshell EC-C18(4.6×50 mm,2.7μm);流动相A为纯水,B为甲醇;梯度洗脱程度见表1;柱温25℃,流速0.7ml/min,进样量5μl,波长210 nm;内标法定量。
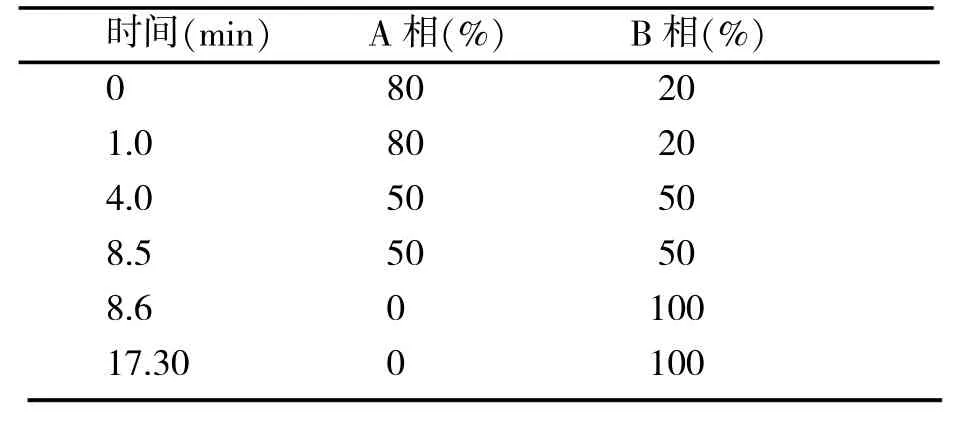
表1 梯度洗脱程序
1.5 标准曲线绘制
准确量取一定量的标准储备液配制成0.5、1.0、5.0、10.0、20.0、50.0 μg/mL 的标准溶液,其中大黄素甲醚内标浓度均为10.0μg/mL。按照1.4中的色谱条件测定峰面积与内标峰面积比值。以峰面积比为纵坐标,质量浓度为横坐标进行回归,绘制槲皮素和β-谷甾醇的标准曲线并计算回归方程。
2 结果与分析
2.1 波长和内标的选择结果
根据相关文献报道,槲皮素有三组紫外吸收峰,波长分别为 210,250,360 nm[7],为了能够达到实验目的,对两种物质的紫外光谱进行扫描,结果发现,在210 nm处两种物质均有吸收,故采用210 nm波长。紫外光谱扫描结果见图1。
由于槲皮素和β-谷甾醇的分子极性差异较大,经试验大黄素甲醚的极性介于两者之间[8],不会对目标峰产生干扰,在波长210 nm处有较大吸收,且三叶青中不含有该成份[9,10],因此选择大黄素甲醚作为该实验的内标物质。
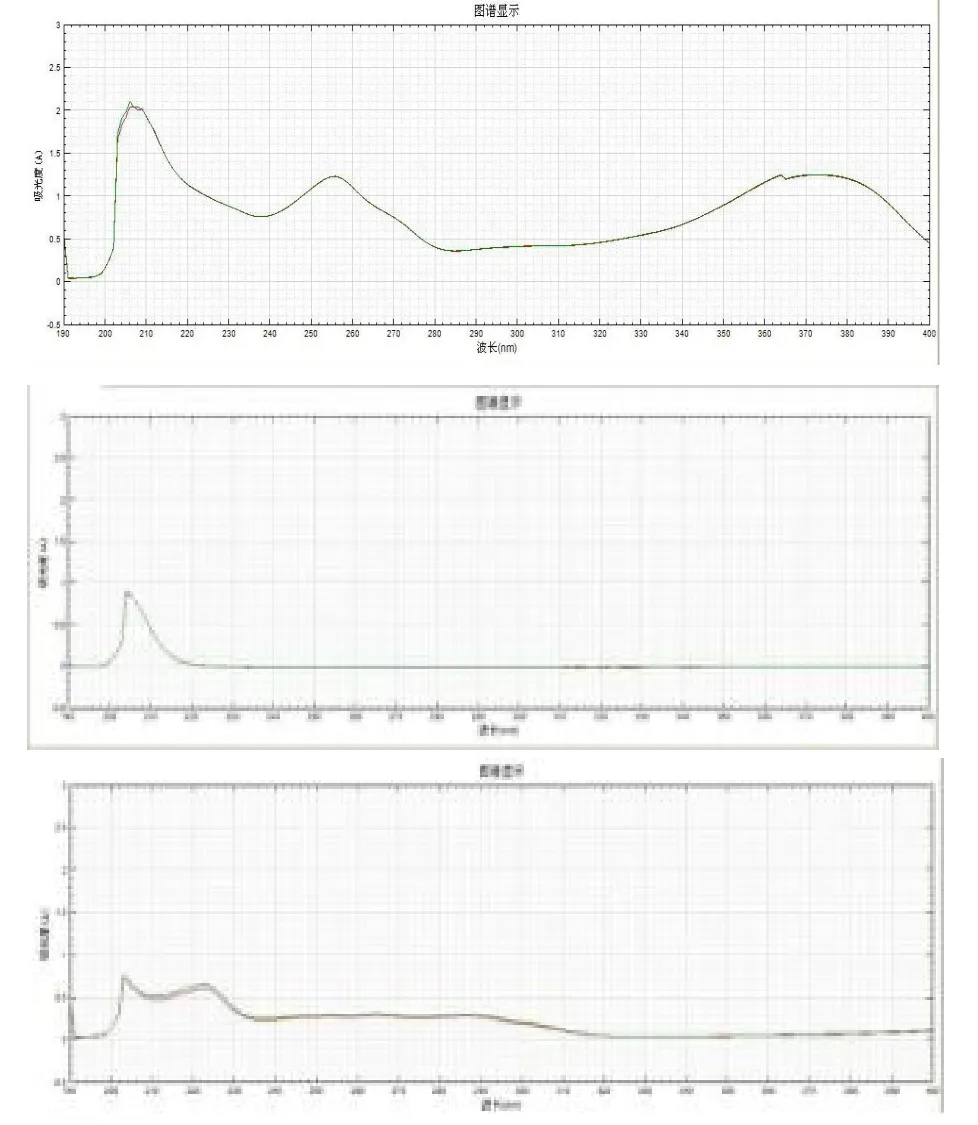
图1 槲皮素与β-谷甾醇紫外光谱图
2.2 标准曲线
以峰面积比为纵坐标,质量浓度为横坐标,绘制槲皮素和β-谷甾醇的标准曲线,分别得出槲皮素的回归方程为y=1.7385x-0.2742,R2=0.9994;β-谷甾醇的回归方程为 y=0.1649x-0.0012,R2=0.9996。
2.3 灵敏度和精密度
以2~5倍基线噪音响应对应的浓度测定混合标准样,以3倍信噪比(S/N)折算前处理方法估算方法检出限,槲皮素的检出限为0.2mg/kg,β-谷甾醇的检出限为0.5mg/kg。混合标准样及样品色谱图如图2所示。
精密吸取标准工作液5μl,连续进样6次,测定槲皮素和β-谷甾醇的峰面积比。结果测得,槲皮素峰面积比RSD为0.68%,β-谷甾醇峰面积比RSD为0.98%。表明仪器及色谱方法和精密度良好。
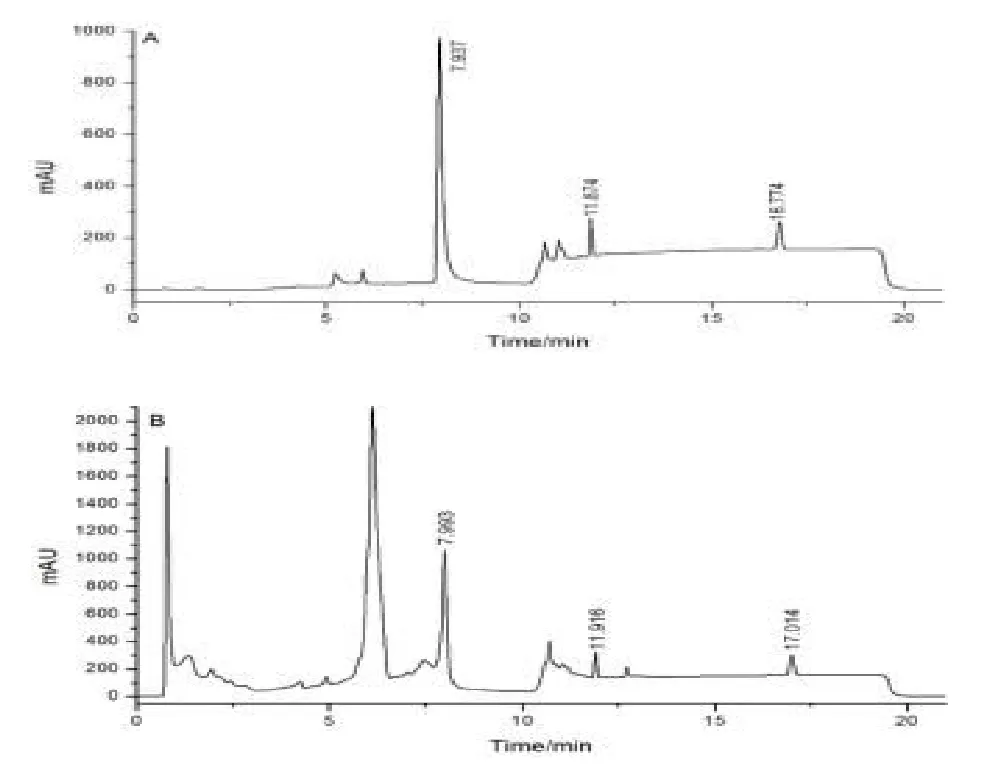
图2 三叶青提取物色谱图
2.4 重复性
随机选取相同三叶青样品5份,按照1.3步骤提取后测定槲皮素和β-谷甾醇的峰面积比。结果显示,槲皮素的峰面积比RSD为2.28%,β-谷甾醇峰面积比RSD为4.32%。
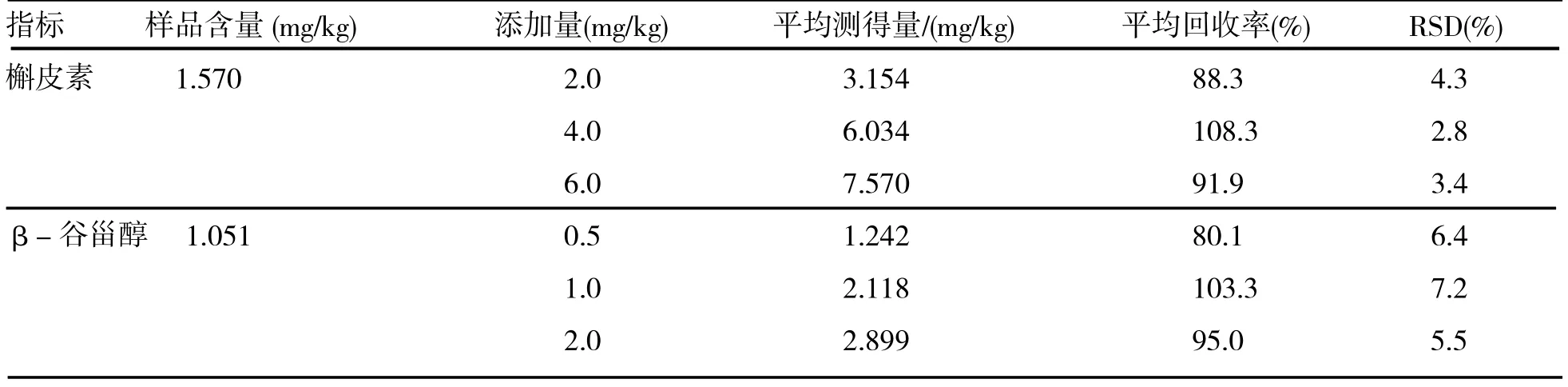
表2 添加回收试验结果(n=3)
2.5 样品测定及回收试验结果
将标准工作液、不同产地的三叶青样品及添加回收样品按照1.3步骤提取后分别进样分析。三个不同产地的三叶青测定结果如表2所示。
选取已知含量的三叶青块根样品0.5g(浙江样品:槲皮素 1.570 mg/kg,β-谷甾醇 1.051 mg/kg),添加一定量的槲皮素及β-谷甾醇对照品,按照1.3步骤提取后进样分析,结果如表3所示。
试验结果表明,槲皮素在添加量为2.0~6.0 mg/kg范围时,回收率为88.3-108.3%,RSD为2.8~4.3%;β-谷甾醇在添加量为 0.5~2.0mg/kg时,回收率在80.1-103.3%,RSD为5.5~7.2%。
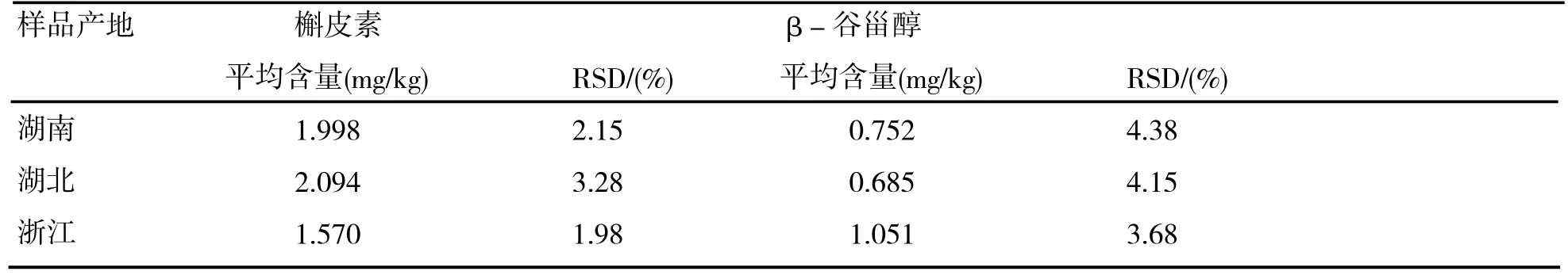
表3 三叶青提取物含量测定结果(n=3)
3 讨论与小结
3.1 提取条件的选择
在样品提取过程中,由于槲皮素极性较强,三叶青中与其极性相近的成份较多,会对色谱分离产生干扰[11,12],因此本实验依次利用甲醇-强酸溶液和三氯甲烷溶液两步液液萃取对三叶青块根进行梯度萃取[13,14],可以有效的去除三叶青中其它杂质的干扰,达到理想的分离效果。
3.2 色谱条件的优化
由于槲皮素与β-谷甾醇的极性差异较大,因此必须采用梯度洗脱方式进行分离。本实验比较了不同比例的乙腈-水、乙腈-磷酸盐、甲醇-水和甲醇-磷酸盐流动相系统。结果表明,当流动相采用100%乙腈时,60min内未观察到β-谷甾醇,只有使用浓度大于90%甲醇的洗脱系统,β-谷甾醇才能够被检测到。同时当甲醇比例大于50%时,样品中槲皮素受其它组份干扰较为严重,无法达到有效分离。因此本实验采用了甲醇-水作为流用相,用梯度洗脱方式进行分离。结果表明其中槲皮素的保留时间约为7.95min,内标大黄素甲醚约为11.90min,β-谷甾醇的保留时间约为16.90min。分离度大于1.5,理论塔板数均大于20000。
但是由于甲醇在210 nm波长处有末端吸收,因此会对其灵敏度产生一定影响,标准品和样品的色谱图表明的10min后基线平台上升的现象也与该因素有关,需要在后续的研究中进一步改进。另外,由于目前对三叶青中黄酮类药物的测定技术较为成熟,因此可在今后的研究中,可对建立三叶青中黄酮类药物和植物甾醇类药物高通量的检测方法进行摸索,并进一步完善三叶青指纹图谱,最终建立三叶青药物的质量标准。
本实验建立了利用高效液相色谱仪对三叶青块根中槲皮素和β-谷甾醇含量测定的方法。该方法采用内标法定量,可有效的消除误差,尤其是提取步骤的偶然误差,使得结果更加准确。同时本实验对方法的线性、灵敏度、精密度、重复性和回收率等进行了考察,并对不同产地的三叶青块根进行了测定。结果表明,该方法相对准确,稳定性强,能够实现对三叶青块根中槲皮素和β-谷甾醇含量的测定。
[1]杨雄志.中药三叶青的药理作用与临床应用.吉林中医药,2009,29(6)∶517-518.
[2]黄真,毛庆秋,魏佳平.三叶青提取物抗炎、镇痛及解热作用的实验研究.中国新药杂志,2005,14(7)∶861-864.
[3]陈丽芸.三叶青化学成分及抗肿瘤活性研究[D].福建中医药大学,2014.
[4]许文,傅志勤,林婧,等.UPLC-MS/MS法同时测定三叶青中10种黄酮类成分[J].药学学报,2014,12∶1711-1717.
[5]刘洋,钱丽华.HPLC法测定三叶青中槲皮素和山奈酚含量研究[J].安微农学通报,2015,21∶26-27
[6]浦锦宝,梁卫青,郑军献,等.HPLC测定三叶青中槲皮素、山奈酚的含量[J].中国中医药科技,2011,2∶134-136
[7]王雅琼,邵强,沙鸥.β-谷甾醇酯化反应过程中的反相高效液相色谱分析[J].扬州大学学报,2005,8∶31-33
[8]闻永举,梁爱军.聚酰胺对大黄素和大黄素甲醚分离研究[J].宜春学院学报,2009,06∶53-54.
[9]陈丽芸,郭素华.三叶青的化学成分及药理作用研究进展[J].浙江中医药大学学报,2012,12∶1368-1370.
[10]林婧,纪明妹,黄泽豪,等.三叶青的化学成分及其体外抗肿瘤活性研究[J].中国药学杂志,2015,08∶658-663.
[11]许文,傅志勤,林婧,等.HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J].中国中药杂志,2014,22∶4365-4372
[12]Xu CJ,DingGQ,Fu JY,etal.Immunoregulatory effects ofethylacetate fraction ofextracts From tetrastigma hemsleyanum dielset.Gilg on immune function of ICR mice[J].Biomed Environ Sci,2008,21∶325-331.
[13]霍昕,杨迺嘉,刘文炜,等.三叶青块根乙醚提取物成分研究[J].药物分析杂志,2008,10∶1651-1653.
[14]程林,胡轶娟,浦锦宝,等.三叶青的高效液相色谱指纹图谱研究[J].浙江中医杂志,2013,4,297-298
S853.7
B
1003-8655(2017)05-0003-03
该项目为2014年高校科学技术研究项目(GJJ14794)。
2017-08-07
何丽针(1965—),女,副教授。研究方向为药物分析化学。
