大黄素对实验性自身免疫性甲状腺炎模型小鼠T细胞亚群和 IFN-γ、IL-4的影响
2017-12-06吴可人叶志鹏
吴可人 叶志鹏 黄 捷 金 法 方 蓉 徐 涛 李 宁
大黄素对实验性自身免疫性甲状腺炎模型小鼠T细胞亚群和 IFN-γ、IL-4的影响
吴可人 叶志鹏 黄 捷 金 法 方 蓉 徐 涛 李 宁
目的 大黄素对实验性自身免疫性甲状腺炎模型小鼠T细胞亚群和IFN-γ、IL-4的影响。方法 通过过量碘剂诱导NOD小鼠建立EAT动物模型,造模4周后各实验组摄入不同剂量的大黄素。造模8周后检测小鼠血浆TgAb水平及甲状腺炎症程度。流式细胞术检测小鼠外周血、脾脏T细胞亚群,分析大黄素对EAT小鼠外周血、脾脏淋巴细胞IFN-γ和IL-4分泌能力的影响。结果 (1)甲状腺病理学观察,大黄素实验组较模型组甲状腺淋巴细胞浸润程度减轻;分级比较有显著性差异(P<0.01);(2)造模后模型组小鼠血浆TgAb水平较对照组明显升高[(44.16±3.59)ng/mL比(11.24±1.52)ng/mL],大黄素实验组升高幅度低于模型组[(26.58±5.24)ng/mL、(19.18±5.73)ng/mL、(23.24±5.47)ng/mL 比(44.16±3.59)ng/mL],各组间有统计学差异(P<0.01);(3)大黄素实验组外周血单核细胞、脾脏淋巴细胞中CD3+CD4+、CD3+CD8+T淋巴细胞的频率较对照组明显升高,外周血单核细胞[(7.72±2.92)%比(4.13±1.45)%,(4.23±1.58)%比(2.76±1.69)%];脾脏淋巴细胞[(7.51±1.31)%比(1.82±1.35)%,(5.59±1.98)%比(0.033±0.034)%],但低于模型组外周血单核细胞[(7.72±2.92)比(17.46±3.71)%,(4.23±1.58)%比(8.92±2.62)%;脾脏淋巴细胞[(7.51±1.31)%比(16.74±4.79)%,(5.59±1.98)%比(11.97±2.21)%](P<0.01);而CD3+CD4+FIN-γ+、CD3+CD4+IL-4+T细胞频率高于对照组但明显低于模型组(P<0.01)。结论 过量碘剂诱导NOD小鼠自身免疫性甲状腺炎造模是可行的;大黄素对造模小鼠甲状腺炎有一定保护作用。大黄素通过抑制CD4+、CD8+T淋巴细胞分化并且抑制IFN-γ和IL-4的分泌,从而抑制造模小鼠的自身免疫反应。
NOD小鼠;实验性自身免疫性甲状腺炎;大黄素;T细胞亚群
自身免疫性甲状腺病(autoimmune thyroid diseases,AITD)是最常见的自身免疫性疾病之一,也是获得性甲状腺功能减退的最常见病因[1]。在人群中AITD的发病率约为1.5%,并多见于女性[2]。目前临床上缺乏有效的治疗药物,迄今为止仅发现极少数物质对实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis,EAT)动物模型有保护作用[3],新的治疗方案和有潜力的药物有待开发。大黄素属蒽醌类衍生物,是中药大黄的重要单体,有一定的免疫抑制作用。本研究探讨大黄素对过量碘剂诱导的EAT动物模型保护作用的机制,为慢性淋巴细胞性甲状腺炎治疗提供一定理论依据。
1 材料与方法
1.1 实验动物 6~8周龄NOD小鼠50只,动物合格证号SCXK(京)2014-0004,购于北京康生物有限公司,体质量18~22g,雌性。动物室保持空气新鲜,相对湿度60%,温度20~24℃,每日光照12h,自由饮食,饮水。动物实验在浙江中医药大学实验动物中心进行。
1.2 试剂与仪器 CD3(批号B103323)、CD4(批号B103824)、CD8(批 号 B103828)、IFN-γ(批 号B585729)、IL-4抗体(批号 B502934)购于 Biolegend公司;小鼠抗甲状腺球蛋白抗体(TgAb)酶联免疫检测试剂盒(批号B20150522)购于乔羽生物有限公司;低速离心机购于Beckman公司;ELISA检测仪购于RAYTO公司;流式细胞仪购于BD公司;显微镜BX51+FL购于OLYMPUS公司。
1.3 动物分组及模型建立 小鼠称重,按随机数字表法分为对照组、模型组、大黄素低、中、高剂量组,每组10只。对照组小鼠饮用去离子水,其他各组小鼠均饮用0.05%碘水(0.64g/L NaI)持续8周[4]。第5周起对低、中、高剂量大黄素组小鼠分别以每日大黄素15mg/kg、75mg/kg、150mg/kg灌胃,对照组和模型组小鼠分别以等量生理盐水灌胃,共处理4周后处死小鼠,取外周血、甲状腺、脾脏。
1.4 标本采集 乙醚麻醉,小鼠麻醉后,眶静脉取血,室温静置6h,3000R/min离心20min,分离血清。颈部正中切口,分离皮肤及肌肉层,暴露器官,显露出甲状腺软骨侧后方的两叶甲状腺。将气管和甲状腺一并取下,迅速剥离甲状腺,冷生理盐水冲洗,滤纸吸干。
1.5 甲状腺病理学检查 小鼠甲状腺组织4%甲醛溶液固定,石蜡包埋,切成4μm切片,苏木素-伊红(HE)染色。采用图像分析计算炎症细胞(子目标面积)与甲状腺组织(目标面积)的比值,参考Tang N[5]的炎症分级标准,0级:正常甲状腺组织;1级:1%以下的甲状腺有淋巴细胞浸润;2级:1~10%淋巴细胞浸润;3级:10~40%淋巴细胞浸润;4级:超过40%淋巴细胞浸润。
1.6 血浆抗小鼠甲状腺球蛋白抗体(TgAb)水平测定 采用ELISA试剂盒双抗体夹心法测定:在各孔加入标准品或样品各100μL,37℃孵育90mim;加入100μL生物化抗体工作液,37℃孵育60min;洗涤3次;加入100μL酶结合物工作液,37℃孵育30min;洗涤5次;加入90μL底物溶液,37℃孵育15min左右;加入50μL终止液,立即在450nm波长测量OD值并计算结果。
1.7 流式细胞术(FCM)测定外周血单核细胞(PBMC)及脾淋巴细胞中的T细胞亚群频率 取模型组、对照组和中剂量大黄素组小鼠外周血及脾脏,分离PBMC及脾淋巴细胞悬液。采用、FCM检测分析三组小鼠外周血单核细胞、脾脏淋巴细胞中CD3+CD4+、CD3+CD8+T淋巴细胞的频率差异。使用50ng/mL佛波酯和1μg/mL离子霉素刺激两种细胞6h后,再利用FCM测试分析各组小鼠外周血单核细胞、脾脏淋巴细胞中 CD3+CD4+IFN-γ+、CD3+CD4+IL-4+T 细胞频率。
1.8 统计学方法 实验数据采用SPSS19.0统计软件进行统计分析,所有数据以均值±标准差(±s)形式表示,不同组间两两比较采用单因素方差分析(One-way ANOVA)中的最小显著性法(LSD)法。P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺病理学检测 模型组小鼠在实验过程中死亡1只,其余各组小鼠均存活至实验结束。显微镜下可见对照组甲状腺滤泡大小较为均匀一致,滤泡上皮细胞为单层立方形或高柱形。模型组滤泡结构紊乱,上皮细胞挤压变扁,间质减少,淋巴细胞浸润明显(见封二图1)。根据炎症分级,模型组、大黄素实验组小鼠高于对照组,且差异有统计学意义(P<0.01);大黄素各实验组与模型组比较炎症有所抑制(P<0.01)。大黄素中剂量组炎症抑制最明显,但与其他实验组相比差异无统计学意义(P>0.05)。见表1。
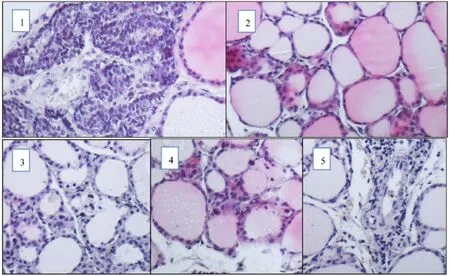
图1 各组小鼠甲状腺组织炎症细胞浸润情况(HE染色 10×10;1.模型组2.对照组3.低剂量组4.中剂量组5.高剂量组)
表1 各组甲状腺病理分级比较(只,±s)

表1 各组甲状腺病理分级比较(只,±s)
注:五组间比较,H=38.347,P<0.01
组别模型组低剂量组中剂量组高剂量组对照组P值鼠数9 1 0 1 0 1 0 1 0甲状腺病理分级4.0 0(3.0 0,4.0 0)3.0 0(2.7 5,3.0 0)2.0 0(2.0 0,3.0 0)3.0 0(2.0 0,3.0 0)0(0,0)<0.0 1
2.2 血浆抗小鼠甲状腺球蛋白抗体(TgAb)水平检测 8周后,小鼠血浆中TgAb浓度,模型组较对照组明显升高(P<0.01)。大黄素各实验组TgAb浓度低于模型组而高于对照组(P<0.01),大黄素中剂量组血浆中TgAb浓度最低,但与其他实验组相比差异无统计学意义(P>0.05),见表 2。
表2 各组血浆抗小鼠甲状腺球蛋白抗体(TgAb)比较(ng/L,±s)

表2 各组血浆抗小鼠甲状腺球蛋白抗体(TgAb)比较(ng/L,±s)
注:与模型组比较,△P<0.01;与对照组比较,**P<0.01
组别模型组低剂量组中剂量组高剂量组对照组统计量(H)P值鼠数9 10 10 10 10 TgAb 44.16±3.59 26.58±5.24△**19.18±5.73△**23.24±5.47△**11.24±1.52 19.254<0.01
2.3 外周血单核细胞及外周血、脾脏淋巴细胞CD3+CD4+、CD3+CD8+T淋巴细胞频率差异 造模后小鼠PBMC与脾淋巴细胞中CD3+CD4+T细胞和CD3+CD8+T细胞相对频率均较对照组明显增加,大黄素实验组增加幅度低于模型组且差异有统计学意义(见表3~4)。相比对照组,在PBMC细胞和脾淋巴细胞中,造模后CD3+CD4+INF-γ+T细胞、CD3+CD4+IL-4+T细胞相对频率均增加,大黄素实验组增加幅度低于模型组(见封二~封三图2~3)。

图2 各组PBMC中CD3+CD4+INF-γ+T细胞和CD3+CD4+IL-4+T细胞频率比较

图3 各组脾淋巴细胞中CD3+CD4+INF-γ+T细胞和CD3+CD4+IL-4+T细胞频率比较
表3 各组PBMC CD3+CD4+T细胞和CD3+CD8+T细胞比较(%,±s)

表3 各组PBMC CD3+CD4+T细胞和CD3+CD8+T细胞比较(%,±s)
注:与对照组比较,**P<0.001;与模型组比较,△P<0.01
组别模型组中剂量大黄素组对照组次数9 10 10 CD3+CD4+T 17.46±3.71**7.72±2.92△4.13±1.45 CD3+CD8+T 8.92±2.62**4.23±1.58△2.76±1.69
表4 各组脾细胞CD3+CD4+T细胞和CD3+CD8+T细胞比较(%,±s)

表4 各组脾细胞CD3+CD4+T细胞和CD3+CD8+T细胞比较(%,±s)
注:与对照组比较,*P<0.05,**P<0.001;与模型组比较,△P<0.001
组别模型组中剂量大黄素组对照组次数9 10 10 CD3+CD4+T 16.74±4.79**7.51±1.31*△1.82±1.35 CD3+CD8+T 11.97±2.21**5.59±1.98**△0.033±0.034
3 讨论
慢性淋巴细胞性甲状腺炎是临床最常见的自身免疫性甲状腺病,以甲状腺内炎症细胞浸润、TgAb和甲状腺多氧化物酶抗体(TPO)的生成为主要特征,受遗传和环境等多种因素影响[6],其确切发病机制尚不明确。本研究通过碘剂诱导NOD小鼠建立EAT动物模型,造模后小鼠甲状腺病理切片光镜下显示滤泡结构紊乱,上皮细胞挤压变扁,间质减少,炎性细胞浸润明显;同时血浆自身抗体水平明显升高,与相关文献结论一致[7],表明过量碘剂诱导造模是成功的。
目前多项体外研究[8-10]表明,大黄素能通过抑制DC成熟、淋巴细胞活化、调节Th1/Th2平衡等途径起到的免疫抑制作用。在本研究中,不同剂量大黄素的摄入减轻了模型动物甲状腺组织炎性细胞浸润程度,血浆TgAb升高幅度下降,证实大黄素对EAT模型动物有一定的保护作用。
CD4+和CD8+T细胞是人体免疫系统中的两种重要免疫细胞,CD4主要表达于辅助T(Th)细胞,是Th细胞TCR识别抗原的共受体,与MHCⅡ类分子的非多肽区结合,参与Th细胞TCR识别抗原的信号转导;而CD8主要表达于细胞毒性T细胞上,通过表面的MHCⅠ分子与CD4等其他免疫细胞的MHCⅡ分子结合,从而识别其他免疫细胞表面结合的抗原物质。在本研究中,造模后各组小鼠PBMC和脾脏淋巴细胞中CD4+和CD8+T细胞相对频率均较对照组明显增加,表明两者都参与了造模小鼠的疾病维持过程,而大黄素通过降低CD4+和CD8+T细胞相对频率的增幅缓解了炎症反应。
细胞因子的种类和细胞因子之间的平衡对Th细胞的分化具有重要的调节作用。初始CD4+T细胞在IFN-γ等的诱导下分化为Th1细胞,分泌IFN-γ。一般认为,IFN-γ可以增强甲状腺上皮细胞HLA-Ⅱ类抗原的表达,触发自身免疫的发生,激活并趋化大量的单核细胞和T淋巴细胞进入甲状腺内,增强细胞毒性作用,促进自身抗体的产生。一些学者认为,IFN-γ表达上调促使CLT患者Th1/Th2细胞平衡向Th1方向偏离,故而CLT患者出现以细胞免疫为主的自身免疫紊乱[11-13]。同样有学者持对立观点,或认为二者作用均衡[14]。本研究中,造模小鼠外周血和脾脏淋巴细胞IFN-γ阳性T细胞频率明显增高,表明造模后T细胞分泌IFN-γ增加,提示Th1细胞分化上调。而PBMC和脾脏淋巴细胞IL-4阳性T细胞频率也有所增高,表明Th2因子也有一定程度的表达上调。YU[15]认为Th1因子在炎症的始发和维持阶段均起到重要作用,而Th2因子可能仅在炎症的维持阶段起作用;也就是说,在甲状腺炎症的维持阶段细胞免疫和体液免疫均参与其中。大黄素干预的造模小鼠,Th1和Th2因子阳性的T细胞频率均低于模型组,表明大黄素对炎症维持阶段的细胞免疫和体液免疫都有一定的抑制作用。
综上所述,在过量碘诱导NOD小鼠EAT模型中,小鼠PBMC和脾淋巴细胞Th1、Th2细胞频率均增加,表明两者可能都参与了炎症维持阶段的疾病发展过程。大黄素能减轻造模后小鼠甲状腺的炎症。大黄素通过抑制CD4+、CD8+T淋巴细胞分化,抑制Th1细胞因子IFN-γ和Th2细胞因子IL-4的分泌,从而在炎症的维持阶段分别抑制造模小鼠的细胞免疫和体液免疫反应。
[1]Shapira Y,Agmon-Levin N,Shoenfeld Y.Geoepidemiology of autoimmune rheumaticdiseases[J].Nat Rev Rheumatol,2010,6(8):468-476.
[2]Kojima K,Asmellash S,Klug CA,et al.Applying proteomicbased biomarker tools for the accurate diagnosis of pancreatic cancer[J].J Gas-trointest Surg,2008,12(10):1683-1690.
[3]Morohoshi K,Osone M,Yoshida K,et al.The sphingosine 1-phosphate receptor modulator FTY720 prevents iodide-induced autoimmune thyroditis in nonobese diabetic mice[J].Autoimmunity,2011,44(16):490.
[4]于秀杰,李庆欣,刘凤华,等.碘过量和甲状腺球蛋白免疫诱发NOD小鼠甲状腺炎的病变特征[J].中华内分泌代谢杂志,2009,25(3):269-273.
[5]Tang H,Mignon-Godefory K,Meroni PL,et al.The effects of a monoclonal antibody to interferon-gamma on experimental autoimmune thyroiditis(EAT):prevention of diseases and decrease of EAT-specific T cells[J].Eur J Immounol,1993,23(1):275-278.
[6]Jacobson EM,Huber A,Tomer Y.The HLA gene complex in thyroid autoimmunity:from epidemiology to etiology[J].J Autoimmune,2008,30(1/2):58-62.
[7]陈雪美,刘焱,范源,等.碘过量与桥本氏甲状腺炎的关系研究进展[J].昆明医科大学学报,2014,35(12):169-174.
[8]林胜璋,荆河,杨潇.大黄素体外抑制人树突状细胞及成熟作用的研究[J].中国中西医结合杂志,2009,29(9):806-809.
[9]王瑞涛,沈乃营,人聪,等.大黄素促进人混合培养淋巴细胞凋亡的实验研究[J].现代肿瘤医学,2010,18(6):1083-1085.
[10]刘昌,刘原兴,吕毅.大黄素体外抑制淋巴细胞增殖的作用研究[J].第四军医大学学报,2006,27(24):2251-2252.
[11] Watanabe M,Yamamoto N,Maruoka H,et al.Independent involvement of CD8+CD25+cells and thyroid autoantibodies in disease severity of Hashimoto’s disease[J].Thyroid,2002,12(9):801-808.
[12] Maloy KJ,Salaun L,Cabill R,et al.CD4+CD25+T(R)cells suppress innate immune pathology through cytokinedependent mechanisms[J].J Exp Med,2003,197(1):111-119.
[13]Vasu C,Dogan RN,Holterman MJ,et al.Selective induction of dendritic cells using granulocyte macrophage-colony stimulating factor,but not fms-like tyrosine kinase receptor 3-ligand,activates thyroglobulin-specific CD4+/CD25+T cells and suppresses experimental autoimmune thyroiditis[J].J Immunol,2003,170(11):5511-5522.
[14]刘通,于振乾,邹红锦,等.MrcroRNA-155在碘致NOD.H-2h4小鼠自身免疫性甲状腺炎发病中的变化研究[J].中国免疫学杂志,2015,31(7):936-941.
[15] YU S,Sharp GC,Braley-mullen H.Dual roles for IFN-gamma,but not for IL-4,in spontaneous autoimmune thyroiditis in NOD.H-2h4 mice[J].J Immunology,2002,169(7):3999-4007.
Effects of Emodin on T Cell Subsets and IFN-γ,IL-4 in Autoimmune Thyroiditis Mice
WU Keren,YE Zhipeng,HUANG Jie,JIN Fa,FANG Rong,XU Tao and LI Ning.
Department of Hepatobiliary Surgery,the First Affiliated Hospital of Zhejiang Chinese Medical University.Hangzhou(310006),China
Objective To investigate the protective effect of emodin on T cell subsets and the secretion of IFN-γ and IL-4 in autoimmune thyroiditis(EAT)mice.Methods Four weeks after modeling,experimental groups were treated with emodin with different doses.The TgAb level in plasma and thyroid inflammation were detected 8 weeks after modeling to evaluate the protective effect of emodin on EAT mice.T cell subset and the levels of IFN-γ and IL-4 in peripheral blood and spleen were detected by flow cytometry.Results The histopathological study revealed that inflammatory infiltration in thyroid was significant reduced after emodin treatment compared with control group(P<0.01).Levels of serum TgAb were significant increased in each group after modeling[(44.16±3.59)ng/mL vs(11.24±1.52)ng/mL],and the increasing amplitudes in emodin treated groups were significantly less than that in model group[(26.58±5.24)ng/mL,(19.18±5.73)ng/mL,(23.24±5.47)ng/mL vs(44.16±3.59)ng/mL,P<0.01].After modeling,the cell frequencies of CD3+CD4+,CD3+CD8+T cells,CD3+CD4+IL-4+and CD3+CD4+IFN-γ+T cells in peripheral blood monocyte and splenic lymphocyte were significant increased in each group compared with control group peripheral blood monocyte:[(7.72%±2.92)%vs(4.13%±1.45)%,(4.23%±1.58)%vs(2.76%±1.69)%];splenic lymphocyte:[(7.51%±1.31)%vs(1.82%±1.35)%,(5.59%±1.98)%vs(0.033±0.034)%,P<0.01],while the in-creasing amplitudes in emodin treated groups were less than that in model group peripheral blood monocyte:[(7.72±2.92)%vs(17.46±3.71)%,(4.23±1.58)%vs(8.92%±2.62)%];splenic lymphocyte:[(7.51±1.31)%vs(16.74±4.79)%,(5.59±1.98)%vs (11.97±2.21)%,P<0.01].The difference in cell frequencies of CD3+CD4+IFN-γ+and CD3+CD4+IL-4+T cells in emodin treated groups were significant higher than that of control group and lower than that of model group(P<0.01).Conclusion The EAT model is visible through an excessive iodine-induced method in NOD mice,and emodin shows a certain inhibitory effect on autoimmune response in EAT mice.This effect could be performed by inhibiting the differentiation of lymphocyte into CD3+CD4+,CD3+CD8+T cells and by inhibiting the secretion of IFN-γ and IL-4 in CD3+CD4+T cells.
NOD mice;experimental autoimmune thyroiditis;emodin;T cell subsets
浙江省中医药科技计划项目(No.2014ZA037)
浙江中医药大学第一附属医院肝胆外科(杭州 310006)
吴可人,Tel:057186008521;E-mail:wkr3000@sina.com
(收稿:2017-04-24 修回:2017-05-24)
