锂-空气电池MnO2和Co3O4正极催化剂的研究进展
2017-12-05胡安俊舒朝著龙剑平
胡安俊,舒朝著,龙剑平
锂-空气电池MnO2和Co3O4正极催化剂的研究进展
胡安俊,舒朝著,龙剑平
(成都理工大学 材料与化学化工学院,四川 成都 610059)
锂-空气电池因具有超高的理论能量密度,被认为是最具发展前景的新一代储能系统。然而,正极缓慢的电极反应成为制约其发展的关键因素之一。催化剂的加入可以有效降低锂-空气电池的过电位,进而提高正极反应的速率。本文首先简要介绍了锂-空气电池的基本结构和工作原理,随后详细综述了近年来用于锂-空气电池正极的过渡金属氧化物(二氧化锰和四氧化三钴)催化剂的研究进展,最后根据目前所存在的问题指出未来的研究方向。
锂-空气电池;正极;综述;二氧化锰;四氧化三钴;催化剂
能源危机和环境污染是现代社会面临的两大挑战[1]。从持续发展的角度来看,世界各国急需加紧探索绿色环保的可再生新能源[2-3]。但是由于这些可再生能源不能连续和稳定地应用于日常生活中,所以需要设计和开发相应的能量存储系统,使其变成可供人们持续利用的能源。在各种不同的电存储系统中,二次电池被认为是一种最有效、简单、可靠的系统,它可以直接实现电能和化学能的相互转换。目前应用最广泛的是锂离子电池,但是低的能量密度(理论值约400 Wh/kg)限制了其在下一代高性能储能系统中的应用[4-5]。而金属-空气电池具有开放结构[6],参与正极反应的活性物质——氧气能持续从周围的空气获得,不需要储存在电池中,因而具有非常高的理论能量密度[7]。其中,锂-空气电池(Lithium-Air Batteries,LAB)的理论能量密度高达3505 Wh/kg(基于2Li + O2↔ Li2O2)[8],是目前商品化锂离子电池能量密度的10倍多,被认为是最具发展潜力的能量存储系统之一,吸引了基础研究及应用领域的广泛关注。
虽然围绕锂-空气电池进行了大量的研究工作,但是很多关键问题仍未得到彻底解决。在锂-空气电池放电和充电过程中,正极的氧还原和氧析出反应高的过电位大大降低了电池的能量效率和循环性能[9],导致其还不能满足商业化能量存储系统的需求。大量的研究结果表明,催化剂的加入可以有效地降低空气电极反应过电位,进而改善电池性能[10]。因此,高效、稳定、廉价的催化剂的开发对锂-空气电池的发展有着至关重要的作用。
传统的氧还原催化剂(比如:金[11-13]、铂[13]、钯[14]等)能够有效地降低极化,导电率和稳定性高,电催化效果较好,但其价格昂贵,很难实现大规模的应用。相比较而言,过渡金属氧化物由于其具有储量丰富、成本低廉和易于制备等优点,且作为锂-空气电池的催化剂显示优良的催化活性,被认为是一类具备商业化潜力的催化剂[15]。其中,锰氧化物是一类被大量研究过的过渡金属氧化物催化剂,在众多锰的氧化物中,二氧化锰(MnO2)由于成本低、毒性小、平均电压平台高,被认为是最适合于应用在锂-空气电池中的催化剂之一[16]。除了锰氧化物外,钴氧化物如四氧化三钴(Co3O4)作为锂-空气电池正极材料也显示出优良的催化活性[17],成为近年来的研究热点。
本文结合锂-空气电池的工作原理,对过渡金属氧化物MnO2和Co3O4在锂-空气电池中作为氧还原复合正极催化剂的研究进展作简要综述。
1 锂-空气电池的工作原理
锂-空气电池是基于金属锂(Li)和氧气(O2)的氧化还原反应,将Li和O2的化学能转换为电能的一种半开放式电池。按所用电解液不同,锂-空气电池主要分为四类:非水系、水系、混合和全固体锂-空气电池[18]。目前研究最为广泛的是非水系锂-空气电池,以非水性锂-空气电池为例,其充放电过程的工作原理如图1所示。

图1 锂-空气电池的工作原理图[18]
放电时,正极发生氧还原反应(Oxygen Reduction Reaction,ORR),反应式为:2Li + O2→ Li2O2,Li氧化产生的Li+迁移到电解液中,并向正极迁移,Li+与来自空气中的O2和来自外部电路的电子结合,形成Li-O化合物;充电时,正极发生氧析出反应(oxygen evolution reaction,OER),反应式为:Li2O2→ 2Li + O2,氧离子氧化成氧气,负极Li+变成金属Li,然后氧气从电池释放或保留在储存器中。
锂-空气电池的典型充放电曲线如图2所示。电池在恒流充电时,工作电压增加到大约4.0 V(标准电压o=2.96 V),充电过电位(chg)显著大于放电过电位(dis),目前充放电循环体系的能量效率仅为2.6 V/4 V=65%[18]。因此,必须寻找更好更高效的氧还原催化剂来降低过电位从而提高能量效率。
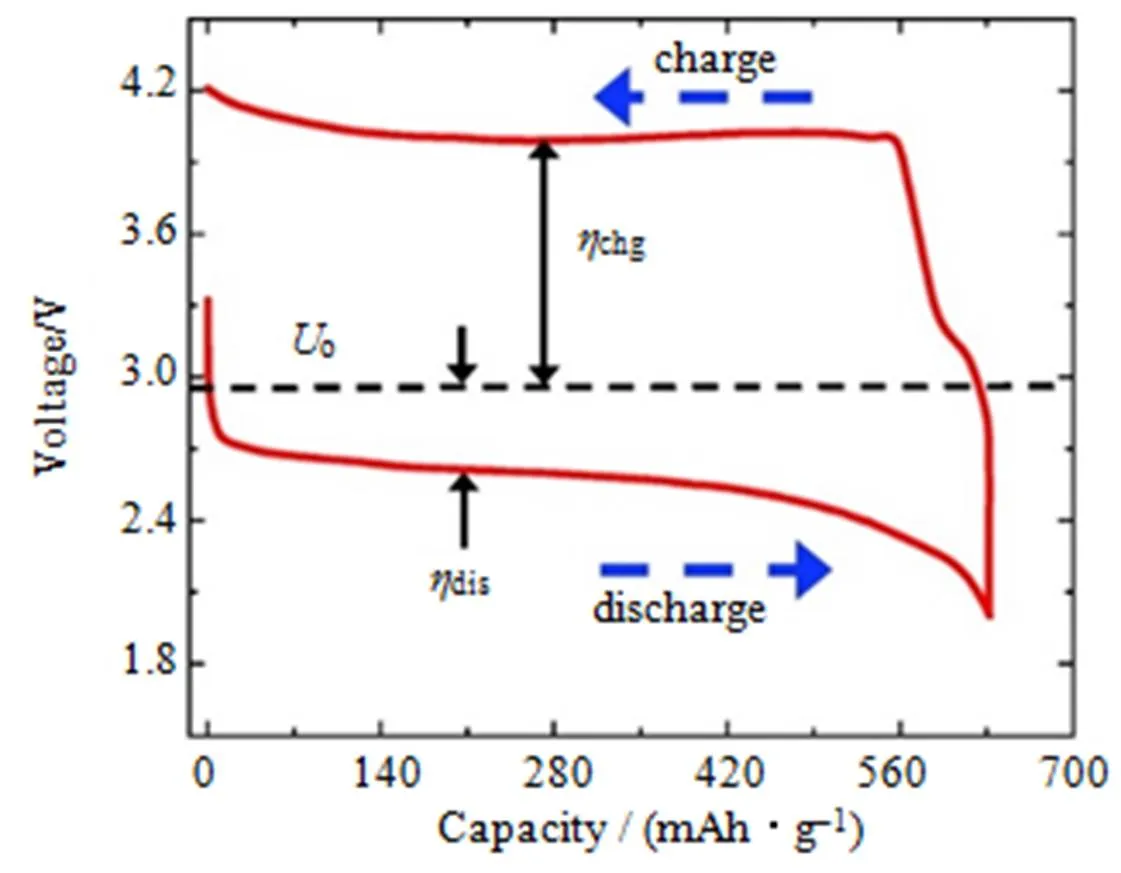
图2 锂-空气电池的典型充放电曲线[18]
2 MnO2正极催化剂的研究进展
MnO2具有不同晶体结构,其电催化活性也根据其晶体结构和形貌的改变而变化[19]。为了了解其结构和电化学活性之间的关系,研究者们研究了不同结晶相和不同形态的MnO2纳米结构作为ORR的电催化剂。发现在所有MnO2纳米结构中,α-MnO2由于其2×2隧道结构表现出更好的ORR动力学,并提供高放电比容量,比无电催化剂电池的放电比容量高出两倍[20-21],具有这种独特纳米结构的α-MnO2是最有希望的催化材料之一[19-23]。然而,MnO2的电催化剂活性仍然低于商业Pt/C基电催化剂。研究发现,在MnO2表面上沉积金属纳米粒子,负载金属氧化物或者与碳纳米材料复合,对提高MnO2催化剂的电催化活性有着显著的效果。
2.1 MnO2与金属及其氧化物复合催化剂
碳基体中的贵金属可以促进过氧化锂(Li2O2)与碳基体之间的粘附,并将Li2O2结晶成低维度(薄层和小尺寸)[24],这样可以有效缓解或延缓电极的失活,并且在充电时能够以较低的过电位进行Li2O2的分解,减少副反应如电解质的氧化分解。但是,碳材料与Li2O2接触不稳定[25-26]。因此,MnO2替代碳材料以支撑贵金属,为改善电极材料的稳定性提供了一种新的思路。
金(Au)在促进Li2O2在MnO2片上的成核、结晶和生长过程中起着关键作用。Liu等[27]提出了一种在石墨烯涂覆的镍泡沫上直接生长多孔Au修饰的δ-MnO2(Au/δ-MnO2)作为锂-空气电池正极催化剂的新设计(如图3为Au/δ-MnO2正极的结构和工作机理),通过Au和δ-MnO2的协同催化作用,实现了薄层和小尺寸Li2O2在δ-MnO2表面的保形生长。由于Li2O2在δ-MnO2上的受控生长,具有Au/δ-MnO2催化剂的锂-空气电池表现出优异的电化学性能,其在100 mA/g的电流密度下产生10 600 mAh/g的高比容量,2.87 V的高放电平台以及0.91 V的低极化(如图4)。钯(Pd)纳米颗粒催化剂显示出类似于商业Pt/C催化剂的ORR活性[28-29]。而MnO2和Pd之间的强相互作用可以提高电催化活性[29-30]。Zahoor等[31]通过简单的水热法合成α-MnO2纳米棒,并用Pd纳米颗粒进行改性以形成Pd沉积的α-MnO2纳米结构(Pd/α-MnO2),然后将Pd/α-MnO2纳米棒用作空气正极催化剂在锂-空气电池中以研究其性能。结果表明,与未沉积Pd或其他催化剂的电池相比,其具有更低的过电位和更高的放电比容量。
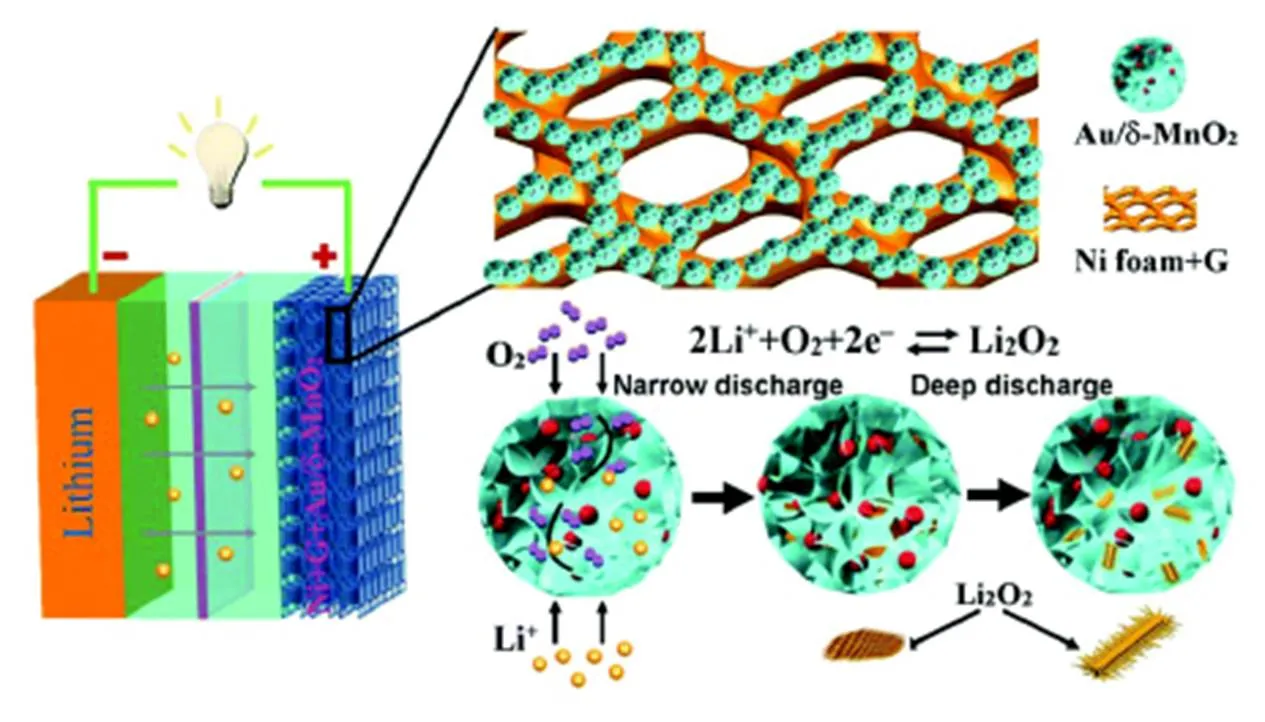
图3 Au/δ-MnO2正极的结构和工作机理[27]
贵金属氧化物由于其优异的ORR和OER催化活性而受到广泛的关注[32-35]。其中,二氧化钌(RuO2)作为催化剂已经在各种电化学体系中得到了广泛的研究,提高ORR和OER动力学的有效策略之一是将Li2O2结晶成低维形态[36]。而Li2O2在有无RuO2修饰的MnO2片上的结晶形态是不同的(如图5),在裸露的MnO2片上形成较大的Li2O2颗粒状结构,而在RuO2修饰的MnO2片表面上形成薄而蓬松的Li2O2层状结构。因此,通过RuO2修饰的MnO2可以进一步改善锂-空气电池的电化学性能[37-39]。Wang等[40]采用液相法在镍基体上制备了RuO2/MnO2催化剂并对其催化活性进行了研究,研究发现,在定容1000 mAh/g下,电流密度高达3200 mA/g(或1.3×10–3A/cm2)时,在氧化还原中间体(redox mediator)LiI的辅助催化下,以RuO2/MnO2为催化剂的锂-空气电池能够可逆充放电170个循环,充电截止电压约为4 V(如图6(a));在定容500 mAh/g下,电池能够循环800次,充电截止电压低于3.8 V(如图6(b))。催化剂的组成和形态控制的优化对电催化活性的改善具有明显影响,三维纳米结构能够提供大的表面积和大的孔隙,能够促进气相氧和液相电解质的扩散,三维结构也可以满足不溶性放电产物的可逆形成和分解,降低氧和电解质的扩散阻力,增强离子传输,并在充放电过程中提供良好的电子通路。
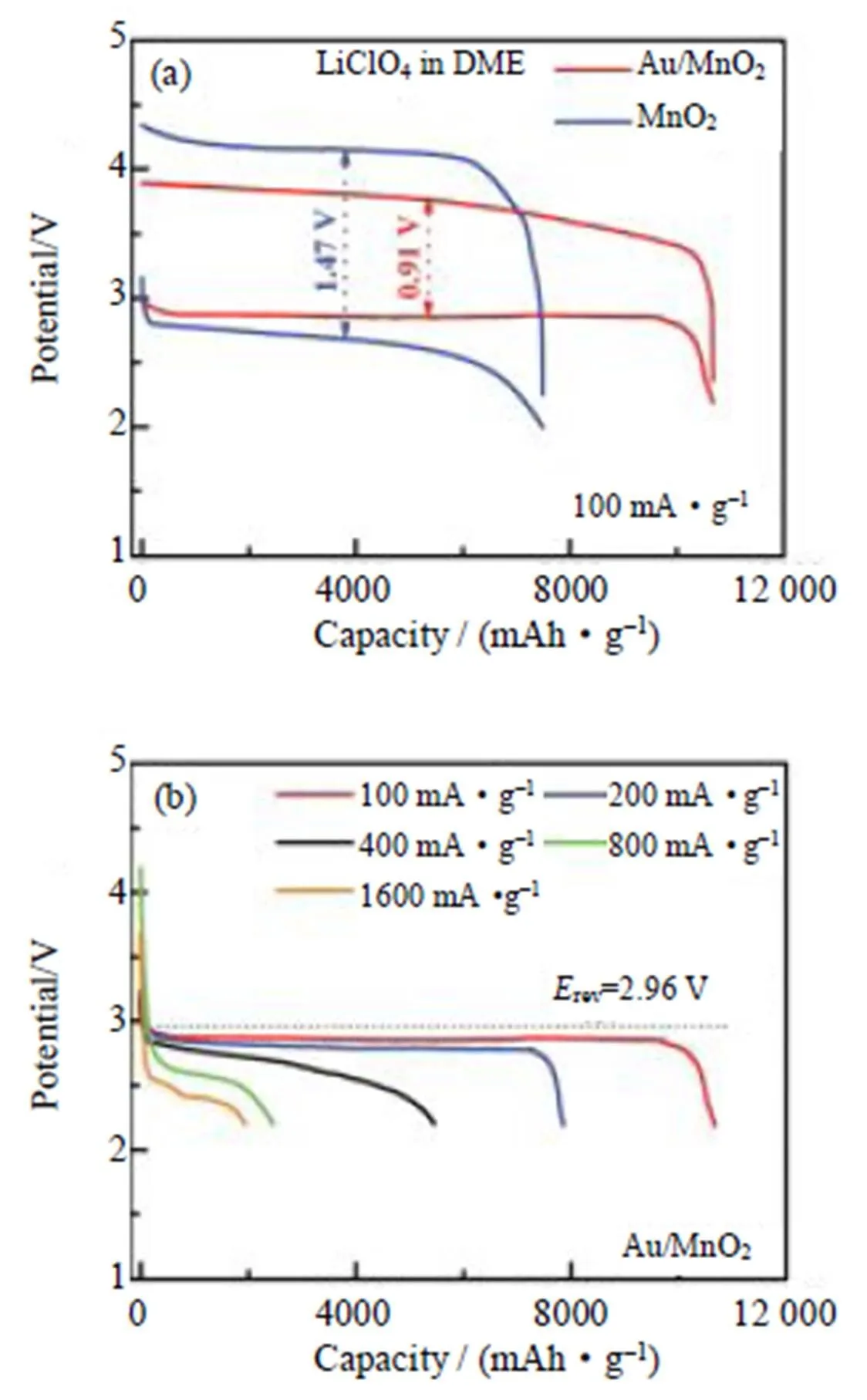
图4 使用0.1 mol/L LiClO4/DME电解液的Li-O2电池的电化学性能:(a)Au/δ-MnO2和δ-MnO2催化剂的电池在100 mA/g电流密度下的电压曲线;(b)Au/δ-MnO2催化剂的电池在不同电流密度下的放电曲线[27]
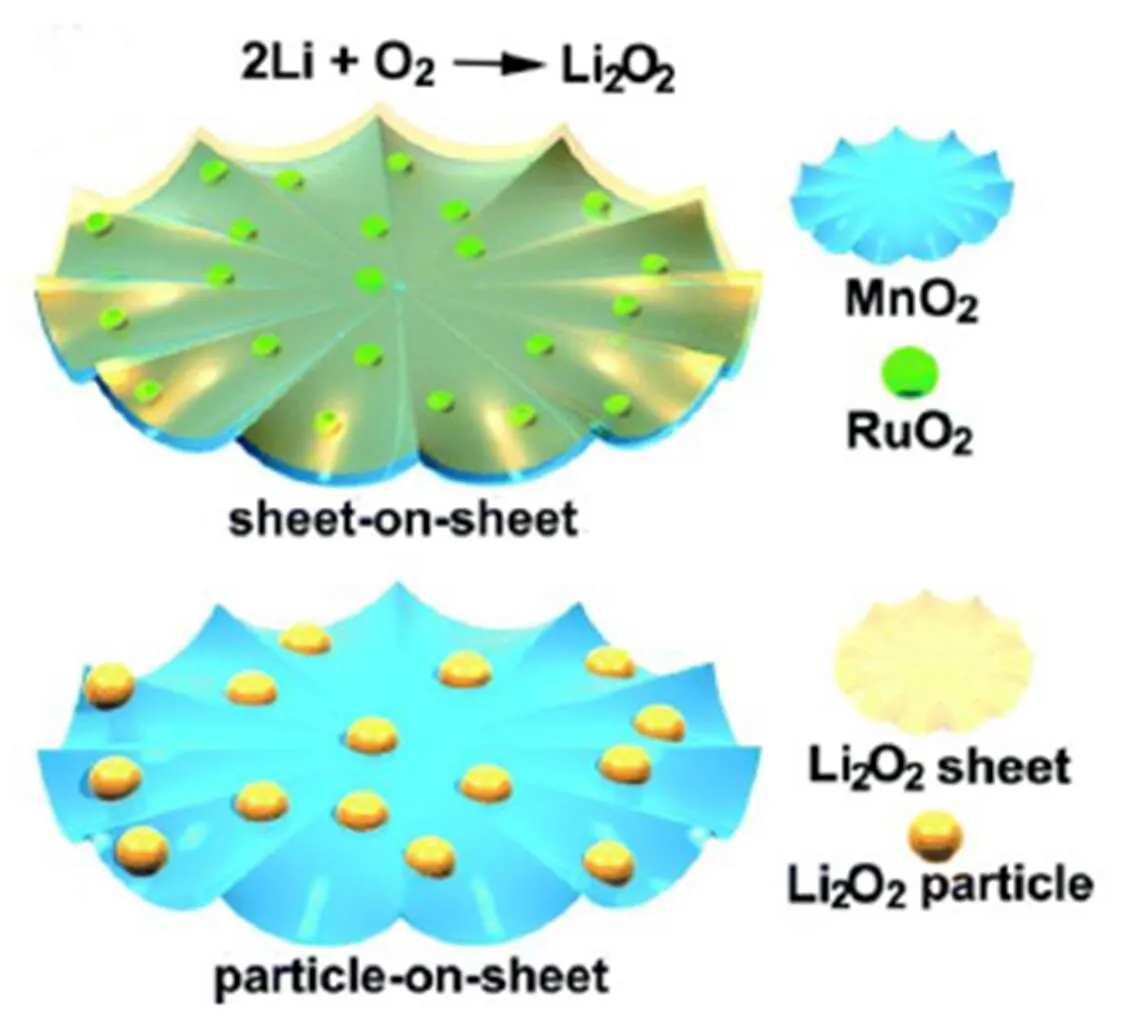
图5 有/无RuO2修饰的MnO2片上Li2O2的形成机理[40]

图6 RuO2/MnO2+LiI正极的Li-O2电池在3200 mA/g的电流密度下,分别在定容(a)1000 mAh/g和(b)500 mAh/g下的循环性能[40]
2.2 MnO2与纳米碳材料复合催化剂
纳米碳材料不仅自身作为催化剂有着出色的催化性能,其也因为价格低廉,种类丰富,具有优异的电导率和电化学稳定性,被广泛用作锂-空气电池催化剂的载体。而MnO2与纳米碳材料复合后可以改善过渡金属氧化物自身导电性较差的问题,同时利用过渡金属元素可变价的特点,提高了催化活性,研究较多的纳米碳材料包括石墨烯、多孔碳、碳纳米管等。
石墨烯由于其特殊的电子导电性,大的比表面积和可控的表面缺陷,已经被视为ORR和OER的优异催化剂[41]。Cao等[42]采用氧化还原法在石墨烯纳米片(GN)上原位生长MnO2,形成α-MnO2/GN复合电极材料,由于所制备的复合材料分散性良好,并且与石墨烯的结合密切,使催化剂的利用效率大为提高,因此电池性能得到明显改善,首次放电比容量高达11 520 mAh/g(如图7(a)),在定容3000 mAh/g下,电流密度为300 mA/g时,可以稳定循环20次,并且放电电压与充电电压保持不变(如图7(b))。由于α-MnO2和GN的协同作用,该复合物对锂-空气电池中的ORR和OER都具有优异的催化性能。这表明MnO2纳米材料的催化性能不仅与颗粒的形态和尺寸有关,还与它们和碳材料的协同作用有关。研究发现,当石墨烯掺杂有氮原子(N)时,由于来自缺陷和官能团的催化活性位点的增加,导致石墨烯二维纳米结构表现出显著的ORR催化活性[43-46]。Park等[47]将α-MnO2纳米管/氮掺杂热剥离石墨烯混合制备了α-MnO2NT/NExG复合正极催化剂,并应用于锂-空气电池,最大功率密度达到了15.8 W/g,这主要归因于α-MnO2纳米阵列良好的催化性能和石墨烯优越的导电性的有机结合。
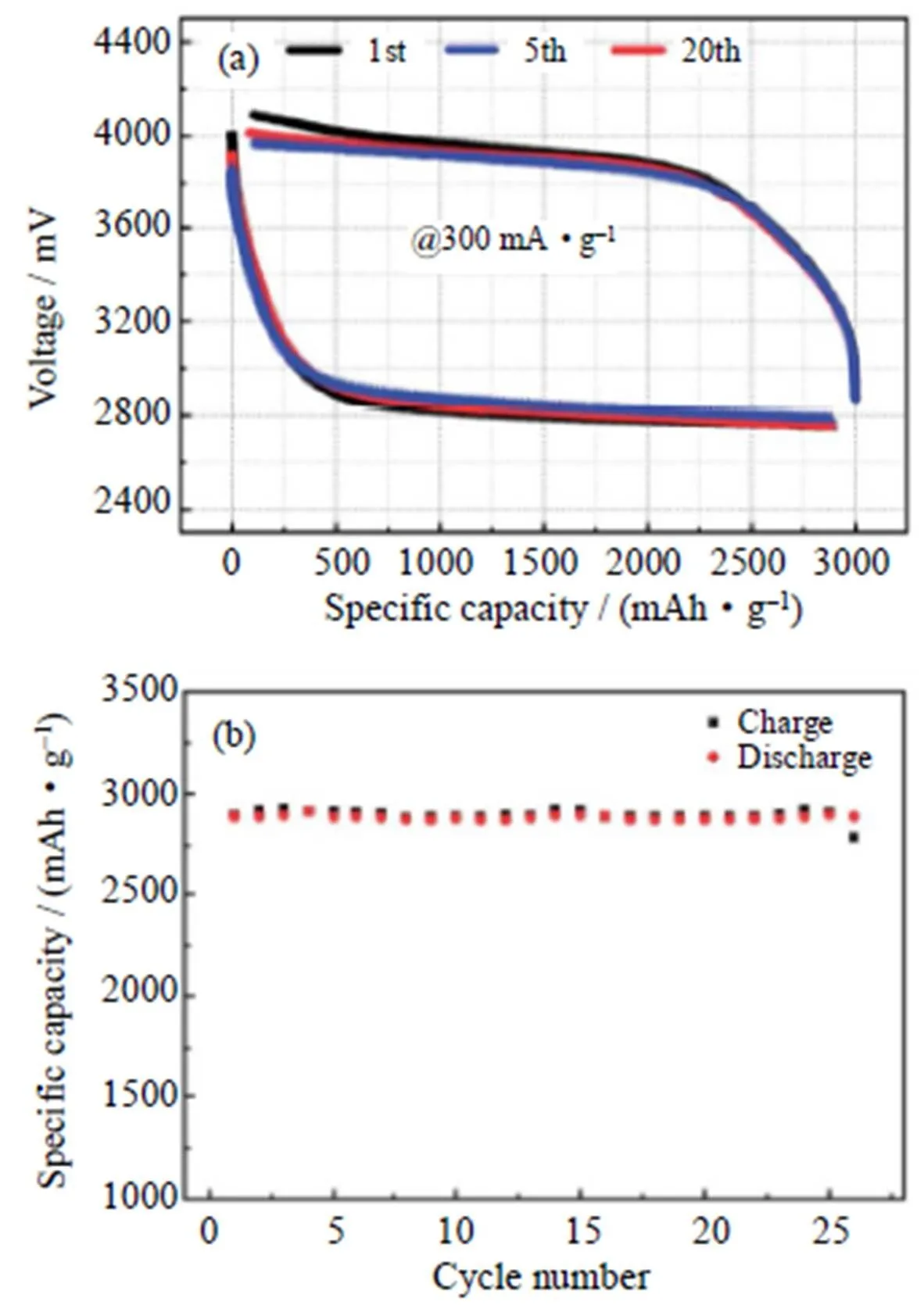
图7 α-MnO2/GN正极的Li-O2电池不同循环次数下的:(a)充放电曲线;(b)充放电容量[42]
碳纳米管(CNT)由于其大的比表面积和优异的化学、热稳定性,是MnO2的理想支撑材料,此外,CNT形成的三维网络孔结构为电子传输和反应物扩散提供了良好的途径,进一步增强催化组分的活性[48]。Wang等[49]将分支MnO2原位生长在CNT上,具有花瓣状纳米片形态的MnO2均匀地涂覆在CNT外部以形成核-壳纳米线。这种结构可以有效地防止CNT与Li2O2的直接接触,从而避免了CNT的分解以及在充电过程中Li2CO3的形成,同时可以提高正极的导电性并改善循环性能,以CNT@MnO2纳米复合材料为催化剂的锂-空气电池表现出稳定的深度放电能力和超过50次的充放电循环性能(如图8(a)),并且在定容500 mAh/g下,电流密度为200 mA/g时,电池可循环200多次(如图8(b))。
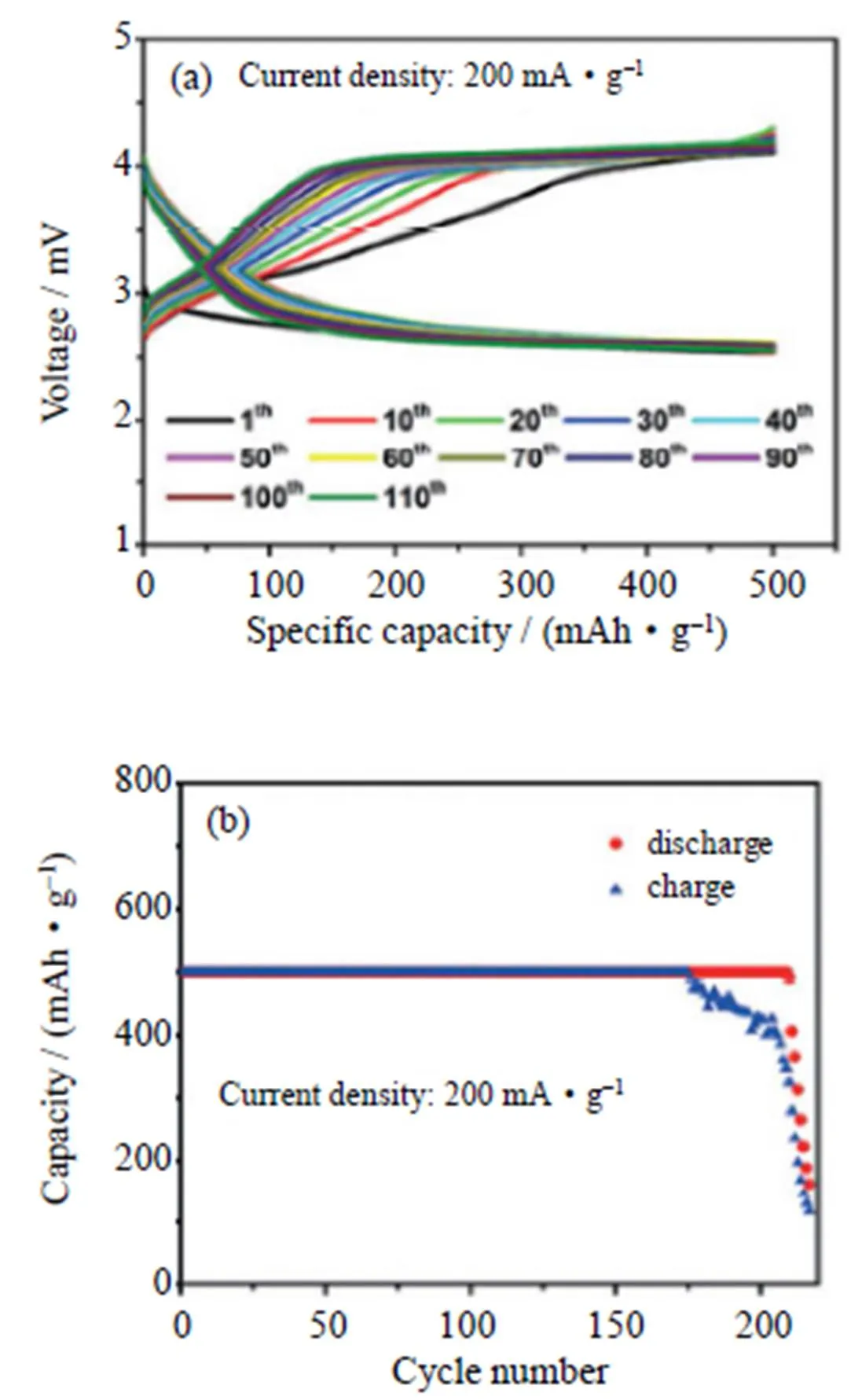
图8 CNT@MnO2正极的Li-O2电池在定容500 mAh/g下,电流密度为200 mA/g时的:(a)充放电曲线;(b)不同循环次数下的容量[49]
锂-空气电池的性能与碳载体的性质有关,如形态、表面积、多孔结构和导电性[50-52]。多孔碳正极结构应具有更大的颗粒内空隙和开放结构以沉积不溶性放电产物,有助于提高放电比容量和循环性能。而碳载体的多尺度多孔网络和高度分散的MnO2纳米结构的组合则有利于离子、氧和电子的输送,并有助于优化电极性能。Han等[53]通过将MnO2纳米结构在层状多孔碳(HPC)上原位氧化还原沉积和生长,合成了MnO2/HPC纳米复合材料(合成示意图如图9),所制备的MnO2/HPC纳米复合材料作为锂-空气电池正极催化剂时,在高达5000 mA/g的电流密度下,电池也可以提供2260 mA/g的比容量(如图10(a)),并且显示出优异的循环稳定性,在定容1000 mAh/g下最高可循环300次(如图10(b))。Chin等[54]结合软模板法和水热法制备了层状介孔碳负载MnO2复合材料(MnO2/C),电化学测试结果表明,由于有序介孔碳的较大比表面积和MnO2较高的催化活性,MnO2/C复合材料对ORR具有优异的催化活性。
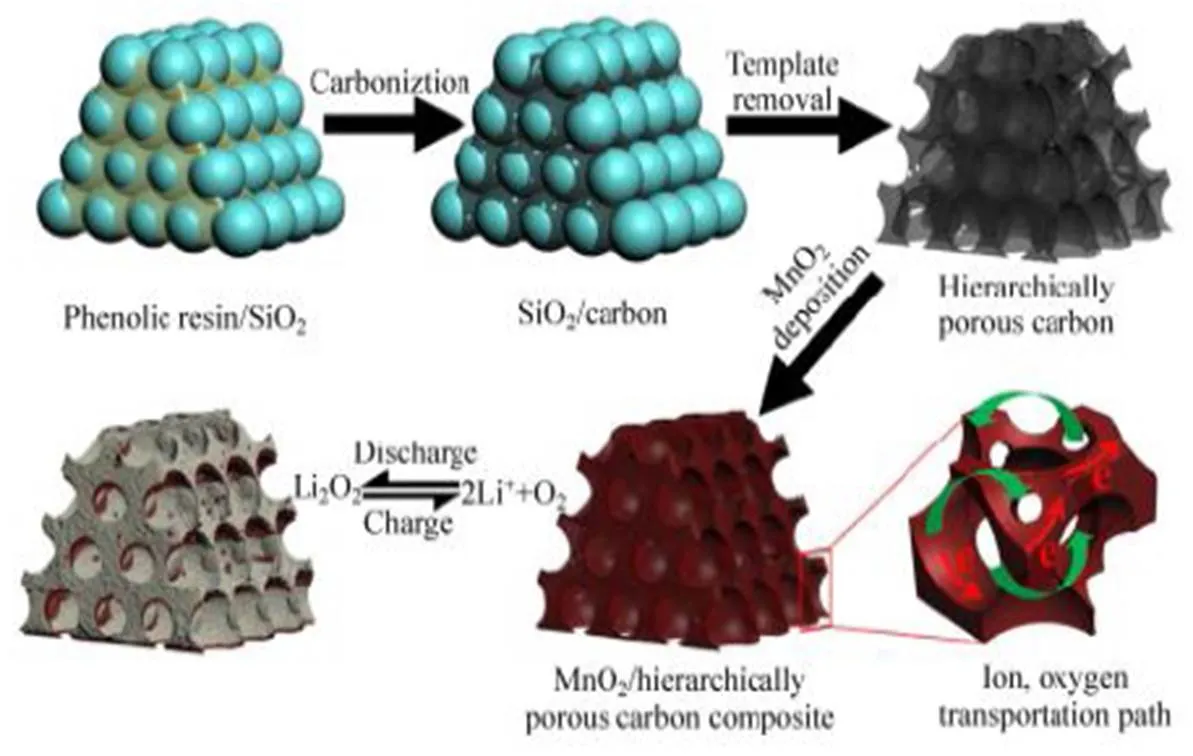
图9 MnO2/HPC纳米复合材料合成示意图[53]

图10 (a)MnO2/HPC正极的Li-O2电池在不同电流密度下的电压曲线;(b)电流密度为350 mA/g下的循环性和终止放电电压[53]
3 Co3O4正极催化剂的研究进展
Co3O4作为锂-空气电池催化剂的不同晶面效应引起了人们的极大关注[55],并且Co3O4的不同暴露晶面对降低锂-空气电池的充放电过电位有显著影响。因此,Co3O4的晶体结构和形态的有效控制可以进一步提高锂-空气电池催化剂的催化性能。而Co3O4与其他材料复合作为锂-空气电池的高性能复合催化剂有大量的研究成果,常见的有贵金属、泡沫镍、石墨烯、多孔碳、碳纳米管等。
3.1 Co3O4与贵金属复合催化剂
贵金属(例如Pd,Pt)纳米颗粒可以引导蓬松多孔的放电产物Li2O2的均匀生长,从而有效地降低正极极化[56-57]。Ishihara等[58]采用介孔硅KIT-6为模板剂合成了平均孔径为3.09 nm的介孔Co3O4,并在其表面沉积贵金属Pd,将此催化剂应用于锂-空气电池。研究表明,Pd/Co3O4催化剂的加入有效地将充电电势降低至3.7 V,减少了电解液的分解,且在0.1×10–3A/cm2的电流密度下,电池的首次放电比容量达到了481 mAh/g,经过23次循环后,容量保持率仍能达到67%。Cao等[59]制备了直接在泡沫镍基材上生长Pt/Co3O4纳米线的无碳无粘结剂空气电极(正极结构和工作机理如图11),Pt的存在不仅促进了Co3O4纳米线的尖端束缚结构的形成,而且还引导了蓬松的Li2O2薄层均匀沉积在Pt/Co3O4纳米线的周围,Li2O2的这种结晶行为减轻了电极的钝化,并通过降低充电过电位来减少副反应。与Co3O4正极相比,具有Pt/Co3O4正极的锂-空气电池的电化学性能得到了显著的改善,该电池可以在定容500 mAh/g下循环50次(如图12)。

图11 Ni泡沫基底上生长的Pt/Co3O4正极的结构和工作机理示意图[59]
3.2 Co3O4与泡沫镍复合催化剂
典型的空气电极包括导电碳基材料和粘合剂的电催化剂,然而,碳基材料和粘合剂的共同使用会生成一系列副产物(如Li2CO3,LiF和LiOH)[60-62]。为了解决这个问题,有研究者通过在镍泡沫上原位生长各种结构的纳米金属氧化物来制备自支撑电极[63-69]。Cui等[70]设计了一种具有三维网络结构的自支撑型Co3O4@Ni电极作为锂-空气电池的正极(充放电过程如图13)。这种电极可以提供大量的催化活性点,催化剂在集流体上附着良好,从而有益于电子传输。将Co3O4@Ni作为锂-空气电池正极催化剂,在0.02×10–3A/cm2的电流密度下进行恒流充放电,实验表明,放电和充电电压分别为2.95 V和3.44 V,充放电过电位仅为0.5 V(如图14(a)),放电比容量达4000 mAh/g(如图14(b))。除了原位法,通过在镍泡沫上有序生长Co3O4纳米阵列将可获得更多的反应活性位点,并且纳米阵列间的间隙也可以提供放电产物的存储容积,从而提高比容量。Yu等[71]通过简便的水热法合成了Ni@Co3O4网状纳米纤维阵列(Ni@Co-WNF),Co3O4纳米纤维在大孔镍泡沫骨架上生长并形成网状结构。这种自支撑和无碳无粘合剂的电催化剂直接用作锂-空气电池的正极催化剂时,性能得到了大幅度提高,在0.1×10–3A/cm2的电流密度下,比容量高达17 118 mAh/g。
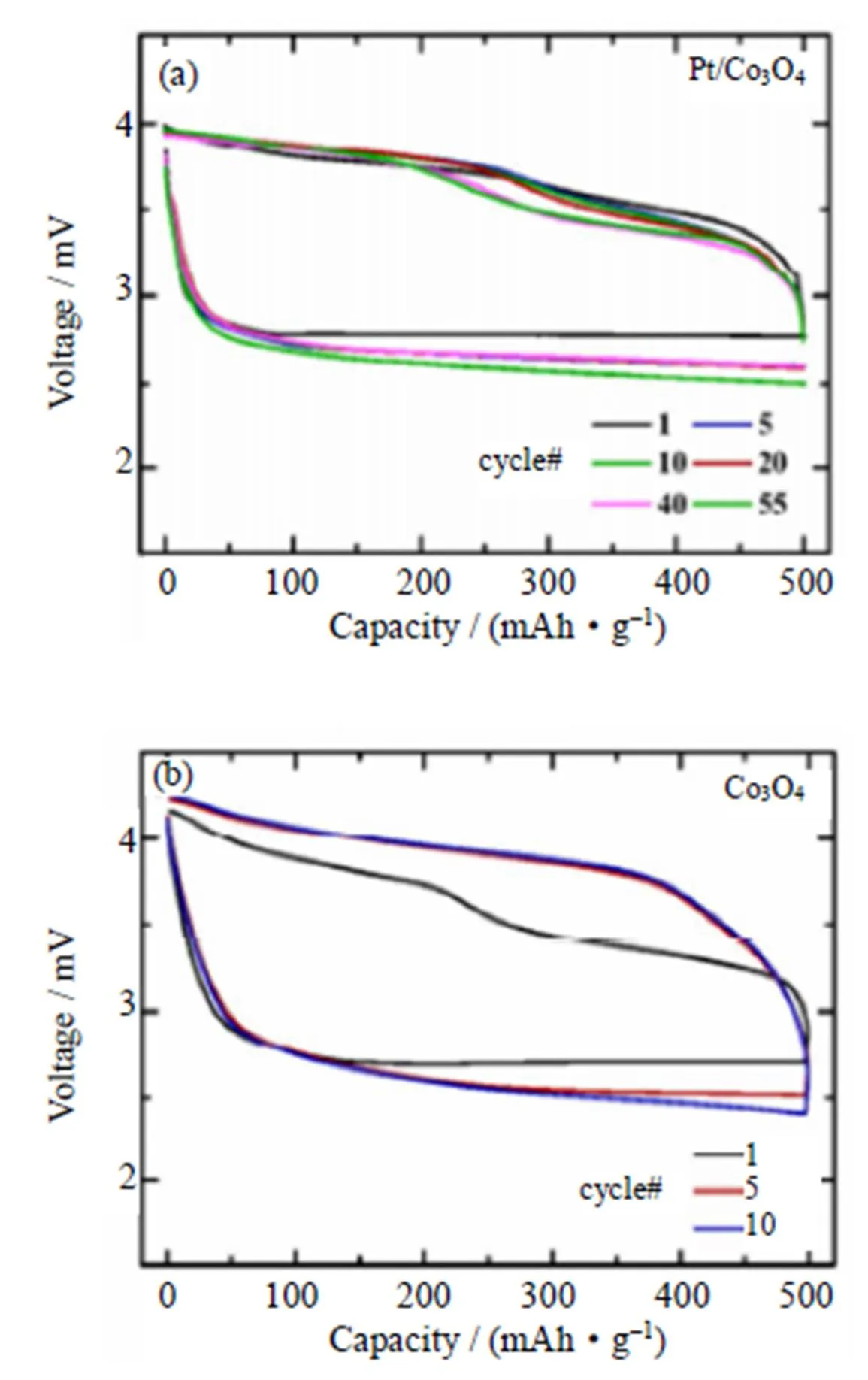
图12 在定容500 mAh/g下,电流密度为100 mA/g时,(a)Pt/Co3O4正极和(b)Co3O4正极的Li-O2电池的电压曲线[59]

图13 自支撑电极充放电过程示意图[70]
3.3 Co3O4与纳米碳材料复合催化剂
Co3O4和石墨烯的复合在改善ORR和OER的动力学方面发挥着协同作用,如Co3O4纳米片的均匀分散赋予了复合材料更多的ORR和OER活性位点;石墨烯的高表面积产生高比容量;石墨烯之间的空间可以容纳Li2O2等不溶性放电产物等。Song等[72]通过简单的水热法在石墨烯上生长了超薄Co3O4纳米片(Co3O4/rGO),并以其作为锂-空气电池正极催化剂研究了电池性能。由于Co3O4和rGO之间的协同效应,复合材料在100 mA/g的电流密度下具有高初始比容量(10 528 mAh/g)(如图14(a))。此外,在113次循环后,截止放电电压保持在2.5 V以上(如图14(b))。石墨烯为纳米结构的均匀负载提供了支撑,纳米活性材料阻止了石墨烯的重新排列,从而在各个维度上形成了良好的混合结构。
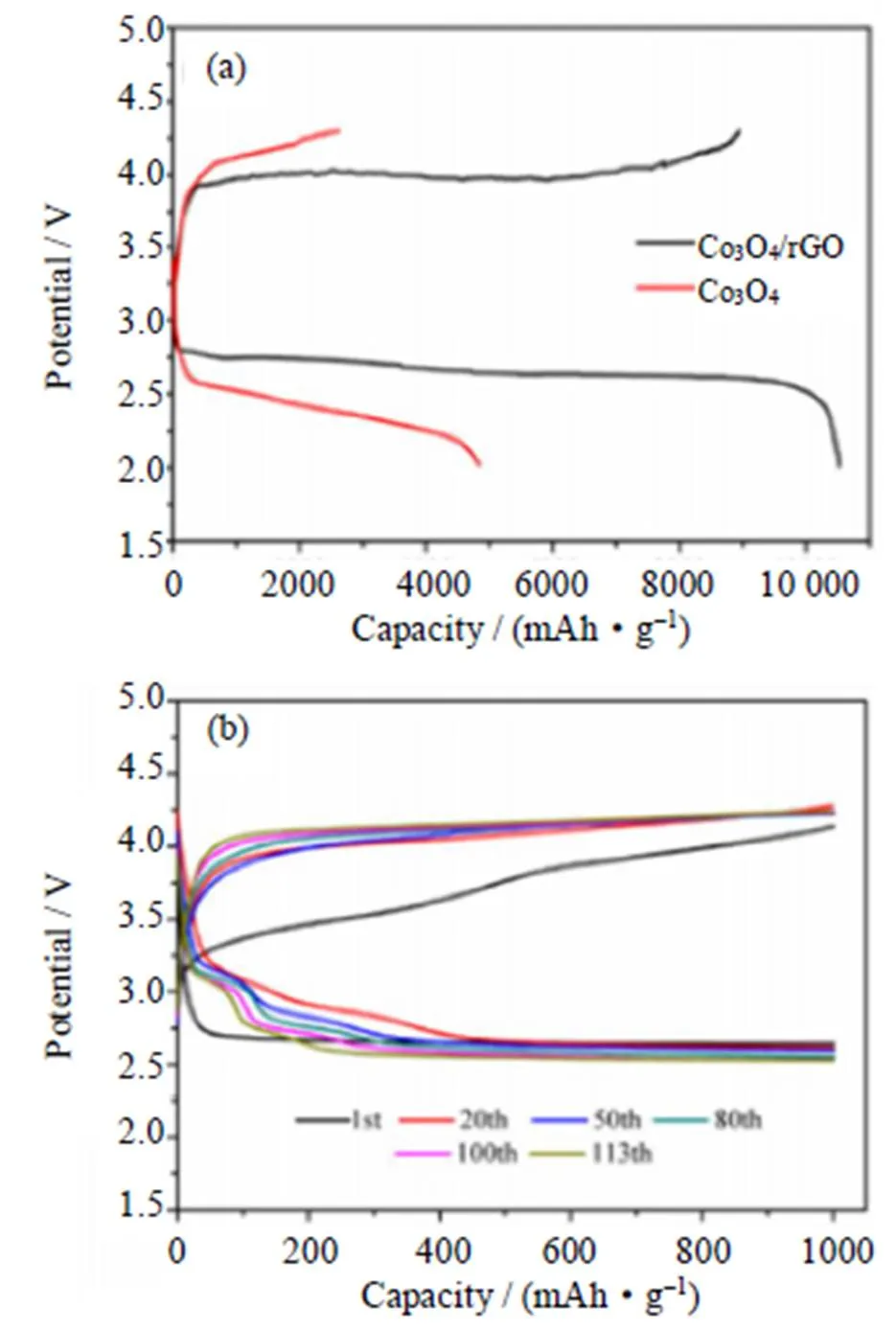
图14 (a)Co3O4正极和Co3O4/rGO正极的Li-O2电池在100 mA/g的首次充放电曲线;(b)Co3O4/rGO正极的Li-O2电池在定容1000 mAh/g下,电流密度为100 mA/g时的充放电曲线[72]
多孔碳的多孔结构有利于促进正极和电解质界面处的氧气扩散以及为反应产物提供更大的存储容积。而金属有机骨架(MOFs)由于其多样的结构拓扑和可调谐功能等优点,被用作合成多孔碳材料的自牺牲模板[73]。Song等[74]提出了一种由金属有机骨架衍生的多孔碳/Co3O4复合材料的简便合成方法(如图15),将此复合材料用作锂-空气电池中的正极催化剂,这种复合材料在100 mA/g的电流密度下,具有约9850 mAh/g的高可逆比容量(如图16(a)),在定容500 mAh/g下,经过50次循环后,能量效率达68%(如图16(b))。这些改进归因于富碳基质中均匀分布的Co3O4纳米颗粒的催化活性和介孔结构的协同作用。Tang等[75]首次设计并成功制备了一种高度石墨化的新型笼式多孔碳-Co3O4电极材料(GPC-Co3O4),结果表明,GPC-Co3O4作为锂-空气电池正极催化剂,显示出0.58 V的超低充电过电位、良好的倍率性能和较长的循环寿命。电池良好的性能归因于多孔碳高的导电性和介孔结构以及具有催化活性的Co3O4纳米颗粒的均匀分散。
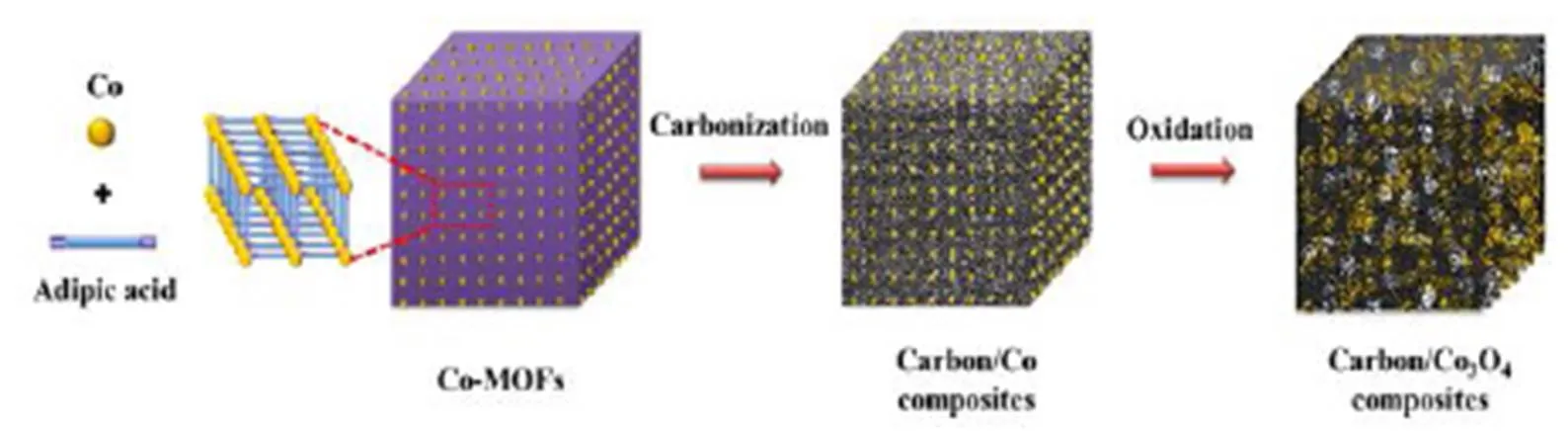
图15 C/Co3O4复合材料的构造过程示意图[74]
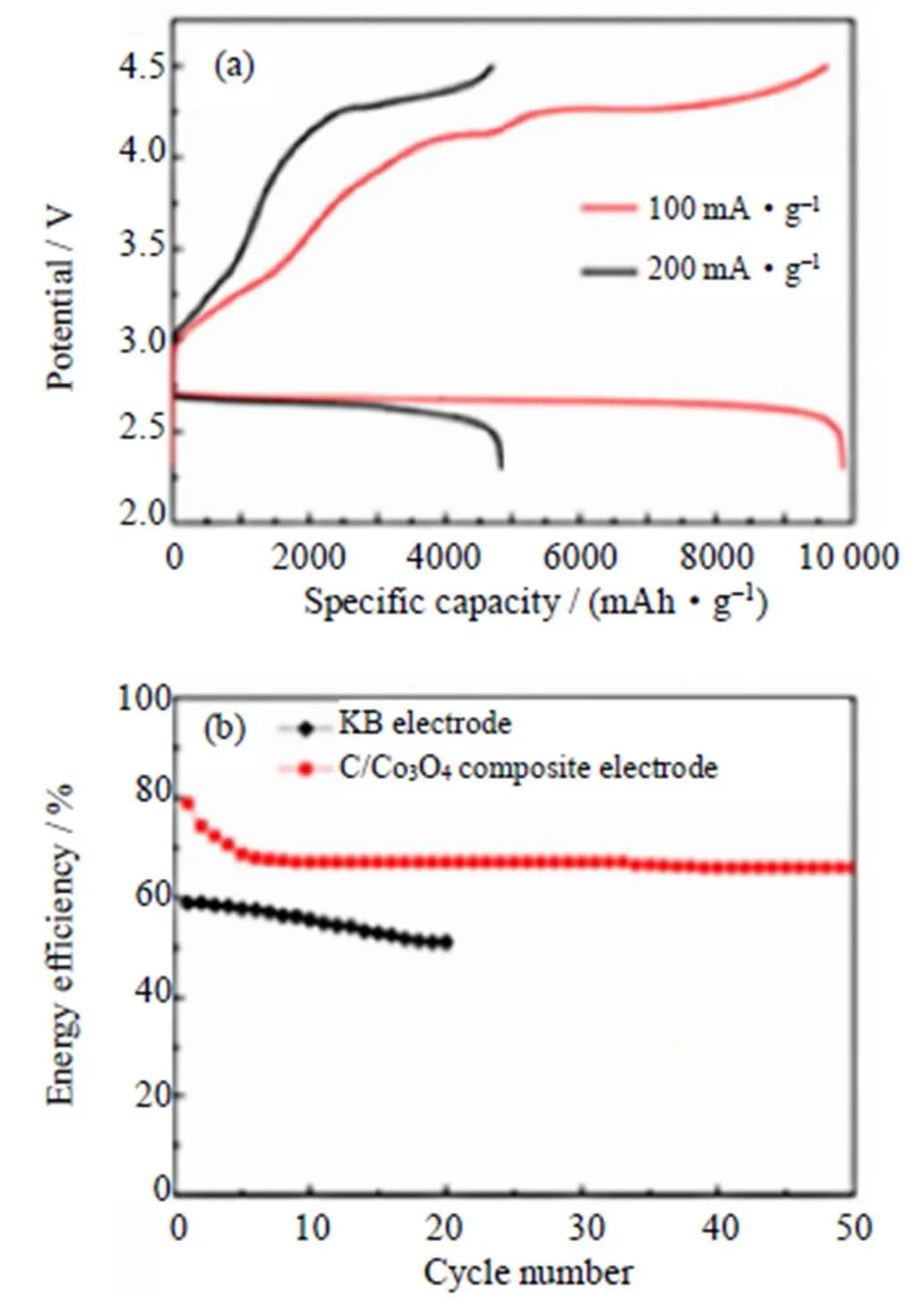
图16 (a)C/Co3O4正极的Li-O2电池在电流密度分别为100和200 mA/g下的首次充放电曲线;(b)能量效率[74]
碳纳米管可以通过缠结形成三维结构,三维结构可以使电极具有疏松多孔的特点,提供大量的空隙,这样有利于放电产物的储存、电解液的润湿和氧的扩散[76]。Huang等[77]合成了一种新型的Co3O4/碳纳米管/碳纤维复合材料(Co3O4/CNT/CFP)。通过化学气相沉积法将CNT沉积在CFP的表面上,再通过电化学沉积直接将Co3O4纳米片涂覆在CNT上,当Co3O4/CNT/CFP作为锂-空气电池的自支撑无粘合剂正极材料使用时,电池表现出优异的性能,在200 mA/g的电流密度下,具有7196.5 mAh/g的比容量(如图17(a)),在定容1000 mAh/g下,可稳定循环25次(如图17(b))。
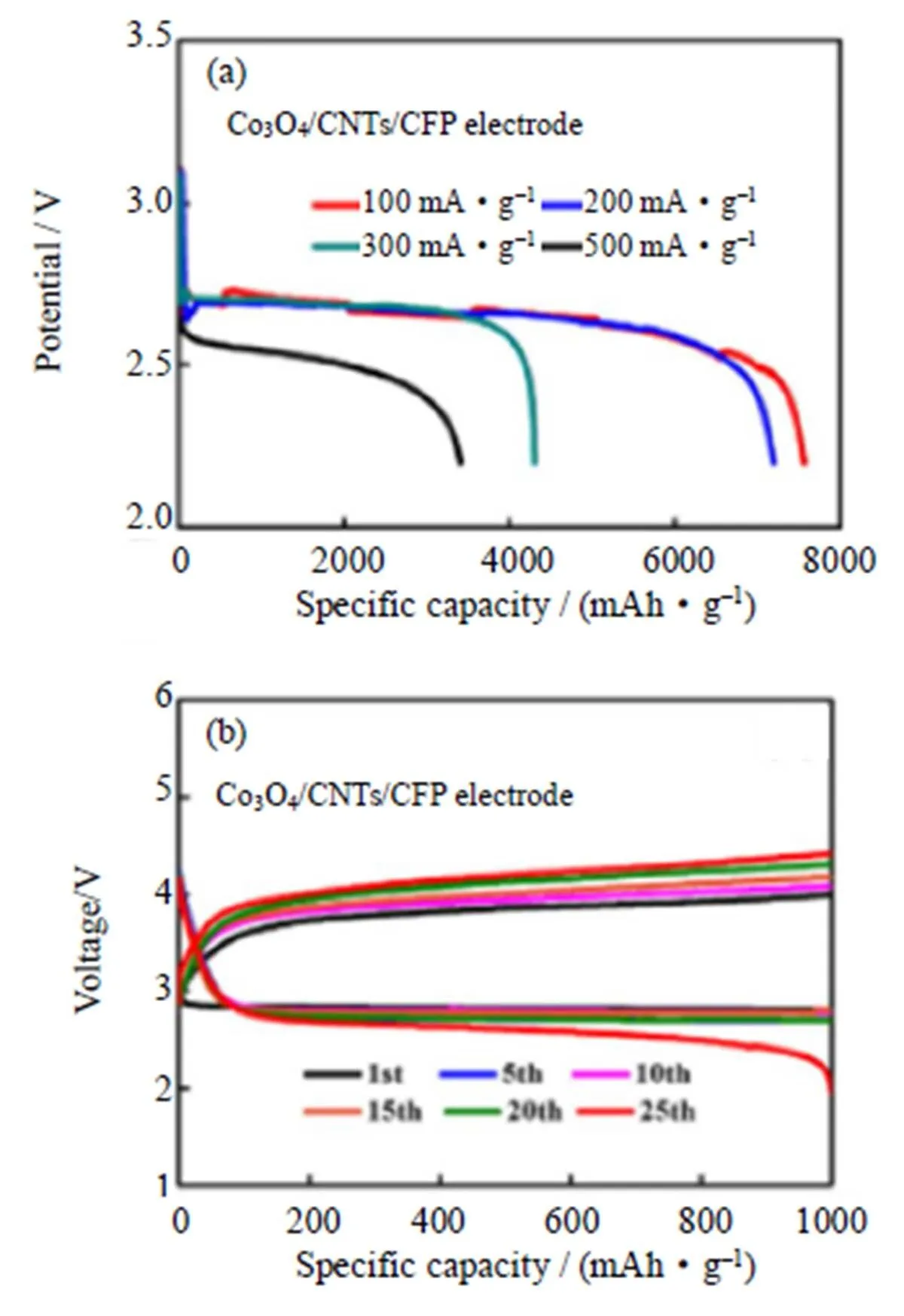
图17 Co3O4/CNT/CFP正极对的Li-O2电池:(a)在不同电流密度下的放电曲线;(b)在定容1000 mAh/g下,电流密度为100 mA/g时的循环性能[77]
4 结束语
本文综述了过渡金属氧化物作为锂-空气电池的正极催化剂的发展现状,讨论了MnO2和Co3O4的研究进展,尽管近年来锂-空气电池正极催化剂的研究取得了不少的突破,但在投入实际商业化应用之前仍有许多问题亟待解决[78-84]。高过电位是限制锂-空气电池发展的首要问题,催化剂能够降低电化学反应过程的活化能,进而大幅度地降低锂-空气电池的过电位,但目前这些催化剂的氧还原反应和氧析出反应机理并没有达成共识,需要做进一步深入系统的研究,为发展高效的锂-空气电池催化剂提供理论指导[85-87]。因此,寻求新的催化材料并进一步研究催化机理,是未来发展可充电锂-空气电池的首要任务。
[1] ARMAND M, TARASCON J M. Building better batteries [J]. Nature, 2008, 451(7179): 652-657.
[2] 杜祥琬. 能源革命: 为了可持续发展的未来[J]. 中国人口·资源与环境, 2014, 24(7): 1-4.
[3] 李春曦, 王佳, 叶学民, 等. 我国新能源发展现状及前景 [J]. 电力科学与工程, 2012, 28(4): 1-8.
[4] WANG J, LI Y, SUN X. Challenges and opportunities of nanostructured materials for aprotic rechargeable lithium-air batteries [J]. Nano Energy, 2013, 2(4): 443-467.
[5] WAGNER F T, LAKSHMANAN B, MATHIAS M F. Electrochemistry and the future of the automobile [J]. J Phys Chem Lett, 2010, 1(14): 2204-2219.
[6] NG D, WEI J, GORLIN Y, et al. A precious-metal-free regenerative fuel cell for storing renewable electricity [J]. Adv Energy Mater, 2013, 3(12): 1545-1550.
[7] CHENG F, CHEN J. Metal-air batteries: from oxygen reduction electrochemistry to cathode catalysts [J]. Chem Soc Rev, 2012, 41(6): 2172-2192.
[8] BRUCE P G, FREUNBERGER S A, HARDWICK L J, et al. Li-O2and Li-S batteries with high energy storage [J]. Nat Mater, 2012, 11(1): 19-29.
[9] LU Y C, GALLANT B M, KWABI D G, et al. Lithium-oxygen batteries: bridging mechanistic understanding and battery performance [J]. Energy Environ Sci, 2013, 6(3): 750-768.
[10] JUNG H G, HASSOUN J, PARK J B, et al. An improved high-performance lithium-air battery [J]. Nat Chem, 2012, 4(7): 579-585.
[11] BADDOUR R F, MODELL M, GOLDSMITH R L. Palladium-catalyzed carbon monoxide oxidation. Catalyst" break-in" phenomenon [J]. J Phys Chem, 1970, 74(8): 1787-1796.
[12] SCHRYER D R, UPCHURCH B T, VAN NORMAN J D, et al. Effects of pretreatment conditions on a Pt/SnO2catalyst for the oxidation of CO in CO2lasers [J]. J Catal, 1990, 122(1): 193-197.
[13] SHEINTUCH M, SCHMIDT J, LECTHMAN Y, et al. Modelling catalyst-support interactions in carbon monoxide oxidation catalysed by Pd/SnO2[J]. Appl Catal, 1989, 49(1): 55-65.
[14] LU Y C, GASTEIGER H A, PARENT M C, et al. The influence of catalysts on discharge and charge voltages of rechargeable Li-oxygen batteries [J]. Electrochem Solid State Lett, 2010, 13(6): A69-A72.
[15] LU Y C, GASTEIGER H A, CRUMLIN E, et al. Electrocatalytic activity studies of select metal surfaces and implications in Li-air batteries [J]. J Electrochem Soc, 2010, 157(9): A1016-A1025.
[16] CHENG H, SCOTT K. Carbon-supported manganese oxide nanocatalysts for rechargeable lithium-air batteries [J]. J Power Sources, 2010, 195(5): 1370-1374.
[17] DÉBART A, BAO J, ARMSTRONG G, et al. An O2cathode for rechargeable lithium batteries: the effect of a catalyst [J]. J Power Sources, 2007, 174(2): 1177-1182.
[18] GIRISHKUMAR G, MCCLOSKEY B, LUNTZ A, et al. Lithium-air battery: promise and challenges [J]. J Phys Chem Lett, 2010, 1(14): 2193-2203.
[19] TRUONG T T, LIU Y, REN Y, et al. Morphological and crystalline evolution of nanostructured MnO2and its application in lithium-air batteries [J]. Acs Nano, 2012, 6(9): 8067-8077.
[20] ZAHOOR A, JEON J S, JANG H S, et al. Mechanistic study on phase and morphology conversion of MnO2nanostructures grown by controlled hydrothermal synthesis [J]. Sci Adv Mater, 2014, 6(12): 2712-2723.
[21] ZAHOOR A, JANG H S, JEONG J S, et al. A comparative study of nanostructured α and δ MnO2for lithium oxygen battery application [J]. RSC Adv, 2014, 4(18): 8973-8977.
[22] CHENG F, SU Y, LIANG J, et al. MnO2-based nanostructures as catalysts for electrochemical oxygen reduction in alkaline media [J]. Chem Mater, 2009, 22(3): 898-905.
[23] NEBURCHILOV V, WANG H, MARTIN J J, et al. A review on air cathodes for zinc-air fuel cells [J]. J Power Sources, 2010, 195(5): 1271-1291.
[24] XU J J, WANG Z L, XU D, et al. Tailoring deposition and morphology of discharge products towards high-rate and long-life lithium-oxygen batteries [J]. Nat Commun, 2013, 4(9): 2438.
[25] GALLANT B M, MITCHELL R R, KWABI D G, et al. Chemical and morphological changes of Li-O2battery electrodes upon cycling [J]. J Phys Chem C, 2012, 116(39): 20800-20805.
[26] OTTAKAM THOTIYL M M, FREUNBERGER S A, PENG Z, et al. The carbon electrode in nonaqueous Li-O2cells [J]. J Am Chem Soc, 2013, 135(1): 494-500.
[27] LIU S, WANG G, TU F, et al. Au-nanocrystals-decorated-MnO2as an efficient catalytic cathode for high-performance Li-O2batteries [J]. Nanoscale, 2015, 7(21): 9589-9596.
[28] DING K. Preparation of palladium particles-decorated manganese dioxide and its catalysis towards oxygen reduction reaction (ORR) [J]. Int J Electrochem Sci, 2010, 5(5): 668-681.
[29] SUN W, HSU A, CHEN R. Palladium-coated manganese dioxide catalysts for oxygen reduction reaction in alkaline media [J]. J Power Sources, 2011, 196(10): 4491-4498.
[30] SALKER A, KUNKALELAR R. Palladium doped manganese dioxide catalysts for low temperature carbon monoxide oxidation [J]. Catal Commun, 2009, 10(13): 1776-1780.
[31] ZAHOOR A, CHRISTR M, JEON J S, et al. Improved lithium oxygen battery performance by addition of palladium nanoparticles on manganese oxide nanorod catalysts [J]. J Solid State Electrochem, 2015, 19(5): 1501-1509.
[32] YILMAZ E, YOGI C, YAMANAKA K, et al. Promoting formation of noncrystalline Li2O2in the Li-O2battery with RuO2nanoparticles [J]. Nano Lett, 2013, 13(10): 4679-4684.
[33] JUNG H G, JEONG Y S, PARK J B, et al. Ruthenium-based electrocatalysts supported on reduced graphene oxide for lithium-air batteries [J]. Acs Nano, 2013, 7(4): 3532-3539.
[34] JIAN Z, LIU P, LI F, et al. Core-shell-structured CNT@ RuO2composite as a high-performance cathode catalyst for rechargeable Li-O2batteries [J]. Angew Chem Int Edi, 2014, 53(2): 442-446.
[35] LI F, TANG D M, ZHANG T, et al. Superior performance of a Li-O2battery with metallic RuO2hollow spheres as the carbon-free cathode [J]. Adv Energy Mater, 2015, 5(13): 6840.
[36] RADIN M D, SIEGEL D J. Charge transport in lithium peroxide: relevance for rechargeable metal-air batteries [J]. Energy Environ Sci, 2013, 6(8): 2370-2379.
[37] GUO K, LI Y, YANG J, et al. Nanosized Mn-Ru binary oxides as effective bifunctional cathode electrocatalysts for rechargeable Li-O2batteries [J]. J Mater Chem A, 2014, 2(5): 1509-1514.
[38] ZHAO G, NIU Y, ZHANG L, et al. Ruthenium oxide modified titanium dioxide nanotube arrays as carbon and binder free lithium-air battery cathode catalyst [J]. J Power Sources, 2014, 270: 386-390.
[39] JANG H, ZAHOOR A, JEON J S, et al. Sea urchin shaped α-MnO2/RuO2mixed oxides nanostructure as promising electrocatalyst for lithium–oxygen battery [J]. J Electrochem Soc, 2015, 162(3): A300-A307.
[40] WANG G Q, HUANG L L, HUANG W, et al. Nanostructured porous RuO2/MnO2as a highly efficient catalyst for high-rate Li-O2batteries [J]. Nanoscale, 2015, 7(48): 20614-20624.
[41] LI Y, WANG J, LI X, et al. Superior energy capacity of graphene nanosheets for a nonaqueous lithium-oxygen battery [J]. Chem Commun, 2011, 47(33): 9438-9440.
[42] CAO Y, WEI Z, HE J, et al. α-MnO2nanorods grown in situ on graphene as catalysts for Li-O2batteries with excellent electrochemical performance [J]. Energy Environ Sci, 2012, 5(12): 9765-9768.
[43] LI Y, WANG J, LI X, et al. Nitrogen-doped graphene nanosheets as cathode materials with excellent electrocatalytic activity for high capacity lithium-oxygen batteries [J]. Electrochem Commun, 2012, 18(1): 12-15.
[44] SHENG Z H, GAO H L, BAO W J, et al. Synthesis of boron doped graphene for oxygen reduction reaction in fuel cells [J]. J Mater Chem, 2012, 22(2): 390-395.
[45] WANG H, MAIYALAGAN T, WANG X. Review on recent progress in nitrogen-doped graphene: synthesis, characterization, and its potential applications [J]. Acs Catal, 2012, 2(5): 781-794.
[46] YANG Z, YAO Z, LI G, et al. Sulfur-doped graphene as an efficient metal-free cathode catalyst for oxygen reduction [J]. Acs Nano, 2011, 6(1): 205-211.
[47] PARK H W, LEE D U, NAZAR L F, et al. Oxygen reduction reaction using MnO2nanotubes/nitrogen-doped exfoliated graphene hybrid catalyst for Li-O2battery applications [J]. J Electrochem Soc, 2013, 160(2): A344-A350.
[48] KITAURA R, SHINOHARA H. Carbon-nanotube-based hybrid materials: nanopeapods [J]. Chem Asian J, 2006, 1(5): 646-655.
[49] WANG F, WEN Z, WU X. CNT@MnO2hybrid as cathode catalysts toward long-life lithium oxygen batteries [J]. Chem Select, 2016, 1(21): 6749-6754.
[50] DING N, CHIEN S W, HOR T S A, et al. Influence of carbon pore size on the discharge capacity of Li-O2batteries [J]. J Mater Chem A, 2014, 2(31): 12433-12441.
[51] XU L, MA J, LI B, et al. A novel air electrode design: a key to high rate capability and long life span [J]. J Power Sources, 2014, 255(255): 187-196.
[52] CHERVIN C N, WATTENDORF M J, LONG J W, et al. Carbon nanofoam-based cathodes for Li-O2batteries: correlation of pore-solid architecture and electrochemical performance [J]. J Electrochem Soc, 2013, 160(9): A1510-A1516.
[53] HAN X P, CHENG F Y, CHEN C C, et al. Uniform MnO2nanostructures supported on hierarchically porous carbon as efficient electrocatalysts for rechargeable Li-O2batteries [J]. Nano Res, 2015, 8(1): 156-164.
[54] CHIN C C, YANG H K, CHEN J S. Investigation of MnO2and ordered mesoporous carbon composites as electrocatalysts for Li-O2battery applications [J]. Nanomaterials, 2016, 6(1): 21.
[55] HE M, ZHANG P, XU S, et al. Morphology engineering of Co3O4nanoarrays as free-standing catalysts for lithium-oxygen batteries [J]. 2016, 8(36): 23713.
[56] LENG L, ZENG X, SONG H, et al. Pd nanoparticles decorating flower-like Co3O4nanowire clusters to form an efficient, carbon/binder-free cathode for Li-O2batteries [J]. J Mater Chem A, 2015, 3(30): 15626-15632.
[57] ZHAO G, LV J, XU Z, et al. Carbon and binder free rechargeable Li-O2battery cathode with Pt/Co3O4flake arrays as catalyst [J]. J Power Sources, 2014, 248: 1270-1274.
[58] ISHIHARA T, THAPA A K, HIDAKA Y, et al. Rechargeable lithium-air battery using mesoporous Co3O4modified with Pd for air electrode [J]. Electrochemistry, 2012, 80(10): 731-733.
[59] CAO J, LIU S, XIE J, et al. Tips-bundled Pt/Co3O4nanowires with directed peripheral growth of Li2O2as efficient binder/carbon-free catalytic cathode for lithium-oxygen battery [J]. Acs Catal, 2015, 5(1): 241-245.
[60] ZHANG L, XIONG K, CHEN S, et al. In situ growth of ruthenium oxide-nickel oxide nanorod arrays on nickel foam as a binder-free integrated cathode for hydrogen evolution [J]. J Power Sources, 2015, 274: 114-120.
[61] BLACK R, OH S H, LEE J H, et al. Screening for superoxide reactivity in Li-O2batteries: effect on Li2O2/LiOH crystallization [J]. J Am Chem Soc, 2012, 134(6): 2902-2905.
[62] OTTAKAM THOTIYL M M, FREUNBERGER S A, PENG Z, et al. The carbon electrode in nonaqueous Li-O2cells [J]. J Am Chem Soc, 2012, 135(1): 494-500.
[63] NASYBULIN E, XU W, ENGELHARD M H, et al. Stability of polymer binders in Li-O2batteries [J]. J Power Sources, 2013, 243(6): 899-907.
[64] LUO W B, GAO X W, SHI D Q, et al. Binder-free and carbon-free 3D porous air electrode for Li-O2batteries with high efficiency, high capacity, and long life [J]. Small, 2016, 12(22): 3031-3038.
[65] HE M, ZHANG P, XU S, et al. Morphology engineering of Co3O4nanoarrays as free-standing catalysts for lithium-oxygen batteries [J]. Acs Appl Mater Interfaces, 2016, 8(36): 23713-23720.
[66] SHEN C, WEN Z, WANG F, et al. Reduced free-standing Co3O4@Ni cathode for lithium-oxygen batteries with enhanced electrochemical performance [J]. Rsc Adv, 2016, 6(20): 16263-16267.
[67] WANG S, WANG Y, WU H, et al. 3D Free-standing hierarchical CuCo2O4nanowire cathodes for rechargeable lithium-oxygen batteries [J]. Chem Commun, 2017, 53 (62), 8711-8714.
[68] LYU Z, ZHANG J, WANG L, et al. CoS2nanoparticles-graphene hybrid as a cathode catalyst for aprotic Li-O2batteries [J]. RSC Adv, 2016, 6(38): 31739-31743.
[69] GUO Y, GAN L, SHANG C, et al. A cake-style CoS2@MoS2/RGO hybrid catalyst for efficient hydrogen evolution [J]. Adv Funct Mater, 2017, 27(5), 1602699.
[70] CUI Y, WEN Z, LIU Y. A free-standing-type design for cathodes of rechargeable Li-O2batteries [J]. Energy Environ Sci, 2011, 4(11): 4727-4734.
[71] YU Q, YU Q, SUN W, et al. Novel Ni@Co3O4web-like nanofiber arrays as highly effective cathodes for rechargeable Li-O2batteries [J]. Electrochim Acta, 2016, 220: 654-663.
[72] SONG Z, CAO N, GAO X, et al. Ultrathin Co3O4nanosheets highly dispersed on reduced graphene oxide: An efficient bi-functional catalyst for Li-O2battery [J]. Fullerene Nanotubes Carbon Nanostruct, 2017, 25(2): 65-70.
[73] ZHU D, ZHENG F, XU S, et al. MOF-derived self-assembled ZnO/Co3O4nanocomposite clusters as high-performance anodes for lithium-ion batteries [J]. Dalton Trans, 2015, 44(38): 16946-16952.
[74] SONG M J, KIM I T, KIM Y B, et al. Metal-organic frameworks-derived porous carbon/Co3O4composites for rechargeable lithium-oxygen batteries [J]. Electrochim Acta, 2017, 230: 73-80.
[75] TANG J, WU S, WANG T, et al. Cage-type highly graphitic porous carbon-Co3O4polyhedron as the cathode of lithium-oxygen batteries [J]. Acs Appl Mater Interfaces, 2016, 8(4): 2796-2804.
[76] HUANG X, YU H, TAN H, et al. Carbon nanotube-encapsulated noble metal nanoparticle hybrid as a cathode material for Li-oxygen batteries [J]. Adv Funct Mater, 2014, 24(41): 6516-6523.
[77] HUANG Y, CHEN J, ZHANG X, et al. Three-dimensional Co3O4/CNTs/CFP composite as binder-free cathode for rechargeable Li-O2batteries [J]. Chem Eng J, 2016, 296: 28-34.
[78] LI F, ZHANG T, ZHOU H. Challenges of non-aqueous Li-O2batteries: electrolytes, catalysts, and anodes [J]. Energy Environ Sci, 2013, 6(4): 1125-1141.
[79] ADAMS J, KARULKAR M, ANANDAN V. Evaluation and electrochemical analyses of cathodes for lithium-air batteries [J]. J Power Sources, 2013, 239(10): 132-143.
[80] GRANDE L, PAILLARD E, HASSOUN J, et al. The lithium/air battery: still an emerging system or a practical reality? [J]. Adv Mater, 2015, 27(5): 784-800.
[81] WEN Z, SHEN C, LU Y. Air electrode for the lithium-air batteries: materials and structure designs [J]. ChemPlusChem, 2015, 80(2): 270-287.
[82] MA Z, YUAN X, LI L, et al. A review of cathode materials and structures for rechargeable lithium-air batteries [J]. Energy Environ Sci, 2015, 8(8): 2144-2198.
[83] JUNG K N, KIM J, YAMAUCHI Y, et al. Rechargeable lithium-air batteries: a perspective on the development of oxygen electrodes [J]. J Mater Chem A, 2016, 4(37): 14050-14068.
[84] EFTEKHARI A, RAMANUJAM B. In pursuit of catalytic cathodes for lithium-oxygen batteries [J]. J Mater Chem A, 2017, 5(17): 7710-7731.
[85] AURBACH D, MCCLOSKEY B D, NAZAR L F, et al. Advances in understanding mechanisms underpinning lithium-air batteries [J]. Nat Energy, 2016, 1(9): 16128.
[86] LI F, CHEN J. Mechanistic evolution of aprotic lithium-oxygen batteries [J]. Adv Energy Mater, 2017(3): 1614-6840.
[87] LIM H D, LEE B, BAE Y, et al. Reaction chemistry in rechargeable Li-O2batteries [J]. Chem Soc Rev, 2017, 46(10): 2873-2888.
(编辑:陈丰)
Research progress of MnO2and Co3O4as cathode catalysts for lithium-air batteries
HU Anjun, SHU Chaozhu, LONG Jianping
(College of Materials and Chemistry & Chemical Engineering, Chengdu University of Technology, Chengdu 610059, China)
Lithium-air batteries are considered as the most promising energy storage devices due to their ultrahigh theoretical energy density. However, Sluggish kinetics of cathode reactions is one of the key factors limiting the development of lithium-air batteries. The overpotential of the lithium-air batteries can be reduced effectively by adding catalyst, and the reaction rate of the oxygen electrode can be improved accordingly. Firstly, the structures and principles of lithium-air batteries are discussed in this review. Then the recent research progress of transition-metal oxides (manganese dioxide and cobaltosic oxide) as cathode catalysts for lithium-air batteries are reviewed. Finally, future research directions in the field are proposed based on the existing problems.
lithium-air batteries; cathode; review; MnO2; Co3O4; catalyst
10.14106/j.cnki.1001-2028.2017.12.010
TM911.41
A
1001-2028(2017)12-0047-11
2017-08-29
舒朝著
四川省教育厅自然科学基金项目(No. 14ZB0064);超纯碲攻关项目(No. SHC128)
舒朝著(1984-)男,吉林长春人,博士,主要从事金属-空气电池研究,E-mail: sczium@163.com;
胡安俊(1993-)男,重庆江北人,研究生,主要从事新能源材料研究,E-mail: 15023293440@163.com。
2017-11-30 14:11
网络出版地址: http://kns.cnki.net/kcms/detail/51.1241.TN.20171130.1411.009.html
