自选酿酒酵母(KDLYS9-3)产β-D-葡萄糖苷酶动力学研究
2017-12-02李艳
李艳
(1.河北科技大学生物科学与工程学院,河北石家庄050018;2.河北省发酵工程技术研究中心,河北石家庄050018)
自选酿酒酵母(KDLYS9-3)产β-D-葡萄糖苷酶动力学研究
李艳1,2
(1.河北科技大学生物科学与工程学院,河北石家庄050018;2.河北省发酵工程技术研究中心,河北石家庄050018)
自选高产β-D-葡萄糖苷酶的酿酒酵母(KDLYS9-3)在葡萄酒酿造过程中具有增强香气的效果。依据菌体生长和产酶试验,利用Logistic方程、DoseResp方程和Nelder方程建立了菌体生长和产酶,以及菌体生长速率与酶生成速率之间关系的动力学模型,通过Origin8.0软件进行非线性拟合,并利用Lineweaver-Burk法作图测定了该菌所产β-D-葡萄糖苷酶的动力学参数Km值和Vmax值。结果显示:自选酿酒酵母KDLYS9-3的菌体生长与产酶的相关性为部分偶联型,动力学模型与试验值吻合度好,方程能够反映菌体生长与产酶的变化规律。菌体生长8 h后开始产酶,菌体进入对数生长期时酶大量生成,到39 h菌体生长进入稳定期,随着菌体生长进入衰亡期后酶也随之停止产生;利用Lineweaver-Burk法求得酶动力学参数Km=8.492 579 mmol/L,Vmax=1.030 715(μmol/L)/min。研究结果为该菌株的理论研究和实际应用奠定了基础。
自选酿酒酵母(KDLYS9-3);β-D-葡萄糖苷酶;动力学方程;米氏常数(Km);最大反应速率(Vmax)
β-D-葡萄糖苷酶在葡萄酒生产过程中可增加葡萄酒的香气[1-3]。目前,所用商品β-D-葡萄糖苷酶大多来自于黑曲霉菌发酵生产得到的酶制剂[4],该酶的加入改善葡萄酒香气的同时也给葡萄酒留下造成蛋白质不稳定的隐患[5]。因此,筛选可以产生β-D-葡萄糖苷酶的酿酒酵母,在进行酒精发酵的同时提高香气物质含量已成为葡萄酒行业关注的重要课题之一。
本研究是对本实验室筛选得到的一株高产β-D-葡萄糖苷酶的酿酒酵母(KDLYS9-3)[6]的菌体生长、产酶以及彼此间的关系在实验的基础上,建立动力学模型,探索细胞生长对产酶的影响,并对该菌所产β-D-葡萄糖苷酶的动力学参数Km和Vmax进行测定,为理论研究和实际应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 酿酒酵母
自选酿酒酵母KDLYS9-3:本研究室于2010年采摘沙城产区夹河、沙营和东水泉3个乡的龙眼葡萄,带回实验室后分别进行自然发酵,在自然发酵后期分离得到的一株酵母菌,对该菌株进行了WL培养基培养的菌落和显微形态分类,结合5.8S rRNA-ITS区域及核糖体26S D1/D2区域RFLP分析的分子鉴定和基因测序证明是一株酿酒酵母[6],后经王彩肖等[7]鉴定为高产β-D-葡萄糖苷酶的菌株。该菌株Genebank登录号为:KX098507,核糖体26S D1/D2区域限制片长多态性(restriction fragment length polymorphism,RFLP)分析的基因序列为:
AGGGGCATTGCCTTAGTACGGCGAGTGAGCGGC AAAAGCTCAAATTTGAAATCTGGTACCTTCGGTGCCC GCGTTGTAATTTGGAGAGGGCAACTTTGGGGCCGTTC CTTGTCTATGTTCCTTGGAACAGGACGTCATAGAGGG TGAGAATCCCGTGTGGCGAGGAGTGCGGTTCTTTGTA AAGTGCCTTCGAAGAGTCGAGTTGTTTGGGAATGCA GCTCTAAGTGGGTGGTAAATTCCATCTAAAGCTAAAT ATTGGCGAGAGACCGATAGCGAACAAGTACAGTGAT GGAAAGATGAAAAGAACTTTGAAAAGAGAGTGAAAAAGTACGTGAAATTGTTGAAAGGGAAGGGCATTTGATCAGACATGGTGTTTTGTGCCCTCTGCTCCTTGTGGGTAGGGGAATCTCGACTTTCACTGGGCCAGCATCAGTTTTGGTGGCAGGATAAATCCATAGGAATGTAGCTTGCCTCGGTAAGTATTATAGCCTGTGGGAATACTGCCAGCTGGGACTGAGGACTGCGACGTAAGTCAAGGATGCTGGCATAATGGTTATATGCCGCCCGTCTTGAACCACGGACCA。
商品对照菌(安琪葡萄酒酵母):中国湖北安琪活性干酵母股份有限公司。
培养基:斜面保藏培养基使用固态YEPD培养基;发酵培养基为液态YEPD培养基。
1.1.2 试剂
对硝基苯基-β-D-葡萄糖苷(pNPG):上海宝曼生物科技有限公司;对硝基苯酚(pNP):天津市博迪化工有限公司;磷酸二氢钠、柠檬酸和无水碳酸钠:天津永大化学试剂有限公司;蛋白胨、葡萄糖、酵母浸粉和琼脂:北京澳博星生物技术有限责任公司。
1.1.3 仪器
Multiskan FC酶标仪:Thermo Fisher Scientific公司;DK-98-1型电热恒温水浴锅:天津市泰斯特仪器有限公司;Jnoec-XS-212202型生物显微镜:南京雄姿光电仪器有限公司;高速离心机LG16-C:北京雷博尔离心机有限公司;ZQTY-70型恒温振荡培养箱:上海知楚仪器有限公司。
1.2 方法
1.2.1 酶活力的测定
粗酶液的获得:挑取保藏斜面上的单菌落,接种到YEPD液态培养基中进行菌种的活化培养,当活菌数达到108~109个/mL时,以106个/mL的接种量接种到液态YEPD培养基中进行发酵产酶培养,培养条件为28℃、190 r/min振荡培养48 h。培养结束后将菌悬液在4 000 r/min下离心15 min,取上清液视为粗酶液待用。
酶活力的测定参考王彩肖等[7]方法。
β-D-葡萄糖苷酶的酶活力单位定义:50℃,pH 5.0时,1 min内β-D-葡萄糖苷酶水解底物pNPG产生1 μmol的pNP所需的酶量。
1.2.2 酵母菌生长曲线的测定
测定酵母生长曲线是在发酵期间定时取样,用无菌水适当稀释,生物显微镜下血球计数板计数,得到菌体的浓度,计算公式为:x=50 000nb
式中:x为总菌数(个/mL);50 000为生物显微镜的自身系数;n为显微镜中上下计数室菌数的平均值;b为稀释倍数,试验做3次平行。
1.2.3 动力学方程及参数的测定
Logistic方程[8]是一种典型的“S”型的模型方程[9-10],最初被用于人口增长趋势的统计,该模型和菌体生长具有很大的相似性,所以利用Logistic方程建立菌体生长模型;利用DoseResp方程建立产酶的动力学模型;菌体生长与产酶之间的关系模型采用Nelder数学方程建立。通过Excel 2003和Origin 8.0软件进行试验值与方程计算值的线性和非线性拟合,并在模型的基础上进行试验验证。
分别配制底物浓度为 5、10、20、30、35 mmol/L,在其他条件相同的情况下测定酶活力,利用Lineweaver-Burk法(简称L-B法,也称双倒数法)作图求得自选酿酒酵母KDLYS9-3所产β-D-葡萄糖苷酶的动力学参数Km值和Vmax值。
2 结果与分析
2.1 自选酿酒酵母KDLYS9-3生长与产酶的测定
发酵过程中每间隔一定时间取样分别测定菌体总数和酶活力,以时间为横坐标,菌体总数和β-D-葡萄糖苷酶活力分别为纵坐标作图得到图1。

图1 KDLYS9-3产酶与菌数曲线图Fig.1 The curve of enzyme and colonies production for KDYLS9-3
可以看出KDLYS9-3存在4 h~8 h的延滞期,在延滞期内菌体适应新的生长环境,几乎检测不到β-D-葡萄糖苷酶的活力,说明菌种在这个时期产酶较少;8 h~39 h为菌体生长的对数期,菌体数量迅速增加。39 h~48 h为菌种生长的稳定期。而菌体产酶活力在8 h~42 h快速提高,42 h~48 h期间维持较高活性,说明在菌体生长的对数期和稳定期是菌体产酶的最佳时期;在48 h后菌体生长进入衰亡期,菌体产酶量也较低。从菌数和酶活力的关系可以得出结论,自选酿酒酵母KDLYS9-3产β-D-葡萄糖苷酶属于对数和稳定期型,即在菌体生长的初期和衰亡期不会产生大量的酶,对数期和稳定期为产酶的最佳时期,说明菌体生长与产酶具有半偶联的关系。
2.2 自选酿酒酵母KDLYS9-3菌体生长动力学模型的建立与拟合
由图1可以看出菌体的生长符合“S”型曲线,Logistic方程[11]被广泛地用于描述菌体生长的模型,通过不依赖于基质浓度的“S”形曲线,简单计算得到具有生物学和几何意义的发酵动力学参数[12-13],说明本研究可以利用Logistic方程建立数学模型,基本公式为:

式中:X为菌体的总菌数,个/mL;Xm为最大细胞浓度,个/mL;μm为最大比生长速率,h-1。由于在 0~8 h时菌体数量基本不增加,所以对本方程进行改进为在t>8 h进行积分,以 t=0 时 X=X0为初始条件,对(1)式积分得:
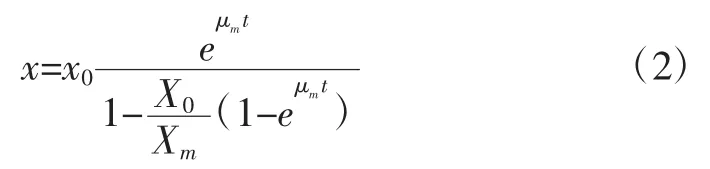
由式2可以整理为公式3:

由图1中的生长曲线和试验数据可知,Xm为最大的菌体浓度1.50×109个/mL,可将公式3看做为:


图2 直线回归方程Fig.2 Linear regression equation
由图2中的线性回归方程的直线斜率K=μm=0.241 2,又由截距可以求得 x0为 2.55×106,xm=1.50×109,μm带入式2中最终得到KDLYS9-3的生长动力学模型为:
①当发酵时间在t=0时,方程为

②当发酵时间为t>0 h

由模型计算所得曲线与试验所得数据曲线的对比为图3。
由图3和图4可以看出,所建模型与试验所测得的数据具有很高的相似性,各数据点的残差较小,说明模型和实测值拟合较好,所建模型可以很好的描述菌种细胞的增长趋势,既菌体经过一段时间的延滞期,之后快速的增长,在39 h之后达到稳定期,之后菌体受环境的影响,使之在一定的时间内保持稳定。通过模型与试验的拟合,可以说明所建模型可以应用到实际的发酵操作中。
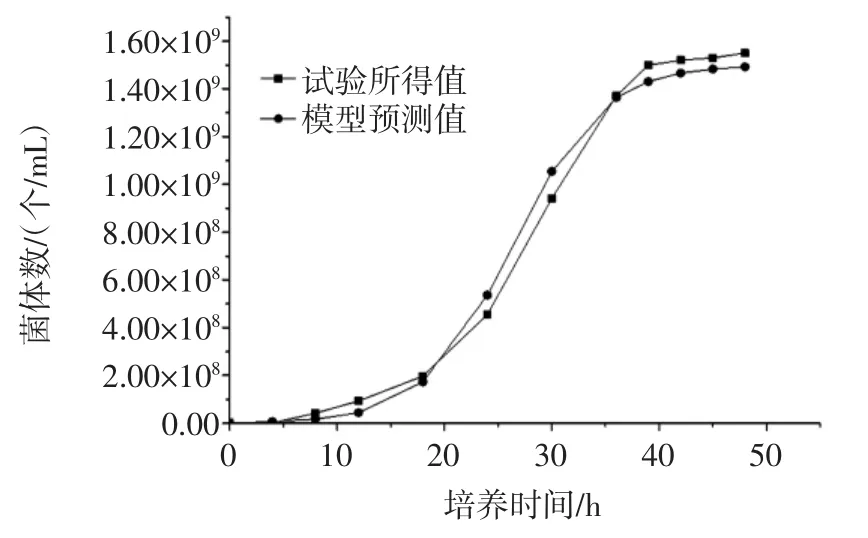
图3 菌体生长动力学模型预测值与实验值对比图Fig.3 Comparison of predicted values and experimental values of the growth kinetics model of the yeast
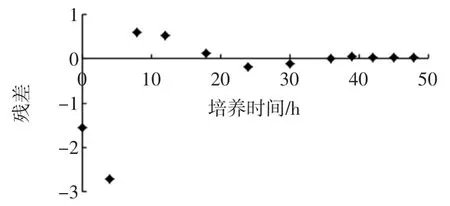
图4 Origin8.0拟合各数据点残差图Fig.4 The fitting of residual for each data point in Origin8.0
2.3 产酶活力动力学模型的建立与拟合
由图1可以看出,酶活曲线呈现类似“S”型,所以本研究使用DoseResp方程进行拟合。DoseResp方程是一种“S”型函数方程,被使用在类菌体生长、受菌体生长的产物生成、基质消耗等[14-15],本研究对产酶活力的动力学建立模型。DoseResp方程公式为:

式中:P(t)为酶活,U/mL;A1、A2、LOGx0和 C 为待定常数,t为生长时间,h。
由实时酶活力测定值P和时间t的对应关系,通过软件Origin 8.0软件进行拟合,可得到常数A1、A2、LOGx0和C分别如表1。

表1 DoseResp方程拟合相关参数Table 1 Fitting parameters of DoseResp equation
由表1可以看出,常数的标准误差都小于0.5,说明拟合效果较好,P<0.05,P 值较小,R2=0.998 74,说明拟合模型极显著,可以反映试验结果。最终得到产酶酶活数学模型为:

由模型的预测值与试验所得值进行比较,做图5和图6。

图5 酶活模型预测值与实验值对比图Fig.5 Comparison of predictive value and experimental value of enzyme activity model

图6 Origin8.0拟合各数据点残差图Fig.6 The fitting of residual for each data point in Origin8.0
由图5和图6可以看出模型预测值与实验值吻合度很好,各个数据点与预测数据点之间的残差都在-0.000 8~0.000 8之间,说明了所建的方程模型可以很好的反映酶活力与发酵时间之间的关系,可以为今后利用自选酿酒酵母KDLYS9-3进行酿酒试验提供数据基础。该模型显示了很好的拟合效果,且具有快速和简便的优点,可以很准确的反应试验结果。
2.4 菌体生长与产酶相关性模型的建立
由图1可以看出,β-D-葡萄糖苷酶是在自选酿酒酵母KDLYS9-3的生长过程中产生的,菌体生长和产酶具有部分偶联关系,本研究利用Nelder方程建立模型,并利用Origin软件进行拟合。基础方程式为公式9:
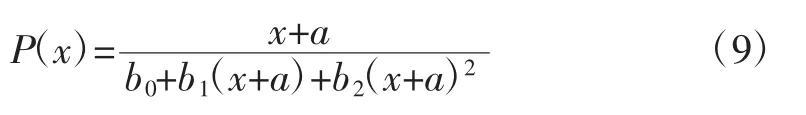
式中:P(x)为反应酶活(U/mL);a、b0、b1和 b2为待定常数;x为菌体数量(106个/mLl)。
经过软件Origin软件拟合方程参数为表2。

表2 Nelder方程拟合参数Table 2 Fitting parameters of Nelder equation
由表2可以看出,常数的标准误差都较小,说明拟合效果较好,P<0.001,P 值较小,R2=0.984,说明拟合模型极显著,模型预测结果可以很好的反映实验结果。最终得到菌体生长与产酶的关系数学模型为:

由模型的预测值与试验所得值进行比较,做图7和图8。
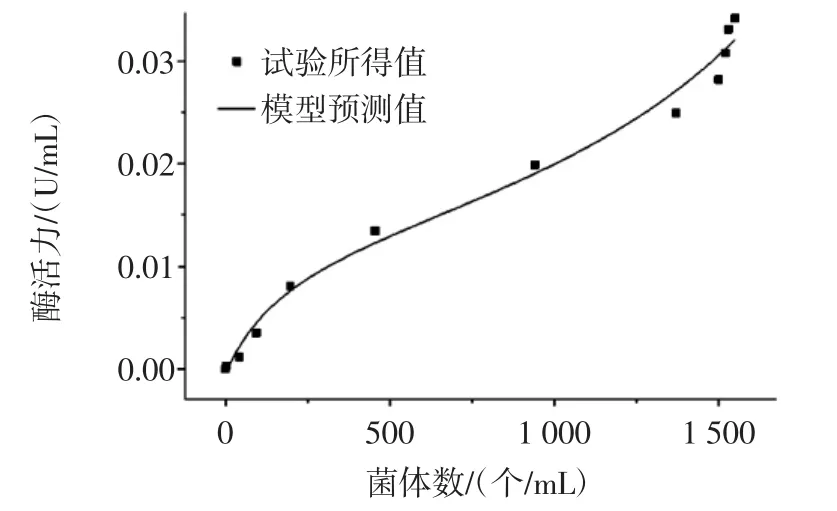
图7 总菌数与酶活的关系Fig.7 The relationship between total colonies and enzyme activity

图8 Origin8.0拟合各数据点残差图Fig.8 The fitting of residual for each data point in Origin8.0
由图7和图8可以看出,试验值与模型预测值吻合较好,说明所建模型符合试验的真实性,可以很好的对自选酿酒酵母KDLYS9-3的生长与β-D-葡萄糖苷酶的生成之间的关系进行描述,由残差图可以看出各数据点的残差在-0.003~0.003之间,也说明了模型可以真实的反映试验的真实值,可以用公式10描述菌体生长与产酶之间的半偶联关系。
2.5 KDLYS9-3产β-D-葡萄糖苷酶的动力学参数Km和Vmax
利用米氏方程[16]和L-B作图法对自选酿酒酵母KDLYS9-3产β-D-葡萄糖苷酶的动力学参数Km值和Vmax值进行测定,以商品安琪酿酒酵母为对照菌,分别以底物浓度为横坐标和酶活力为纵坐标做图9。

图9 底物浓度与酶活的关系Fig.9 The relationship between substrate concentration and enzyme activity
由图9可以看出,底物浓度与对酶活力的影响,在底物浓度5 mmol/L~35 mmol/L范围内,酶活力随底物浓度的升高而逐渐增大。以米氏方程11和12可建立1/S和1/V的一元线性关系;

以1/S为横坐标和1/V为纵坐标做图10。
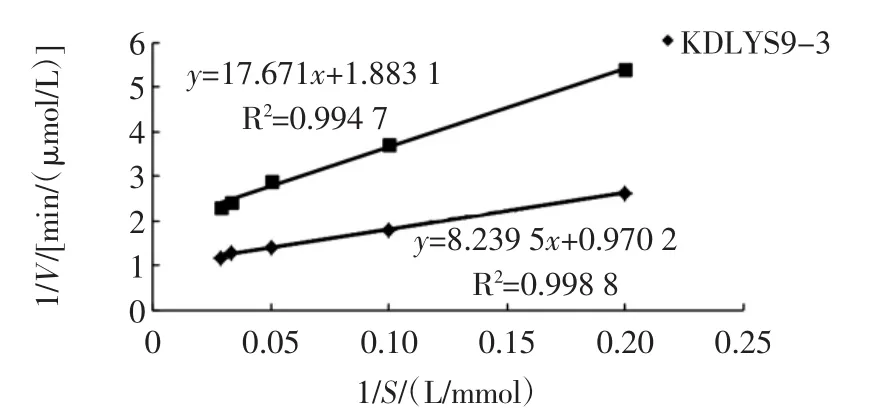
图10 两种酵母菌所产酶1/V和1/S关系图Fig.10 The relationship of 1/V and 1/S in the enzyme from the two yeasts
由图10可以看出KDLYS9-3和安琪酵母所产酶的1/S和1/V的线性拟合方程分别为y=8.239 5x+0.970 2和y=17.671x+1.8 831,线性相关性系数R2分别为0.998 8和0.994 7,拟合直线与试验值吻合度很高,说明拟合效果很好。由横纵截距可以求出KDLYS9-3的酶动力学参数为Km=8.492 579 mmol/L,Vmax=1.030 715(μmol/L)/min;安琪酵母的 β-D-葡萄糖苷酶动力学参数为Km=9.383 994 mmol/L,Vmax=0.531 039(μmol/L)/min。
Km可以反映底物与酶的亲和力大小,Km越小,说明酶与底物的亲和力越强,反之则越弱[17-18],由两种菌的酶动力学参数Km和Vmax可以看出:KDLYS9-3的Km值小于安琪酵母的Km值,说明KDLYS9-3所产β-D-葡萄糖苷酶对pNPG底物的反应亲和力要强于商品菌安琪酿酒酵母。
3 结论
本文应用Logistic方程、DoseResp方程和Nelder方程分别对自选高产β-D-葡萄糖苷酶的酿酒酵母KDLYS9-3生长、产酶、生长与产酶之间的半偶联关系进行了数学描述,建立了数学模型,结果显示出所建数学模型与实验值吻合性很好,证明了生长和产酶存在的部分偶联关系。对自选菌和商品菌所产β-D-葡萄糖苷酶的动力学参数Km和Vmax值进行测定,由此证明了KDLYS9-3所产β-D-葡萄糖苷酶对pNPG的底物亲和力强于对照菌,该菌株具有很好的应用潜质。
[1]Gamero A,Hernández-Orte P,Querol A,et al.Effect of aromatic precursor addition to wine fermentations carried out with different Saccharomyces species and their hybrids[J].International journal of food microbiology,2011,147(1):33-44
[2]González-Pombo P,Fariña L,Carrau F,et al.Aroma enhancement in wines using co-immobilized Aspergillus niger glycosidases[J].Food chemistry,2014,143:185-191
[3]Ünal M Ü,Aksoy V A,şener A.Isolation,purification and determination of some biochemical properties of β-glucosidase from Muscat of Bornova grape[J].European Food Research and Technology,2014,238(1):9-15
[4]Rodríguez M E,Lopes C,Valles S,et al.Selection and preliminary characterization of β-glycosidases producer Patagonian wild yeasts[J].Enzyme and Microbial Technology,2007,41(6):812-820
[5]Ferreira R B,Pi?arra-Pereira M A,Monteiro S,et al.The wine proteins[J].Trends in food science&technology,2001,12(7):230-239
[6]赵静静,李艳.沙城产区酿酒酵母多样性研究[J].食品科学,2012,33(5):224-228
[7]王彩肖,武伟伟,李艳.产β-D-葡萄糖苷酶酵母菌的筛选及产酶性质研究[J].酿酒科技,2014(10):14-18
[8]Komali A S,Zheng Z,Shetty K.A mathematical model for the growth kinetics and synthesis of phenolics in oregano(Origanum vulgare)shoot cultures inoculated with Pseudomonas species[J].Process Biochemistry,1999,35(3):227-235
[9]郑毅,张志国,关雄.苏云金芽孢杆菌蛋白酶发酵动力学模型的构建[J].生物数学学报,2008,23(4):727-734
[10]刘建忠,翁丽萍.黑曲霉过氧化氢酶发酵过程的数学模型[J].工业微生物,2002,32(3):6-9
[11]Gabriel J P,Saucy F,Bersier L F.Paradoxes in the logistic equation[J].Ecological Modelling,2005,185(1):147-151
[12]张凯丽,郑晗青,牛启启,等.酿酒酵母工程菌分批发酵产UMP动力学模型[J].食品工业科技,2015,36(9):158-161
[13]Mahajan P M,Gokhale S V,Lele S S.Production of nattokinase using Bacillus natto NRRL 3666:media optimization,scale up,and kinetic modeling[J].Food Science and Biotechnology,2010,19(6):1593-1603
[14]李侠,彭丹,张春晖,等.红枣酒发酵动力学研究[J].中国酿造,2012,31(1):190-193
[15]王虎虎,董洋,徐幸莲,等.酸化亚氯酸钠对鸡肉致病菌的致死模型研究[J].中国食品学报,2013(9):33-38
[16]Epstein E,Hagen C E.A kinetic study of the absorption of alkali cations by barley roots[J].Plant physiology,1952,27(3):457
[17]Jacobo-Velázquez D A,Hernández-Brenes C,Cisneros-Zevallos L,et al.Partial purification and enzymatic characterization of avocado(Persea americana Mill,cv.Hass)lipoxygenase[J].Food research international,2010,43(4):1079-1085
[18]Anese M,Sovrano S.Kinetics of thermal inactivation of tomato lipoxygenase[J].Food chemistry,2006,95(1):131-137
Research on the Enzyme Kinetics of Poducing Beta-D-Glucosidase from Indigenous Saccharomyces cerevisiae KDLYS9-3
LI Yan1,2
(1.College of Bioscience and Bioengineering,Hebei University of Science and Technology,Shijiazhuang 050018,Hebei,China;2.Hebei R&D Center for Fermentation Engineering,Shijiazhuang 050018,Hebei,China)
Indigenous Saccharomyces cerevisiae KDLYS9-3 produces high activity beta-D-glucosidase,and it has the effect of enhancing aroma during the wine making process.Based on the experiment of bacteria growth and enzyme production,the Logistic equation,DoseResp equation and Nelder equation were used to build a dynamic model for the yeast growth and enzyme production,and the relationship of yeast growth rate and enzyme producing rate in this study.After the nonlinear fitting by Origin 8.0 software,and graphed by the method of Lineweaver-Burk,the kinetic parameters of Kmand Vmaxvalues for the enzymes of this yeast producing beta-D-glycosidase were detected.The result shows that the bacteria growth and enzyme production dynamic model of KDLYS9-3 were correlation with the test results,the dynamic model equation can reflect the variety regulation of bacteria growth and enzyme production,the correlation was part of the coupling relationship.The yeast began to produce enzymes after 8 h growth,and it produced a large number of enzymes when entered the logarithm of growth.The growth of yeast was stable after 39 h.With the decline phase of the yeast,the enzyme also stopped producing.The kinetic parameters of the KDLYS 9-3 enzyme were obtained by the double reciprocal method.The Kmwas 8.492 579 mmol/L,and the Vmaxwas 1.030 715 (mu/L)/min.The results helped set the basement of the strains'theoretical foundation and practical application.
Indigenous Saccharomyces cerevisiae KDLYS9-3;beta-D-glucosidase;kinetic equation;Km;Vmax
10.3969/j.issn.1005-6521.2017.23.032
河北省自然科学基金项目(C2011208028);河北省科技支撑计划项目(16227106D)
李艳(1958—),女(汉),教授,本科,研究方向:传统发酵工程创新技术、葡萄酒和果酒酿造。
2017-08-14
