纳米氧化铜催化2-芳基取代酞嗪酮的合成反应研究
2017-12-02马宇强马养民杨秀芳罗力文史天彩
张 金, 马宇强, 马养民, 2, 杨秀芳, 2,罗力文, 史天彩
(1.陕西科技大学 化学与化工学院, 陕西 西安 710021; 2.陕西农产品加工技术研究院, 陕西 西安 710021)
纳米氧化铜催化2-芳基取代酞嗪酮的合成反应研究
张 金1, 马宇强1, 马养民1, 2, 杨秀芳1, 2,罗力文1, 史天彩1
(1.陕西科技大学 化学与化工学院, 陕西 西安 710021; 2.陕西农产品加工技术研究院, 陕西 西安 710021)
酞嗪酮类化合物是一类具有良好药理活性的含氮杂环化合物.以邻甲酰基苯甲酸、苯肼为原料,以乙醇作为溶剂,在纳米CuO的催化下回流8 h,以较高的收率合成了2-芳基取代酞嗪酮类化合物10个,并通过1H-NMR、13C-NMR、MS、熔点等手段对产物进行了表征.结果表明,该合成酞嗪酮类化合物的方法具有操作简便、收率较高、溶剂与催化剂廉价易得等优点,且催化剂可重复使用.
酞嗪酮; 纳米氧化铜; 可回收
0 引言
杂环化学是有机化学的一个重要分支,含氮杂环化合物则在所有杂环化合物当中属于应用最广泛,种类最多的一类杂环化合物,多数含氮杂环化合物具有较好的生物活性、药理活性.酞嗪酮类化合物是一类六元含氮杂环化合物,据报导其在治疗糖尿病[1]、高血压[2]、乙型肝炎[3]、哮喘[4]、惊厥[5]、心血管疾病[6]等疾病都有良好的效果,如目前市场上一种成熟的药物-盐酸氮卓斯汀就属于酞嗪酮类化合物,可作为一种效果非常好的抗组胺剂来治疗过敏性鼻炎,并且在一些抑制剂如磷酸二酯酶抑制剂、聚腺苷二磷酸-核糖聚合酶抑制剂[7-9]中也可以发现酞嗪酮结构.基于酞嗪酮类化合物具有良好的生物活性、药理活性,该类化合物的合成受到广大有机合成工作者的关注.
国内外合成酞嗪酮的方法主要分为两类.一类是[3+2+1]环缩合反应,其特点为底物中有一个羰基,再通过CO羰基化反应与芳香肼反应缩合成环.这一类反应多以邻溴苯甲醛与苯肼[10]经过钯催化羰基化反应来完成,如图1(a)所示;随后也有很多科研工作者通过使用不同的CO替代品如八羰基二钴[11]、六羰基钼[12]等来完成这个反应,如图1(b) 所示;2014年湘潭大学邓国军教授课题组报导了一种使用邻溴苯甲酸甲酯与苯肼反应,钯催化剂催化多聚甲醛作为CO替代物来合成2-芳基取代酞嗪酮的方法[13],如图1(c) 所示.
另一类是[4+2]环缩合方法,主要是指使用邻甲酰基苯甲酸或邻苯二羰基化合物与苯肼来反应 ,如图2所示.本文所探究的反应亦属于这一类反应,如图3所示,这一类反应因不需要额外的羰基源故反应相对容易完成[14-19].然而目前已有的这些方法都或多或少的存在一定的局限性与不足,如使用贵金属Pd催化剂增加了反应成本;使用有毒的CO气体参与反应;使用毒性较大的溶剂等.因此,寻找一种高效、低廉的反应体系来合成酞嗪酮及其衍生物显得尤为重要.
本文发展了以纳米氧化铜为催化剂,乙醇为溶剂,邻甲酰基苯甲酸与苯肼为底物的一锅法合成2-芳基取代酞嗪酮的方法,该方法溶剂绿色无毒,催化剂高效低廉且可重复使用,实验操作也相对简单.
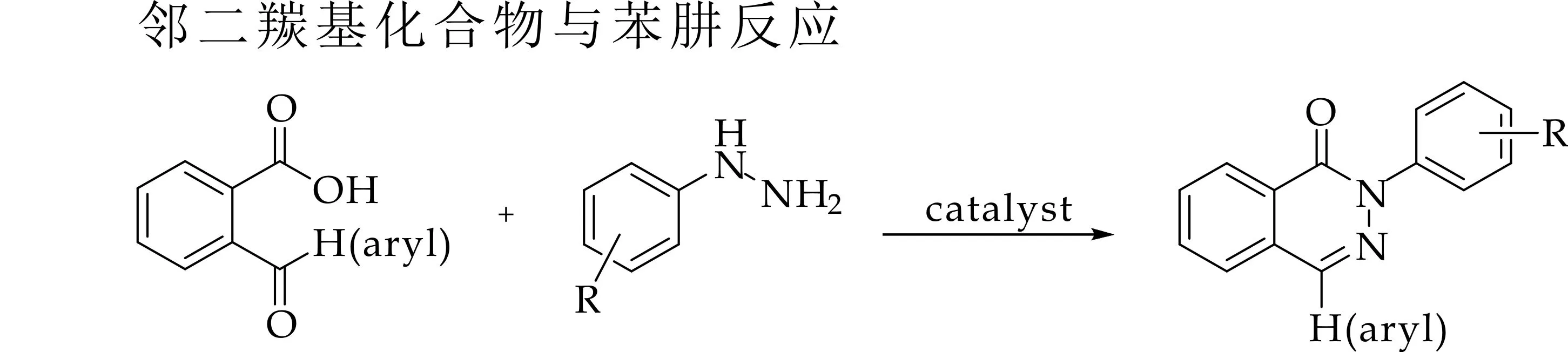
图2 [4+2]环缩合制备酞嗪酮
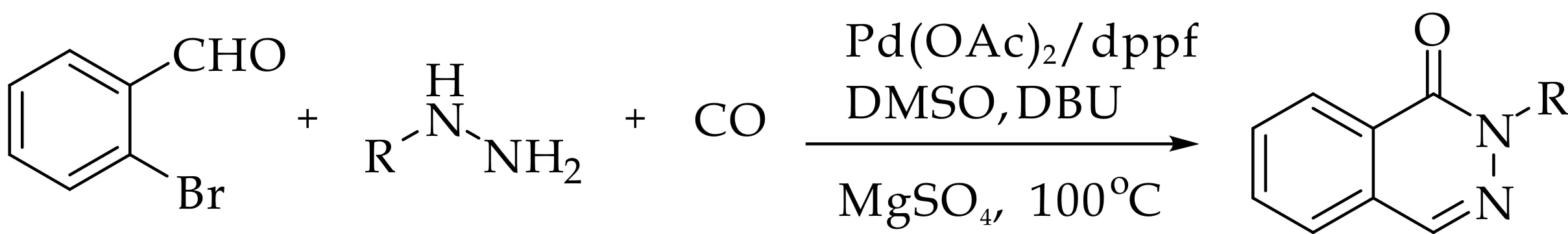
(a) CO为羰基化试剂

(b) Co2(CO)8为羰基化试剂

(c) (CH2O)n为羰基化试剂
图1 [3+2+1]环缩合制备酞嗪酮

图3 本文所用方法
1 实验部分
1.1 试剂与仪器
(1)主要试剂:纳米CuO (直径40 nm),阿拉丁试剂有限公司;邻甲酰基苯甲酸,阿拉丁试剂有限公司;所用的芳香肼,上海迈瑞尔化学技术有限公司.
(2)主要仪器:XT5 型显微熔点仪,北京市科仪电光仪器厂;AVANCE Ⅲ 400MHz 核磁共振仪(TMS内标)和Impact HDQ-TOF 高分辨质谱,德国 Bruker 公司; 旋转蒸发仪,上海亚荣科技有限公司;DF-101S 型集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司.
1.2 实验过程
2-芳基取代酞嗪酮的合成路线如图4所示.

图4 2-芳基-酞嗪酮的合成路线
在反应瓶中依次加入1.0 mmoL邻甲酰基苯甲酸、1.0 mmoL芳香肼、0.05 mmoL纳米CuO、5 mL无水乙醇,在回流的温度下搅拌反应,反应过程中使用TLC监测反应进程,反应结束后收集反应液倒入0.7 g硅胶(200~300目)中进行拌样,浓缩溶剂待干燥后研为粉末,使用硅胶装柱,用石油醚∶乙酸乙酯=10∶1混合溶剂为淋洗液,分离得到产物后通过重结晶纯化产物,并通过NMR、MS以及熔点测定对产物结构进行表征.
目标化合物表征数据如下:
2-苯基-1-(2H)-酞嗪酮(3a):棕褐色晶体,熔点:103 ℃~105 ℃,1H-NMR(CDCl3,400 MHz,ppm)δ8.52 (d,J=8.0 Hz,1H),8.30(s,1H),7.88-7.80(m,2H),7.77-7.75(m,1H),7.68-7.66(m,2H),7.52-7.49(m,2H),7.41-7.38(m,1H);13C-NMR (100 MHz,CDCl3,ppm)δ159.2,142.0,138.4,133.4,131.9,129.6,128.7,128.7,127.7,127.3,126.1,125.7;MS (EI) m/z (%) 221(100),193,165,89,77.HRMS calcd.for:C14H11N2O [M+H]+=223.087 1,found=223.087 3.
2-(4-甲基苯基)-1-(2H)-酞嗪酮(3b):棕褐色油状物,1H-NMR(CDCl3,400 MHz,ppm)δ8.51(d,J=8.0 Hz,1H),8.28(s,1H),7.87-7.79(m,2H),7.76-7.74(m,1H),7.54-7.52(m,2H),7.31-7.29(m,2H),2.41(s,3H);13C-NMR(100 MHz,CDCl3,ppm)δ159.2,139.4,138.3,137.7,133.4,131.7,129.5,129.4,128.6,127.2,126.1,125.5,21.2;HRMS calcd.for:C15H13N2O [M+H]+= 237.102 8,found=237.102 7.
2-(3-甲基苯基)-1-(2H)-酞嗪酮(3c):棕褐色油状物,1H-NMR(CDCl3,400 MHz,ppm):δ8.51(d,J=8.0 Hz,1H),8.28(s,1H),7.87-7.79(m,2H),7.76-7.74(m,1H),7.46-7.36(m,3H),7.21-7.20(s,1H),2.43(s,3H);13C-NMR (100 MHz,CDCl3,ppm):δ159.1,141.7,138.7,138.3,133.4,131.9,129.4,128.5,128.5,128.5,127.1,126.3,126.0,122.8,21.3;HRMS calcd.for:C15H13N2O [M+H]+=237.102 8,found=237.103 1.
2-(4-乙基苯基)-1-(2H)-酞嗪酮(3d):棕褐色固体,熔点104 ℃~106 ℃,1H-NMR(CDCl3,400 MHz,ppm)δ8.51(d,J=8.0 Hz,1H),8.28(s,1H),7.87-7.79(m,2H),7.75(d,J=8.0 Hz,1H),7.56(d,J=8.0 Hz,2H),7.33-7.31(m,2H),2.74-2.69(q,J=6.7 Hz,2H),1.28(t,J=8.0 Hz,3H);13C-NMR (100 MHz,CDCl3,ppm)δ159.1,143.8,139.6,138.2,133.3,131.8,129.5,128.6,128.1,127.2,126.0,125.5,28.5,15.4;HRMS calcd.for:C16H15N2O [M+H]+=251.118 4,found=251.118 1.
2-(4-甲氧基苯基)-1-(2H)-酞嗪酮(3e):淡黄色固体,熔点105 ℃~107 ℃,1H-NMR(CDCl3,400 MHz,ppm)δ8.53(d,J=7.8 Hz,1H),8.30(s,1H),7.95-7.74(m,3H),7.68-7.51(m,2H),7.10-6.98(m,2H);13C-NMR (100 MHz,CDCl3,ppm)δ159.2,158.9,138.2,135.0,133.3,131.8,129.5,128.5,127.2,126.9,126.0,114.0,55.5;HRMS calcd.for:C15H13N2O2[M+H]+=253.097 7,found=253.097 6.
2-(4-叔丁基苯基)-1-(2H)-酞嗪酮(3f):黄色固体,熔点85 ℃~87 ℃,1H-NMR(CDCl3,400 MHz,ppm)δ8.52(d,J=8.0 Hz,1H),8.28(s,1H),7.87-7.79(m,2H),7.75(d,J=8.0 Hz,1H),7.59- 7.57(m,2H),7.52-7.50(m,2H),1.36(s,9H);13C-NMR (100 MHz,CDCl3,ppm)δ159.2,150.7,139.4,138.2,133.3,131.8,129.5,128.6,127.3,126.0,125.7,125.2,34.6,33.3;HRMS calcd.for:C18H19N2O [M+H]+=279.149 7,found=279.149 9.
2-(3-氟苯基)-1-(2H)-酞嗪酮(3g):白色固体,熔点103 ℃~105 ℃,1H-NMR(CDCl3,400 MHz,ppm):δ8.49(d,J=7.6 Hz,1H),8.28(s,1H),7.93-7.76(m,2H),7.74(d,J=8.1 Hz,1H),7.53-7.41(m,3H),7.08(td,J=8.3,2.4 Hz,1H).13C-NMR (100 MHz,CDCl3,ppm):δ162.4(d,JCF=244 Hz),159.0,143.0(d,JCF=9.9 Hz),138.7,133.6,132.1,129.7(d,JCF=8.8 Hz),129.3,128.3,127.2,126.2,121.1(d,JCF=2.9 Hz),114.5(d,JCF=20.0 Hz),113.2 (d,JCF= 24.7 Hz).HRMS (ESI) Calcd for C14H10FN2O [M+H]+:241.077 7;Found:241.077 5.
2-(4-氟苯基)-1-(2H)-酞嗪酮(3h):棕褐色固体,熔点157 ℃~159 ℃,1H-NMR(CDCl3,400 MHz,ppm):δ8.50(d,J=7.6 Hz,1H),8.28(s,1H),7.88-7.74(m,3H),7.67- 7.62(m,2H),7.20-7.14(m,2H).13C-NMR(100 MHz,CDCl3,ppm):δ161.6 (d,JCF=246 Hz),159.1,138.6,137.8,133.6,132.1,129.4,128.4,127.5(d,JCF= 8.5 Hz),127.2,126.2,115.5(d,JCF=22.8 Hz).MS (EI) m/z (%) 240 (100),211,184,109,95;HRMS calcd.for:C14H9FN2O [M+H]+=241.077 2,found=241.077 1.
2-(4-氯苯基)-1-(2H)-酞嗪酮(3i):棕褐色固体,熔点168 ℃~170 ℃,1H-NMR (CDCl3,400 MHz,ppm)δ8.53(d,J=7.8 Hz,1H),8.31(s,1H),7.92-7.82(m,2H),7.81-7.76(m,1H),7.71-7.65(m,2H),7.51-7.45(m,2H).13C-NMR (100 MHz,CDCl3,ppm):δ158.6 ,139.9,138.2,133.2,132.8,131.6,129.0,128.3,127.9,126.8,126.4,125.7.HRMS calcd.for:C14H9ClN2O [M+H]+=257.047 62,found=257.047 60.
2-(3-氯苯基)-1-(2H)-酞嗪酮(3j):亮黄色固体,熔点133 ℃~135 ℃,1H-NMR(CDCl3,400 MHz,ppm):δ8.47 (d,J= 7.7 Hz,1H),8.26(s,1H),7.85-7.77(m,2H),7.73-7.70(m,2H),7.61 (d,J=8.0 Hz,1H),7.39(t,J=8.0 Hz,1H),7.33(d,J=8.3 Hz,1H).13C-NMR (100 MHz,CDCl3,ppm):δ158.9,142.7,138.7,134.1,133.6,132.1,129.5,129.2,128.2,127.6,127.1,126.2,125.8,123.7.HRMS calcd.for:C14H9ClN2O [M+H]+=257.047 62,found=257.047 61.
2 结果与讨论
2.1 反应条件的优化
以邻甲酰基苯甲酸、苯肼为反应底物,考察不同的溶剂、催化剂对反应产率的影响,结果如表1所示.当不加催化剂时以乙醇为溶剂,回流温度下反应6 h,此条件下酞嗪酮的产率只有30%(序号1);相同条件下加入5 mol% nano CuO作为催化剂时发现产率提升近一倍,表明纳米氧化铜的作用很大(序号2);当反应时间提升为8 h时产率达到了80%(序号3),然而进一步提升反应时间到10 h时,酞嗪酮的产率并没有很明显的提升(序号4),所以确定最佳反应时间为8 h;当使用纳米氧化锌替代纳米氧化铜作为催化剂时,相同的反应条件下只得到了40%产率的酞嗪酮,纳米四氧化三铁也被用于催化这个反应,但是并没有得到很高的产率(序号5-6),因此确定纳米氧化铜为最佳的催化剂;后面同样考察了不同的溶剂对于反应的影响,甲醇、乙腈、DMF相对于乙醇来说都没有能使反应更好的进行(序号7-9),经过以上的实验确定最佳反应条件为:使用纳米氧化铜作为催化剂,乙醇作为溶剂,在回流温度下搅拌反应8 h.
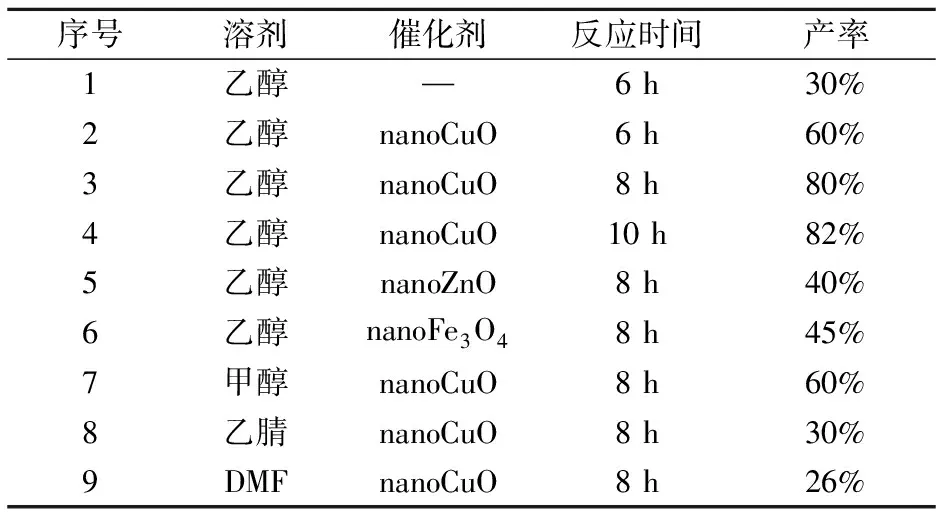
表1 反应条件的筛选
2.2 反应底物的拓展
在优化的反应条件下,考察该催化体系对目标产物的催化效果,结果如表2所示.从表2可以看出,相对来说,供电子取代基取代的苯肼得到的对应产物的产率较高,卤素取代的苯肼则反应活性较低;邻位间位取代基相对于对位取代基明显反应活性要有所降低,说明空间位阻效应对于这个反应有一定的影响.

表2 不同取代基团对产率的影响
2.3 催化剂的重复使用
将反应液过滤后回收得到的催化剂用乙醇洗涤、烘干,以邻甲酰基苯甲酸、苯肼为反应底物,探究使用不同次数后催化剂对于反应的催化效果,重复使用3次后发现3a的产率由80%降为73%,这说明催化剂的活性随着使用次数的增加并没有明显降低,如表3所示.

表3 催化剂的重复利用
3 结论
以纳米氧化铜作为催化剂,乙醇作为溶剂在回流温度下搅拌反应8 h可以有效合成2-芳基取代酞嗪酮,该方法具有实验操作简单,使用无毒的乙醇作为溶剂,价格低廉的纳米氧化铜作为催化剂,且催化剂具有可以回收重复使用,反应时间短、效率高等特点.
[1] Madhavan G R,Chakrabarti R,Kumar S K B,et al.Novel phthalazinone and benzoxazinone containing thiazolidinediones as antidiabetic and hypolipidemic agents[J].European Journal of Medicinal Chemistry,2001,36(7-8):627-637.
[2] Demirayak S,Karaburun A C,Beis R,et al.Some pyrrole substituted aryl pyridazinone and phthalazinone derivatives and their antihypertensive activities[J].European Journal of Medicinal Chemistry,2004,39(12):1 089-1 095.
[3] El Ashry E S,Abdel-Rahman A A,Rashed N,et al.Homoacyclovir analogues of unnatural bases and their activity against hepatitis B virus[J].Pharmazie,1999,54(12):893-897.
[4] Ukita T,Sugahara M,Terakawa Y,et al.Novel,potent,and selective phosphodiesterase-4 inhibitors as antiasthmatic agents:Synthesis and biological activities of a series of 1-pyridylnaphthalene derivatives[J].Journal of Medicinal Chemistry,1999,42(6):1 088-1 099.
[5] Grasso S,Derro G,De Sarro A,et al.Synthesis and anticonvulsant activity of novel and potent 6,7-methylenedioxyphthalazin-1(2H)-ones[J].Journal of Medicinal Chemistry,2000,43(15):2 851-2 859.
[6] Coelho A,Ravina E,Fraiz N,et al.Design,synthesis and structure-activity relationships of a novel series of 5-alkylidenepyridazin-3(2H)-ones with a non-cAMP-bas-ed antiplatelet activity[J].Journal of Medicinal Chemistry,2007,50(26):6 476-6 484.
[7] Vander M,Bommele K M,Boss H,et al.Synthesis and structure-activity relationships of cis-tetrahydrophthalazinone/pyridazinone hybrids:A novel series of potent dual PDE3/PDE4inhibitory agents[J].Journal of Medicinal Chemistry,2003,46(10):2 008-2 016.
[8] Cockcroft X L,Dillon K J,Dixon L,et al.Phthalazinones 2:Optimisation and synthesis of novel potent inhibitors of poly (ADP-ribose) polymerase[J].Bioorganic amp; Medicinal Chemistry Letters,2006,16(4):1 040-1 044.
[9] Prime M E,Courtney S M,Brookfield F A,et al.Phthalazinone pyrazoles as potent,selective,and orally bioavailable inhibitors of aurora-a kinase[J].Journal of Medicinal Chemistry,2011,54(1):312-319.
[10] Wu X F,Neumann H,Neumann S,et al.Palladium catalyzed synthesis of phthalazinones:Efficient carbonylative coupling of 2-bromobenzaldehydes and hydrazines[J].Chemistry-A European Journal,2012,18(28):8 596-8 599.
[11] Suresh A S,Baburajan P,Ahmed M.Convenient method for the synthesis of phthalazinones via carbonylation of 2-bromobenzaldehyde using Co2(CO)8as a CO source[J].Tetrahedron Letters,2014,55(24):3 482-3 485.
[12] Rao K P,Basak A K,Deb P K,et al.Microwave assisted palladium-catalyzed synthesis of phthalazinones and pyridopyridazinones[J].Tetrahedron Letters,2013,54(28):3 694-3 696.
[13] Wang H M,Cai J H,Huang H W,et al.Palladium-catalyzed phthalazinone synthesis using paraformaldehyde as carbon source[J].Organic Letters,2014,16(20):5 324-5 327.
[14] Shi L Y,Hu L,Wang J Q,et al.Highly efficient synthesis of n-substituted isoindolinones and phthalazinones using Pt nanowires as catalysts[J].Organic Letters,2012,14(7):1 876-1 879.
[15] Heravi M M,Baghernejad B,Oskooie H A,et al.A novel method for the synthesis of 1(2H)-phthalazinone derivatives using heteropolyacids as heterogeneous and recyclable catalysts[J].Organic Letters ,2008,14(5):375-384.
[16] Hemdan M M,Taha S M,Gabr A M,et al.Hydrazine derivatives and o-benzoylbenzoic acid as a source of phthalazines with their antimicrobial activities[J].Journal of Chemical Research,2010,34(2):102-105.
[17] Morgan D O,Ollis W D,Stanforth S P.Preparation and cycloaddition reactions of novel heterocyclic mesomeric betaines[J].Tetrahedron,2000,56(30):5 523-5 534.
[18] Poli D,Catarzi D,Colotta V,et al.The identification of the 2-phenylphthalazin-1(2H)-one scaffold as a new decorable core skeleton for the design of potent and selective human A3 adenosine receptor antagonists[J].Journal of Medicinal Chemistry,2011,54(7):2 102-2 113.
[19] Zare L,Mahmoodi N,Yahyazadeh A,et al.An efficient one-pot synthesis of pyridazinones and phthalazineones using HY-zeolite[J].Journal of Heterocyclic Chemistry,2011,48(4):864-867.
【责任编辑:陈佳】
CuOnanoparticles-catalyzedsynthesisof2-Arylsubstitutedphthalazinones
ZHANG Jin1, MA Yu-qiang1, MA Yang-min1,2, YANG Xiu-fang1,2, LUO Li-wen1, SHI Tian-cai1
(1.College of Chemistry and Chemical Engineering, Shaanxi University of Science amp; Technology, Xi′an 710021, China; 2.Shaanxi Research Institute of Agricultural Products Processing Technology, Xi′an 710021, China)
Phthalazinones is one of the nitrogen control heterocycle compounds and proved to have extensive pharmacological activities.Ten of substituted phthalazine-1(2H)-ones were prepared in good yields with 2-carboxybenzaitehyde and aromatic hydrazines as the substrate,alcohol as the solvent and nano CuO as the catalyst.All of the products were characterized by1H-NMR,13C-NMR,MS and melting points test.This method has many advantages,such as simple experimental procedures,environmentally friendly solvent,inexpensive and recyclable catalyst.
phthalazinones; nano CuO; recycable
2017-07-10
陕西省科技厅科技统筹创新工程计划项目(2016KTTSNY03-04); 陕西省科技厅重大科技创新计划项目(2013ZKC(二)07-03); 陕西省教育厅2017年专项科学研究计划(17JK0107); 陕西科技大学博士科研启动基金项目(BJ12-26)
张 金(1985-),男,黑龙江北安人,讲师,博士,研究方向:反应方法学
2096-398X(2017)06-0095-04
O626
A
