不同化疗方案对多发性骨髓瘤患者T细胞亚群及相关细胞因子水平的影响
2017-12-01宋丽丽潘迎英
宋丽丽,张 日,潘迎英⋆,郜 晓
(1.张家港市中医医院肿瘤血液科,江苏 张家港 215600;2.苏州大学附属第一医院血液科,江苏 苏州 215000)
不同化疗方案对多发性骨髓瘤患者T细胞亚群及相关细胞因子水平的影响
宋丽丽1,张 日2,潘迎英⋆1,郜 晓1
(1.张家港市中医医院肿瘤血液科,江苏 张家港 215600;2.苏州大学附属第一医院血液科,江苏 苏州 215000)
目的:探讨不同化疗方案对多发性骨髓瘤(multiple myeloma,MM)患者T淋巴细胞亚群和相关细胞因子水平的影响。方法:将2011年6月至2013年12月期间张家港市中医医院肿瘤血液科收治的60例MM患者随机分为硼替-地塞组(30例)和VAD-沙利组(30例)。为硼替-地塞组患者采用VD方案(硼替佐米+地塞米松)进行化疗,为VAD-沙利组患者联合应用改良的VAD方案(长春新碱+表柔比星+地塞米松)和沙利度胺进行化疗,并对比两组患者治疗的效果及治疗前后其调节性T细胞(Regulatory T cells,Treg)、辅助性T细胞17(T helper cell 17,Th17)、IL-6(白细胞介素-6)、IL-17(白细胞介素-17)和TGF-β(转化生长因子-β)的水平。结果:硼替-地塞组患者治疗的总有效率高于VAD-沙利组患者,治疗后其Treg的水平高于VAD-沙利组,其TH17、IL-6、IL-17的水平低于VAD-沙利组,差异有统计学意义(P<0.05)。结论:与联合应用改良的VAD方案和沙利度胺相比,用VD方案治疗MM的临床效果更好。
多发性骨髓瘤;硼替佐米;沙利度胺;细胞因子;辅助性T细胞17;调节性T细胞
多发性骨髓瘤(multiple myeloma,MM)是一种血液系统恶性肿瘤。此病的发病原因主要是患者骨髓中的浆细胞发生异常的克隆性增生[1]。临床研究发现[2],MM患者的血液循环中常存在T淋巴细胞与细胞因子的异常表达,前者主要包括调节性T细胞(Regulatory T cells,Treg)和辅助性T细胞17(T helper cell 17,Th17)等,后者主要包括白细胞介素-6(interleukin-6,IL-6)、白细胞介素-17(interleukin-17,IL-17)和转化生长因子-β(transforming growth factor-β, TGF-β)等。相关的临床研究证实,Treg与Th17的水平与
MM的发生、发展密切相关。为了对比用VD方案与联合应用改良的VAD方案和沙利度胺治疗MM的临床效果,笔者对张家港市中医医院肿瘤血液科收治的60例MM患者进行了对照研究。
1 研究对象与方法
1.1 研究对象的纳入标准
病情符合《血液病诊断及疗效标准》(第三版)中规定的MM的诊断标准。2)Durie-Salmon分期为Ⅰ期、Ⅱ期或Ⅲ期。
1.2 研究对象的临床资料
选取2011年6月至2013年12月期间张家港市中医医院肿瘤血液科收治的60例MM患者。将这60例患者随机分为硼替-地塞组(30例)和VAD-沙利组(30例)。硼替-地塞组患者中有男24例,女6例;其年龄在58岁至72岁之间,平均年龄(64.2±3.7)岁;其中Durie-Salmon分期为Ⅰ期的患者有5例,为Ⅱ期的患者有18例,为Ⅲ期的患者有7例;其中血中M蛋白类型为IgG型的患者有12例,为IgA型的患者有8例,为IgM型的患者有5例,为轻链型的患者有5例。VAD-沙利组患者中有男23例,女7例;其年龄在58岁至70岁之间,平均年龄(63.1±2.6)岁;其中Durie-Salmon分期为Ⅰ期的患者有6例,为Ⅱ期的患者有18例,为Ⅲ期的患者有6例;其中血中M蛋白类型为IgG型的患者有14例,为IgA型的患者有6例,为IgM型的患者有3例,为轻链型的患者有7例。两组患者的一般临床资料相比差异无统计学意义(P>0.05),具有可比性。
1.3 治疗方法
为硼替-地塞组患者采用VD方案进行化疗。具体的化疗方法是:1)在对患者进行化疗的第1天、第4天、第8天、第11天,使用1.3 mg/m2的硼替佐米(商品名:万珂,由西安杨森制药有限公司生产)对其进行静脉推注,1次/d。2)在对患者进行化疗的第1天、第2天、第4天、第5天、第8天、第9天、第11天、第12天,使用20 mg/m2的地塞米松对其进行静脉滴注,1次/d。3)治疗28天为1个周期,应连续治疗2个周期。为VAD-沙利组患者联合应用改良的VAD方案和沙利度胺进行化疗。具体的化疗方法是:1)让患者口服沙利度胺(商品名:反应停,由常州制药厂有限公司生产)进行治疗,开始用药时每天服100 mg。然后,根据患者的耐受情况逐渐为其增加用药量(每周最多增加50 mg),直至用药量达到200 mg/d。2)将0.5 mg的长春新碱加入到20 ml的生理盐水中,对患者进行静脉注射,1次/d。用药时间为对患者进行化疗的第1天和第4天。3)将l0 mg的表柔比星加入到20 ml的生理盐水中,对患者进行静脉注射,1次/d。用药时间为对患者进行化疗的第1天和第4天。4)将40 mg的地塞米松加入到250 ml的生理盐水中,对患者进行静脉滴注,1次/d。用药时间为对患者进行化疗的第1天、第2天、第3天、第4天、第9天、第10天、第11天、第12天、第17天、第18天、第19天、第20天。5)治疗28天为1个周期,应连续治疗2个周期。
1.4 检测设备和试剂
1.4.1 检测设备 本次研究所用的检测设备主要包括:1)1.5 ml的微量离心管、2 ml的微量离心管、移液器和微量高速离心机(均由Eppendorf公司生产)。2)超净工作台(由苏州净化设备仪器厂生产)。3)37 ℃恒温箱(由福意联恒温箱公司生产)。4)550酶标仪(由Bio-rad公司生产)。5)COBAS INTEGRA 400 Plus型全自动生化分析仪(由Roche公司生产)。6)MDF-328E型低温冰箱(由日本三洋公司生产)。7)FACS Calibur型流式细胞仪(由美国Becton Dickinson公司生产)。
1.4.2 检测试剂 本次研究所用的检测试剂主要包括:1)CD3/CD4/CD8单克隆抗体、CD4/ CD25单克隆抗体、鼠抗人Foxp3型单克隆抗体、CD3单克隆抗体、CD8单克隆抗体、IL-17A单克隆抗体、同型对照IgG2a和同型对照IgG1(均由美国Becton Dickinson公司生产)。2)IL-6检测试剂盒和IL-17检测试剂盒(均由上海拜力生物科技有限公司生产)。3)TGF-β检测试剂盒(由上海富众生物科技发展有限公司生产)。
1.5 检测方法
1.5.1 进行Treg检测和Th17检测的方法 采用流式细胞技术对两组患者Treg、Th17的水平进行检测。进行Treg检测的方法是:1)取两支流式管,分别标记为测定管和同型对照管。2)在这两支流式管中均加入20μl的 CD4-FITC抗体。然后,将5μl的CD25-APC抗体加入到测定管中,并将等量的同型抗体加入到同型对照管中。3)在测定管和同型对照管中分别加入受检者的细胞悬液100μl,避光孵育30 min。孵育结束后,用PBS缓冲液对这两支流式管中的细胞悬液进行离心洗涤,然后弃去上清液。4)在这两支流式管中加入固定液和破膜液,避光孵育30min。孵育结束后,用PBS缓冲液重悬细胞。5)将20μl的Foxp3-PE抗体加入到测定管中,并将等量的同型抗体加入到同型对照管中,避光孵育30 min。孵育结束后,用PBS缓冲液对细胞悬液进行离心洗涤,然后弃去上清液。6)使用0.3ml的PBS缓冲液重悬细胞,然后使用流式细胞仪对流式管中Treg的含量进行检测。进行TH17检测的方法是:1)取两支流式管,分别标记为测定管和同型对照管。2)在这两支流式管中均加入受检者的细胞悬液100μl。然后,将20μl的CD4抗体(FITC标记)和5 μl的CD3抗体(APC标记)加入到测定管中,将等量的同型抗体加入到同型对照管中,避光孵育30min。3)孵育结束后,用PBS缓冲液对这两支流式管中的细胞悬液进行离心洗涤。弃去上清液后,用PBS缓冲液重悬细胞,并对细胞悬液进行细胞染色。4)将染色后的细胞悬液加入到培养板中,按标准工作浓度依次加入佛波酯、离子霉素和含莫能霉素的Golgistop蛋白转运抑制剂,吹打混匀后将培养板置于细胞培养箱内培养5h。5)将培养后的细胞悬液重新置于测定管和同型对照管中,并在这两支流式管中均加入固定液和破膜液,避光孵育30min。孵育结束后,使用PBS缓冲液对细胞悬液进行离心洗涤。弃去上清液后,使用PBS缓冲液重悬细胞。6)将20μl的IL-17-PE抗体加入到测定管中,并将等量的同型抗体加入到同型对照管中,避光孵育30 min。孵育结束后,用PBS缓冲液对细胞悬液进行离心洗涤,然后弃去上清液。7)使用0.3 ml的PBS缓冲液重悬细胞,然后使用流式细胞仪对流式管中TH17的含量进行检测。
1.5.2 进行IL-6、IL-17和TGF-β检测的方法 采用ELISA双抗体夹心法对两组患者IL-6、IL-17和TGF-β的水平进行检测(严格按照试剂盒操作说明书中规定的实验步骤进行实验操作)。
1.6 观察指标
观察并对比两组患者治疗的效果及治疗前后其Treg、Th17、IL-6、IL-17和TGF-β的水平。
1.7 疗效评定标准
CR(完全缓解):患者的肿瘤病灶消失。2)PR(部分缓解):患者的肿瘤病灶缩小50%以上。3)MR(微效):患者的肿瘤病灶缩小25%至50%。4)NC(稳定):患者的肿瘤病灶缩小不足25%。5)PD(进展):患者的肿瘤病灶未缩小,甚至在增大。
1.8 统计学分析
采用SPSS 13.0统计软件对研究数据进行统计学处理,患者Treg、Th17、IL-6、IL-17和TGF-β的水平用(±s)表示,采用t检验,治疗的总有效率用%表示,采用χ²检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗效果的比较
硼替-地塞组患者中治疗效果为CR的患者有10例(占33.3%),为PR的患者有7例(占23.3%),为MR的患者有2例(占6.7%),为NC的患者有9例(占30.0%),为PD的患者有2例(占6.7%)。硼替-地塞组患者治疗的总有效率为93.3%(28/30)。VAD-沙利组患者中治疗效果为CR的患者有3例(占10.0%),为PR的患者有11例(占36.7%),为MR的患者有1例(占3.3%),为NC的患者有5例(占16.7%),为PD的患者有10例(占33.3%)。VAD-沙利组患者治疗的总有效率为66.7%(20/30)。与VAD-沙利组患者相比,硼替-地塞组患者治疗的总有效率更高,差异有统计学意义(P<0.05)。详见表1。
2.2 治疗前后两组患者Treg、Th17水平的比较
在进行治疗前,两组患者Treg、Th17的水平相比差异无统计学意义(P>0.05)。经过2个周期的化疗后,两组患者Treg的水平均较治疗前明显升高,其Th17的水平均较治疗前明显下降,差异有统计学意义(P<0.05)。与VAD-沙利组患者相比,硼替-地塞组患者Treg水平升高的幅度和Th17水平降低的幅度均更大,差异有统计学意义(P<0.05)。详见表2。
2.3 治疗前后两组患者IL-6、IL-17和TGF-β水平的比较
在进行治疗前,两组患者IL-6、IL-17和TGF-β水平相比差异无统计学意义(P>0.05)。经过2个周期的化疗后,两组患者IL-6、IL-17和TGF-β水平均较治疗前明显下降,差异有统计学意义(P<0.05)。与VAD-沙利组患者相比,硼替-地塞组患者IL-6水平和IL-17水平降低的幅度均更大,差异有统计学意义(P<0.05)。两组患者TGF-β水平降低的幅度相比差异无统计学意义(P>0.05)。详见表3。
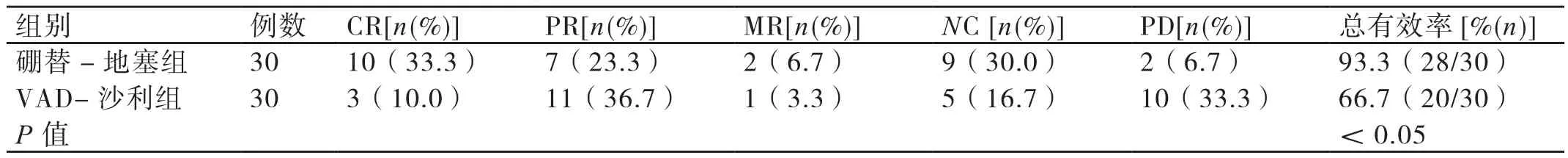
表1 两组患者治疗效果的比较
表2 治疗前后两组患者Treg、Th17水平的比较 ( %,±s)

表2 治疗前后两组患者Treg、Th17水平的比较 ( %,±s)
注:▲与治疗后比较,差异具有统计学意义,P<0.05;△与VAD-沙利组比较,差异具有统计学意义,P<0.05。
组别 例数 Treg的水平 Th17的水平治疗前 治疗后 治疗前 治疗后硼替-地塞组 30 3.48±1.20▲ 4.87±1.32△ 2.67±0.93▲ 1.73±0.91△VAD-沙利组 30 3.46±1.27▲ 4.35±1.22 2.64±0.97▲ 2.04±0.90
表3 治疗前后两组患者IL-6、IL-17和TGF-β水平的比较 ( ±s)
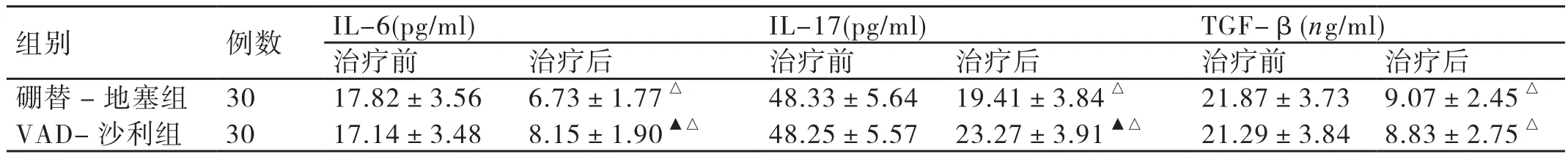
表3 治疗前后两组患者IL-6、IL-17和TGF-β水平的比较 ( ±s)
注:▲与硼替-地塞组比较,差异具有统计学意义,P<0.05;△与治疗前比较,差异具有统计学意义,P<0.05。
组别 例数 IL-6(pg/ml) IL-17(pg/ml) TGF-β(ng/ml)治疗前 治疗后 治疗前 治疗后 治 疗前 治疗后硼替-地塞组 30 17.82±3.56 6.73±1.77△ 48.33±5.64 19.41±3.84△ 21.87±3.73 9.07±2.45△VAD-沙利组 30 17.14±3.48 8.15±1.90▲△ 48.25±5.57 23.27±3.91▲△ 21.29±3.84 8.83±2.75△
3 讨论
MM是一种血液系统恶性肿瘤。此病的发病机制十分复杂。有研究指出,MM的发生、发展与电离辐射、慢性抗原刺激、免疫功能紊乱、EB病毒或疱疹病毒感染诱发的C-MYC、N-RAS、K-RAS或H-RAS密切相关。
Treg是一种同时具有免疫无能和免疫抑制两大特性的T细胞亚群。临床研究发现,MM患者Treg的水平与其病情的严重程度密切相关[3]。Th17是一种以分泌IL-17为主要特征的T细胞亚群。Schmidmaier H等[4]在临床研究中应用流式细胞仪对MM患者外周血及骨髓中Th17的水平进行检测。研究结果显示,MM患者外周血及骨髓中Th17的水平均明显高于正常人。
IL-6是一种细胞因子,具有刺激初始CD4+T细胞向Th17分化的作用[5]。有研究指出,MM患者IL-6的水平明显高于正常人,且其IL-6的水平与其病情的严重程度密切相关[6]。Fulciniti M等[7]指出,IL-6是促进骨髓瘤细胞生长的关键因子。
IL-17是Th17的主要效应分子。2006年,Alexandrakis MG等[8]通过临床研究发现,MM患者IL-17的水平明显高于正常人,且其IL-17的水平与其病情的严重程度密切相关。TGF-β是一种具有调节细胞生长和分化作用的细胞因子[9]。研究发现,几乎所有的肿瘤细胞中都可以检测到TGF-β的mRNA[10]。
硼替佐米、地塞米松、长春新碱、表柔比星、地塞米松和沙利度胺均为临床上常用的抗肿瘤药物[11]。硼替佐米(bortezomib)属于氨基硼酸衍生物,其商品名为万珂。此药能够有效地抑制转录因子NF-κB、肿瘤坏死因子α(TNF-α)、血管内皮生长因子(VEGF)和IL-6的活性,降低骨髓基质细胞的粘附能力[12]。沙利度胺(Thalidomide)属于谷氨酸衍生物,其商品名为反应停。此药具有调节免疫细胞活性、抑制炎性细胞因子活性和诱导抗肿瘤免疫反应等作用,从而可有效地抑制骨髓瘤细胞的生长和增殖[13]。为了对比用VD方案(硼替佐米+地塞米松)与联合应用改良的VAD方案(长春新碱+表柔比星+地塞米松)和沙利度胺治疗MM的临床效果,笔者将2011年6月至2013年12月期间张家港市中医医院肿瘤血液科收治的60例MM患者随机分为硼替-地塞组和VAD-沙利组。为硼替-地塞组患者采用VD方案进行化疗,为VAD-沙利组患者联合应用改良的VAD方案和沙利度胺进行化疗。治疗结束后,对比两组患者治疗的效果及治疗前后其Treg、Th17、IL-6、IL-17和TGF-β的水平。本次研究的结果显示,硼替-地塞组患者治疗的总有效率高于VAD-沙利组患者,治疗后其Treg的水平高于VAD-沙利组,其TH17、IL-6、IL-17的水平低于VAD-沙利组,差异有统计学意义(P<0.05)。
综上所述,与联合应用改良的VAD方案和沙利度胺相比,用VD方案治疗MM的临床效果更好。
[1]King AJ, Gooding S, Ramasamy K.Managing multiple myelo ma in the over 70s:a review[J].Maturitas, 2015, 80(2):148-154.
[2]Dasgupta A, Saxena R.Regulatory T cells:a review[J].Natl Med J India, 2012, 25(6):341-351.
[3]Joao C, Costa C, Coelho I,et al.Long-term su rvival in mul tiple myeloma[J].Clin Case Rep, 2014, 2(5):173-179.
[4]Schmidmaier R, Oversohl N, Schnabel B,et al.Helper T cell s (CD3 + /CD4 + ) within the autologous peripheral blood stem cell graft positively correlate with event free sur vival of multiple myeloma patients[J].Exp Oncol, 2008,30(3):240-243.
[5]全丽娜, 刘爱春, 郭秀臣,等.B非霍奇金淋巴瘤患者Th17、Treg水平及Th17/Treg失衡的研究[J].实用肿瘤学杂志, 2013, 27(5):400-405.
[6]Schaffert H, Pelz A, Saxena A,et al.IL-17-producing CD4 T cells contribute to the loss of B-cell tolerance in ex perimental autoimmune myasthenia gravis[J].Eur J Immun ol, 2015, 45(5):1339-1347.
[7]Fulciniti M, Hideshima T, Vermot-Desroches C,et al.A hig h-affinity fully huma n anti-IL-6 mAb, 1339, for the tr eatment of multiple myeloma[J].Clin Cancer Res, 2009,15(23):7144-7152.
[8]Alexandrak is MG, Pappa CA, Miyakis S,et al.Serum interle ukin-17 and its relationship to angiogenic factors in multip le myel oma[J].Eur J Intern Med, 2006, 17(6):412-416.
[9]Nowak R, Kwiecien M, Tkacz M,et al.Transforming growth factor-beta (TGF- beta) signaling in paravertebral musc les in juvenile and adolescent idiopathic scoliosis[J].Biomed Res Int, 2014(2014):594287-594287.
[10]Stephen TL, Rutkowski MR, Allegrezza MJ,et al.Transformi ng growth factor beta-mediated suppression of antitumo r T cells requ ires FoxP1 transcription factor expression[J].Immunity, 2014, 41(3):427-439.
[11]Soriani A, Fionda C, Ricci B,et al.Chemotherapy-elicited upregulation of NKG2D and DNAM-1 ligands as a therapeu ti c target in multiple myeloma[J].Oncoimmunology, 2013,2(12):e26663-e26663.
[12]李娟, 刘俊茹, 黄蓓晖,等.含硼替佐米的诱导化疗序贯自体造血干细胞移植治疗多发性骨髓瘤的疗效和安全性[J].中华内科杂志, 2012, 51(4):279-282.
[13]Mitsiades CS, Che n-Kiang S.Immunomodulation as a thera peutic strategy in the treatment of multiple myeloma[J].Crit Rev Oncol Hematol, 2013, 1(10):5-13.
R73
B
2095-7629-(2017)8-0064-04
宋丽丽,女,1983年12月出生,江苏张家港人,主治医师,硕士, 研究方向为血液疾病的诊断与治疗
*通讯作者:潘迎英
