五台山野生迎红杜鹃组织培养技术研究
2017-12-01,,,,,
, , , , ,
(1.山西农业大学农学院, 山西 太谷 030800;2.山西省临汾市曲沃县人力资源和社会保障局企业养老保险管理服务中心, 山西 临汾 043400)
·种子生产·
五台山野生迎红杜鹃组织培养技术研究
王育选1,任建宏1,王鹏丽1,王晓璐1,赵娟1,王瑞瑞2
(1.山西农业大学农学院, 山西 太谷 030800;2.山西省临汾市曲沃县人力资源和社会保障局企业养老保险管理服务中心, 山西 临汾 043400)
以五台山野生迎红杜鹃的种子为试验材料,比较了不同培养基配方、生长调节剂种类和浓度对迎红杜鹃组织培养的影响,建立了迎红杜鹃组织培养再生体系。结果表明:最佳消毒方式为70%的酒精浸泡30 s+8.0%次氯酸钠浸泡处理8 min+无菌水冲洗;基本培养基为Anderson+0.1 mg/L NAA;增殖培养基为Anderson+1.0 mg/L ZT+0.1 mg/L NAA;生根培养基为Anderson+1.0 mg/L NAA;炼苗移栽基质以腐殖土∶珍珠岩=2∶1混合效果最好。
迎红杜鹃; 组织培养; 五台山
迎红杜鹃(Rhododendronmucronulatum)为杜鹃科杜鹃属的植物,是我国华北地区仅有的2种野生杜鹃之一,又名迎山红、蓝荆子、尖叶杜鹃。迎红杜鹃一种落叶灌木,花先叶开放,花紫红色,自然花期早,且花期较长,耐寒性强,病虫害少,耐修剪,可在华北、东北地区广泛栽培,具有很高的观赏价值;而且它还具有药用价值,对于慢性气管炎、肠炎等有一定疗效[1-2]。迎红杜鹃分布于我国华北山区、东北大部,在山西省五台山也有分布,但十分稀少,已被列为二级保护植物[3]。
杜鹃可以通过播种、扦插、压条和组织培养进行繁殖[4-6]。迎红杜鹃种子较小,播种繁殖较难;扦插繁殖受材料限制繁殖系数较低;而组织培养是高效的无性繁殖技术, 也是种质创新和良种培育技术。已有学者对迎红杜鹃的嫩芽、嫩枝进行研究并建立了组织培养体系[7-9]。
本试验以五台山野生迎红杜鹃种子为材料,对迎红杜鹃种子外殖体消毒、诱导分化、增殖培养、生根培养和炼苗移栽进行系统研究,建立迎红杜鹃的快繁技术体系,为进一步开展五台山野生迎红杜鹃的种质资源保存、新品种选育和繁育推广工作提供参考依据。
1 材料与方法
1.1 试验材料及培养条件
试验材料为迎红杜鹃的种子,采自山西省五台山。无菌培养条件为:温度(25±20)℃,光照时间12 h/d,光照强度1 800~2 500 lx。
1.2 外殖体消毒
将迎红杜鹃的种子从蒴果中取出后包于滤纸中,以70%的酒精浸泡30 s后无菌水冲洗1次,再以0.1%升汞(HgCl2) 浸泡5~10 min或8.0%次氯酸钠(NaClO)浸泡5~10 min,最后用无菌水冲洗5次,每次2~3 min。消毒后种子接种于同一基本培养基上。每处理接种30粒饱满种子,重复3次。接种后30 d观察并记录不同消毒处理的污染率、褐化率和死亡率。种子植入后30 d观察并记录存活材料数。
污染率(%)=接种污染数/接种总数×100%;
成活率(%)=未污染发芽数/接种总数×100%;
褐化率(%)=未污染褐化数/接种总数×100%。
1.3 基本培养基
基本培养基使用Anderson、Read和改良MS 3种培养基和不同激素浓度的9个处理(见表2),培养基中另加30 g/L蔗糖、6.5 g/L琼脂粉,pH值为5.2~5.6。每处理接种30粒饱满种子,重复3次。种子植入后50 d观察并记录芽诱导率和生长情况。
1.4 增殖培养基
将种子萌发获得的组培苗接种于3种细胞分裂素
表2 不同基本培养基的诱导分化试验结果

处理培养基芽诱导率(%)生长情况1Anderson+0.1mg/LNAA56.7生长势好,叶色绿叶片较大、2Anderson+0.5mg/LNAA43.3生长势较好,叶色浅叶片窄3Anderson+1.0mg/LNAA30.0生长势较好,叶色浅叶片窄4Read+1mg/LZT+0.1mg/LNAA23.3生长势弱,叶色浅叶片窄5Read+3mg/LZT+0.5mg/LNAA43.3生长势弱,叶色浅6Read+5mg/LZT+1.0mg/LNAA50.0生长势较好,叶色绿叶片较大7改良MS+1mg/LZT+0.1mg/LNAA26.7生长势弱,叶色浅叶片窄8改良MS+3mg/LZT+0.5mg/LNAA40.0生长势较好,叶色绿9改良MS+5mg/LZT+1.0mg/LNAA36.7生长势若,叶色浅叶片窄
表3 不同组合增殖培养试验结果
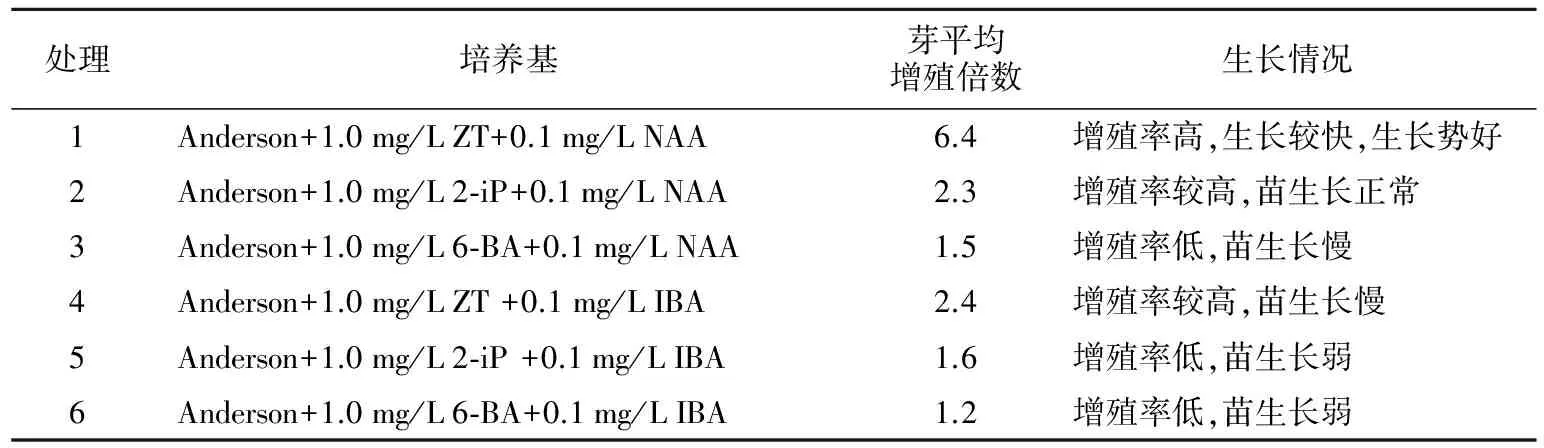
处理培养基芽平均增殖倍数生长情况1Anderson+1.0mg/LZT+0.1mg/LNAA6.4增殖率高,生长较快,生长势好2Anderson+1.0mg/L2⁃iP+0.1mg/LNAA2.3增殖率较高,苗生长正常3Anderson+1.0mg/L6⁃BA+0.1mg/LNAA1.5增殖率低,苗生长慢4Anderson+1.0mg/LZT+0.1mg/LIBA2.4增殖率较高,苗生长慢5Anderson+1.0mg/L2⁃iP+0.1mg/LIBA1.6增殖率低,苗生长弱6Anderson+1.0mg/L6⁃BA+0.1mg/LIBA1.2增殖率低,苗生长弱
(ZT、2-iP、6-BA)和2种生长素(NAA、IBA)组合的6种培增殖养基(见表3)。每处理接种无菌苗30棵,重复3次。30 d后观察丛生芽增殖倍数和生长情况。
1.5 生根培养基
当组培苗苗高为3 cm以上时,将其从基部切下,接种到IBA和NAA不同浓度的生根培养基(表4)中进行生根,每处理组培苗30棵,重复3次。60 d后观察生长情况。
1.6 炼苗移栽
将生根培养40 d的组培苗从无菌培养室转移到普通试验室,将瓶口松动完全揭开炼苗10 d。移栽时,将苗从培养瓶中取出,用自来水洗掉根部的培养基,将根浸泡在0.2%的多菌灵溶液中3 min,然后栽到由腐殖土和珍珠岩配置的4种不同基质中(表5) ,每个处理30株生根组培苗,30 d后调查统计小苗的成活率和生长情况。
2 结果与分析
2.1 不同消毒方式的消毒效果比较
迎红杜鹃种子植入培养基后12~15 d开始萌发,到20 d以后萌发数逐渐减少,30 d统计种子的污染率、褐化率和萌发成活率。迎红杜鹃种子采用不同消毒方式和时间的消毒效果见表1。结果表明,无论是升汞还是次氯酸钠,消毒时间越长,污染率和成活率越低,但外殖体的褐化率越高。在相同处理时间条件下,升汞处理的外殖体污染率低于次氯酸钠,但升汞处理的褐化率较高。从成活率看,升汞处理8 min的成活率为58.9%,略高于次氯酸钠处理8 min的成活率56.7%。综合而言,迎红杜鹃种子消毒最佳方式为70%的酒精浸泡30 s+次氯酸钠浸泡处理8 min+无菌水冲洗。
2.2 不同培养基对诱导分化的影响
不同培养基的种子诱导分化芽成活率和生长情况结果见表2。3种培养基诱导分化效果中以Anderson培养基效果最好,其次为Read培养基,改良MS培养基的效果较差。其中,Anderson+0.1 mg/L NAA培养基的诱导分化效果最好,成活率达56.7%,且组培苗生长势好,叶色绿且叶片较大。同一种类培养基不同激素浓度的诱导培养效果也存在差异,如Anderson+0.1 mg/L NAA培养基的成活率为56.7%,而Anderson+1.0 mg/L NAA的成活率仅为30.0%,且生长势弱,叶色浅叶片窄。由此可见,迎红杜鹃种子的最佳基本培养基为Anderson+0.1 mg/L NAA。
表1 不同消毒方式消毒效果的比较
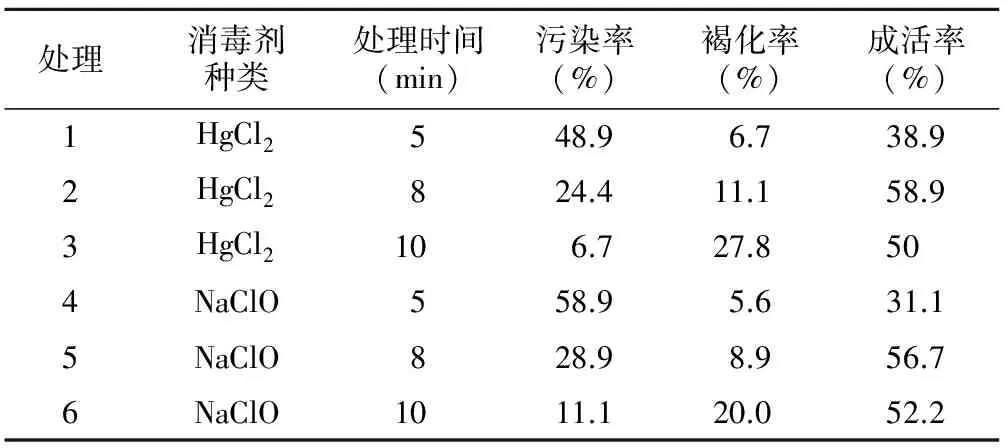
处理消毒剂种类处理时间(min)污染率(%)褐化率(%)成活率(%)1HgCl2548.96.738.92HgCl2824.411.158.93HgCl2106.727.8504NaClO558.95.631.15NaClO828.98.956.76NaClO1011.120.052.2
2.3 不同组合对增殖培养的影响
由表3可知,6种不同激素组合的培养基对组培苗的增殖倍数和生长情况产生较大影响。以Anderson+1.0 mg/L ZT+0.1 mg/L NAA的增殖效果最好,平均增殖倍数达6.4倍,且生长较快,长势好。不同的细胞分裂素增殖效果存在差异,ZT的增殖效果最佳,其次为2-ip,6-BA效果最差。不同的生长素对增殖培养的增殖倍数也有影响,NAA的效果明显高于IBA。
2.4 不同生根培养基对生根的影响
组培苗转入生根培养基30 d左右开始长出白色的根尖,之后逐渐伸长,60 d形成根系。本试验中,NAA的生根率和生根条数明显优于IBA。随着NAA的浓度升高,组培苗的生根率越高。而随着IBA浓度的变化,生根率先升高又下降,以0.5 mg/L浓度时生根效果最好。以Anderson+1.0 mg/L NAA生根培养基的生根效果最佳,生根率为93.3%,平均生根4.4条。
表4 不同生根培养基试验结果
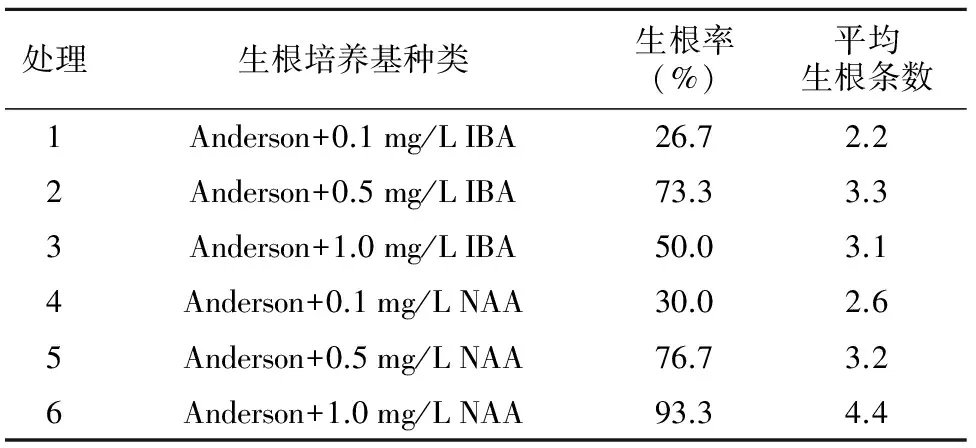
处理生根培养基种类生根率(%)平均生根条数1Anderson+0.1mg/LIBA26.72.22Anderson+0.5mg/LIBA73.33.33Anderson+1.0mg/LIBA50.03.14Anderson+0.1mg/LNAA30.02.65Anderson+0.5mg/LNAA76.73.26Anderson+1.0mg/LNAA93.34.4
2.5 不同基质对组培苗移栽成活的影响
由表5可知,3号基质(体积比腐殖土∶珍珠岩=2∶1)的移栽成活率86.7%,长势较好,效果最好;其次为2号基质,移栽成活率73.3%;4号珍珠岩基质移栽效果最差,成活率仅为26.7%,且生长势较弱。
表5 不同基质对组培苗移栽成活结果

处理基质移栽苗数(个)成活率(%)1腐殖土3066.72腐殖土∶珍珠岩=1∶13073.33腐殖土∶珍珠岩=2∶13086.74珍珠岩3026.7
3 结论与讨论
在植物组织培养工作中,无菌外殖体的获得非常重要。由于迎红杜鹃的种子较小,操作较为困难和灭菌不彻底造成污染,成为最终影响消毒效果的重要因素。本试验消毒过程中将种子包于滤纸中进行消毒处理,从而降低了操作难度,提高了工作效率。目前,杜鹃组织培养过程中通常采用升汞浸泡消毒,如周兰等[9]采用升汞消毒2~5 min处理迎红杜鹃茎段;李媛等[7]采用0.25 g/L多菌灵浸泡45 min+75%酒精消毒30 s+0.1%升汞消毒6 min处理嫩枝;吴雅文等[10]采用0.1%升汞3 min+无菌水清洗1 min+0.1%升汞3 min处理迷人杜鹃种子。本试验中升汞消毒处理8 min的成活率略高于次氯酸钠浸泡,但考虑到升汞属剧毒管制类药品,药品的购买和管理程序都较为复杂,因此可用次氯酸钠替代升汞。本试验采用70%的酒精浸泡30 s+8.0%次氯酸钠浸泡处理8 min+无菌水冲洗的消毒方式既可以达到良好的消毒效果,又可以减少对实验操作者的伤害和环境的污染。
目前,杜鹃类植物组织培养的培养基有Anderson、Read、MS、WPS等[5-6]。根据杜鹃种类、外殖体组织部位、生长状态等的营养需求不同选用培养基也不同。周兰对迎红杜鹃嫩枝使用改良MS培养基取得了较好的效果[9],而李媛则认为,选用Read培养基对嫩枝培养达到较好的诱导成活率[7]。本试验中,Anderson培养基的培养效果明显优于Read和改良MS培养基。选用Anderson+0.1 mg/L NAA培养基的成活率为56.7%,取得了较好的诱导效果。因此,选择适宜的培养基是植物组织培养成败的关键。
适当的生长调节剂能诱导植物的细胞分裂、分化、生长和发育。细胞分裂素ZT、2-iP和6-BA等诱导植物细胞发生增殖,在增殖培养中发挥关键作用[11]。在杜鹃的增殖培养中,有人认为细胞分裂素2-iP的效果好,也有人认为ZT更好,6-BA也有应用[6]。本研究仅对细胞分裂素和生长素的最佳组合进行了探讨,而已有研究表明,降低细胞分裂素浓度既可以提高增殖倍数又可保持较好的生长势,因此可以对此进一步研究优化。杜鹃的生根培养也需要使用适当种类和浓度的生长素[5-6]。本研究中迎红杜鹃的生根培养中使用NAA 1.0 mg/L效果较好。
生根组培苗的移栽成活率高低直接决定了组培体系的繁殖效率。而基质对组培苗移栽成活率具有重要影响。不同基质的保水性、肥力和透气性不同,从而影响组培苗的移栽成活率和生长状况[10]。本试验中采用腐殖土与珍珠岩体积比2∶1的混合基质表现出较优的移栽成活效果。腐殖土属微酸性土壤,可提供迎红杜鹃生长所需的酸性环境和肥力,珍珠岩则能提高土壤疏水性和透气性,有利于根生长。
[1]郁书君.华北乡土杜鹃——迎红杜鹃[J].中国花卉盆景,1992(7):6.
[2]陈有民,王玉华,俞玖,等.迎红杜鹃引种北京平原的研究[J].北京林业大学学报,1992(4):111-118.
[3]上官铁梁,谢树莲,郑凤英,等.山西省珍稀濒危植物及其保护对策研究[J].山西大学学报(自然科学版),1997,20(1):80-90.
[4]连亚燕,宋希强,史佑海.中国野生杜鹃花繁殖技术研究进展[J].热带农业科学,2015,35(4):96-100.
[5]张晓雅,孙红梅,田颖辉.杜鹃组织培养技术研究进展[J].北方园艺,2006(4):76-77.
[6]郭秀莲,张正银,王晓东,等.杜鹃花组织培养研究概况[J].时珍国医国药,2009,20(9):2 129-2 131.
[7]李媛,侯可雷.五莲山野生迎红杜鹃组织快繁技术[J].江苏农业科学,2014,42(8):55-56,180.
[8]杨丽娟,马立军,秦树林,等.迎红杜鹃组培繁殖技术的研究[J].吉林农业大学学报,2010,32(2):172-176.
[9]周兰,曹后男,孙博,等.迎红杜鹃组培快繁技术体系的研究[J].延边大学农学学报,2008,30(4):229-235.
[10]吴雅文,李枝林,白天,等.迷人杜鹃组培快繁技术的研究[J].种子,2015,34(3):112-116.
[11]刘志华,马艳红,曹枫.罗布麻种子组培再生体系的研究[J].种子,2010,29(4):5-8.
Research on Tissue Culture ofRhododendronmucronulatumfrom Wutai Mountain
WANGYuxuan1,RENJianhong1,WANGPengli1,WANGXiaolu1,ZHAOJuan1,WANGRuirui2
2016-10-25
山西省科技攻关项目(20130311014-1);山西农业大学博士科研启动项目(2012 YJ 13)。
王育选(1968—),男,硕士研究生,实验师,研究方向:植物组织培养。
赵 娟,博士,副教授,硕士生导师;E-mail:sxndzhaojuan@163.com。
10.16590/j.cnki.1001-4705.2017.03.122
S 685.21
A
1001-4705(2017)03-0122-04
