基于生长指标筛选耐低磷马尾松幼苗优良种源
2017-12-01,,,,
, , , ,
(贵州大学 a.农业生物工程研究院,山地植物资源保护与种质创新教育部重点实验室;b.贵州省森林资源与环境研究中心, 贵阳 550025)
基于生长指标筛选耐低磷马尾松幼苗优良种源
崔博文a,b,乔光a,范付华b,丁贵杰b,文晓鹏a
(贵州大学 a.农业生物工程研究院,山地植物资源保护与种质创新教育部重点实验室;b.贵州省森林资源与环境研究中心, 贵阳 550025)
以广西桐棉(GT)、福建龙岩(FL)、福建武平(FW)、江西崇义(JC)、湖南汝城(HR)、四川眉山(SM)及贵州孟关(GM)等7个种源的马尾松幼苗进行盆栽试验,采用营养液培养,探讨正常磷条件(KH2PO4浓度10 mg/L)和轻度低磷(4.0 mg/L)、中度低磷(2.0 mg/L)及重度低磷(0.5 mg/L)胁迫对马尾松幼苗生长情况的影响。结果表明,低磷胁迫对株高生长量、根系和地上部生物量以及根冠比都有不同程度的影响,其中对GT、FL、JC、HR和GM等种源马尾松幼苗的生长有抑制作用,但在SM和FW种源上,这些指标反而在不同程度上得到提升,SM的绝大多数生长指标高于FW,说明SM耐低磷的能力高于FW,并且这2个种源对低磷的耐受能力均高于其他种源;在筛选耐低磷胁迫的马尾松种源时,可以直接采用容易测定的生长指标进行耐性评价。
马尾松; 种源; 低磷胁迫; 生长指标
磷是植物生长发育不可缺少的营养元素之一,目前,土壤磷匮乏及低磷胁迫已成为严重影响农作物产量和森林生态系统生产力的逆境之一[1]。施用磷肥是目前农业生产上解决土壤磷缺乏的主要措施,但磷在土壤中迁移扩散能力较低,施入到土壤中的磷肥很容易转化为溶解度极低的磷酸盐或被土壤铁、铝氧化物吸附,使得土壤中磷的生物有效性较低,难以被作物吸收和利用[2],过度施磷还可能会引起一系列的环境污染。利用植物自身的遗传潜力筛选耐低磷种质是解决磷素障碍最经济有效的途径之一[3],现已成为植物营养学家和遗传育种学家共同关注的热点问题[4]。
植物为适应低磷胁迫会发生相应的变化,其中形态变化是低磷胁迫适应的主要形式[5]。马尾松(Pinusmassoniana)作为南方优势的用材树种,在其漫长的进化历程中,孕育了丰富的遗传多样性资源[6]。谢钰容[7]探讨了马尾松对低磷胁迫的适应机制和磷效率,表明福建武平和广东信宜两种源磷素敏感性较低;秦晓佳[8]通过不同磷浓度下生理生化及生长指标分析表明,贵州孟关种源较湖南汝城和广西古蓬种源更耐低磷胁迫,为马尾松耐低磷种质的进一步挖掘指明了方向。但以上研究所选种源相对较少,难以对不同马尾松产地进行比较评价。在马尾松种质已有的研究基础上,通过对低磷胁迫下7个不同种源马尾松幼苗的生长特性进行比较分析,旨在进一步挖掘马尾松耐低磷新种质,为生产提供优质种源。
表1 马尾松种源地概况及种子性状

种源地代码经度(°)纬度(°)年均温(℃)年降水量(mm)无霜期(d)千粒重(g)发芽率(%)四川眉山SM102.929.716.91257.53068.6965.00贵州孟关GM106.7126.5715.3120027010.8570.00广西桐棉GT10321.9222.1120035011.8278.33福建龙岩FL117.0125.1220.51705.42828.0155.00福建武平FW116.125.1120.41421.82787.8381.67江西崇义JC113.9725.6517.91739.53079.7148.33湖南汝城HR113.6825.5516.51545.727312.7645.00
表2 试验营养液的配方

大量元素浓度(g/L) 微量元素浓度(mg/L) Fe盐浓度(mg/L)Ca(NO3)2·4H2O1.18 H3BO32.86 FeSO4·7H2O2.78KNO30.51 MnCl2·4H2O1.81 EDTA⁃Na3.73MgSO4·7H2O0.49 ZnSO4·7H2O0.22 CuSO4·5H2O0.08 (NH4)2MoO4·4H2O0.02
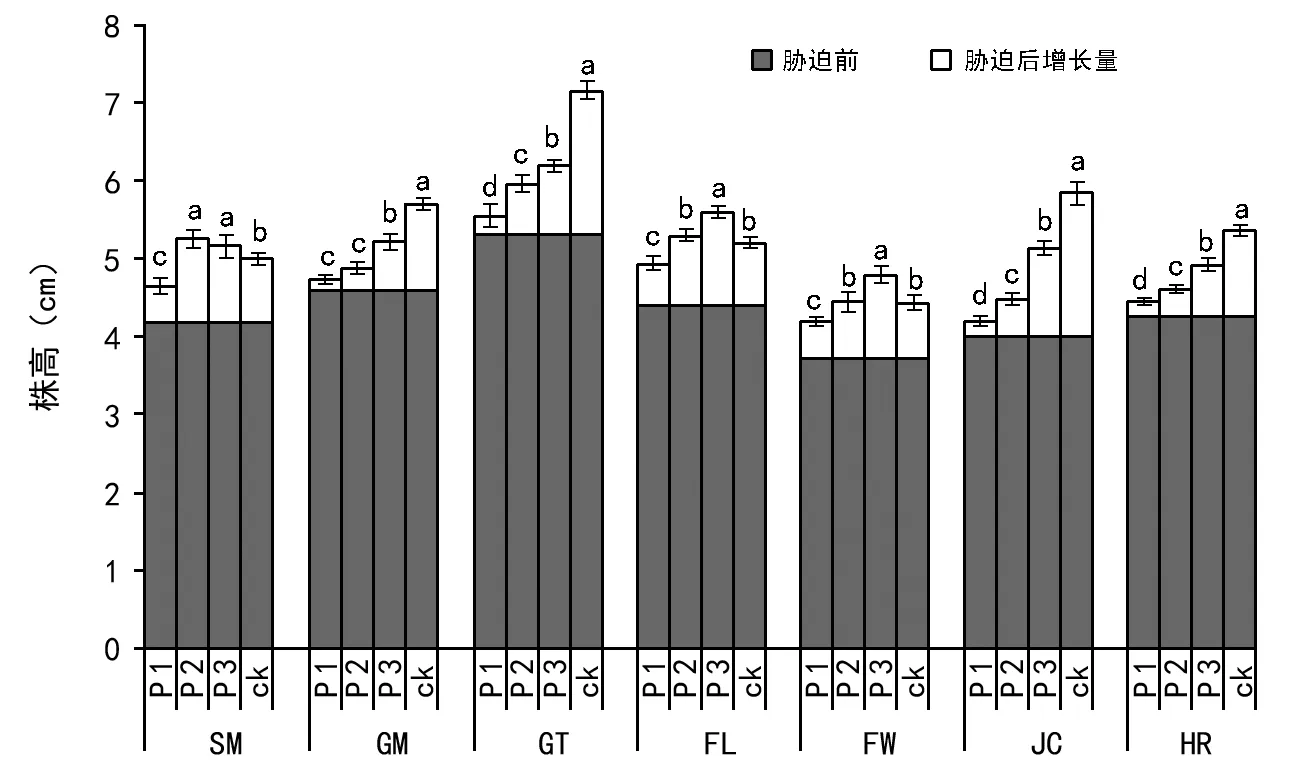
注:不同字母表示处理间差异显著(plt;0.05)。下同。图1 低磷胁迫对不同种源马尾松株高的影响
1 材料与方法
1.1 材 料
根据全国马尾松种源试验结果[7-9],选择在各地表现较好的5个种源:广西桐棉(GT)、福建龙岩(FL)、福建武平(FW)、江西崇义(JC)及湖南汝城(HR),以及2个中部红壤低磷地区种源:四川眉山(SM)及贵州孟关(GM),收集这些种源的种子,共7份材料。各种源地均属于亚热带气候区,雨量充沛,地域广阔(表1)。
1.2 方 法
1.2.1 播种育苗
选择种粒饱满无破损的种子,清洗干净(期间水选,除去秕种),用高锰酸钾(0.3%)浸泡灭菌20 min,绞干后放在浸湿的消毒纱布中闷种30 min,多次清洗后置于始温48 ℃的温水中浸泡24 h。育苗盘于0.3%的高锰酸钾浸泡灭菌30 min,石英砂和珍珠岩洗净后于121~125 ℃温度区间高温灭菌3 h,冷却烘干后备用。
将处理过的石英砂置于育苗盘中,每盘点播60粒,每种源重复3次,以珍珠岩为覆土(3~5 mm),每日浇水,及时清理死苗。播种育苗过程在20~25 ℃室内进行,环境保证通风和充足光照。出苗后35 d进行移栽及后续胁迫处理。
1.2.2 胁迫处理
出苗35 d后,选取长势一致的健壮幼苗,用蒸馏水小心洗净根部,移栽到装有珍珠岩的塑料花钵(上口径12 cm,下口径9.5 cm,高11 cm)中进行培养,移栽5 d后开始胁迫处理。处理以修改的秦晓佳[8]营养液(表2)为基础,通过添加KH2PO4调节成4个P浓度梯度:中磷(ck)10 mg/L,重度低磷胁迫(P1)0.5 mg/L,中度低磷胁迫(P2)2.0 mg/L,轻度低磷胁迫(P3)4.0 mg/L,并相应调整KNO3和 Ca(NO3)2·4 H2O的含量以满足幼苗对N、K的需求,此外在配置时添加Fe
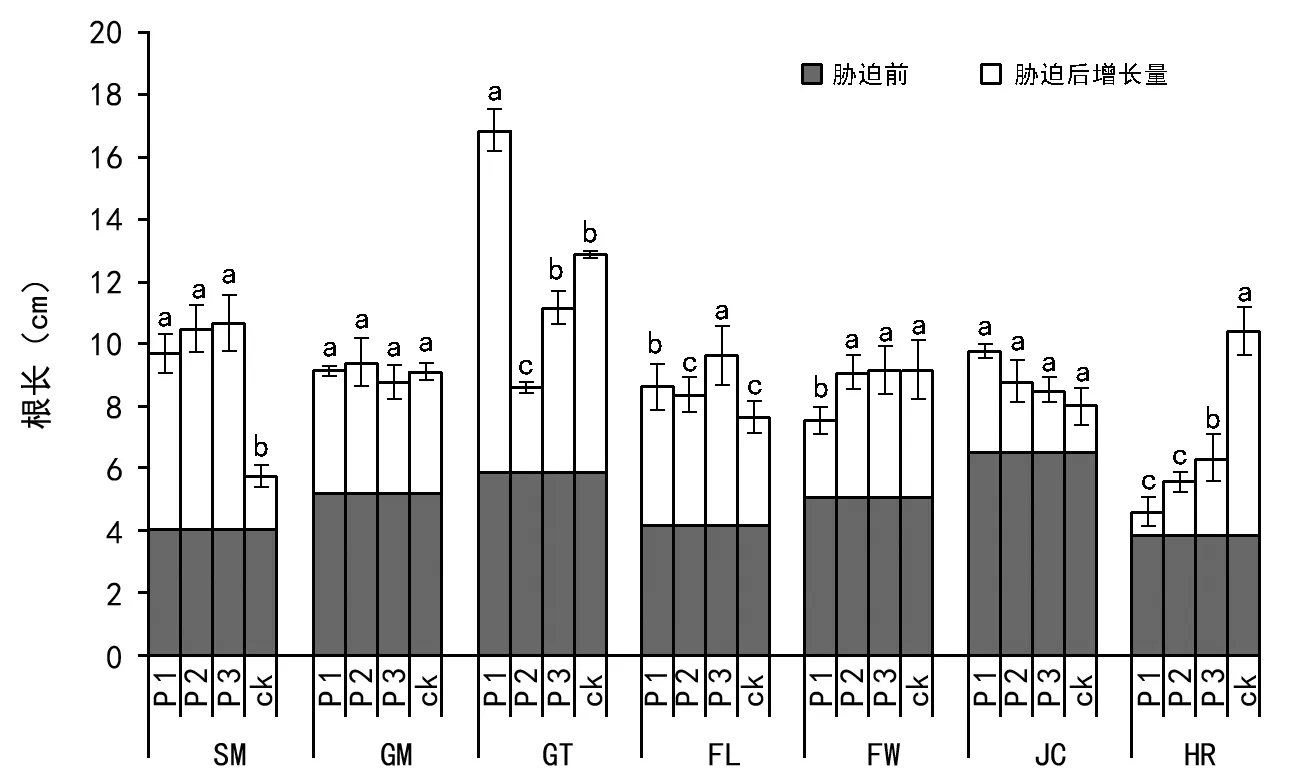
图2 低磷胁迫对不同种源马尾松株高的影响
表3 低磷处理对不同种源马尾松生物积累量的影响
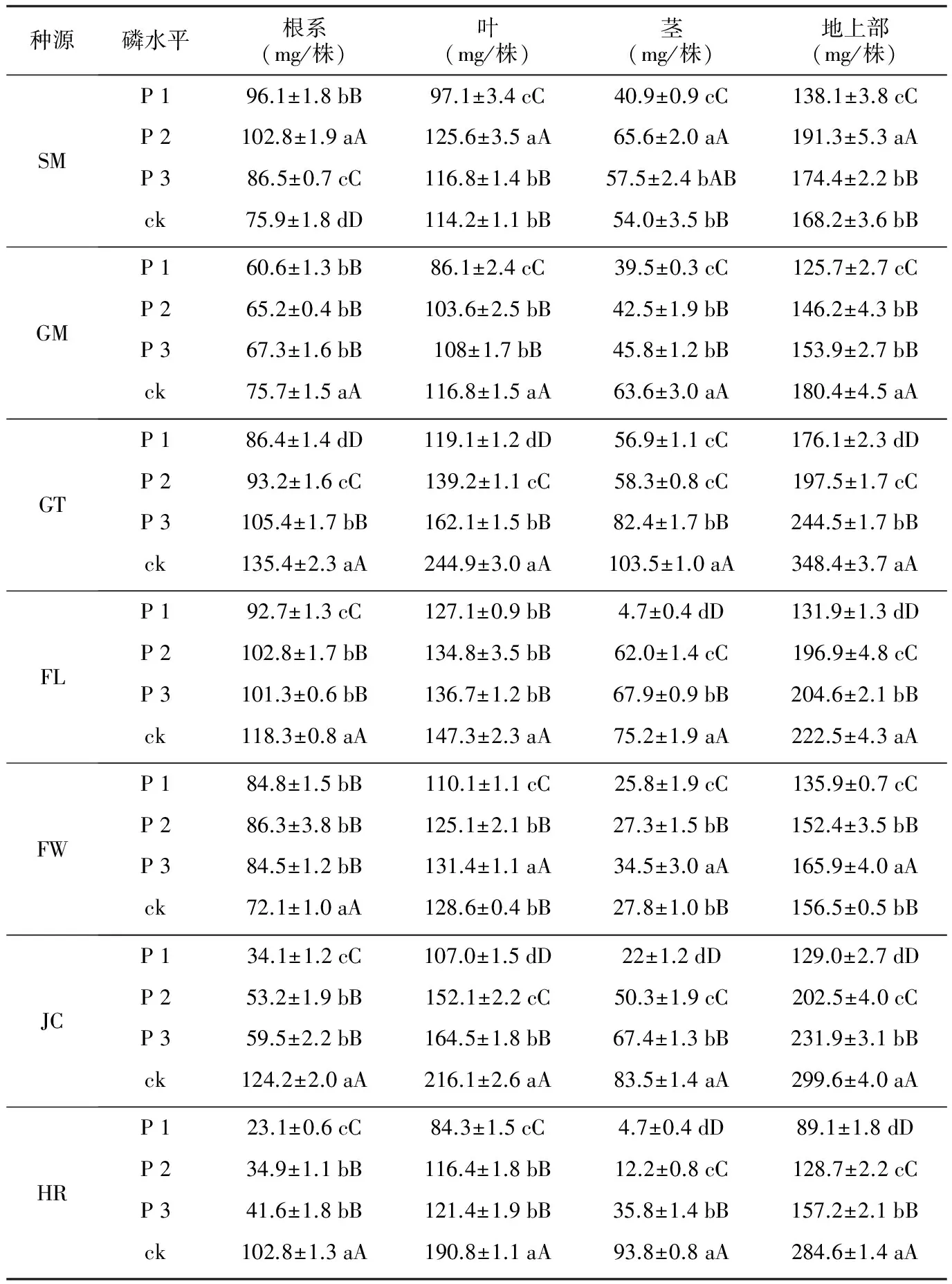
种源磷水平根系(mg/株)叶(mg/株)茎(mg/株)地上部(mg/株)SMP196.1±1.8bB97.1±3.4cC40.9±0.9cC138.1±3.8cCP2102.8±1.9aA125.6±3.5aA65.6±2.0aA191.3±5.3aAP386.5±0.7cC116.8±1.4bB57.5±2.4bAB174.4±2.2bBck75.9±1.8dD114.2±1.1bB54.0±3.5bB168.2±3.6bBGMP160.6±1.3bB86.1±2.4cC39.5±0.3cC125.7±2.7cCP265.2±0.4bB103.6±2.5bB42.5±1.9bB146.2±4.3bBP367.3±1.6bB108±1.7bB45.8±1.2bB153.9±2.7bBck75.7±1.5aA116.8±1.5aA63.6±3.0aA180.4±4.5aAGTP186.4±1.4dD119.1±1.2dD56.9±1.1cC176.1±2.3dDP293.2±1.6cC139.2±1.1cC58.3±0.8cC197.5±1.7cCP3105.4±1.7bB162.1±1.5bB82.4±1.7bB244.5±1.7bBck135.4±2.3aA244.9±3.0aA103.5±1.0aA348.4±3.7aAFLP192.7±1.3cC127.1±0.9bB4.7±0.4dD131.9±1.3dDP2102.8±1.7bB134.8±3.5bB62.0±1.4cC196.9±4.8cCP3101.3±0.6bB136.7±1.2bB67.9±0.9bB204.6±2.1bBck118.3±0.8aA147.3±2.3aA75.2±1.9aA222.5±4.3aAFWP184.8±1.5bB110.1±1.1cC25.8±1.9cC135.9±0.7cCP286.3±3.8bB125.1±2.1bB27.3±1.5bB152.4±3.5bBP384.5±1.2bB131.4±1.1aA34.5±3.0aA165.9±4.0aAck72.1±1.0aA128.6±0.4bB27.8±1.0bB156.5±0.5bBJCP134.1±1.2cC107.0±1.5dD22±1.2dD129.0±2.7dDP253.2±1.9bB152.1±2.2cC50.3±1.9cC202.5±4.0cCP359.5±2.2bB164.5±1.8bB67.4±1.3bB231.9±3.1bBck124.2±2.0aA216.1±2.6aA83.5±1.4aA299.6±4.0aAHRP123.1±0.6cC84.3±1.5cC4.7±0.4dD89.1±1.8dDP234.9±1.1bB116.4±1.8bB12.2±0.8cC128.7±2.2cCP341.6±1.8bB121.4±1.9bB35.8±1.4bB157.2±2.1bBck102.8±1.3aA190.8±1.1aA93.8±0.8aA284.6±1.4aA
注:相同种源同一指标中不同大、小写字母分别表示plt;0.01和plt;0.05差异显著水平。
盐溶液2.5 mL/L。每个处理重复3次,每3天浇1次营养液(15 mL)。处理在人工气候箱(上海新苗QHX-250 BS-Ⅲ)中进行,光照10 h/d,强度20 000 lx,温度18~22 ℃,湿度75%。
1.2.3 形态指标测定
幼苗胁迫60 d后小心取出整株待测样品,仔细清理干净后,吸干表面水分,分别测定新鲜根系、茎、叶(针叶簇)的重量,以及根长(根颈部至主根生长点)、株高(根颈部至植株顶端生长点)等植株形态数据,其中根、茎、叶(针叶簇)的鲜重采用天平直接称重,根长、株高采用处理后与处理前(平均值)测定值的增量表示,根冠比以根系鲜重与地上部鲜重的比值计算。
1.3 数据处理
测定数据通过Microsoft Excel 2010和SPSS 20.0统计分析软件进行计算,SPSS 20.0 按种源单因素(磷水平)检验LSD(Least Significant Difference)法进行差异显著性分析。
2 结果与分析
2.1 低磷胁迫对株高的影响
结果表明,不同低磷处理会降低不同种源马尾松种质的株高增长量(图1):3种低磷胁迫对GM、GT、JC和HR种源的株高生长量具有显著的抑制作用,但对SM、FL和FW种源株高的影响因低磷胁迫程度不同而异。轻度低磷胁迫下,SM、FL和FW种源的株高增长显著高于对照;中度低磷胁迫下,SM和FL种源的株高增长较对照高,其中SM种源株高甚至略高于轻度低磷胁迫,但未达显著水平;重度低磷胁迫下,SM、FL和FW种源株高的增长显著低于对照和其他胁迫程度。可见,低磷会抑制株高的生长,但不同的种源表现出的生长状态有所差异,其中SM种源较耐受中度和重度低磷胁迫,FL较耐重度低磷胁迫。
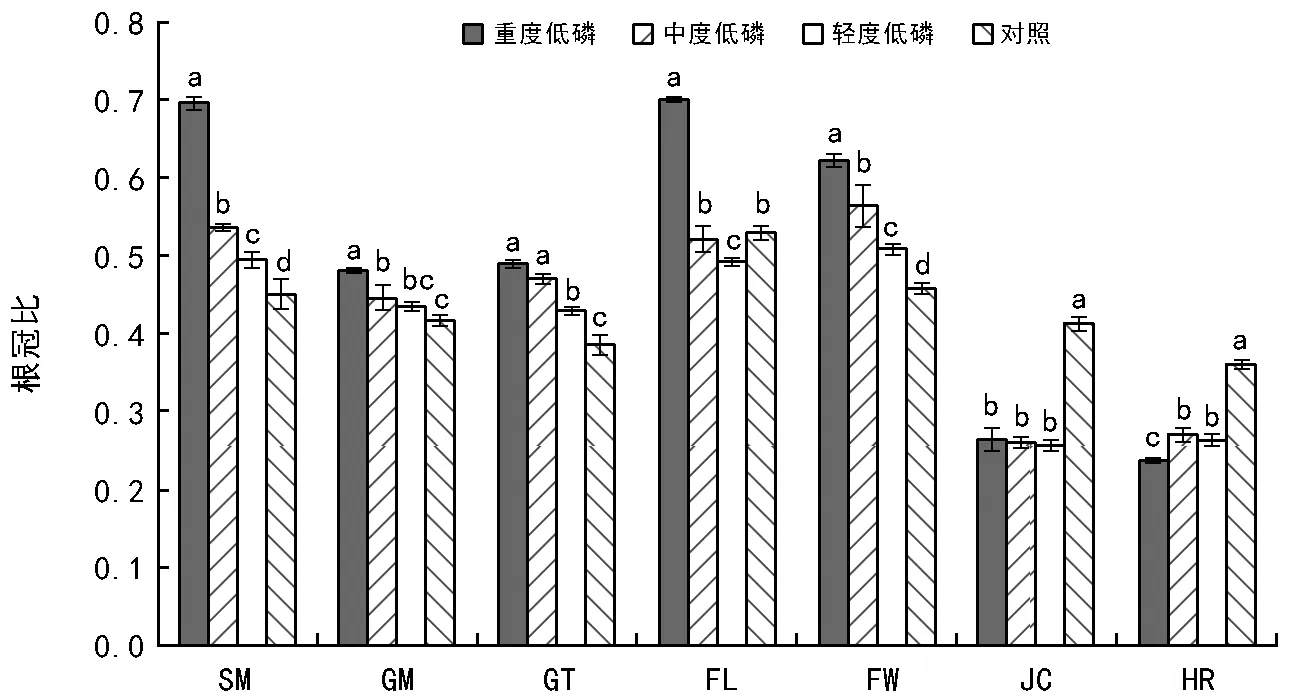
图3 低磷处理对不同种源马尾松根冠比的影响
2.2 低磷胁迫对主根长的影响
胁迫处理60 d后,各种源幼苗根系分布在基质4~18 cm范围,主要集中在8~10 cm范围内。不同磷水平对各种源马尾松幼苗根长的影响比较复杂(图2),低磷处理显著抑制了HR种源根的伸长,但对FW和GM种源的抑制作用未达到显著水平;相反,低磷胁迫促进了SM、JC和FL的根系生长,尤其是SM种源,3种低磷处理均显著高于对照;对于GT种源的根长,轻度和中度低磷胁迫具抑制作用,而重度低磷胁迫具显著促进作用。
2.3 磷胁迫对根系重的影响
由表3可得,不同低磷处理会对SM和FW种源马尾松幼苗的根重有显著促进作用,而对其他种源的根重积累产生不同程度的抑制作用。SM和FW种源的根重为中度低磷gt;重度低磷gt;轻度低磷gt;对照,且SM种源变化幅度较大;JC、HR和FL种源在各低磷条件下根系均积累量显著低于其对照,但轻度和中度胁迫下差异不显著;GM和GT种源的根重积累量在低磷胁迫下低于对照,并随着缺磷程度加深而减小,在各胁迫处理间GT种源根重差异达到极显著水平,而GM种源差异不显著,说明胁迫程度对GT种源的根系生物积累量影响大于GM种源根系。
2.4 低磷胁迫对地上部鲜重的影响
马尾松地上部由茎和针叶簇组成,其重量的变化反映了植株在一定环境中的生长状况。从表3可以看出,不同低磷处理对不同种源马尾松种质的地上部生物量积累的影响不同,GM、GT、FL、JC和HR种源的幼苗,其叶、茎和地上部鲜重积累量随低磷胁迫程度加大而减少,与对照相比,3个低磷胁迫处理均达到极显著水平;SM和FW种源地上部积累量随低磷胁迫程度加大,呈现先增加后降低的趋势,FW种源在4.0 mg/L(P 3)、SM种源在2.0 mg/L(P 2)的低磷条件下,地上部积累量最高,并且均显著高于对照。
2.5 低磷胁迫对根冠比的影响
根冠比在植物生长中具有指示作用,具有合理根冠比的植物往往具有较好的抗逆性。从图3可以看出,在低磷胁迫下,SM、FL和FW的根冠比高于其他种源。FL种源在轻度低磷胁迫时根冠比显著低于对照处理,在中度低磷时与对照近似,在重度低磷时显著高于对照;JC和HR种源根冠比在3种低磷胁迫下显著低于对照,低磷胁迫处理间差异较小;SM、GM、GT和FW种源的根冠比在低磷胁迫下均高于对照处理,并随胁迫程度加大而增加,其中SM和FW种源根冠比在各处理间的差异均达到显著水平,在一定程度上说明这些种源对低磷胁迫具有较强的耐受性。
3 讨 论
磷是植物生长发育的必需营养元素,作为植物体内代谢过程的调节者,参与碳水化合物、蛋白质和脂肪的代谢[4]。植物生长早期,充足的磷素营养尤为重要,生长前期吸收的磷,可以再利用参与新生组织的形成与代谢[10]。土壤缺磷是农业生产中普遍存在的限制因素,土壤中的钙离子、铁离子和铝离子等易与磷结合形成难溶的磷酸盐,造成植物可用有效磷的缺乏[11]。马尾松种植区土壤有效磷很低,严重制约其生长及经济产量[9,12]。因此,挖掘低磷胁迫下生长表现良好的种源,可为马尾松的选育及对低磷耐性机理的解析奠定基础。
在低磷条件下,植物相对生长量可以反映其磷营养效率,植物较高的相对生长量,说明低磷对它们的生长抑制程度较小,其对低磷的忍耐程度较高,具有较高的磷效率[3]。本研究中,四川眉山(SM)、福建龙岩(FL)和福建武平(FW)种源在轻度低磷胁迫下株高高于对照,其中SM种源甚至在中度低磷胁迫下仍保持较高的株高生长,说明该种源植株具有较高磷效率,较耐低磷。有研究表明,FW种源对低磷胁迫也具有较强的耐受能力,折射出本研究结果的可靠性;同时,磷素吸收效率、磷素利用效率、苗高、生物量等指标都具有较高的遗传力[7],因此,在筛选耐低磷胁迫的马尾松种源时,可以直接采用容易测定的生长指标进行耐性评价。
根系是植物吸收养分的主要器官。许多研究证实,由于磷在土壤中易固定,移动性差,低磷胁迫时,植物通过根系适应性反应来提高其对土壤磷的吸收能力,具体表现为根长增加、侧根增多、根毛及侧根密度增加等[11,13-14]。本研究发现,低磷处理促进了SM种源根的伸长的增重,推测其耐低磷性是由于根系迅速生长,增大了根系吸收面积,以此提高对土壤磷的吸收能力。
在植物生长初期,评价其对磷胁迫敏感程度的方法是比较低磷与正常供磷条件下生物量的差异[10]。本研究发现,与对照相比,SM种源地上部生物量在低度、中度和重度缺磷条件下的变化率分别为+3.6%、+13.7%、-17.9%;FW种源相应的变化率分别为+6.0%、-2.5%、-13.1%。因此,以胁迫后地上部生物量积累变化率来看,SM和FW种源在有效磷水平较低(SM,2.0 mg/L;FW,4.0 mg/L)的情况下,地上部鲜重积累量达到最大,这一结果与根系生物量积累一致,意味着这2个资源较适应低磷环境生长,对低磷有较强的耐受性。
根冠比是影响作物养分吸收效率的重要因子,低磷条件下作物根冠比增加是作物对逆境的一种主动适应反应机制[15]。植物在低磷条件下改变了光合产物在地上部和根系的分配:向根系的运输量增加,而且根系对同化物的利用效率也有所提高,表现出根系优先生长,获得更大的吸收表面积;向地上部运输的同化物质相对少,表现为植物生长速率明显降低,最终表现为根冠比增加[16-18]。陈永亮等[14]研究发现,低磷胁迫下落叶松幼苗的根冠比较对照显著增加,表明低磷胁迫处理影响了碳水化合物在落叶松幼苗地上部及根系之间的分配,诱导了地上部同化物向根系的转移,促进了整个根系的生长。本研究也发现,SM和FW种源在低磷胁迫下幼苗根冠比显著高于对照,属于较强耐受性的种源。
综合以上低磷胁迫下马尾松幼苗的生长情况,筛选出SM(四川眉山)和FW(福建武平)为较耐低磷种源,其中四川眉山表现优于福建武平种源。但由于本研究仅对低磷胁迫下马尾松幼苗生长情况进行了探讨,研究结果还不能完全确定马尾松耐低磷种质和解析耐低磷机理,这将是我们未来的工作内容。
[1]杨青,张一,周志春,等.异质低磷胁迫下马尾松家系根构型和磷效率的遗传变异[J].植物生态学报,2011,35(12):1 226-1 235.
[2]陈声奇,陈爱珠,周畅.植物忍耐低磷胁迫机理的研究进展[J].湖南农业科学,2007(2):43-46.
[3]潘晓华,刘水英,李峰,等.低磷胁迫对不同水稻品种幼苗生长和磷效率的影响[J].江西农业大学学报(自然科学版),2002,24(3):297-300.
[4]张丽梅,贺立源,龚阳敏,等.不同耐低磷玉米自交系生长发育特征研究[J].植物营养与废料学报,2006,12(1):56-62.
[5]佘贵连,吴敏,韦家少,等.低磷胁迫对巴西橡胶树苗期生长及相关生理指标的影响[J].福建林业科技,2009,36(4):136-139.
[6]崔博文,范付华,丁贵杰,等.基于马尾松反转录转座子序列的IRAP标记开发及应用[J].林业科学研究,2016,29(3):348-353.
[7]谢钰容.马尾松对低磷胁迫的适应机制和磷效率研究[D].中国林业科学研究院,2003.
[8]秦晓佳,丁贵杰.低磷胁迫对不同种源马尾松幼苗的影响[J].林业科技,2012,37(3):1-5.
[9]秦国峰,周志春.中国马尾松优良种质资源[M].北京:中国林业出版社,2012:52-62.
[10]苏雅乐其其格,杨荣华,邰继承,等.磷素水平对水稻幼苗生长发育的影响[J].内蒙古民族大学学报(自然科学版),2007,22(1):53-58.
[11]徐立华,徐相波,王玉红,等.低磷胁迫对4个玉米自交系幼苗生长及生理生化特性的影响[J].山东农业科学,2014,46(5):82-84.
[12]徐向华,丁贵杰.马尾松适应低磷胁迫的生理生化响应[J].林业科学,2006,42(9):24-28.
[13]Lynch J,Brown K M.Ethylene and plant responses to nutritional stress.Physoil.Plant[J].1997(3):613-619.
[14]陈永亮,李修岭,周晓燕.低磷胁迫对落叶松幼苗生长及根系酸性磷酸酶活性的影响[J].北京林业大学学报,2006,28(6):46-50.
[15]孙海国,张福锁,杨军芳.缺磷胁迫对小麦根细胞周期蛋白基因cyclAt表达的影响[J].植物生理学报,2000,26(5):441-445.
[16]梁秀兰,林英春,解丽霞.酸性红壤低磷胁迫对玉米苗期生长的影响[J].玉米科学,2004,12(专刊):98-100.
[17]章爱群,贺立源,门玉英,等.磷水平对不同耐低磷玉米基因型幼苗生长和养分吸收的影响[J].应用与环境生物学报,2008,14(3):347-350.
[18]苏贺,牛晓雪,陈小文,等.低磷胁迫对转基因抗虫玉米苗期生长的影响[J].中国农业大学学报,2014,19(3):63-72.
(本栏目责任编辑:周忠燕)
Effect of Low-phosphorus Stress on the Seedling Growth of MassonPine
(Pinusmassoniana) ProvenancesCUIBowena,b,QIAOGuanga,FANFuhuab,DINGGuijieb,WENXiaopenga
2016-09-10
贵州省重大专项(20126011-1);“863”计划(2011 AA 10020301)。
崔博文(1984—),男,博士生,主要从事森林培育研究;E-mail:hbqhd16cuibowen@163.com。
文晓鹏,博士,教授,主要从事林木生物技术与遗传育种研究;E-mail:xpwensc@hotmail.com。
10.16590/j.cnki.1001-4705.2017.01.063
S 791.248
A
1001-4705(2017)01-0063-05
