麻疯树油脂皂基的抑菌及皮肤刺激性试验研究
2017-12-01李金勇张士彦四川大学生命科学学院能源植物生物燃油制备及利用国家地方联合工程实验室四川成都610064
李金勇,张士彦,李 娜,颜 钫,唐 琳(四川大学 生命科学学院 能源植物生物燃油制备及利用国家地方联合工程实验室,四川 成都610064)
麻疯树油脂皂基的抑菌及皮肤刺激性试验研究
李金勇,张士彦,李 娜,颜 钫,唐 琳
(四川大学 生命科学学院 能源植物生物燃油制备及利用国家地方联合工程实验室,四川 成都610064)
利用麻疯树油脂及其叶乙醇提取物作为原料,采用正交试验方法,考察氢氧化钠浓度、皂化温度、搅拌时间对皂基总游离碱含量的影响,确定最佳皂化条件,并制得含有和不含有麻疯树叶乙醇提取物的两种皂基。配制浓度梯度为10mg/mL、15mg/mL、20mg/mL、30mg/mL的皂液,利用滤纸片法考察这两种皂基对金黄色葡萄球菌、大肠杆菌、白色念珠菌的抑菌效果。以配制浓度为50mg/mL的皂液进行家兔皮肤刺激性试验,考察对皮肤的刺激效果。结果显示:氢氧化钠浓度为12%、皂化温度为40℃、搅拌时间为15min时的条件最佳,且总游离碱含量最低为0.30%。两种皂液对白色念珠菌无抑菌效果,对金黄色葡萄球菌和大肠杆菌有明显的抑菌效果。随着浓度增加,抑菌效果呈现增强的趋势,有无麻疯树叶乙醇提取物在抑菌效果上没有明显差异。皮肤刺激性试验表明,这两种皂液对家兔皮肤有轻微刺激性,但含有麻疯树叶乙醇提取物的皂液对家兔皮肤刺激性较弱。
麻疯树;皂基;正交试验;抑菌;皮肤刺激
麻疯树(JatrophacurcasL.)为大戟科(Euphorbiaceae)麻疯树属植物[1],主要分布在热带和亚热带地区。据报道[2],麻疯树具有一定的药用和药理特性,可治疗一些常见疾病。近年研究发现,麻疯树叶提取物具有体外抗病毒[3]和杀菌的作用[4,5]。
麻疯树的种仁含油量高达60%以上,含有棕榈酸、硬脂酸等饱和脂肪酸和油酸、亚油酸、棕榈油酸等不饱和脂肪酸[6]。由于油脂中含有大量的有毒成分,特别是佛波酯[7]限制了它在食用油工业的应用,因此近年来麻疯树的应用研究主要集中在生物柴油上。经四川大学生命科学学院研究[8],从麻疯树果实中制备的新型燃油可适用于各种柴油发动机,并在闪点、凝固点、硫含量、一氧化碳排放量、颗粒值等关键技术上优于国内零号柴油。李沁玲等[9]利用小苏打作为反应试剂,采用正交试验法探索了麻疯树饼粕的最佳脱毒条件,在此条件下实现了良好的脱毒效果,而且对饼粕中原有的营养成分不构成较大的破坏,为麻疯树在脱毒饲料上的应用提供了技术支撑。
麻疯树籽油不仅可提炼制成生物柴油,还可作为制皂的原料[10]。Rangwala Juzer Ali、Sarasan Geetha[11]利用麻疯树油脂制得肥皂,其总脂肪物、总游离碱、pH等指标符合当地标准,被认定为三级肥皂,可用于人们日常洗浴。Mak-Mensah E E、Firempong C K在研究中指出[12],麻疯树油脂可制造药皂或化妆品的洗浴皂,对皮肤有一定的保护作用。
传统的药皂是以牛油、椰子油或其他油脂和少量发泡剂、烧碱等原料制成,并额外加入法定含量的杀菌剂,具有清洁去污和杀菌的作用,可保护皮肤健康、预防疾病。常见传统药皂分为酚类药皂、硼酸类药皂和硫磺类药皂[13]。在皂基中加入酚类化合物如苯酚等制成的药皂为酚类药皂,这类药皂对皮肤刺激性较强,皮肤敏感者或有小伤口的人不宜使用,且该类药皂杀灭真菌的效果相对较差。如今开发的新产品,如滴露、舒肤佳等品牌药皂中使用的即是酚类杀菌剂。硼酸类药皂是在皂基中加入一定量的硼酸制成,但硼酸的消毒能力相对较弱,仅能抑制部分细菌的繁殖,对病毒、寄生虫等束手无策,较适合普通的皮肤消毒。硫磺类药皂是在皂基中加入硫磺,在洗浴时产生硫化氢和五氯硫磺,可杀灭螨虫、疥虫等寄生虫和部分真菌等,对疥疮有辅助疗效。但硫磺皂抑制皮肤分泌的作用较强,使用后皮肤可能变得干燥。麻疯树油脂中含有天然的抗菌成分,由麻疯树油脂制得的皂基不但具有抗菌效果,而且在成品皂的生产过程中不添加抗菌剂,生产过程简单,大大降低了生产成本,因此研究麻疯树油脂制备皂基具有一定的应用意义。
1 材料与方法
1.1 试验材料、试剂与仪器
麻疯树籽油来自云南神宇新能源公司;成熟的麻疯树叶片,晾干备用;白色念珠菌(ATCC10231)、金黄色葡萄球菌(ATCC6583)、大肠埃希氏菌(ATCC25922)冻干菌种(含复苏液)购于广东环凯生物科技有限公司;营养琼脂培养基、马铃薯葡萄糖琼脂培养基在无菌条件下配置备用;成年家兔8只,雌雄各1/2,由四川大学动物实验中心提供;25mm×25mm纱布块,由青岛海诺生物工程有限公司提供。
阿莫西林、盐酸伊曲康唑购于四川大学校医院;无水乙醇、氢氧化钠、氯化钠、氢氧化钾、硫酸、酚酞均为国产分析纯;双蒸水;活性炭;电子秤ESJ120-4(精度0.0001g)、MS300型磁力搅拌器、酒精计、恒温水浴锅、无菌操作台、恒温培养箱、高压蒸汽灭菌锅。
1.2 试验方法
皂基的制备:①溶液的配置。精确称取氢氧化钠6.7g,分别加入40%乙醇溶液40mL、50mL、60mL,配置成浓度为14%、12%、10%的氢氧化钠溶液以备用。0.3mol/L的硫酸标准滴定溶液按GB/T 601-2002[14]中的4.3配置,0.1mol/L的氢氧化钾—乙醇标准滴定溶液按GB/T 601-2002中的4.24配置,10g/L酚酞指示液按GB/T 603-2002[15]中的4.1.4.12配置。②正交试验设计。选取反应液氢氧化钠的浓度(A)、皂化温度(B)、搅拌时间(C)作为考察因素,设计3水平进行皂化反应,自然干燥得皂基后,以皂基中总游离碱含量为考察指标,利用L9(34)的实验表设计正交试验。每次试验称取麻疯树籽油50g,按QB/T 2623.2-2003[16]方法测定皂基中总游离碱的含量,因素水平见表1。③麻疯树叶乙醇提取物的提取。称取干燥粉碎的麻疯树叶68g,加入20倍质量倍数的40%的乙醇溶液,浸提60h后过滤,用8%—10%质量倍数的活性炭吸附色素3h后过滤得麻疯树叶乙醇提取物。④皂化过程。称取氢氧化钠6.7g,利用正交试验得出的最佳条件进行皂化反应得不含有麻疯树叶乙醇提取物皂基。另称取氢氧化钠6.7g,用麻疯树叶乙醇提取物溶解后,同上方法皂化得含有麻疯树叶乙醇提取物皂基。将两种皂基放在室温下20—30天,自然干燥成型。
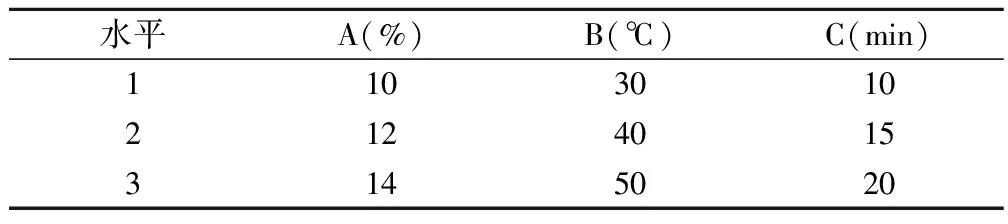
表1 正交试验因素水平
抑菌试验:①菌悬液的制备。将实验菌种按照按使用说明书进行菌种复苏并传代培养至第三代,采用梯度稀释平板法制备浓度在107—108cfu/mL的菌悬液备用。②样品制备。用无菌生理盐水将两种皂基配置成浓度梯度为10mg/mL、15mg/mL、20mg/mL、30mg/mL的皂液作为实验组,以阿莫西林(10mg/mL)、盐酸伊曲康唑(10mg/mL)为阳性对照组、无菌生理盐水为空白对照度。③试验方法。在无菌条件下,采用滤纸片法[17]进行抑菌试验操作,每次吸取金黄色葡萄球菌和大肠杆菌菌悬液100μL均匀涂布在营养琼脂培养基上,吸取白色念珠菌菌悬液100μL均匀涂布在马铃薯葡萄糖琼脂培养基上,每组试验采样滤纸片(直径6mm)8次。分别在37℃、28℃下培养24h、48h,测量并记录抑菌圈大小,求取平均值,结果见表2、表3。
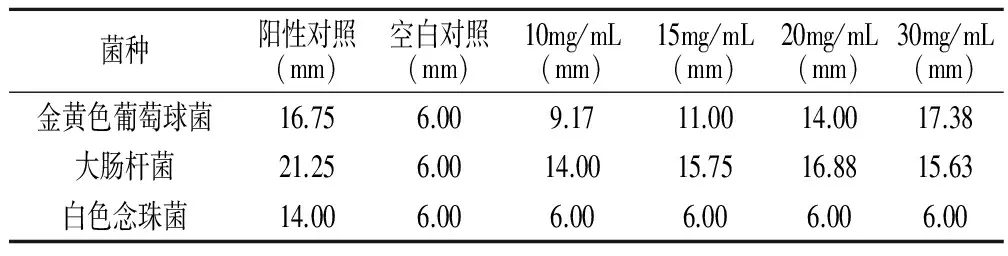
表2 不含麻疯树叶乙醇提取物皂液的抑菌效果
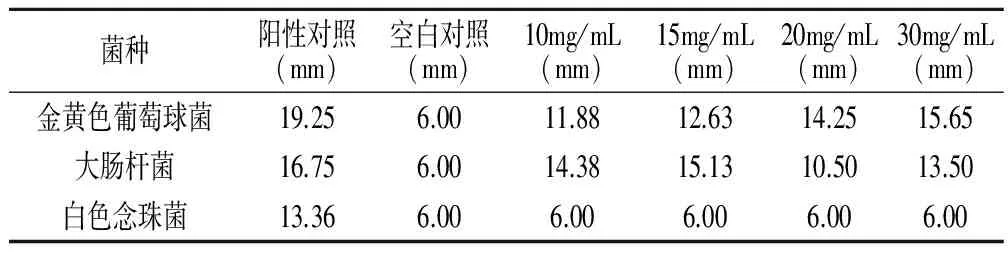
表3 含有麻疯树叶乙醇提取物皂液的抑菌效果
皮肤刺激性试验:①样品制备。用无菌生理盐水将这两种皂基配置成50mg/mL的皂液为实验组,无菌生理盐水为对照组,采用自身对照。②试验方法。试验采用健康、背部皮肤无损的新西兰白兔8只,雌雄各半,体重2—3kg,每组各4只。试验前24h将实验动物背部脊柱两侧毛剪掉,去毛范围为10cm×15cm,作为试验和观察部位;再将制备好的两种皂液分别吸取0.5mL直接涂在试验接触部位(图1),对照组接触部位涂抹无菌生理盐水。用25mm×25mm透气性好的纱布块覆盖接触部位包扎带固定4h后,除去敷贴物,用温水洗净拭干并分别在1h、24h、48h和72h观察涂抹部位有无红斑和水肿情况。③评价方法及标准。按卫生部2007版《化妆品卫生规范》[18]中皮肤刺激反应评分方法,根据每只动物涂拭区皮肤是否形成红斑、水肿及其程度,分别判为0—4分。急性皮肤刺激性试验根据1h、24h、48h和72h各观察点最高积分均值[即:(红斑积分+水肿积分)/受试动物数]进行评价。皮肤刺激强度以积分均值的大小进行判定:0—0.4为无刺激性,0.5—1.9为轻刺激性,2.0—5.9为中刺激性,6.0—8.0为强刺激性。
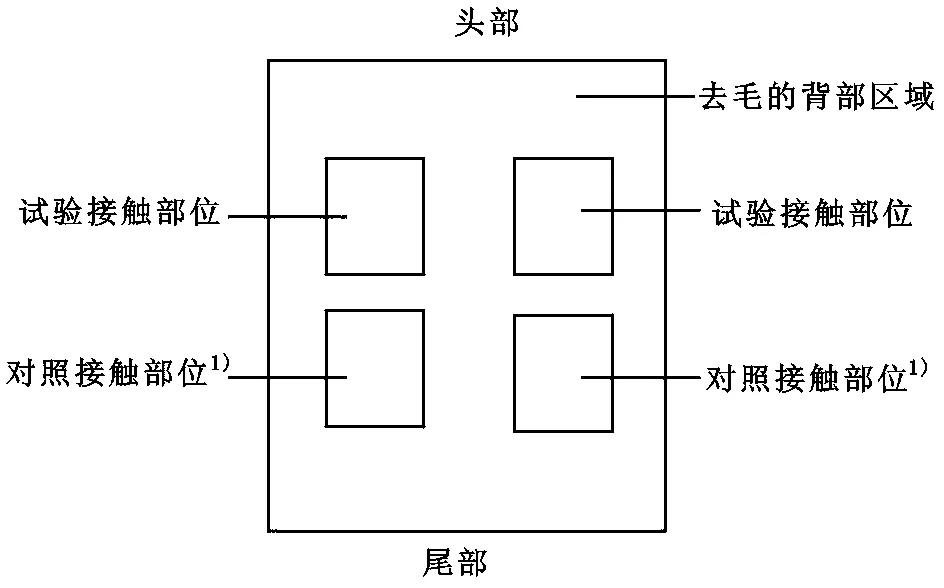
图1 皮肤应用部位
2 试验结果
2.1 正交试验结果
L9(34)正交试验设计与结果见表4。按QB/T 2623.2-2003规定以两次平行测定总游离碱结果的算术平均值表示至小数点后两位作为测定结果。在重复条件下获得的两次独立测定结果的绝对差值不大于0.05%,以大于0.05%的情况下不超过5%为前提作为其精密度。
由表4可知,两次平行试验绝对差值均未超过5%,在其精密度范围之内。由极差R可知,各因素对总游离碱含量的影响程度为氢氧化钠浓度(A)gt;皂化温度(B)gt;搅拌时间(C)。以每个因子在每个水平下的均值K 可以看出,在第二水平上,其总游离碱含量最低,因此结合正交试验结果可知最佳皂化条件为A2B2C2,即氢氧化钠浓度为12%、皂化温度为40℃、搅拌时间为15min,此时总游离碱含量最低为0.30%。
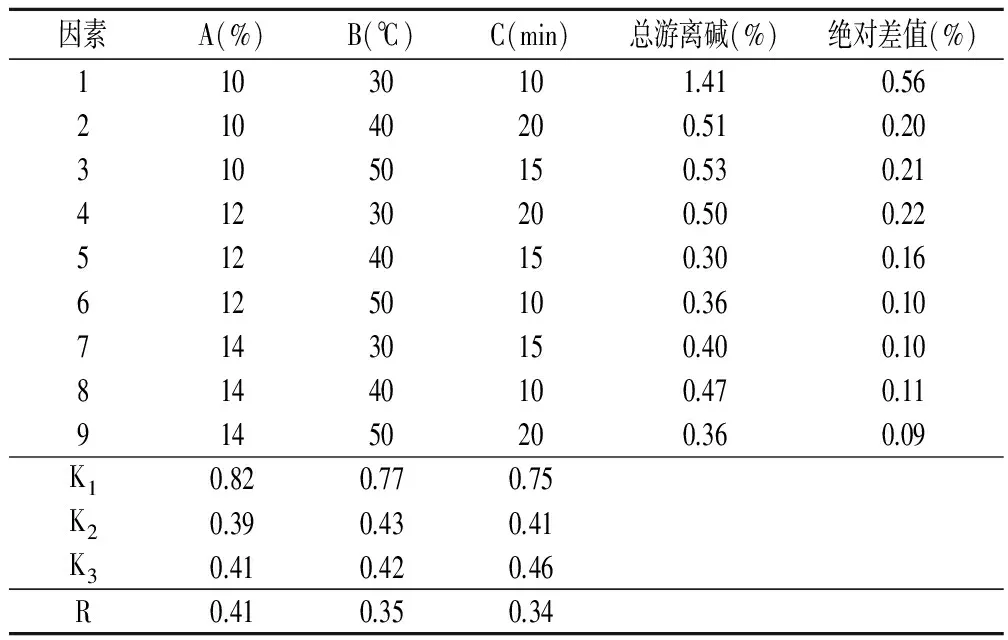
表4 L9(34)正交试验设计与结果
2.2 抑菌试验结果试验
测得两种皂液的平均抑菌圈大小见表2、表3。两种皂液对金黄色葡萄球菌和大肠杆菌具有明显的抑菌效果,在10—30mg/mL浓度范围内,两种皂基对金黄色葡萄球菌和大肠杆菌的抑菌效果随浓度的增大都呈现增强的趋势,但对白色念珠菌则无抑菌效果。抑菌圈均值随浓度的关系见图2、图3。图2、图3可见,有无麻疯树叶乙醇提取物的皂基在对大肠杆菌和金黄色葡萄球菌的抑菌效果上无明显差异。
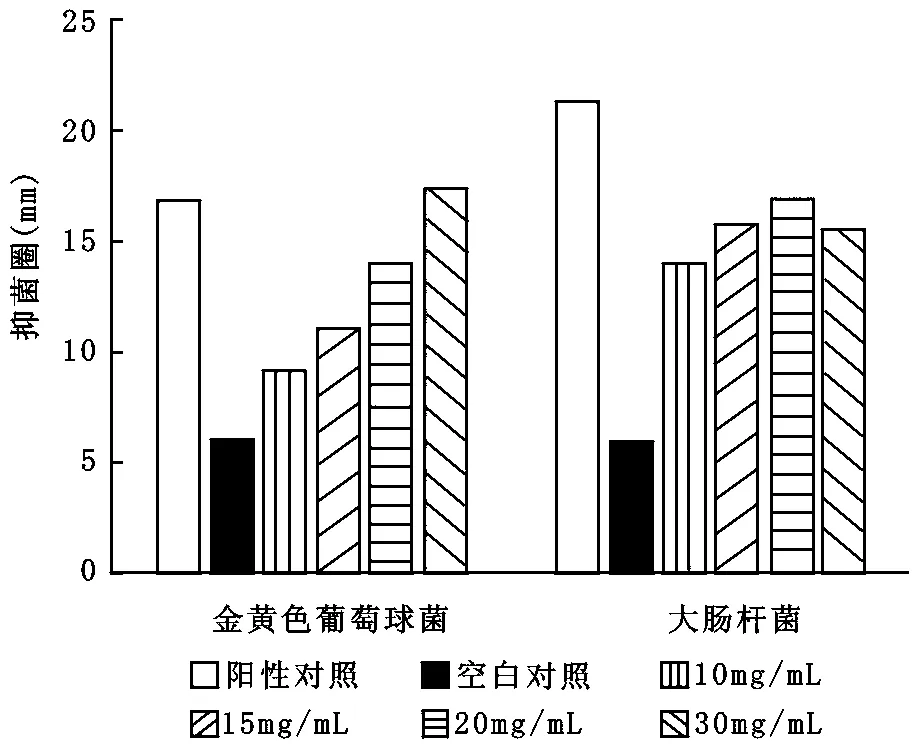
图2 不含麻疯树叶乙醇提取物皂液抑菌圈均值与浓度的关系
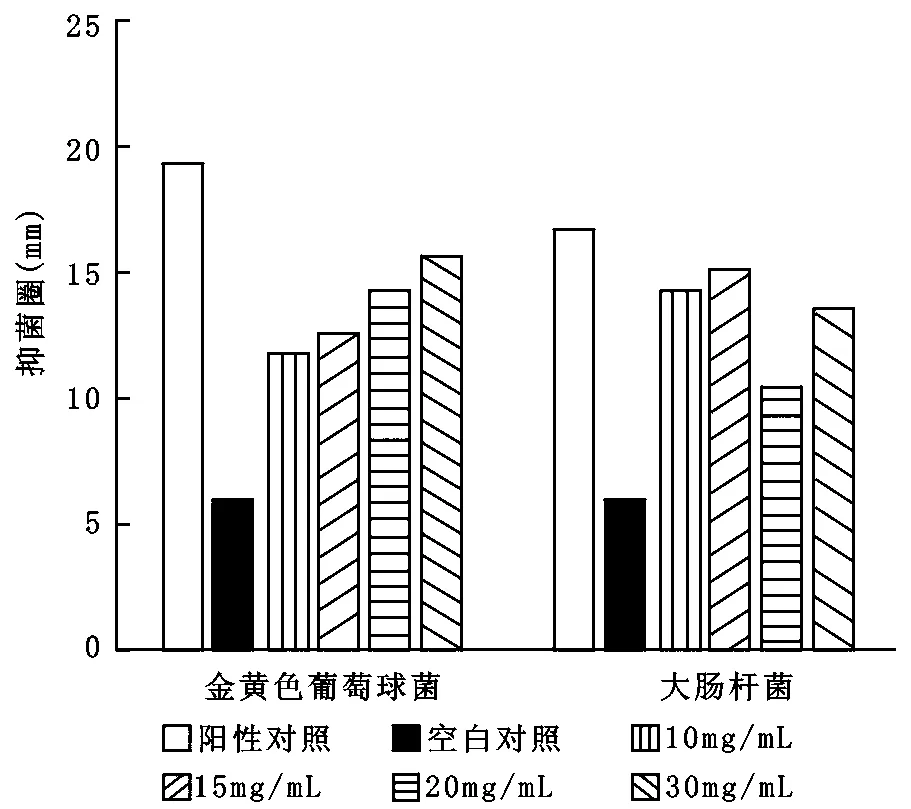
图3 含有麻疯树叶乙醇提取物皂液抑菌圈均值与浓度的关系
2.3 皮肤刺激试验结果
两种皂液对家兔皮肤在1h、24h、48h、72h观察点处积分均值和刺激强度的结果见表5、表6。结果显示,两种皂液对家兔单次皮肤刺激试验均出现轻微刺激反应,对照组家兔皮肤无异常发现。1h两组家兔皮肤均出现明显红斑和轻微水肿,24h水肿消退,但红斑无明显消退迹象。48h和72h红斑依然存在,较1h和24h相比,红斑有所减轻但依然肉眼可见。

表5 含有麻疯树叶提取皂液对家兔急性皮肤刺激性试验结果
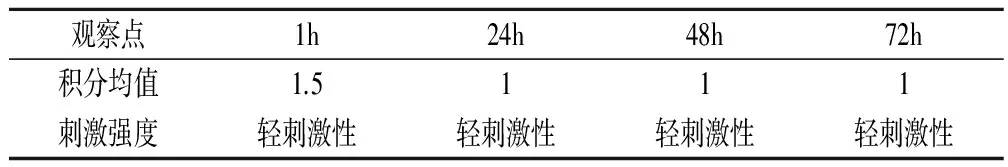
表6 不含麻疯树叶提取物皂液对家兔急性皮肤刺激性试验结果
3 结论与讨论
本文首先利用三因素三水平正交试验探究麻疯树油脂制备皂基的最佳皂化条件,以麻疯树籽油和麻疯树叶乙醇提取物为原料结合最佳皂化条件,制备出含有与不含有麻疯树叶乙醇提取物两种皂基,并对其抑菌效果和对皮肤刺激做出探究,为麻疯树油脂皂基制备成品肥皂提供基础资料。
通过正交试验对皂化条件进行优化,试验结果显示各因素对总游离碱含量影响的大小为:氢氧化钠浓度gt;皂化温度gt;搅拌时间。结合极差和均值的分析,皂化的最佳条件是A2B2C2,即氢氧化钠浓度为12%、皂化温度为40℃、搅拌时间为15min,此时总游离碱含量最低为0.30%。抑菌试验显示,两种皂液对白色念珠菌均无抑菌效果,对金黄色葡萄球菌和大肠杆菌有明显的抑菌效果,且随着浓度的增大抑菌效果呈现增强的趋势,有无麻疯树叶乙醇提取在抑菌效果上无明显差异。家兔急性皮肤刺激试验表明,这两种皂液对家兔皮肤有轻微刺激性,含有麻疯树叶乙醇提取物的皂液对家兔皮肤刺激相对温和。
总之,急性皮肤刺激试验结果从动物外推到人的可靠性有限,白色家兔在大多数情况下对有刺激性或腐蚀性的物质较人类敏感,且试验中使用封闭式接触是一种在超常规实验室条件下的试验,人类在实际使用化妆品或洗浴用品过程中很少存在这种接触方式。毒性方面,Makkar H P S等人[19]利用甲醇溶剂结合磁力搅拌器进行提取,并对料液比、时间、温度方面做出优化,可提取出几乎不含佛波酯的麻疯树油脂,为麻疯树油脂的安全无毒提供了有力保障。
麻疯树油脂皂基在制作过程中不会破坏甘油的有效成分,并将其最大限度的保留,其制备的成品皂在清洁的同时可以形成一层保护膜,达到对肌肤良好的保湿效果。
麻疯树油脂皂基中总游离碱是由皂化后残余的碱产生,总游离碱含量不宜过高(含量低于1%)。而由麻疯树油脂按最优条件皂化其总游离碱含量只有0.3%,完全符合总游离碱含量标准。另外,麻疯树油脂具有天然抗菌活性,皂基制备过程中不需要额外添加抗菌剂,使得生产操作得以简单化并大大降低了生产成本,并且对皮肤的刺激性较温和,有一定的保湿效果。因此,利用麻疯树油脂制皂是可行的,特别是在生产制备药皂上具有广阔的应用前景。
[1]程贝,李光军,代凌锋,等.麻疯籽中佛波酯的提取与分析方法综述[J].公共卫生与预防医学,2013,24(3)∶63-64.
[2]林娟,周选围,唐克轩,等.麻疯树植物资源概况[J].热带与亚热带植物学报,2004,12(3)∶285-290.
[3]刘娟,雷蕾,唐琳,等.麻疯树提取物体外抗病毒和杀菌作用的初步研究[J].时珍国医国药,2009,20(8)∶1890-1893.
[4]Kalimuthu K,Vijayakumar S,Senthilkumar R.Antimicrobial Activity of the Biodiesel Plant,JatrophacurcasL.[J].Internationl Journal of Pharma and Bio Sciences,2010,1(3)∶1-5.
[5]Lgbinosa O O,Lgbinosa E O,Aiyegoro O A.Antimicrobial Activity and Phytochemical Screening of Stem Bark Extracts fromJatrophacurcas(Linn)[J].African Journal of Pharmacy and Pharmacology,2009,3(2)∶58-62.
[6]佘珠花,刘大川,刘金波,等.麻疯树籽油理化特性和脂肪酸组成分析[J].中国油脂,2005,30(5)∶30-31.
[7]Kulyal Poonam,Kanti Tiwari Uma,Shukla Arvind,etal.Chemical Constituents Isolated from Seed ofJatrophacurcas[J].Asian J Chem,2011,23(7)∶2939-2942.
[8]苟圆,华坚.麻疯树资源的开发利用现状及前景[J].资源开发与市场,2007,23(6)∶519-522.
[9]李沁玲,颜钫,彭彤,等.结合UPLC的麻疯树饼粕低成本脱毒研究[J].资源开发与市场,2015,31(12)∶1411-1414.
[10]李向勇.麻疯树秋季扦插育苗技术[J].农机服务,2005,(7)∶22-22.
[11]Rangwala Juzer Ali,Sarasan Geetha.Synthesis of Medicinal Soap from Non Edible (JatrophaOil) and Study of Its Quality Parameters Including Antimicroobial Activity[J].Research Journal of Chemical Sciences,2014,4(4)∶58-62.
[12]Mak-Mensah E E,Firempong C K.Chemical Characteristics of Toilet Soap Prepared from Neem (AzadirachtaindicaA.Juss) Seed Oil[J].Asian Journal of Plant Science and Research,2011,1(4)∶1-7.
[13]胡其峰.看清肥皂、香皂和药皂[J].科学咨询.2003,(17)∶44.
[14]GB/T 601-2002,化学试剂标准滴定溶液的制备[S].
[15]GB/T 603-2002,化学试剂试验方法中所用制剂及制品的制备[S].
[16]QB/T 2623.2-2003,肥皂试验方法 肥皂中总游离碱含量的测定[S].
[17]刘如运.几种常用抑菌试验方法的评价及比较[J].现代企业教育,2013,(14)∶341-342.
[18]中华人民共和国卫生部.化妆品卫生规范[S].2007∶102-105.
[19]Rakshit K,Devappa,Makkar H P S,etal.Optimization of Conditions for the Extraction of Phorbol Esters fromJatrophaOil[J].Biomass and Bioenergy,2010,34(8)∶1125-1133.
BacteriostasisandSkinIrritationTestResearchofJatrophacurcasL.OilSoap
LI Jin-yong,ZHANG Shi-yan,LI Na,YAN Fang,TANG Lin
(National Local Joint Engineering Laboratory for Energy Plant Bio-oil Production and Application,College of Life Sciences,Sichuan University,Chengdu 610064,China)
UsingJatrophacurcasL. oil as well asJatrophacurcasL.leaves ethanol extract as raw material,and orthogonal experiment was carried out to investigate the effects of NaOH concentration,saponification temperature and stirring time on the soap tatol free alkali,determined the optimum conditions of saponification,and preparation of two kinds of sopa cotaniningJatrophaleaves ethanol extract and excludingJatrophacurcasL.leaves ethanol extract.Preparation concentration gradient was 10mg/mL,15mg/mL,20mg/mL,30mg/mL soap liquid respectively,filter method was used to examine the antibacterial effect of the Staphylococcus aureus,E.coli,Candida albicans.Preparation concentration was 50mg/mL of soap liquid for the rabbit acute skin irritation test to measure theJatrophaoil soap stimulation to the skin effect.The results showed that the concentration of NaOH was 12%,saponification temperature was 40℃,the stirring time was 15min which was the best condition,and the total free alkali for a minimum of 0.30%.Two soaps on Candida albicans had no antimicrobial effect,onStaphylococcusaureusandE.colihad obvious bacteriostatic effect.Bacteriostatic effect with the increase of the concentration showed a trend of increase,there was no obvious difference on the bacteriostasis effect for the presence ofJatrophacurcasL.leaves ethanol extract or not.Skin irritation test showed that these two kinds of soap with mild irritation to rabbit skin,and cotaniningJatrophacurcasL.leaves ethanol extract soap to rabbit skin irritation would weaken.
JatrophacurcasL.;soap;orthogonal test;bacteriostatic;skin irritation
10.3969/j.issn.1005-8141.2017.04.017
Q949.97;Q949.753.5
A
1005-8141(2017)04-0473-04
2017-02-06;
2017-03-23
四川省科技支撑计划项目(编号:2011JZ0002)资助。
李金勇(1990-),男,安徽省合肥人,硕士研究生,研究方向为天然产物应用。
唐琳(1966-),女,四川省成都人,博士,副教授,主要从事资源植物学与植物生物技术等研究工作。
