无机砷影响蛋白核小球藻光合活性的特征研究
2017-12-01许荔萍周昉冯宁张建英
许荔萍,周昉,冯宁,张建英*
(1. 浙江大学 环境与资源学院, 浙江 杭州 310058; 2. 杭州市环境保护科学研究院, 浙江 杭州 310014)
无机砷影响蛋白核小球藻光合活性的特征研究
许荔萍1,周昉1,冯宁2,张建英1*
(1. 浙江大学 环境与资源学院, 浙江 杭州 310058; 2. 杭州市环境保护科学研究院, 浙江 杭州 310014)
采用蛋白核小球藻(Chlorellapyrenoidosa)进行无机砷毒性暴露实验,分析As(III)和As(V)对蛋白核小球藻光合活性的影响差异.结果表明: 该藻对无机砷具有较强的耐受性,在砷浓度大于37.5 mg·L-1暴露条件下,小球藻叶绿素a合成、光系统II(PSII)最大光量子产量(Fv/Fm)、实际光量子产量(Yield)及相关参数与无机砷浓度呈显著负相关,As(III)对小球藻光合活性抑制作用显著高于As(V).As(III)和As(V) 150.0 mg·L-1暴露96 h对小球藻光系统II影响差异最大,Fv/Fm、Yield、rETRmax和线性斜率(α)分别降低了77%,91%,92%,85%和19%,50%,51%,23%.透射电镜进一步表明,小球藻亚细胞结构形态受砷胁迫出现叶绿体片层间空泡化、类囊体基粒片层受挤压、蛋白核缩小及脂质滴.As(III)对蛋白核小球藻光系统II (PSII)抑制作用大于As(V),可为深入了解无机砷对淡水微藻光合活性的影响机理提供一定的参考.
无机砷;蛋白核小球藻;叶绿素荧光;透射电镜
砷是自然环境中普遍存在的有毒类金属,水体中无机砷主要以三价砷As(III)和五价砷As(V)形态存在[1].近年来,含砷杀虫剂、除草剂的使用,化石燃料的燃烧以及含砷矿产的大量开采等人类活动导致水体砷浓度日益增大[2],砷污染较为严重的国家主要分布于亚洲,以孟加拉、中国、印度最为典型[3].砷的毒性研究已涉及多种水生生物,如无脊椎动物和海洋浮游植物等[4],淡水微藻作为水体重要的初级生产者,砷污染下其生长及光合活性等重要生命活动均受到影响.已有研究表明,铜绿微囊藻在10 mg·L-1As(III)胁迫下,其叶绿素a的合成和光系统II (PSII)受到了显著抑制[5].一般而言,As(III)对动物及海洋浮游植物的毒性大于As(V)[6-7],然而,As(III)和As(V)对淡水微藻的毒性大小仍存在争议.如BAHAR等[8]研究表明,As(III)对淡水小球藻(Chlorellasp)96 h EC50为111.8 (105.5~118.4) mg·L-1,显著高于As(V) 8.33 (6.99~9.24) mg·L-1,As(V)的毒性大于As(III).光合作用是微藻最基本、最重要的生理生态特征,光合作用中光能吸收、传递及转化是由位于光合膜上具有特定分子排列的色素蛋白复合体系光系统I (PSI)和光系统II (PSII)所推动[9].PSII在光反应过程中激发高能电子、分解水分子、释放氧和推动电子传递,对启动第1步光反应非常重要[10],叶绿素荧光技术能够快速反映藻的PSII光化学变化[11].
为探讨不同价态砷As(III)和As(V)对淡水微藻光系统II (PSII)影响的差异,本研究以生态毒理实验中常用的蛋白核小球藻(Chlorellapyrenoidosa)为实验对象[12-13],应用叶绿素荧光技术研究了As(III)和As(V)对蛋白核小球藻光系统II (PSII)的影响,比较不同价态砷As(III)和As(V)对小球藻光系统II (PSII)最大光量子产量(Fv/Fm)、实际光化学量子产量(Yield)及相关参数的影响,从而揭示As(III)和As(V)对小球藻光合活性的影响差异;再结合透射电镜来表征As(III)和As(V)对蛋白核小球藻亚细胞器的损伤特征,从光系统II (PSII)和超微观形态变化2个层面揭示蛋白核小球藻对As(III)和As(V)的应迫机理.
1 材料与方法
1.1 藻种及培养条件
蛋白核小球藻(FACHB-9)购自中国科学院水生生物研究所淡水藻种库.藻种采用BG11培养基置于光照培养箱,培养温度设为25 ℃、光照强度4 000 lx、光暗周期比14 h∶10 h、摇床转速120 r·min-1.藻种初始细胞密度约为106cells·L-1,培养时长5 d,每组设定3个平行样,并以不加砷藻液为空白对照.
1.2 实验设计
取对数期蛋白核小球藻进行实验,初始细胞密度约为106cells·L-1,As(III)浓度梯度设为15.0,37.5,75.0,112.5,150.0和225.0 mg·L-1,As(V)浓度梯度设为15.0,37.5,112.5,150.0,225.0和375.0 mg·L-1,每组设置3个平行样,并以不加砷的藻液作为空白对照,培养时长5 d,每隔24 h取样,用分光光度计UV-2450测定小球藻的光密度.选取37.5,112.5及150.0 mg·L-1浓度对小球藻进行无机砷毒性暴露,时长5 d,并设置空白对照,每隔24 h定时取样,用叶绿素荧光仪测定小球藻的叶绿素a含量及叶绿素荧光参数.
1.3 实验方法
1.3.1 小球藻细胞生长测定
蛋白核小球藻细胞密度(Y×106cell·mL-1)与吸光值OD690(X)之间具有很好的线性关系,可得线性回归方程为Y=16.127X-0.18 (R2>0.999).因此其生长状况采用分光光度计UV-2450测得的光密度值 (OD690)进行表征;同时根据细胞生长状况计算砷对小球藻的生长抑制率η.
μ=[ln(Nn)-ln(N0)] / (tn-t0),
η=(μ0-μs)/μ0×100%,
式中,N0和Nn分别为起始时间(t0)和毒性测试时间(tn)的藻密度,μ0与μs分别为空白组与处理组的生长率.
1.3.2 叶绿素a及叶绿素荧光参数测定
通过叶绿素荧光仪(PHYTO-PAM,Walz,Germany)测定藻类初始光合活性、空白组(不添加砷)以及砷暴露24,48,72,96和120 h后的光合作用活性.取2 mL藻样,暗反应5 min后,先打开测量光(measuring light, ML)仪器检测最小荧光F0,随后打开饱和脉冲(saturation pluse, SP),得到最大荧光Fm,(Fm-F0) 即为可变荧光Fv,Fv与Fm的比值(Fv/Fm),即为光系统II的最大光量子产量(Fv/Fm)[14].将仪器设定为每隔20 s强度逐渐增大的光化光(actinic light, AL),得到快速光响应曲线(rapid light curve, RLC),利用PHYTO-PAM分析软件v2.13可直接读取光响应曲线特征参数: 最大电子传递速率(rETRmax)、线性区段斜率α[15].在光适应180 s后,打开饱和脉冲测定蛋白核小球藻的实际光化学量子产量(Yield).在光频率为32 Hz时测得即时荧光(Ft)与叶绿素a浓度呈线性关系,因此可得藻叶绿素a含量[14].
1.3.3 亚细胞形态学分析
取20 mL藻液3 000 r·min-1离心10 min,弃上清液,将藻泥收集于1.5 mL离心管,加入2.5%的戊二醛溶液,4 ℃固定过夜,然后按下列步骤处理样品[16]:
(1) 3 500 r·min-1离心10 min,弃固定液,用2%琼脂凝固5 min,加0.1 mol·L-1,pH值为 7.0的磷酸缓冲液漂洗样品3次,每次15 min;再用1%的锇酸溶液固定样品1.5 h;固定结束后,用0.1 mol·L-1,pH 值为7.0的磷酸缓冲液漂洗样品3次,每次15 min;
(2) 用梯度浓度(包括30%,50%,70%,80%,90%和95% 6种浓度)的乙醇溶液对样品进行脱水处理,每种浓度处理15 min,再用100%的乙醇处理20 min;最后过度到纯丙酮处理20 min;脱水后的样品用V/V=1/1包埋剂与丙酮的混合液处理1 h;再用V/V=3/1包埋剂与丙酮的混合液处理样品3 h;最后将样品浸没于纯包埋剂中处理过夜;
(3) 将经过渗透处理的样品包埋起来,70 ℃加热过夜.包埋好的样品在Reichert超薄切片机中切片,获得70~90 nm的切片,该切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色15 min后,在Hitachi H-7650型透射电镜中观察.
1.4 数据统计分析
用SPSS 20软件(IBM)进行数据分析,3次重复实验结果均以平均值±标准偏差(mean±SD)表示.砷毒性剂量-效应采用Probit回归分析求得;暴露组与空白组差异显著性分析由one-way ANOVA方差分析法和最小显著极差法(LSD)完成.叶绿素荧光快速光曲线数据由PhytoWin软件直接读出,其参数由PhytoWin软件经Platt拟合给出.
2 结果与讨论
2.1 As(III)与As(V)对小球藻的剂量效应特征
不同砷暴露浓度下小球藻的生长曲线表明,砷浓度低于37.5 mg·L-1时,蛋白核小球藻对砷毒性表现出一定的耐受性,而当砷浓度高于75.0 mg·L-1时,会显著抑制小球藻的生长,且随着砷暴露浓度的增大,其抑制作用增强(见图1和图2).用SPSS Probit回归分析获得48,72,96及120 h暴露时间下,As(III)对该藻的EC50值分别为 174.7,111.0,93.7及87.7 mg·L-1均显著低于As(V)的EC50值213.0,159.0,150.7及144.7 mg·L-1(p<0.01)(见表1),表明同等条件下As(III)对蛋白核小球藻的毒性显著大于As(V).
表1 As(III)与As(V)对蛋白核小球藻的EC50值
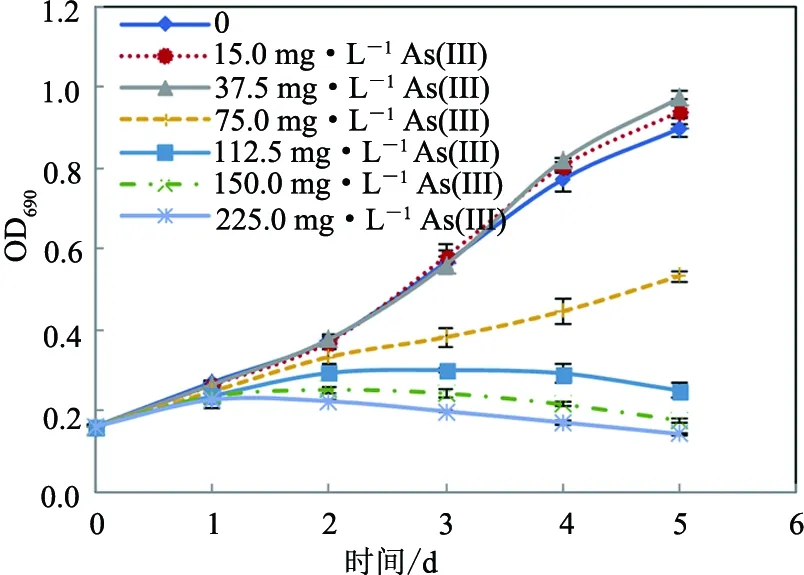
图1 As(III)对蛋白核小球藻生长的影响Fig.1 Effects of As(III) on the growth of C. pyrenoidosa

图2 As(V)对蛋白核小球藻生长的影响Fig.2 Effects of As(V) on the growth of C. pyrenoidosa
2.2 小球藻叶绿素a对不同价态砷的响应差异
由表2可知,在37.5 mg·L-1砷暴露下,藻内叶绿素a合成未受到抑制;而高砷胁迫下,藻内叶绿素a含量显著低于空白组,且叶绿素a对As(III)浓度的变化更为敏感.37.5 mg·L-1As(III)暴露48~96 h后,叶绿素a含量显著高于空白组(p<0.05),这与37.5 mg·L-1As(III)刺激蛋白核小球藻的生长实验结果相一致.当砷浓度高于112.5 mg·L-1时,As(III)与As(V)对小球藻叶绿素a合成的抑制作用存在显著性差异(p<0.01),相同浓度下As(III)对叶绿素a的合成抑制更为显著.在150.0 mg·L-1As(V)和As(III)暴露48,72,96 h后,胞内叶绿素a分别降低了17% (p<0.01),27% (p<0.01),46% (p<0.01)和30% (p<0.01),64% (p<0.01),71% (p<0.01).综上所述,叶绿素a对 As(III)和As(V)的暴露响应规律与As(III)和As(V)对小球藻生长的影响一致,均表现为高浓度As(III)对该藻的生长抑制作用大于As(V).
表2 As(III)与As(V)对蛋白核小球藻叶绿素a的影响
Table 2 Effects of different concentrations of As(III) and As(V) on the chlorophyll a content ofC.pyrenoidosa
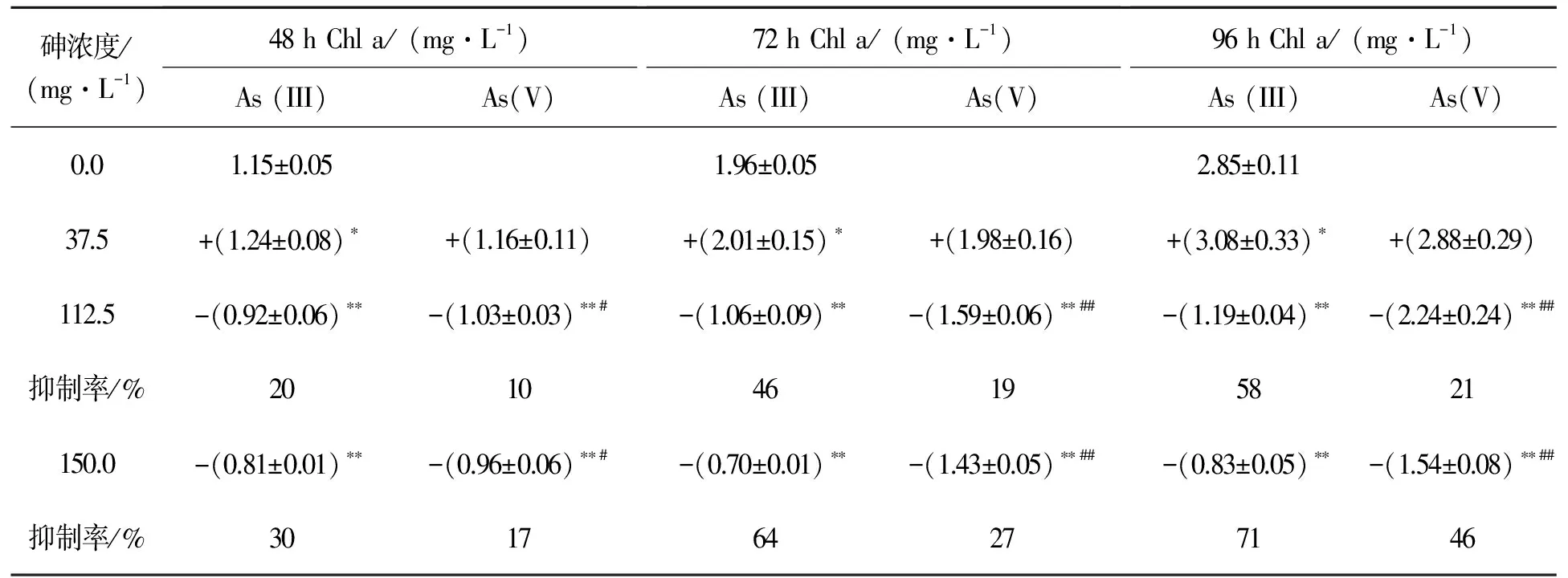
砷浓度/(mg·L-1)48hChla/(mg·L-1)As(III)As(V) 72hChla/(mg·L-1)As(III)As(V) 96hChla/(mg·L-1)As(III)As(V)0.01.15±0.051.96±0.052.85±0.1137.5+(1.24±0.08)∗+(1.16±0.11)+(2.01±0.15)∗+(1.98±0.16)+(3.08±0.33)∗+(2.88±0.29)112.5-(0.92±0.06)∗∗-(1.03±0.03)∗∗#-(1.06±0.09)∗∗-(1.59±0.06)∗∗##-(1.19±0.04)∗∗-(2.24±0.24)∗∗##抑制率/%201046195821150.0-(0.81±0.01)∗∗-(0.96±0.06)∗∗#-(0.70±0.01)∗∗-(1.43±0.05)∗∗##-(0.83±0.05)∗∗-(1.54±0.08)∗∗##抑制率/%301764277146
*p<0.05,**p<0.01, 分别表示暴露组与空白组有统计学上的差异与显著差异,#p<0.05,##p<0.01, 分别表示As (III)与As(V)有统计学上的差异与显著差异, +、-分别表示促进和抑制作用.
2.3 As(III)与As(V)抑制小球藻光合活性的差异
由图3可知,无机砷浓度为150.0 mg·L-1时,蛋白核小球藻最大光量子产量(Fv/Fm)及最大电子传递速率(rETRmax)等叶绿素荧光参数均显著低于空白组(p<0.01),且随着暴露时间的延长整体呈下降趋势.150.0 mg·L-1As(III) 和As(V)暴露96 h对小球藻PSII影响差异最大,最大光量子产量(Fv/Fm)分别降低了77% (p<0.01)和19% (p<0.01),实际光化学量子产量(Yield)分别降低了91% (p<0.01)和50%(p<0.01),线性区段斜率(α)分别降低了85% (p<0.01)和23% (p<0.01),最大电子传递速率(rETRmax)分别降低了92% (p<0.01)和51% (p<0.01)(见图3),说明As(III)对小球藻PSII抑制作用显著高于As(V) (p<0.01).
最大光量子产量(Fv/Fm)代表的是暗适应条件下光系统II(PSII)中能够将吸收的光能转化为光化学能量的反应中心的比例,体现了最大光合潜能[17].当小球藻处于光化光条件时,质体醌A (QA)通过质体醌B (QB)、质体醌 (PQ)和光系统I (PSI)不断向烟酰胺腺嘌呤二核苷磷酸 (NADP+)传递电子,电子最终传递给CO2,因此质体醌A (QA)始终保持氧化状态,最大光量子产量(Fv/Fm)值较高[18].而当小球藻受到砷胁迫时,光系统II和光系统I之间的电子传递受阻,质体醌A氧化还原反应受到限制,此时最大光量子产量(Fv/Fm)会降低.由图3(a)可知,砷浓度为150.0 mg·L-1时,As(III)对小球藻PSII最大光量子产量(Fv/Fm)的抑制作用极显著高于As(V) (p<0.01),说明As(III)对PSII电子传递抑制更强.图3(d)进一步证实了As(III)对小球藻电子传递的抑制作用更大.由于光合磷酸化与光合电子传递相偶联[19],所以砷能抑制蛋白核小球藻光系统II上的醌 (Q)向质体醌 (PQ)的电子传递,从而抑制小球藻的光合活性.综上,As(III)暴露下小球藻PSII电子传递受阻更为严重,从而降低了藻的光化学量子效率,抑制了蛋白核小球藻的光合作用活性.
2.4 As(III)与As(V)对小球藻亚细胞结构的影响
图4(a)显示了正常蛋白核小球藻(C.pyrenoidosa)的亚细胞结构,蛋白核小球藻由细胞壁(cell wall, CW)包裹,叶绿体(chloroplast, C)呈叶片状位于细胞周边,几乎占据整个细胞,类囊体(thylakoid, T)呈片层状条理分布于叶绿体中,蛋白核(pyrenoid, P)周围由一圈分布均匀的淀粉颗粒(starch grain, S)包围着.与空白组相比,225.0 mg·L-1As(III)与As(V)处理48 h后,藻细胞类囊体结构因受到挤压凌乱地分布于叶绿体中,并出现了脂质滴 (lipid droplets, Ld)(见图4(b)、(c)).由于类囊体是叶绿体中执行光能吸收和转化的场所,光合膜挤压受损将抑制光合电子的传递,抑制光合作用,从而阻碍细胞生长.与As(V)处理组相比,As(III)处理后叶绿体片层之间空泡状结构更为严重,类囊体基粒片层受挤压程度明显高于As(V)(见图4(b)、4(c)),进一步证实了As(III)对小球藻光合损伤作用显著大于As(V).
3 结 论
通过研究As(III) 和As(V)对蛋白核小球藻光系统II (PSII)的影响及差异,并观察了As(III)和As(V)对小球藻叶绿体光合膜造成的损伤,揭示了As(III)对小球藻光系统II (PSII)的抑制作用大于As(V).150.0 mg·L-1As(III) 和As(V)暴露96 h对小球藻PSII影响差异最大,最大光量子产量(Fv/Fm)、实际光量子产量(Yield)、最大电子传递速率(rETRmax) 和线性斜率(α)前者分别降低了77%,91%,92%,85%,后者分别降低了19%,50%,51%,23%.高浓度无机砷胁迫下蛋白核小球藻叶绿体片出现了层间空泡化、淀粉粒增多、蛋白核缩小、脂质滴等现象,且As(III)胁迫下小球藻类囊体受损程度高于As(V).本研究从光合电子传递和亚细胞结构形态特征层面,揭示了As(III)对蛋白核小球藻光合活性的抑制作用要大于As(V),丰富了不同价态As(III)和As(V)对淡水微藻毒效应的研究.
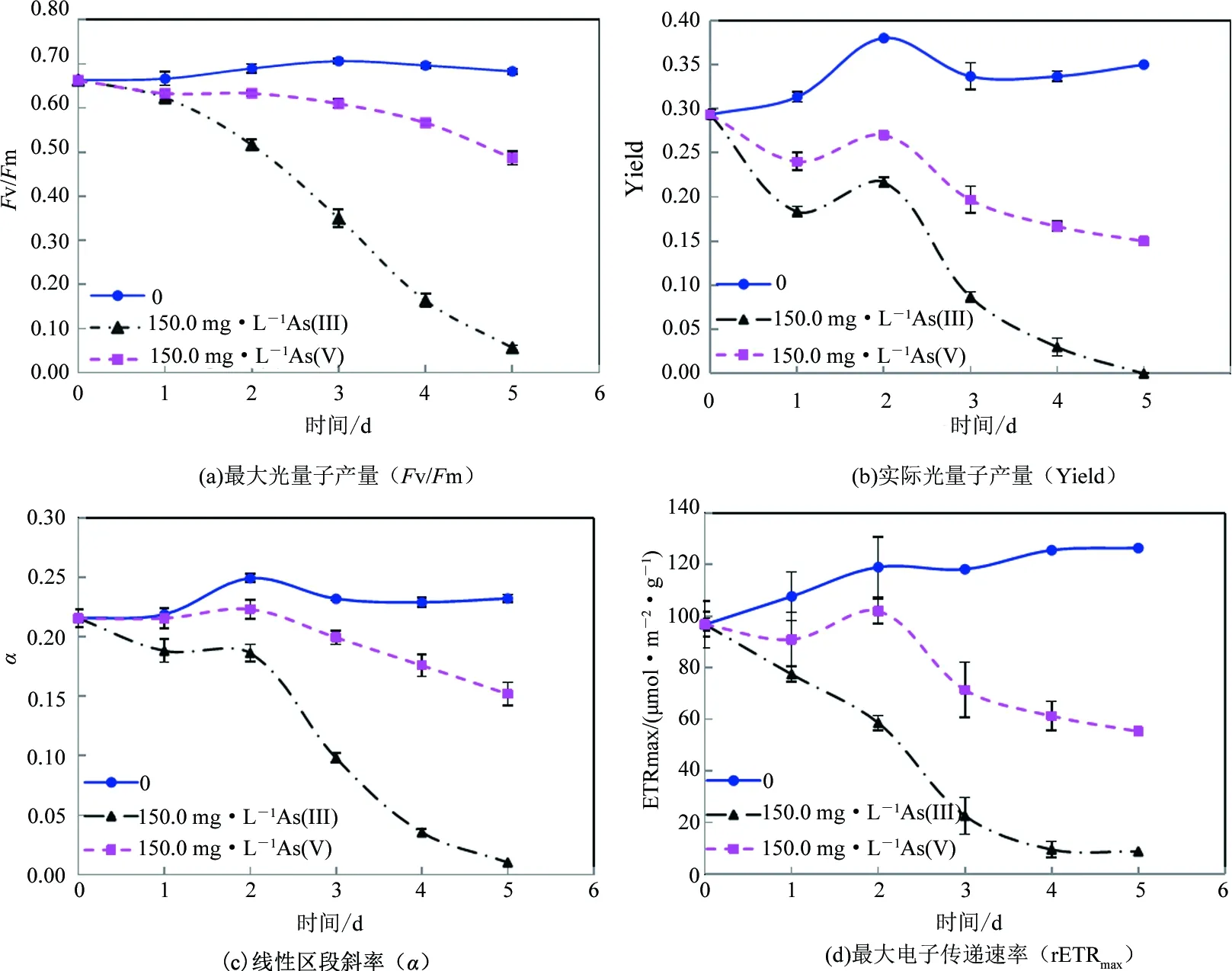
图3 As(III)与As(V)对蛋白核小球藻叶绿素荧光参数的影响Fig.3 Effects of different concentrations of As(III) and As(V) on the chlorophyll fluorescence parameters of C. pyrenoidosa
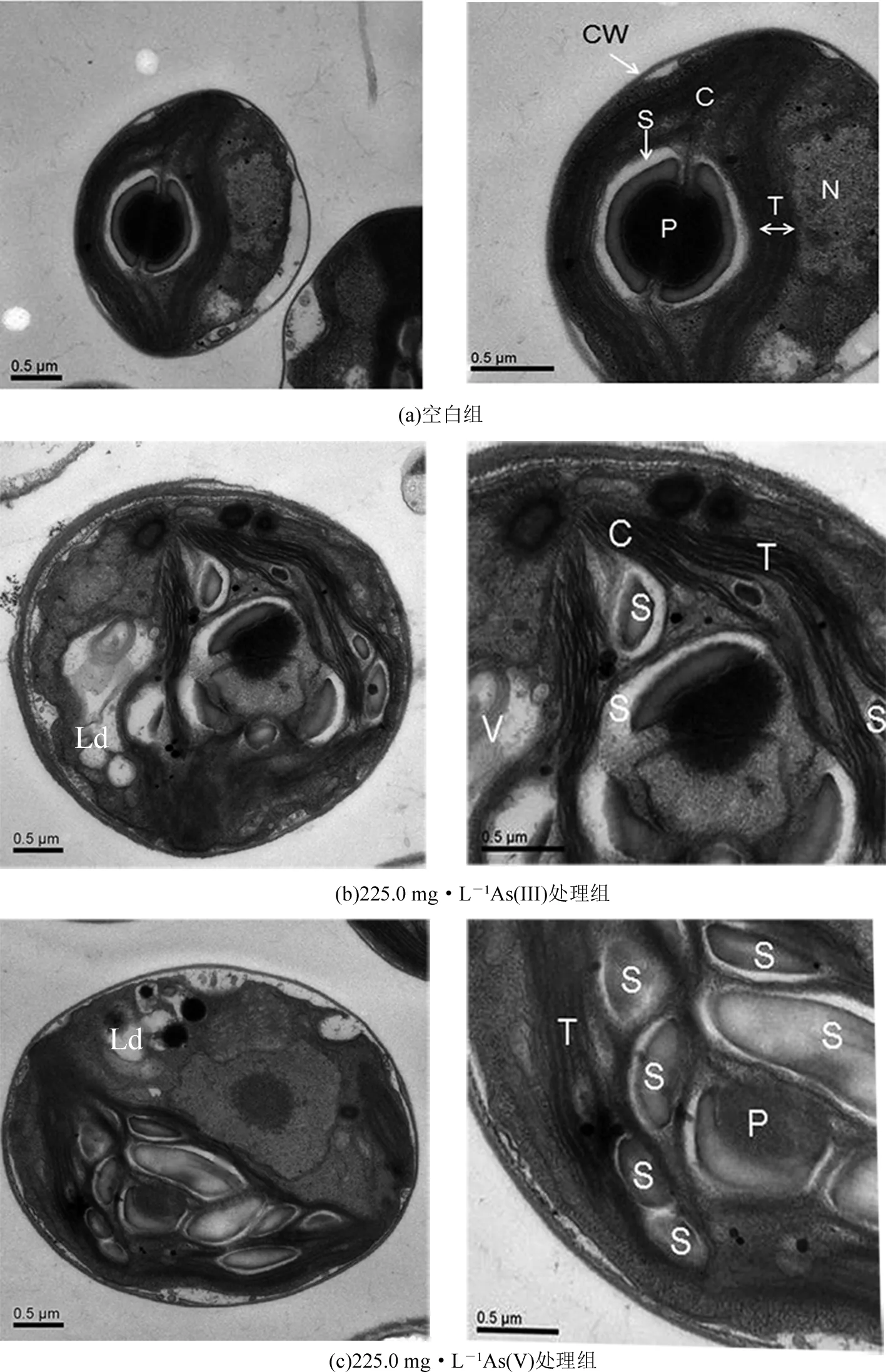
图4 蛋白核小球藻处理48 h后的亚细胞结构TEM图Fig.4 TEM images of subcellular structure of C. pyrenoidosa treated for 48 h
放大倍数: 左列×30 000,右列×50 000;图中,CW—细胞壁,C—叶绿体,T—类囊体,P—蛋白核,S—淀粉颗粒,Ld—脂质滴,N—细胞核,V—液泡.
Magnification : left column×30 000,right column×50 000; CW—cell wall, C—chloroplast, T—thylakoid, P—pyrenoid, S—starch grain, Ld—lipid droplets, N—nucleus, V—vacuole.
[1] CULLEN W R, REIMER K J. Arsenic speciation in the environment[J].ChemicalReviews, 1989, 89(4): 713-764.
[2] WANG Y, WANG S, XU P P, et al. Review of arsenic speciation, toxicity and metabolism in microalgae[J].ReviewsinEnvironmentalScienceandBio/Technology, 2015, 14(3): 427-451.
[3] GILOTEAUX L, DURAN R, CASIOT C, et al. Three-year survey of sulfate-reducing bacteria community structure in Carnoules acid mine drainage (France), highly contaminated by arsenic[J].FEMSMicrobiologyEcology, 2013, 83(3): 724-737.
[4] SCHALLER J, MKANDAWIRE M, DUDEL E G. Heavy metals and arsenic fixation into freshwater organic matter under Gammarus pulex L. influence[J].EnvironmentalPollution, 2010, 158(7): 2454-2458.
[5] WANG S Z, ZHANG D Y, PAN X L. Effects of arsenic on growth and photosystem II (PSII) activity ofMicrocystisaeruginosa[J].EcotoxicologyandEnvironmentalSafety, 2012, 84(7): 104-111.
[6] DUESTER L, GEEST V D H, MOELLEKEN S, et al. Comparative phytotoxicity of methylated and inorganic arsenic and antimony species toLemnaminor,WolffiaarrhizaandSelenastrumcapricornutum[J].MicrochemicalJournal, 2011, 97(1): 30-37.
[7] NEFF J M. Ecotoxicology of arsenic in the marine environment[J].EnvironmentalToxicologyandChemistry, 1997, 16(5): 917-927.
[8] BAHAR M M, MEGHARAJ M, NAIDU R. Influence of phosphate on toxicity and bioaccumulation of arsenic in a soil isolate of microalgaChlorellasp[J].EnvironmentalScienceandPollutionResearch, 2016, 23(3): 2663-2668.
[9] 秦晓春, SUGA M, 匡廷云, 等. 高等植物光系统I—捕光天线I (PSI-LHCI) 超分子复合物的晶体结构和能量传递途径[J].科学通报, 2016, 16(19): 2163-2175.
QIN X C, SUGA M, KUANG T Y, et al. Crystal structure of plant PSI-LHCI supercomplex and its energy transfer mechanism[J].ChineseScienceBulletin, 2016, 61(19): 2163-2175.
[10] UMENA Y, KAWAKAMI K, SHEN J R, et al. Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 A[J].Nature, 2011, 473(7345): 55-60.
[11] RITCHIE R J, MEKJINDA N. Arsenic toxicity in the water weed Wolffia arrhiza measured using pulse amplitude modulation fluorometry (PAM) measurements of photosynthesis[J].EcotoxicologyandEnvironmentalSafety, 2016, 132: 178-185.
[12] ZHANG J H, WANG J, FENG J, et al. Toxic effects of 1,4-dichlorobenzene on photosynthesis inChlorellapyrenoidosa[J].EnvironmentalMonitoringandAssessment, 2016, 188(9): 526-536.
[13] 丁腾达, 倪婉敏, 张建英. 硅藻重金属污染生态学研究进展[J].应用生态学报, 2012, 23(3): 857-866.
DING T D, NI W M, ZHANG J Y. Research advances in heavy metals pollution ecology of diatom[J].ChineseJournalofAppliedEcology, 2012, 23(3): 857-866.
[14] ZHANG M, KONG F X, WU X D, et al. Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing[J].Hydrobiologia, 2008, 603(1): 267-278.
[15] RALPH P J, GADEMANN R. Rapid light curves: A powerful tool to assess photosynthetic activity[J].AquaticBotany, 2005, 82(3): 222-237.
[16] ROCCHETTA I, MAZZUCA M, CONFORTI V, et al. Effect of chromium on the fatty acid composition of two strains of Euglena gracilis[J].EnvironmentalPollution, 2006, 141(2): 353-358.
[17] BJÖRKMAN O, DEMMIG B. Photon yield of O2evolution and chlorophyll fluorescence characteristics at 77 K among vascular plants of diverse origins[J].Planta, 1987, 170(4): 489-504.
[18] MALLICK N, MOHN F H. Use of chlorophyll fluorescence in metal-stress research: A case study with the green microalgaScenedesmus[J].EcotoxicologyandEnvironmentalSafety, 2003, 55(1): 64-69.
[19] 匡廷云.光合作用原初光能转化过程的原理与调控[M]. 南京: 江苏科学技术出版社, 2003: 360-362.
KUANG T Y.MechanismandRegulationofPrimaryEnergyConversionProcessinPhotosynthesis[M]. Nanjing: Jiangsu Science and Technology Press, 2003: 360-362.
XU Liping1, ZHOU Fang1, FENG Ning2, ZHANG Jianying1
(1.InstituteofEnvironmentalScience,ZhejiangUniversity,Hangzhou310058,China; 2.HangzhouInstituteofEnvironmentalScience,Hangzhou310014,China)
InfluenceofinorganicarseniconphotosyntheticactivityofChlorellapyrenoidosa.Journal of Zhejiang University(Science Edition),2017,44(6): 675-681
The arsenic contamination in aquatic environment has drawn significant attention to ecotoxic risk. The valence states of arsenic including arsenite [As(III)] and arsenate [As(V)] play an important role for their behavior and toxicity at different levels of exposure concentrations. In this study, the toxicity of different concentrations of As(III) and As(V) toChlorellapyrenoidosawas determined and compared based on four different test endpoints: The growth inhibition rate, the chlorophyll a (Chl a) concentration, the chlorophyll fluorescence parameters of photosystem II (PSII) and the ultra-structural morphology of cells. The EC50values of As(V) were higher than As(III), which indicated that As(III) was more toxic toC.pyrenoidosathan As(V). The Chl a concentration ofC.pyrenoidosatreated by As(V) was higher than that treated by As(III). In general, the chlorophyll fluorescence parameters including the maximum quantum yields (Fv/Fm), the effective quantum yields (Yield), the maximum electron transport rate (rETRmax) and the linear section slope (α) ofC.pyrenoidosatreated by 150.0 mg·L-1As(III) for 96 h were decreased by 77%, 91%, 92% and 85%, which was higher than that exposed to As(V) of 19%, 50%, 51% and 23%, respectively, and chlorophyll fluorescence parameters were inhibited by high concentrations of both arsenic. The ultrastructural morphology of cells grown in the two species arsenic was observed by transmission electron microscopy. The cell wall separated from the cell membrane, accumulated starch granules were observed in the chloroplast, and diminishing pyrenoid and some lipid droplets were also observed in the cytoplasm. The mechanism of arsenite and arsenate toxicity toC.pyrenoidosawas explored, and the inhibition of PSII photosynthetic efficiency toC.pyrenoidosawas determined. These results will help to develop an understanding of the biologically mediated environmental processes of arsenite and arsenate.
inorganic Arsenic;Chlorellapyrenoidosa; chlorophyll fluorescence; transmission electron microscopy
2017-03-31.
国家自然科学基金资助项目(21477103).
许荔萍(1990—),ORCID: http://orcid.org/0000-0002-2855-422X,女,硕士,主要从事水生态毒理学研究,E-mail:21314017@zju.edu.cn.
*通信作者,ORCID: http://orcid.org/0000-0002-1636-5544,E-mail:zjy@zju.edu.cn.
10.3785/j.issn.1008-9497.2017.06.006
X 172
A
1008-9497(2017)06-675-07

