QuEChERS—液相色谱—离子阱—飞行时间质谱法快速筛查玉米酒糟粕中的10种真菌毒素
2017-11-30张帆王美玲戴洁芸颜鸿飞张莹戴华
张帆+王美玲+戴洁芸+颜鸿飞+张莹+戴华

摘要:建立了玉米酒糟粕中多种真菌毒素类物质(黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、α-玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮、玉米赤霉烯酮)的离子阱-飞行时间质谱检测法。样品经乙腈超声提取,提取液经QuEChERS吸附剂净化,以C18色谱柱(150 mm×4.6 mm,3.5 μm)分离,乙腈和0.1%乙酸为流动相梯度洗脱,正负模式同时扫描;以保留时间和化合物精确分子离子质量对真菌毒素进行识别。结果表明,10种化合物在一定浓度范围内线性关系良好,相关系数大于0.98。定量限(S/N≥10)为3~20 μg/kg。3种水平的加标平均回收率为51.6%~111.3%,相对标准偏差(RSD)为4.1%~14.7%。该方法利用精确质量数匹配和自建标准谱库检索,实现快速筛查,并使用多级特征碎片离子进行确证,具有简便、快速、高效、准确等优点,适用于玉米酒糟粕中多种真菌毒素类物质的快速筛查和测定。
关键词:高效液相色谱-离子阱-飞行时间串联质谱;玉米酒糟粕;真菌毒素;筛查
中图分类号: O657.7+2 文献标志码: A 文章编号:1002-1302(2017)20-0202-04
玉米是干法生产燃料乙醇的主要原料,玉米酒糟是现代化燃料乙醇工厂干法生产燃料乙醇过程中,用玉米籽实与精选酵母混合发酵生产乙醇和二氧化碳后,剩余的发酵残留物通过低温干燥形成的共生产品。在燃料乙醇生产中,淀粉发酵得到乙醇,但玉米颗粒中的剩余部分(胚乳、胚芽)仍保留着包括能量、蛋白和磷在内的许多初始营养价值,可回收并重新组合成各种动物饲料组分。我国已成为全球最大的玉米酒糟蛋白饲料进口国。然而营养变异和真菌毒素污染是玉米和玉米酒糟面临的主要问题,给食品工业、饲料工业和畜牧业生产带来了一系列不容忽视的问题。
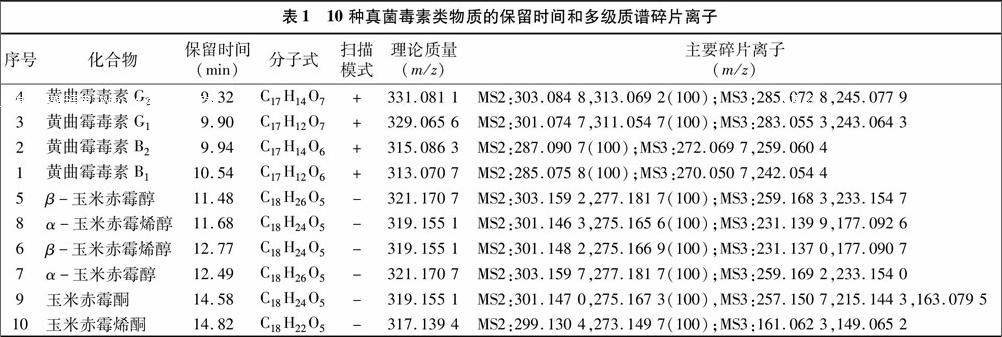
真菌毒素是由真菌产生的次生代谢产物,常见真菌毒素有黄曲霉毒素、镰刀菌毒素、玉米赤霉烯酮类、伏马菌素等。黄曲霉素是一类毒性极强的物质,具有强致癌性和强免疫抑制性,天然污染的黄曲霉毒素主要有黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2,其中花生、玉米污染最为严重。玉米赤霉烯酮(ZEN)是由镰刀菌产生的一种类雌激素真菌毒素,广泛存在于霉变的玉米、高粱、小麦、大麦等粮食作物中,能刺激雌激素受体转录,降低家畜的耗料量,导致其生长下降,也是玉米酒糟质量安全的主要问题,主要包括α-玉米赤霉醇、β-玉米赤霉醇、α玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮等[1]。为了保护人们身体健康,很多国家包括中国制定了粮谷和饲料中一部分真菌毒素的限量。欧盟已经规定了所有饲料原料、饲料、饲料添加剂、辅助性饲料里面的黄曲霉毒素含量不能超过20 μg/kg。我国GB 13078—2001《饲料卫生标准》规定,玉米花生饼(粕)中黄曲霉毒素B1限量为50 μg/kg。
目前对于粮谷和饲料中真菌毒素的检测方法主要有免疫法、薄层色谱法(TLC)、高效液相色谱法HPLC)、气相色谱-质谱法(GC-MS)及高效液相色谱-质谱法(HPLC-MS)等[2-6]。然而离子阱飞行时间串联质谱(LCMS-IT-TOF)兼具离子阱和高分辨飞行时间质谱的检测能力,能够进行分子量的精确测定,同时还能提供多级质谱碎片离子信息,使被测化合物的筛查和确证更加简便化。真菌毒素的样品前处理技术包括液-液萃取和固相萃取,最常用的小柱是免疫亲和柱[7]和Mycosep 226萃取柱[8-9]。这些小柱虽然操作方便快捷,但是价格昂贵,增加了分析成本。分散固相萃取样品前处理方法(QuEChERS)是近几年发展起来的样品前处理方法,由于前处理简单、快速、高效,适用于各种分子结构和极性化合物的提取净化,广泛应用于水果、蔬菜中多种农药残留的检测。但这种方法在真菌毒素分析中使用很少。本研究基于QuEChERS原理的快速提取方法,结合离子阱-飞行时间质谱技术,免去繁琐的SPE净化步骤,只需1步提取浓缩就可实现玉米酒糟粕中10种真菌毒素类物质的快速筛查和定量测定,以期为玉米和玉米酒糟粕的进出口检测提供依据。
1 材料与方法
1.1 仪器、试剂与材料
液相色谱-离子阱-飞行时间串联质谱(日本岛津公司);工作站LC MS solution V 3.6;SK-1涡旋混匀器(常州澳华仪器有限公司);Sigma 2-16P高速离心机(德国Sigma公司);Turbo Vap Ⅱ全自动氮吹浓缩仪(美国Capliper公司)。
黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、α-玉米赤霉醇、β-玉米赤霉醇、玉米赤霉烯酮、α-玉米赤霉烯醇、β-玉米赤霉烯醇和玉米赤霉酮购于美国Sigma Aldrich公司和德国Dr.Ehrenstorfer公司,纯度≥95%。N-丙基乙二胺吸附剂(PSA)、十八烷基键合硅胶吸附剂(C18-封端)和石墨化炭黑吸附剂(GCB)均为40~60 μm,购于北京艾杰尔有限公司。甲醇、乙腈为色谱纯(德国Merck公司)。其余试剂均为分析纯,试验用水为超纯水(美国Millipore超纯水仪制备)。
1.2 标准溶液配制
分別称取1 mg上述标准品,置于10 mL棕色容量瓶中,用甲醇溶解并定容配制成100 μg/mL的标准储备液,转入棕色样品瓶中,-18 ℃下避光保存。试验时用甲醇稀释上述标准储备液,配制成不同浓度的混合标准使用液,4 ℃下保存。
试样制备:取样品约500 g,用粉碎机粉碎,装入洁净容器内作为试样,密封并标明标记,室温下保存。
1.3 样品前处理
称取5 g均匀试样(精确至0.01 g)于50 mL塑料离心管中,加入10 mL水涡旋混匀并浸泡10 min,再加入2 g氯化钠和15 mL 1%乙酸乙腈,涡旋混匀后,振荡提取15 min,6 000 r/min 离心3 min;取上清液至另一刻度离心管中,再用10 mL 1%乙酸乙腈溶液重复上述提取操作,合并提取液并定容至25 mL。取10 mL提取液,加入2 g无水硫酸镁、100 mg C18粉末和50 mg PSA粉末,涡旋混匀2 min,6 000 r/min离心3 min;取5 mL上清液,40 ℃下氮气吹至近干,用2 mL甲醇-水混合溶液(等体积)溶解残渣,过0.22 μm滤膜待测。endprint
1.4 色谱条件
色谱柱:Agilent C18柱(4.6 mm×150 mm,3.5 m)。流动相A为0.1%乙酸水溶液,流动相B为乙腈,梯度洗脱程序:0~5 min,90% A~60% A;5.1~13 min 60% B~30% B,保持2 min;15.1~18 min 30% B~90% B。柱温为40 ℃。进样体积为10 μL。
1.5 质谱条件
离子源:ESI,正负离子同时扫描;扫描范围:MS1 m/z 200~400,MS2 m/z 50~400,MS3 m/z 50~400;加热模块温度:200 ℃;CDL温度:200 ℃;雾化气流速:1.5 L/min;干燥气体压力:100 kPa;离子源电压:正离子模式+4.5 kV,负离子模式-3.5 kV;检测器电压:1.6 kV;质量数校准方法:自动调谐优化电压,外标法校准质量数。数据采集系统为LC MS solution V 3.6。
2 结果与分析
2.1 质谱条件和色谱条件的优化
黄曲霉毒素类物质易在正离子模式下电离,形成[M+H]+准分子离子,玉米赤霉烯酮类物质在正离子模式下形成[M-H]-准分子离子;因此充分利用离子阱飞行时间串联质谱快速正负极转换功能,对样品同时进行正负离子模式扫描,实现1次进样得到所有化合物的质谱信息,节省分析时间。同时优化质谱的离子源温度、干燥气流、检测器电压,使所有目标化合物都有良好的响应信号。
流动相考察了水-甲醇、0.1%乙酸-甲醇、0.1%甲酸-乙腈、5 mmol/L乙酸胺-乙腈、0.1%乙酸-乙腈等体系对色谱峰形以及质谱强度的影响。比较发现,选择0.1%乙酸-乙腈作为流动相,梯度洗脱时,各化合物的离子化效率高且分离效果好,10种真菌毒素类物质的保留时间和多级质谱碎片离子见表1。
2.2 提取方法优化
真菌毒素类物质多属于弱极性或中等极性,易溶于甲醇、乙腈、丙酮、三氯甲烷等有机溶剂。文献报道常用的提取溶剂有甲醇水溶液(80 ∶ 20,V ∶ V)或乙腈水溶液(86 ∶ 14,V ∶ V)。由于玉米酒糟粕属于干性样品,本研究中先加水将样品充分浸泡,再用1%乙酸乙腈提取,以保证提取溶剂与样品充分接触,提高回收率。加入过量氯化钠,具有盐析作用,使乙腈与水分层,同时降低基质中亲水性成分的溶解度,减少杂质干扰。
2.3 净化条件的优化
文献报道的真菌毒素类物质基本上采用免疫亲和柱和多功能净化柱净化,本研究则采用分散固相萃取进行净化,对C18、PSA、GCB等填料的净化效果进行比较。结果表明,石墨化炭吸附剂能有效去除基质中色素的影响;PSA吸附剂能去除样品基质中的脂肪酸。C18吸附剂可以去除样品中的油脂和其他非极性干扰物,对目标化合物的吸附量不大。通过优化试验,发现加入50 mg PSA和100 mg C18混合吸附剂的净化效果较好,能满足大部分化合物的回收率要求(图1)。
2.4 基质效应
本研究用离子抑制率,即基质空白添加中监控离子响应强度比标准溶液中相应监控离子响应强度减少的百分比,来表述样品基质对监控离子响应强度的抑制作用。试验结果显示,本试验条件下黄曲霉毒素B1、α-玉米赤霉醇、β-玉米赤霉醇和玉米赤霉酮的基质抑制效应较严重,抑制率为48.5%~739%,而其他物质的基质抑制效应较小,低于20%。尝试改变流动相比例或梯度等方法来消除基体效应,结果发现还是无法避免共流出杂质产生的严重基质抑制效应。因此本研究采用空白基质配标来消除基体效应。
2.5 定性筛查及确证
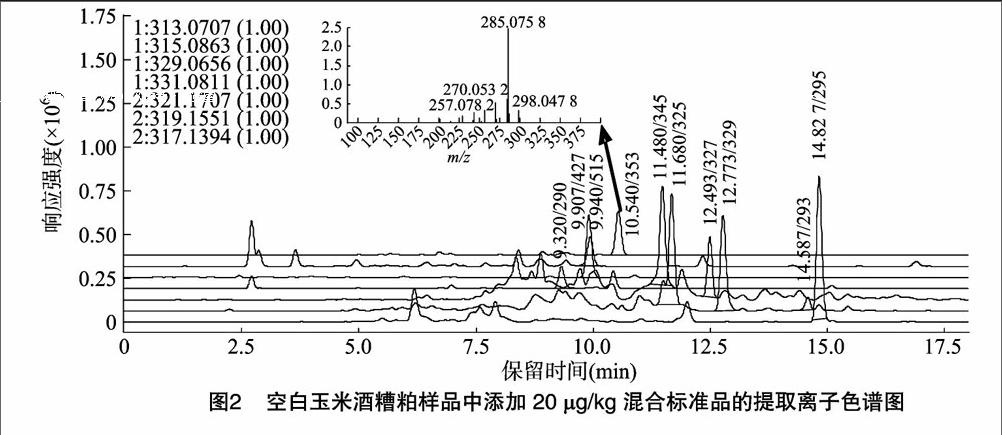
在本研究条件下,对实际樣品进行正负离子扫描,将所获得的总离子流图应用高精度的质量提取,得到各化合物的分子特征离子提取色谱图。图2为空白玉米酒糟粕中添加10种真菌毒素类物质的离子提取色谱图,通过检索精确质量谱库,得到每种化合物与精确质量谱库中化合物的匹配度,结果表明10种真菌毒素类的匹配度均较高。因此,根据保留时间、精确质量即可对多种化合物进行定性筛查,筛查出的阳性样品再经二级谱图扫描,通过二级特征碎片离子标准数据库检索进行确证。
2.6 方法的线性关系及定量限
采用空白基质配制不同浓度的混合标准溶液进行测定,以各组分的峰面积对质量浓度绘制标准曲线,求得线性回归方程和线性相关系数(表2)。以10倍信噪比(S/N≥10)对应的空白样品添加质量浓度作为方法的定量限(LOQ),经样品添加试验确定玉米酒糟粕中10种真菌毒素类的定量限为3.0~20 μg/kg。
2.7 回收率与精密度试验
在空白玉米酒糟粕样品中,添加低、中、高3种浓度水平的混合标准溶液进行添加回收试验,平行测定6次,计算回收率和相对标准偏差。结果表明,10种真菌毒素类化合物的平均回收率为51.6%~111.3%,相对标准偏差(RSD)为4.1%~14.7%(表2)。
2.8 实际样品分析
应用本方法对124个玉米酒糟粕样品进行真菌毒素的筛查与测定。结果发现,在玉米酒糟粕中玉米赤霉醇类毒素有相当水平的检出,其中玉米赤霉烯酮检出率最高,含量为 23~646 μg/kg,α-玉米赤霉醇、β-玉米赤霉醇的含量分别为22~50、30~83 μg/kg。黄曲霉毒素的检出率相对较低,黄曲霉毒素总量一般低于20 μg/kg。图3、图4分别为玉米赤霉烯酮阳性样品的提取离子流图和多级质谱图。
3 结论
建立了玉米酒糟粕样品中10种真菌毒素类化合物的液相色谱-离子阱-飞行时间串联质谱筛查方法。样品经乙腈提取,QuEChERS技术净化,通过离子阱-飞行时间质谱的精确质量数匹配和二级特征碎片离子标准谱库检索,可实现对不同真菌毒素类化合物的同时定性筛查和定量分析。该方法前处理过程简便、灵敏度高、选择性好,能满足日常检测要求,可为玉米酒糟粕中真菌毒素的检测和监控提供技术保障,对严格控制其产品质量具有重要意义。endprint
参考文献:
[1]孟 娟,张 晶,张 楠,等. 固相萃取-超高效液相色谱-串联质谱法检测粮食及其制品中的玉米赤霉烯酮类真菌毒素[J]. 色谱,2010,28(6):601-607.
[2]冯 翀. 食品中真菌毒素检测分析-以酶联免疫吸附法(ELISA)为例[J]. 中国科技博览,2011(36):264-265.
[3]胡骁飞,职爱民,刘庆堂,等. 真菌毒素ELISA检测方法新进展[J]. 中国农学通报,2010,26(8):100-103.
[4]曾红燕,黎源倩,敬海泉. 高效液相色谱法测定粮食中玉米赤霉烯酮及其代谢物[J]. 分析化學,2006,34(3):351-354.
[5]胡 娜,徐 玲. 真菌毒素检测方法研究进展[J]. 食品科学,2007,28(8):563-565.
[6]张晓飞,岳延涛,杨美华,等. 色谱-质谱联用技术在真菌毒素检测中的研究进展[J]. 贵州农业科学,2009,37(12):109-114.
[7]Schuhmacher R,Krska R,Grasserbauer M,et al. Immuno-affinity columns versus conventional clean-up: a method-comparison study for the determination of zearalenone in corn[J]. Fresenius Journal of Analytical Chemistry,1998,360(2):241-245.
[8]Biselli S,Hummert C. Development of a multicomponent method for fusarium toxins using LC-MS/MS and its application during a survey for the content of T-2 toxin and deoxynivalenol in various feed and food samples[J]. Food Additives and Contaminants,2005,22(8):752-760.
[9]Biselli S,Hartig L,Wegner H,et al. Analysis of fusarium toxins using LC-MS-MS:application to various food and feed matrices[J]. Spectroscopy,2005,20(2):20-26.endprint
