茉莉酸甲酯对高温胁迫、生物蚕食无花果幼苗的影响
2017-11-30郭正兵韩柏明郭强
郭正兵+韩柏明+郭强
摘要:以波姬红无花果为试材,40 ℃高温胁迫经茉莉酸甲酯处理的无花果幼苗,分析与抗逆相关的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、茉莉酸合成路径中脂氧合酶(LOX)活性变化及丙二醛、脯氨酸、多酚含量,同时,采用黑绒金龟蚕食伤害经茉莉酸甲酯处理的无花果幼苗,分析与生物胁迫相关的多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)活性变化及单宁、胰蛋白酶抑制素含量。结果表明,高温胁迫经50 μmol/L茉莉酸甲酯处理的无花果幼苗,其SOD、POD、CAT活性与未用茉莉酸甲酯处理(对照)相比有显著增加,脯氨酸、多酚含量提高,丙二醛含量降低;生物蚕食经50 μmol/L茉莉酸甲酯处理的幼苗叶片,其PPO、PAL活性增加,单宁、胰蛋白酶抑制素含量提高。经茉莉酸甲酯处理的无花果幼苗,高温胁迫、生物蚕食能通过增加SOD、POD、CAT活性抵御非生物逆境的胁迫,通过提高PPO、PAL活性增强对生物胁迫的抗性。
关键词:无花果;抗逆;茉莉酸甲酯;超氧化物歧化酶;过氧化物酶;多酚氧化酶;高温胁迫;生物蚕食
中图分类号: S663.301 文献标志码: A 文章编号:1002-1302(2017)20-0138-06
无花果(Ficus carica L.)为桑科榕属多年生落叶灌木或小乔木,原产于亚洲西部,目前我国各地均有栽培,尤以新疆维吾尔自治区南部、广东、福建沿海地区、江浙一带及胶东半岛栽培较多,北京以南的内陆地区近些年无花果栽培面积也迅速增加,北京以北地区因天气寒冷,若栽培无花果须采用温室大棚等设施进行越冬。无花果栽培面积的不断扩大导致需苗量越来越大,而植物生长调节剂研究应用可为无花果的广泛栽培提供理论指导[1]。
茉莉酸甲酯(MeJA)是通过硬脂酸途径产生的脂肪酸衍生物,广泛存在于各类植物中[2]。当植物受到创伤、昆虫咬食或病原菌侵染等引发局部及系统性的伤害信号时,会产生茉莉酸甲酯等茉莉酸类物质,进而提高植物本身的抗性[3]。茉莉酸甲酯对植物的调节作用主要体现在2个方面:一是调节植物种子萌发、花粉发育、衰老等生长发育,二是调节植物伤害应答、抵抗病原菌侵袭等防御系统,并在转录水平上影响植物次生代谢[4]。茉莉酸类物质诱导植物次生代謝物含量的增加,主要是以信号分子的形式参与到植物次生代谢过程中,调控相关关键酶基因的表达,影响关键酶活性,从而对次生代谢物的产生进行调控[5],茉莉酸类物质在植物抵御逆境胁迫上起着关键作用。本研究利用茉莉酸甲酯处理经高温胁迫、生物蚕食的无花果幼苗叶片,进行抗逆酶活性分析,为茉莉酸甲酯在无花果中的应用提供理论基础。
1 材料与方法
1.1 试验材料
试验用外植体为波姬红无花果幼嫩枝条,2014年3月采自江苏省句容市江苏农林职业技术学院。试验用试剂为 6-苄基腺嘌呤(6-BA)、萘乙酸(NAA)、吲哚丁酸(IBA)、赤霉素(GA)、2% NaClO、0.1% HgCl2、75%乙醇、蔗糖、琼脂、MS培养基等。茉莉酸甲酯用适量的无水乙醇溶解,加入Tween-80乳化,并用蒸馏水定容,使Tween-80终浓度为1%。
1.2 无花果幼苗的扩繁
将无花果幼嫩枝条茎段接种培养30 d,将初始培养基上分化、生长健壮的芽切下,接种于MS+6-BA 0.5 mg/L+NAA 0.2 mg/L+GA 0.2 mg/L+蔗糖30 g/L+琼脂8.0 g/L(pH值5.8)的壮苗培养基上培养30 d,再将生长健壮的无花果组培苗接入生根培养基进行生根培养。培养条件为温度25 ℃、光照度2 000 lx、光照时间14 h/d。
1.3 无花果幼苗的移植与试验处理
将无菌的波姬红无花果组培苗移栽到装有营养土 ∶ 蛭石为1 ∶ 1的营养钵中,选取4叶株龄的高度、长势、叶色基本一致的幼苗置于培养箱内培养1周,温度为25 ℃、光照度为 2 000 lx、光照时间为14 h/d、相对湿度为70%~80%,其间正常浇水;采用50 μmol/L茉莉酸甲酯溶液均匀喷施无花果幼苗的叶表面和叶背,至药液欲滴为度,以喷施相同浓度乙醇和Tween-80、不含茉莉酸甲酯的水溶液为对照,光照培养箱内培养1 d。一部分幼苗于40 ℃高温胁迫1 d,取出,置于适宜环境中自然生长,并在胁迫前(0 d)及胁迫后、1、2、3、4 d 采集叶样;另一部分幼苗用黑绒金龟蚕食叶片进行生物胁迫,分别于处理后0、1、2、3、4 d采集叶样,重复4次,每重复12株苗。叶片洗净,用蒸馏水冲洗,吸水纸吸干,去除粗大的主叶脉,待测。
1.4 生理指标的测定
1.4.1 丙二醛 参照孔祥生等的方法[6]采用硫代巴比妥酸(TBA)法测定丙二醛含量:吸取离心的上清液2 mL(对照为 2 mL 蒸馏水)于试管中,加入2 mL 0.6% TBA溶液,摇匀;沸水浴煮沸,自试管内溶液出现小气泡开始计时,约10 min;取出试管,冷却,3 000 r/min离心15 min;取上清液并测量体积,以0.6% TBA溶液为空白,分别测定波长为450、532、600 nm处的吸光度。
1.4.2 脯氨酸 参照李合生的方法[7]采用茚三酮法测定脯氨酸含量:准确吸取叶片提取液移入试管中,加水补足体积到1 mL;分别加入0.25 mL甲酸、1.0 mL茚三酮-乙二醇甲醚溶液,沸水中加热15 min;取出,移入70 ℃恒温水浴锅中继续发色10 min,加入5 mL异丙醇溶液,静置5 min;测定波长 510 nm 处吸光度,利用脯氨酸浓度标准曲线计算脯氨酸含量。
1.4.3 多酚 参照卜彦花等的方法[8]测定无花果叶片多酚含量。
1.4.4 单宁 采用香草醛法[9]测定单宁含量:称取叶片 0.2 g,剪碎,浸入25 mL甲醇中提取2 h;取上清液,添加4%香草醛、甲醇溶液各2.0 mL,盐酸1.0 mL,混合,30 ℃水浴 20 min;室温下用分光光度计测定波长为510 nm处的吸光度,并以不同浓度单宁酸为标样绘制单宁浓度与吸光度的标准曲线,计算单宁含量,单位为mg/g。endprint
1.4.5 胰蛋白酶抑制素[10] 准确称取葉片0.2 g,加入4 mL含7%聚乙烯吡咯烷酮(PVP)、1.67 mmol/L苯硫脲、0.3 mol/L KCl、0.4 mmol/L维生素C(抗坏血酸)的Tris-HCl缓冲液(50 mmol/L,pH值7.8),研磨成匀浆;13 000 r/min 4 ℃离心10 min;取上清液,测定胰凝乳蛋白酶含量,测定时,先在含有0. 001 5 mg胰凝乳蛋白酶的 1.0 mmol/L HCl溶液中加入等量提取液混合反应10 min,再取100 μL混合液与2.9 mL含有0.5 mmol /L N-苯甲酰-L-酪氨酸乙酯(BTEE)的甲醇-磷酸缓冲液(pH值8.0)混匀,以BTEE和胰凝乳蛋白酶作对照,于波长256 nm处测定10 min内吸光度的变化值,单位时间内吸光度变化0.01代表生成1个单位胰蛋白酶抑制素,用U/g表示。
1.5 抗氧化酶活性的测定
称取0.5 g无花果叶片置于研钵内,加入少量经预冷的50 mmol/L含1% PVP、pH值为7.8的磷酸缓冲液,冰浴研磨;匀浆移入离心管,并用相应的磷酸缓冲液分2次冲洗研钵,并移入离心管,使提取液的终体积为5 mL;提取液于冷冻离心机内11 000 r/min 4 ℃离心20 min;取上清液,测定酶的活性,测定温度为25 ℃。
1.5.1 苯丙氨酸解氨酶(PAL) 参照邹志燕等的方法[11]测定PAL活性:在2.80 mL含20 mmol/L L-苯丙氨酸的硼酸缓冲液(0.2 mol/L,pH值8.8)中加入20 μL酶提取液,混匀,于波长290 nm处测定2 min内吸光度的变化,以1 min吸光度变化0.01表示1个酶活力单位,用U/(g·min)表示。
1.5.2 多酚氧化酶(PPO) 以邻苯二酚为底物,参照宫玉艳等的方法[12]测定PPO活性:在2.9 mL含0.02 mol/L邻苯二酚的磷酸缓冲液(0.2 mol/L,pH值7.4)中加入100 μL酶提取液,混匀,于波长420 nm处测定2 min内吸光度的变化,以1 min吸光度变化0.01表示1个酶活力单位,用U/(g·min)表示。
1.5.3 过氧化物酶(POD) 以愈创木酚为底物,参照郑炳松的方法[13]测定POD活性:在2.99 mL含0.2%愈创木酚和0.3% H2O2的磷酸缓冲液(0.05 mol/L,pH值7.4)中加入 10 μL 酶提取液,混匀,于波长470 nm处测定3 min内吸光度的变化,以1 min吸光度变化0.1表示1个酶活力单位,用 U/(g·min) 表示。
1.5.4 过氧化氢酶(CAT) 参照孔祥生等的方法[6]测定CAT活性:在含0.3% H2O2的磷酸缓冲液(0.05 mol/L,pH值7.0)中加入20 μL酶提取液,混匀,于波长240 nm处测定2 min内吸光度的变化,以1 min吸光度变化0.1表示1个酶活力单位,用U/(g·min)表示。
1.5.5 超氧化物歧化酶(SOD) 采用邻苯三酚自氧化法[7]测定SOD活性:将待测酶提取液加入到缓冲液中,混匀;加入邻苯三酚,迅速混匀,快速倒入石英比色杯中,25 ℃恒温池中于波长325 nm处连续测定2 min内吸光度变化,以1 mL反应液中1 min抑制邻苯三酚自氧化速率达50%的酶量定义为1个酶活力单位。
1.5.6 脂氧合酶(LOX)[14] 在含25 μL油酸钠母液、2 900 μL 磷酸缓冲液的溶液中加入75 μL粗酶液,以磷酸缓冲液为空白对照,25 ℃恒温池中于波长234 nm处测定吸光度,加酶液后30 s开始计时,每隔15 s测1次吸光度,共测量6次,以1 g样品1 min吸光度增加0.01为1个LOX酶活力单位。重复3次。
1.5.7 DPPH自由基清除率和总还原力测定 (1)DPPH自由基清除率的测定。在10 mL比色管中依次加入4.0 mL DPPH溶液和黄酮提取液,再加入无水乙醇至刻度,混匀立即用1 cm比色皿在517 nm波长处测吸光度,记为Di;再在温室避光保存30 min后测吸光度,记为Dj;对照试验为只加DPPH的乙醇溶液,其吸光度记为Dc。按下式计算自由基清除率(K):K=[1-(Di-Dj)/Dc]×100%。(2)总还原力的测定。在10 mL离心管中分别加入0.2 mol/L的pH值为6.6的磷酸缓冲液2.5 mL和样品溶液1 mL,加入2.5 mL 1%铁氰化钾,混合均匀后于50℃反应20 min。取出后加入2.5 mL 10%三氯乙酸终止反应,5 000 r/min离心10 min。取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL FeCl3,混匀后静置 10 min,在700 nm处检测吸光度。以维生素C作为阳性对照。
1.6 数据分析
试验数据采用Spsspasw Statistics 17.0软件进行统计,采用Duncans法进行差异显著性分析。
2 结果与分析
2.1 茉莉酸甲酯处理对高温胁迫无花果幼苗植株的影响
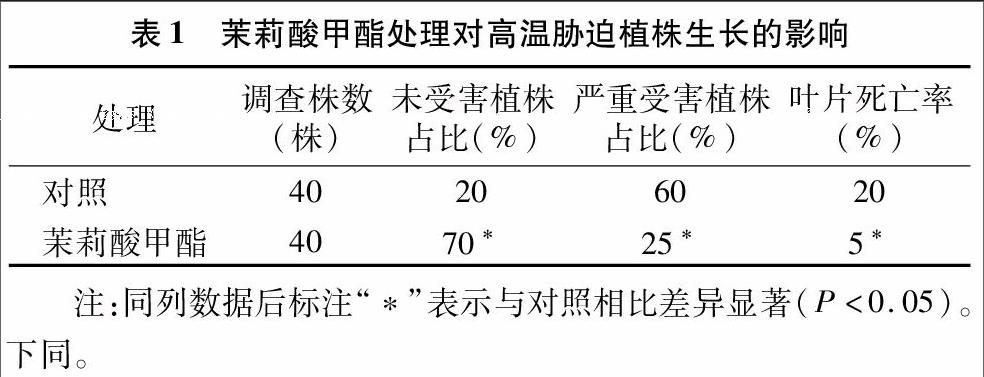
50 μmol/L茉莉酸甲酯处理的无花果幼苗经40 ℃高温胁迫1 d,并在适宜环境中自然生长3个月,结果发现,所有的植株都受到不同程度的高温胁迫影响,伤害轻微的植株的叶片出现零星褐色斑点或局部小面积坏死斑块,伤害严重的植株的叶片慢慢枯萎脱落,生长点坏死,但植株未见死亡,仍可从茎基部萌发侧芽,恢复生长;茉莉酸甲酯处理的植株恢复生长相对较快,叶片相对较大。由表1可见,未喷施茉莉酸甲酯(对照)处理的植株伤害相对较重,严重受害植株占比、叶片死亡率分别为60%、20%,而茉莉酸甲酯处理的严重受害植株占比、叶片死亡率分别仅为25%、5%。
2.2 茉莉酸甲酯处理对高温胁迫无花果叶片丙二醛、脯氨酸、多酚含量的影响endprint
2.2.1 丙二醛 由图1可见,与对照相比,喷施50 μmol/L茉莉酸甲酯的無花果,其叶片丙二醛含量有显著降低(P<0.05);胁迫处理第1 d采样,无花果叶片丙二醛含量较胁迫当天采样(0 d)有所上升,后呈缓慢下降态势。
2.2.2 脯氨酸 由图2可见,与丙二醛相反,喷施50 μmol/L茉莉酸甲酯的无花果,其叶片脯氨酸含量显著高于对照(P<0.05);脯氨酸含量变化趋势与丙二醛也有所不同,对照与喷施茉莉酸甲酯处理的无花果,其叶片脯氨酸含量在第1~3 d采样时呈上升态势,第4 d略有下降。
2.2.3 多酚 由表2可见,茉莉酸甲酯处理的无花果幼苗经高温胁迫,其叶片总酚含量迅速升高,显著高于对照(P<0.05),其中没食子酸、咖啡酸、原儿茶酸、龙胆酸、丁香酸、p-香豆酸的含量在第3 d采样时相对最高,均显著高于对照(P<0.05),无花果幼苗通过促进叶片多酚的合成以抵御逆境胁迫;对照植株经高温胁迫处理,没食子酸、咖啡酸、原儿茶酸、龙胆酸、丁香酸、p-香豆酸、总酚含量低于同期茉莉酸甲酯处理的植株。
2.3 茉莉酸甲酯处理对高温胁迫无花果叶片抗氧化酶活性的影响
2.3.1 LOX 茉莉酸是植物进行抗逆的一种重要激素,LOX是茉莉酸合成路径中的第一个关键酶,且茉莉酸具有自我激活合成路径的作用,外源茉莉酸的喷施能促进内源茉莉酸的合成,而LOX活性的高低可反映内源茉莉酸的含量大小。由图3可见,茉莉酸甲酯处理的无花果幼苗经高温胁迫,其叶片LOX活性在1~3 d采样时呈上升态势,4 d时略有下降,其中,第2~3 d采样的叶片LOX活性显著高于对照处理(P<0.05);对照叶片的LOX活性呈缓慢上升趋势,变化相对较小。
2.3.2 SOD 由图4可见,茉莉酸甲酯处理的无花果幼苗经高温胁迫,其叶片SOD活性在1~3 d采样时呈上升态势,4 d时略有下降,其中,2~4 d采样的叶片SOD活性显著高于对照处理(P<0.05);对照处理的无花果叶片其SOD活性在 1 d 采样时含量上升,后逐渐下降。
2.3.3 CAT 由图5可见,茉莉酸甲酯处理的无花果幼苗经高温胁迫,其叶片CAT活性在1~2 d采样时上升,3~4 d 呈下降态势,其中,1~4 d采样的叶片CAT活性显著高于对照处理(P<0.05);对照处理的叶片CAT活性变化趋势与茉莉酸甲酯处理一致,呈先升后降态势。
2.3.4 POD 由图6可见,茉莉酸甲酯处理的无花果幼苗经高温胁迫,其叶片POD活性变化趋势与CAT一致,在1~2 d 采样时上升,3~4 d下降,其中,1~4 d采样的叶片POD活性显著高于对照处理(P<0.05);对照处理的叶片POD活性呈先升后降态势。
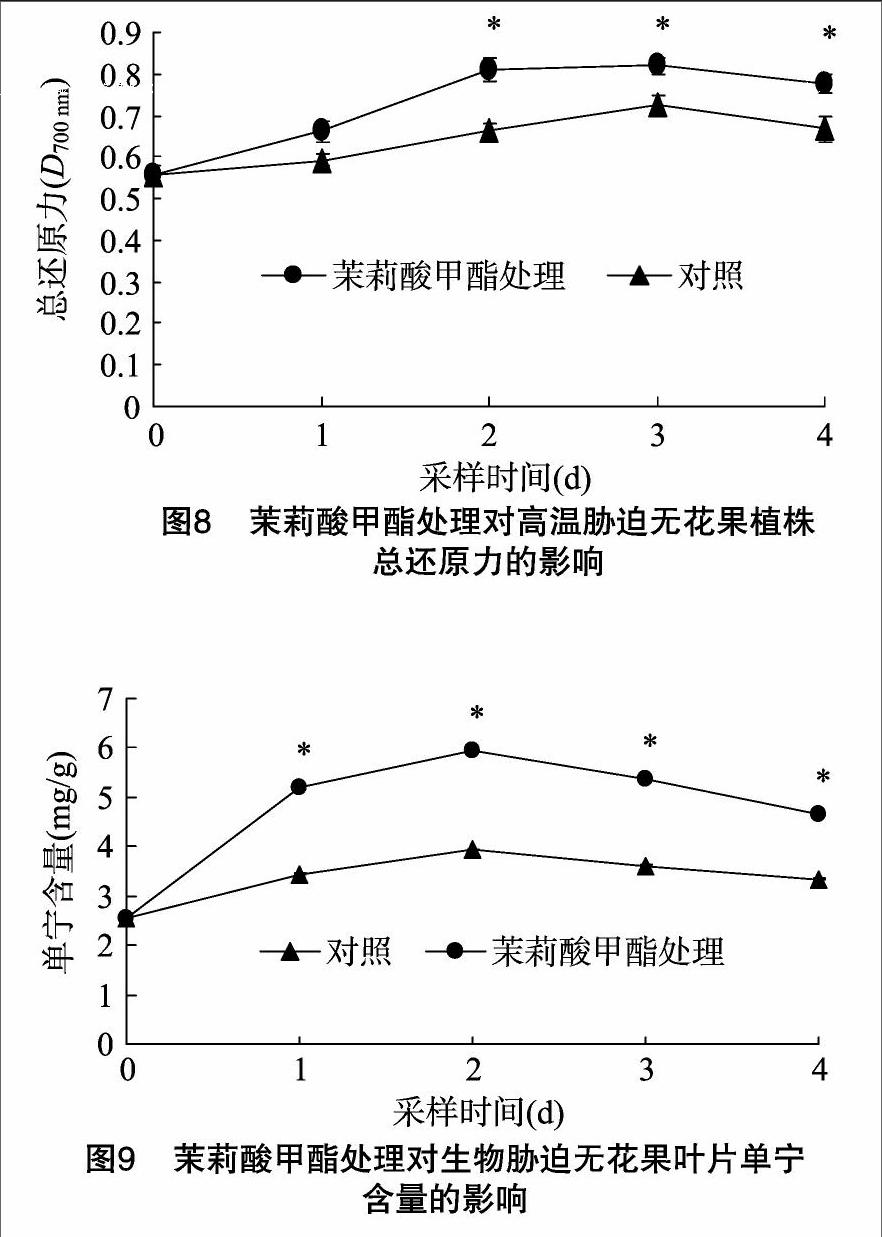
2.3.5 DPPH自由基的清除和总还原力 由图7、图8可见,茉莉酸甲酯和对照处理的无花果幼苗经高温胁迫,其植株DPPH自由基清除率、总还原力随采样时期的延长呈先升后降趋势,这可能与高温胁迫后酚酸、没食子酸、总酚含量的变化相关;50 μmol/L茉莉酸甲酯处理的植株DPPH自由基清除率和总还原力在2~4 d采样时均显著高于对照(P<0.05)。
2.4 茉莉酸甲酯处理对生物胁迫无花果叶片抗性物质的影响
2.4.1 单宁 利用黑绒金龟蚕食经茉莉酸甲酯处理的无花果叶片,对其进行生物胁迫,结果(表9)表明,叶片单宁含量在1~2 d采样时上升,3~4 d下降,其中,1~4 d采样的叶片POD活性显著高于对照处理(P<0.05);对照叶片单宁含量变化趋势与茉莉酸甲酯处理的一致。
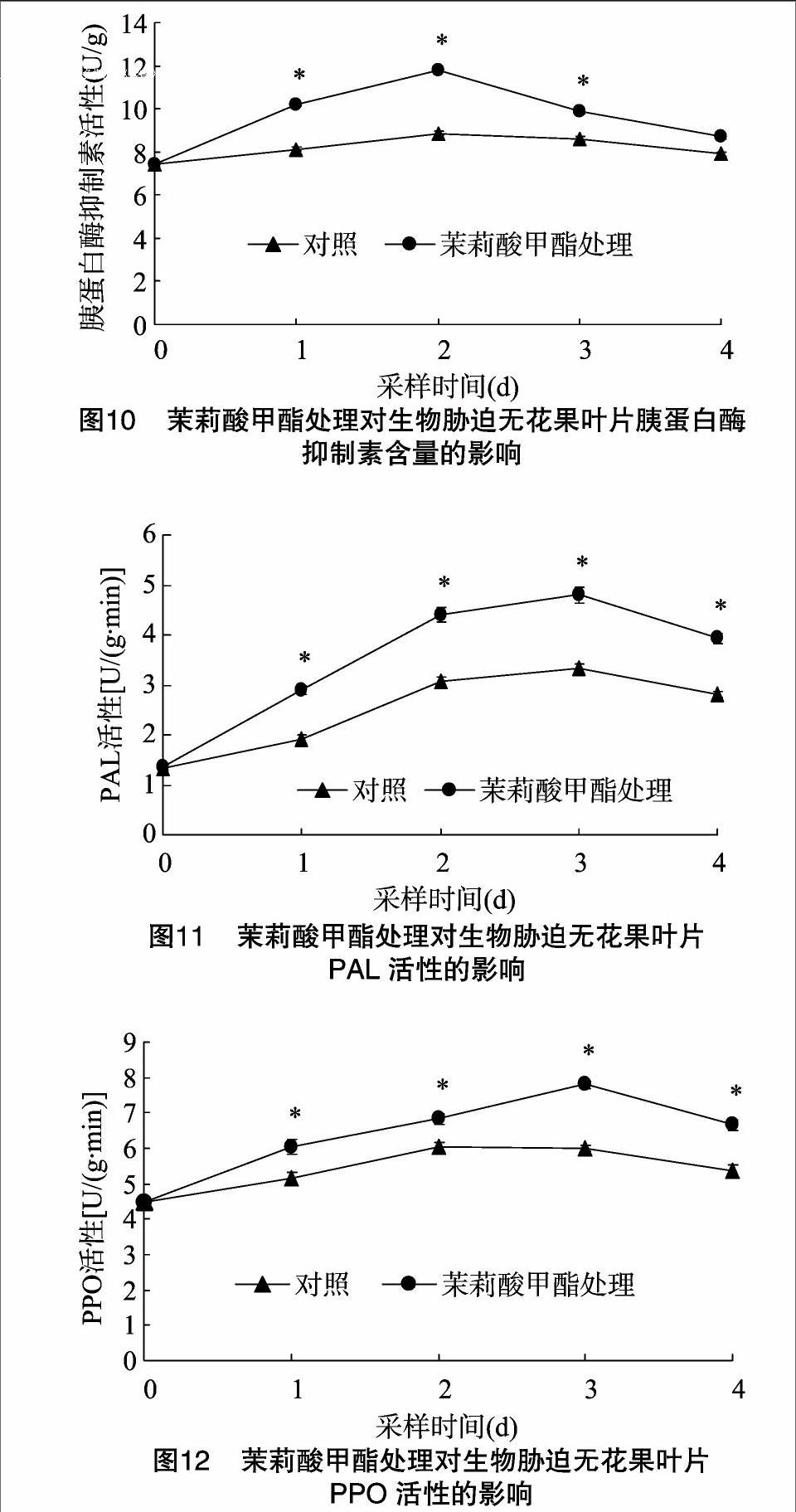
2.4.2 胰蛋白酶抑制素 由图10可见,茉莉酸甲酯处理的无花果幼苗经生物胁迫,其叶片胰蛋白酶抑制素含量变化趋势与单宁一致,在1~2 d采样时上升,3~4 d下降,其中,1~3 d采样的叶片胰蛋白酶抑制素含量显著高于对照处理(P<0.05);对照处理的叶片胰蛋白酶抑制素也呈先升后降态势。
2.5 茉莉酸甲酯处理对生物胁迫无花果叶片抗性酶活性的影响
由图11、图12可见,茉莉酸甲酯处理的无花果幼苗经生物胁迫,其叶片苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)活性在1~3 d采样时有明显上升,且显著高于对照(P<0.05),在4 d采样时虽有明显下降,但与对照相比差异显著(P<0.05)。
2.6 茉莉酸甲酯处理对高温、生物胁迫无花果叶片内源茉莉酸含量的影响
茉莉酸在植物抗逆方面起着重要的作用。由图13可见,无论是高温处理(4 d)后还是生物蚕食(4 d)后,茉莉酸甲酯处理的无花果叶片的茉莉酸含量明显高于对照,这可能是因为用茉莉酸甲酯处理能刺激植物体内茉莉酸的合成,进而来应答外界环境的胁迫。
3 结论与讨论
植物在生长发育过程中必须不断进行生理代谢来应对外界生物和非生物胁迫环境以维持生存,而防御因子是调控植物生长及繁殖最重要的一个因子,可应对外来的非生物和生物胁迫[15-16]。植物激素在调节植物代谢应答逆境胁迫方面起着关键的作用,主要有茉莉酸(JA)、水杨酸、乙烯3种激素[17]。茉莉酸是一种重要的植物生长调节剂,在调控植物种子萌发、根伸长、胚胎发育、性别决定、幼苗发育、块茎形成、果实成熟、叶片衰老等生长发育方面起着重要的作用[18-20],尤其在植物干旱、盐胁迫、高温等逆境胁迫应答[21-23]中作用更为明显,但在无花果上的相关研究相对较少。本试验研究表明,高温胁迫或生物蚕食经茉莉酸甲酯处理的无花果,其叶片内源茉莉酸含量急剧上升,这与Pedranzani等的研究结论[24-26]较为吻合,盐胁迫、伤口、渗透胁迫、紫外辐射等不同胁迫都会导致内源茉莉酸含量的增加,并启动一系列应答逆境胁迫的途径。
当植物遭受胁迫时,体内会产生羟基自由基(·OH)、超氧阴离子自由基(O-2 · )、过氧化氢(H2O2)等活性氧(ROS),过多的ROS能使脂类、蛋白质、核酸氧化[27],造成植物氧化损伤[28],而植物会产生超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、谷胱甘肽还原酶(GR)、抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物(GPX)等一些抗氧化的酶来抵御伤害。茉莉酸能使植物产生抗氧化剂和次级代谢产物[29],增强植物的抗氧化系统及其清除自由基的能力[30],如利用茉莉酸甲酯处理蓖麻,能使其体内APX活性升高;茉莉酸甲酯能减轻百草枯药剂对玉米的氧化伤害[31];悬钩子经过茉莉酸甲酯处理后抗氧化能力迅速升高[32]。本试验结果表明,茉莉酸甲酯处理能使高温胁迫处理的无花果叶片抗氧化酶SOD、POD、CAT活性增强,叶片内源DPPH清除率、总还原力升高,使叶片的受伤害程度降低,与表型分析一致。endprint
除非生物胁迫响应外,茉莉酸也参与无花果植株的生物胁迫响应。茉莉酸甲酯处理能增强植物对害虫的抗性[33];田间西红柿经茉莉酸甲酯处理,西花蓟马、蚜虫的数量锐减[34],且甜菜夜蛾数量也减少很多[35];桃喷施茉莉酸甲酯,蚜虫数量减少[36];与对照植株比,茉莉酸甲酯处理的菠菜其真菌侵害数量减少,且茉莉酸甲酯能减少线虫对燕麦、菠菜等植物的伤害[37]。另外,茉莉酸甲酯熏蒸棉花还能诱导植株产生乙酸叶醇酯、罗勒烯、金合欢烯等挥发性物质,通过间接诱导释放挥发性物质和直接防御蛋白以抵御昆虫的伤害[38]。本试验结果表明,利用黑绒金龟蚕食经茉莉酸甲酯处理的无花果叶片,其内源茉莉酸含量增加,PAL、PPO氧化酶活性急剧上升,单宁、胰蛋白酶抑制素物质含量增加,这些物质含量的增加能抵御外界生物的进一步侵害,使植物尽快恢复正常生长状态。
参考文献:
[1]张华英. 无花果的研究与产业化发展对策[J]. 资源开发与市场,2003,19(5):314-316.
[2]Schilmiller A L,Howe G A. Systemic signaling in the wound response[J]. Current Opinion in Plant Biology,2005,8(4):369-377.
[3]Balbi V,Devoto A. Jasmonate signalling network in Arabidopsis thaliana:crucial regulatory nodes and new physiological scenarios[J]. New Phytologist,2008,177(2):301-318.
[4]Wasternack C,Hause B. Jasmonates:biosynthesis,perception,signal transduction and action in plant stress response,growth and development. [J]. Annals of Botany,2013,111(6):1021-1058.
[5]Rowe M L,Staswick P E. Jasmonic acid-amino acid conjugation enzyme assays[J]. Methods in Molecular Biology,2013,1011:145-157.
[6]孔祥生,易现峰. 植物生理学实验技术[M]. 北京:中国农业出版社,2008:257-259.
[7]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:258-260.
[8]卜彦花,周娜娜,王春悦,等. 福林酚试剂法和紫外分光光度法测定冬枣多酚含量的比较研究[J]. 中国农学通报,2012,28(1):212-217.
[9]冉晓刚,江 海,陈文强. 秦巴山区橡子和橡子淀粉中单宁及矿质元素含量的测定[J]. 江苏农业科学,2011,39(6):543-546.
[10]宗 娜,阎云花,王琛柱. 昆虫对植物蛋白酶抑制素的诱导及适应机制[J]. 昆虫学报,2003,46(4):533-539.
[11]邹志燕,王振中. 茉莉酸诱导水稻幼苗对稻瘟疫病抗性作用的研究[J]. 植物病理学报,2006,36(5):432-438.
[12]宫玉艳,段立清,王爱清. 茉莉酸诱导对枸杞叶片生化物质及酶活性的影响[J]. 植物保护,2010,36(2):61-65.
[13]郑炳松. 现代植物生理生化研究技术[M]. 北京:气象出版社,2006:41-42.
[14]陈昆松,徐昌杰,许文平,等. 猕猴桃和桃果實脂氧合酶活性测定方法的建立[J]. 果树学报,2003,20(6):436-438.
[15]Masood A,Iqbal N,Khan N A. Role of ethylene in alleviation of cadmium-induced photosynthetic capacity inhibition by sulphur in mustard[J]. Plant,Cell and Environment,2012,35(3):524-533.
[16]Khan M I,Iqbal N,Masood A,et al. Salicylic acid alleviates adverse effects of heat stress on photosynthesis through changes in proline production and ethylene formation[J]. Plant Signal Behavior,2013,8(11):263-274.
[17]Takahashi H,Kanayama Y,Zheng M S,et al. Antagonistic interactions between the SA and JA signaling pathways in Arabidopsis modulate expression of defense genes and gene-for-gene resistance to cucumber mosaic virus[J]. Plant and Cell Physiology,2004,45(6):803-809.
[18]Ballaré C L. Jasmonate-induced defenses:a tale of intelligence,collaborators and rascals[J]. Trends in Plant Science,2011,16(5):249-257.endprint
[19]Wasternack C. Action of jasmonates in plant stress responses and development—applied aspects[J]. Biotechnology Advances,2014,32(1):31-39.
[20]Wasternack C,Hause B. Jasmonates and octadecanoids:signals in plant stress responses and development[J]. Progress in Nucleic Acid Research and Molecular Biology,2002,72:165-221.
[21]Reinbothe C,Springer A,Samol I,et al. Plant oxylipins:role of jasmonic acid during programmed cell death,defence and leaf senescence. Febs Journal,2009,276:4666-4681.
[22]Browse J. Jasmonate passes muster:a receptor and targets for the defense hormone[J]. Annual Review of Plant Biology,2009,60(1):183-205.
[23]Browse J,Howe G A. New weapons and a rapid response against insect attack[J]. Plant Physiology,2008,146(3):832-838.
[24]Pedranzani H,Racagni G,Alemano S,et al. Salt tolerant tomato plants show increased levels of jasmonic acid[J]. Plant Growth Regulation,2003,41(2):149-158.
[25]Kramell R,Miersch O,Atzorn R,et al. Octadecanoid-derived alteration of gene expression and the “oxylipin signature” in stressed barley leaves. Implications for different signaling pathways[J]. Plant Physiology,2000,123(1):177-188.
[26]Demkura P V,Abdala G,Baldwin I T,et al. Jasmonate-dependent and-independent pathways mediate specific effects of solar ultraviolet B radiation on leaf phenolics and antiherbivore defense[J]. Plant Physiology,2010,152(2):1084-1095.
[27]Panda S K,Chaudhury I,Khan M H. Heavy metal indunced lipid peroxidation and affects antioxidants in wheat leaves[J]. Biologia Plantarum,2003,46:289-294.
[28]Gill S S,Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology Biochemisty,2010,48:909-930.
[29]Kim O,Bang K,Shin Y,et al. Enhanced production of asiaticoside from hairy root cultures of Centellaasiatica (L.) urban elicited by methyl jasmonate[J]. Plant Cell Report,2007,26:1941-1949.
[30]Chanjirakul K,Wang S Y,Wang C Y,et al. Effect of natural volatile compounds on antioxidant capacity and antioxidant enzymes in raspberries[J]. Postharvest Biology Technology,2006,40:106-115.
[31]Beydler B D,Osadchuk K,Cheng C L,et al. The juvenile phase of maize sees upregulation of stress-response genes and is extended by exogenous JA[J]. Plant Physiology,2016,171(4):2648-2658.
[32]Ghasemnezhad M,Javaherdashti M. Effect of methyl jasmonate treatment on antioxidant capacity:internal quality and postharvest life of raspberry fruit[J]. Caspian Journal of Environment Science,2008,6:73-78.endprint
[33]Halitschke R,Baldwin I T. Jasmonates and related compounds in plant insect interactions[J]. Journal of Plant Growth Regulation,2004,23:238-245.
[34]Thaler J S,Stout M J,Karban R,et al. Jasmonate-mediated induced plant resistance affects a community of herbivores[J]. Ecological Entomology,2001,26:312-324.
[35]Thaler J S,Fidantsef A L,Duffey S S,et al. Trade-offs in plant defense against pathogens and herbivores:a field demonstration of chemical elicitors of induced resistance[J]. Journal of Chemical Ecology,1999,25:1597-1609.
[36]Boughton A J,Hoover K,Felton G W. Impact of chemical elicitor applications on greenhouse tomato plants and population growth of the green peach aphid,Myzuspersicae[J]. Entomologia Experimentalis et Applicata,2006,120:175-188.
[37]Soriano I R,Asenstorfer R E,Schmidt O,et al. Inducible flavone in oats (Avena sativa) is a novel defense against plant-parasitic nematodes[J]. Phytopathology,2004,94:1207-1214.
[38]Rodriguez-Saona C,Crafts-Brandner S J,Pare P W,et al. Exogenous methyl jasmonate induces volatile emissions in cotton plants[J]. Journal of Chemical Ecology,2001,27:679-695.endprint
