甜菜雄性不育系高效组培再生体系的建立
2017-11-30张自强白晨张惠忠李晓东付增娟赵尚敏鄂圆圆张辉王良张必周
张自强+白晨+张惠忠+李晓东+付增娟+赵尚敏+鄂圆圆+张辉+王良+张必周

摘要:以甜菜雄性不育系32467为材料,对无菌苗植株再生的各个因素进行研究。结果表明,打磨后的种球先熏蒸,再进行消毒處理,可明显降低污染率;诱导丛生芽再生率最高的外植体是叶柄;最优诱导分化培养基、继代培养基和生根培养基分别为MS+0.7 mg/L NAA+1.2 mg/L KT、MS+0.5 mg/L NAA+0.4 mg/L KT和MS+1.2 mg/L NAA。
关键词:甜菜;雄性不育系;再生体系;组织培养
中图分类号: S566.304.3 文献标志码: A 文章编号:1002-1302(2017)20-0107-02
甜菜是我国重要的糖料作物之一,在北方农业生产中占有重要地位。然而随着甜菜机械化作业程度的不断提高,特别是大规模集约化生产的不断推进,甜菜生产中病虫草害越来越重,通过人工防治病虫害及除草成本越来越高[1-6]。因此,顺应现代农业发展方向、结合甜菜产业发展需求开展甜菜抗性转基因育种研究可加速育种进程,也是今后甜菜产业发展的必然选择[7-13]。
部分植物基因工程的遗传转化技术相对成熟,但甜菜转基因育成品种一直未见报道。甜菜转基因品种未能产业化应用是由多种原因造成的,其中甜菜很难建立起高效的遗传转化再生体系是其中一个重要的限制因素[14-15]。本研究通过对甜菜雄性不育系的多种外植体进行再生培养,研究分析影响甜菜外植体再生的因素,建立并优化甜菜植株再生体系,为甜菜转基因开展前期基础性工作。
1 材料与方法
1.1 供试材料
供试材料为甜菜雄性不育系32467,由内蒙古农牧业科学院特色作物研究所提供。
1.2 方法
1.2.1 无菌苗培养 将磨掉花萼完整的甜菜种球,用百菌清(霜霉烟剂)密闭熏蒸24 h后,在超净工作台中移至灭过菌的三角瓶中,随后用75%乙醇消毒2 min,无菌水漂洗3次;再用0.1%的氯化汞处理20 min,无菌水漂洗3次;最后将消毒后的种子接种于MS培养基上,置于组培室培养,培养温度 23 ℃。
1.2.2 诱导分化培养基的选择 在超净工作台上,将无菌苗置于无菌培养皿中,将无菌苗的叶柄切成1 cm左右的小段,随后将叶柄接种于含有不同浓度生长调节剂的分化培养基(表1)中进行分化诱导培养,以筛选出诱导叶柄分化成不定芽的最适培养基。每种培养基接种叶柄120个。
1.2.3 高诱导率外植体的筛选 在超净工作台中,将无菌苗的下胚轴、叶柄、丛生芽块均切成长约1 cm的小段,分别置于筛选出的最佳不定芽诱导率培养基,根据不同类型外植体诱导率,确定诱导率最高的培养基。3种不同类型的外植体均接种120个。
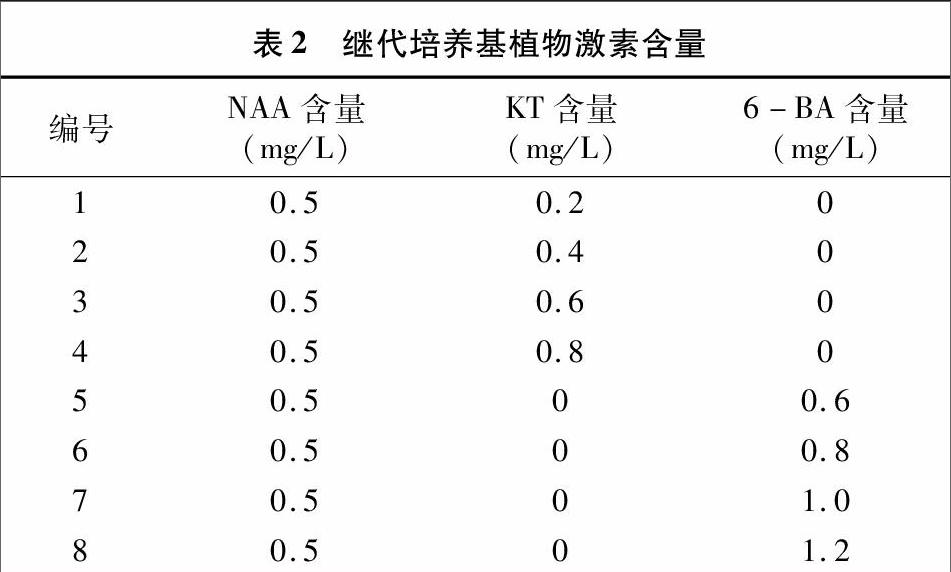
1.2.4 继代培养基的选择 当诱导的丛生芽长到约1 cm时,在超净工作台中将丛生芽分切为单苗,接种于继代培养基中进行继代培养(表2),根据不同培养基中幼苗生长情况,筛选最佳继代培养基。
1.2.5 生根培养基的选择 将幼苗丛生芽分切成约1.5 cm长的单株,分别接种于含0.4、0.8、1.2、1.6、2.0、2.4 mg/L NAA的MS培养基中,培养室进行培养,培养条件:温度23 ℃,光照度2 000 lx,光照时间13 h。3周左右即可诱导生根。观察不同培养基生根情况,根据生根诱导率,确定最佳生根培养基。
2 结果与分析
2.1 诱导分化培养基筛选
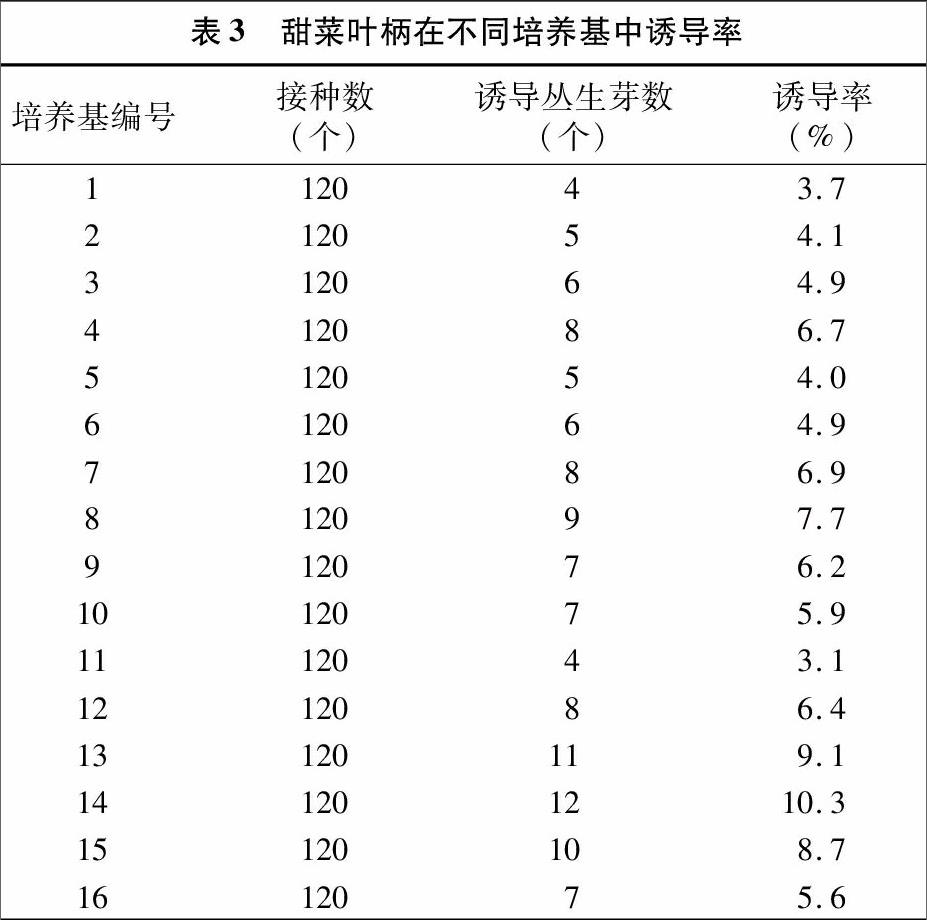
由表3可知,不同激素浓度的培养基诱导甜菜丛生芽再生的效果不同。在16种不同激素浓度的培养基中,诱导率最高的是14号培养基,其诱导率达10.3%。因此最佳诱导分化培养基成分确定为MS+0.7 mg/L NAA+1.2 mg/L KT。
2.2 不同外植体再生性比较结果分析
将甜菜雄性不育系无菌苗的3种类型外植体,分别接种于筛选出的最佳诱导分化培养基中。由表4可知,叶柄的诱导率最高,达10.8%,明显高于丛生芽块的4.2%和下胚轴的6.7%。因此确定最佳的外植体为叶柄。
2.3 继代培养基筛选结果分析
将生长状况相似的健壮甜菜雄性不育系丛生芽接种于不同植物激素类型和含量的继代培养基中,其生长状况差异较大。由表5可知,添加MS+0.5 mg/L NAA+0.4 mg/L KT培养基中丛生芽生长速度最快,植株健壮,无玻璃化、褐化等现象出现,但随着KT含量的增加,丛生芽出现不生长甚至死亡的现象。接种于含有6-BA激素的培养基中的丛生芽陆续出现玻璃化现象,且随着6-BA含量的增加,玻璃化现象更加明显。因而,确定继代培养基成分为MS+0.5 mg/L NAA+0.4 mg/L KT。
2.4 生根培养基筛选结果分析
将生长健壮的丛生芽接种在含有不同浓度NAA的诱导培养基中,由表6可知,当NAA低浓度时生根诱导率随着NAA浓度的升高而增加,NAA浓度为1.2 mg/L时,诱导率最高,达到83.33%。然而,随着NAA浓度的持续升高,生根诱导率呈现下降的趋势。因而确定最佳生根培养基为MS+1.2 mg/L NAA。
3 结论与讨论
本研究以甜菜雄性不育系32467为材料,对甜菜无菌苗植株再生的各个因素进行研究,建立了甜菜雄性不育系植株再生体系。乙醇和氯化汞消毒之前,先对打磨后的种球进行熏蒸,可明显降低污染率;诱导丛生芽再生率最高的外植体是叶柄;筛选出的最优诱导分化培养基MS+0.7 mg/L NAA+1.2 mg/L KT;筛选出的最优继代培养基为MS+0.5 mg/L NAA+0.4 mg/L KT;筛选出的最优生根培养基为MS+1.2 mg/L NAA。
参考文献:
[1]张翼飞,张晓旭,刘 洋,等. 中国甜菜产业发展趋势[J]. 黑龙江农业科学,2013(8):156-160.endprint
[2]吴玉梅,张福顺,张玉霜,等. 我国甜菜生产经营方式及对甜菜产业发展的影响[J]. 中国糖料,2014(2):84-86.
[3]许桥良,卢秉福. 甜菜生产机械化发展的回顾与展望[J]. 中国糖料,2016(5):73-75.
[4]王申莹,胡志超,张会娟,等. 国内外甜菜生产与机械化收获分析[J]. 中国农机化学报,2013(3):20-25.
[5]何忠明. 甜菜病虫草害综合防治技术措施探讨[J]. 新疆农垦科技,2005(5):32-33.
[6]郑庆伟. 甜菜病虫草害的防治[J]. 农药市场信息,2012(14):40.
[7]Slavova Y. Possibility of restricting the cases of verification in sugar beet cultured in vitro[J]. National Centre For Agrarian Sciences,2002(8):211-214.
[8]Bezhin K,Santel H J,Gerhards R. Evaluation of two chemical weed control systems in sugar beet in Germany and the Russian Federation[J]. Plant Soil and Environment,2015,61(11):489-495.
[9]喬志文. 我国甜菜病虫草害种类分布及化学防治历程[J]. 中国糖料,2003(4):42-46.
[10]卢秉福,耿 贵,周艳丽. 甜菜块根收获机械化技术[J]. 中国糖料,2013(2):65-67.
[11]韩长杰,尹文庆,杨宛章,等. 甜菜机械化收获方式分析与探讨[J]. 中国农机化,2012(1):71-74.
[12]Vargas-Ramirez J M,Haagenson D M,Pryor S W. Beet tissue ensiling:an alternative for long-term storage of sugars in industrial beets for nonfood use[J]. Biomass and Bioenergy,2016,85(85):135-143.
[13]Bezhin K,Santel H J,Gerhards R. Evaluation of two chemical weed control systems in sugar beet in Germany and the Russian Federation[J]. Plant Soil and Environment,2015,61(11):489-495.
[14]刘巧红,程大友,徐德昌,等. 甜菜种子无菌苗的制备与快速繁殖技术[J]. 中国甜菜糖业,2008(3):21-22.
[15]牛素清,白 晨,张惠忠,等. 甜菜组培快繁及植株再生的研究[J]. 华北农学报,2007,22(增刊1):16-19.endprint
