过氧化氢浸种处理对油菜幼苗抗寒生理特性的影响
2017-11-30叶朝军万林孙继金渊博王怡娟江海东
叶朝军+万林+孙继+金渊博+王怡娟+江海东

摘要:以南农油4号(Brassica napus cv. Nannongyou 4)油菜品种为试验材料,研究0.05%浓度过氧化氢(H2O2)浸种处理对低温下油菜幼苗活性氧、抗氧化酶系统和非酶抗氧化剂的影响。结果表明,0.05%浓度过氧化氢浸种能够有效降低丙二醛(MDA)含量,在胁迫后期(大于3 d),H2O2处理下的油菜叶片H2O2含量和 O-2 · 产生速率均显著低于对照。抗氧化酶活性的数据表明,H2O2浸种处理能有效提高逆境胁迫下油菜叶片中的抗氧化酶活性,以处理6 d为例,油菜叶片的SOD、POD、CAT活性分别提高了29.8%、21.0%、50.3%;另外,H2O2浸种处理后油菜的AsA、GSH含量,AsA/DHA和GSH/GSSG也有显著增加。由此可见,过氧化氢浸种处理可缓解低温对油菜的伤害。
关键词:油菜;过氧化氢;浸种;低温胁迫;抗氧化系统
中图分类号: S634.301 文献标志码: A 文章编号:1002-1302(2017)20-0104-03
油菜是我國长江中下游地区主要的油料作物,其种植面积和总产均居世界首位[1]。近年来,直播油菜以其省工节本的优点受到广大农民的欢迎。但由于耕作制度的改变或茬口的原因等,往往播种较晚,出苗后容易遭受低温冻害,引起代谢紊乱而影响油菜生长[2]。因此研究和防治冷害对油菜的影响意义重大。
植物在正常生长情况下,体内活性氧(ROS)的产生与清除处于一种动态平衡。而在低温胁迫条件下植物体内膜脂过氧化进程加快,ROS的代谢紊乱,积累的ROS会对植物造成毒害作用[3-4]。植物体内清除ROS的系统有抗氧化酶类及非酶抗氧化剂等物质,这些物质协同作用能有效清除ROS,保护膜的完整性,提高植物抗寒性。植物体内的抗氧化系统由小分子抗氧化物和抗氧化酶组成[5]。侯丽霞研究发现用适宜浓度双氧水(H2O2)喷施油菜叶片提高了油菜的抗寒性[6]。浸种是生产上一种常用的药剂处理方式,周筱玲研究表明,H2O2浸种能显著提高油菜种子发芽率[7]。万林等研究表明,H2O2浸种能有效缓解低温胁迫对苗期油菜生长的抑制效应[8]。
总体来看,目前H2O2浸种对油菜抗寒生理研究较为薄弱。万林等试验在大田进行,温度波动较大[8]。因此,本试验以抗寒性品种南农油4号为试验材料,研究其经过H2O2浸种处理后,苗期油菜在低温胁迫下叶片中ROS含量、抗氧化酶活性及抗氧化物质含量的变化,以期为油菜的抗寒栽培提供理论依据和技术支持。
1 材料与方法
1.1 试验材料与设计
供试油菜品种为南农油4号(Brassica napus cv. Nannongyou 4)。2013年10月28日,以筛选出的质量浓度为0.05%的H2O2于黑暗下浸泡油菜种子8 h,以去离子水浸种作为对照。浸种完成后用去离子水漂洗3次后晾干,播于规格为7 cm×7 cm×5 cm 的小花盆中,培养基质为沙土(1 ∶ 1混合)。置于(20.0±1.0) ℃/(15.0±1.0) ℃光照培养箱中培养,油菜苗长出真叶时定苗,待油菜长出3张真叶开始进行低温胁迫。设置光照培养箱内温度为4.0±1.0 ℃,连续胁迫9 d,每个处理重复3次。测量时,从3个重复处理中选取生长一致的5株幼苗,每株幼苗均以自上而下第3张真叶作为测量对象。
1.2 测定方法
H2O2含量测定参照Moloi等的方法[9];丙二醛(MDA)含量测定参照Hodges等的方法[10];超氧阴离子自由基(O-2 · )产生速率测定参照Elstner等的方法[11]并有所改动。取 0.5 mL 的粗酶液、0.5 mL的65 mmol/L磷酸缓冲液(pH值为7.8)、1 mL的10 mmol/L磺胺和1 mL的7 mmol/L的α-萘胺,摇匀后 25 ℃ 水浴20 min。在530 nm条件下测定其吸光度。超氧化物歧化酶(SOD)活性和过氧化物酶(POD)活性测定参照Tan等的方法[12];过氧化氢酶(CAT)活性测定主要是参照Chance等的方法[13]并有所修改。0.1 mL酶液加 3 mL CAT反应液(0.075% H2O2溶液1 mL,0.05 mol/L pH值7.0的磷酸缓冲液1.9 mL),240 nm下比色,每隔30 s读取吸光度的下降值。抗坏血酸(AsA)及脱氢抗坏血酸(DHA)含量参照Khanna-Chopra等的方法[14]提取测定;谷胱甘肽还原型(GSH)和氧化型(GSSG)含量参照Paradiso等的方法[15]测定。以上测量均在南京农业大学植物生理实验室测量完成。
1.3 数据分析与作图
每个测量数据均5次重复,取其平均值。采用Excel 2010作图,运用SPSS 19.0进行差异显著性分析。
2 结果与分析
2.1 油菜叶片MDA含量的比较
从图1可以看出,随着胁迫时间延长,对照油菜MDA含量呈上升趋势,而H2O2处理油菜MDA含量呈先降后升的趋势。在胁迫期间,H2O2处理油菜MDA含量均低于对照。在胁迫3、6、9 d,H2O2处理下MDA含量比对照分别减少了269%、23.7%、11.4%。
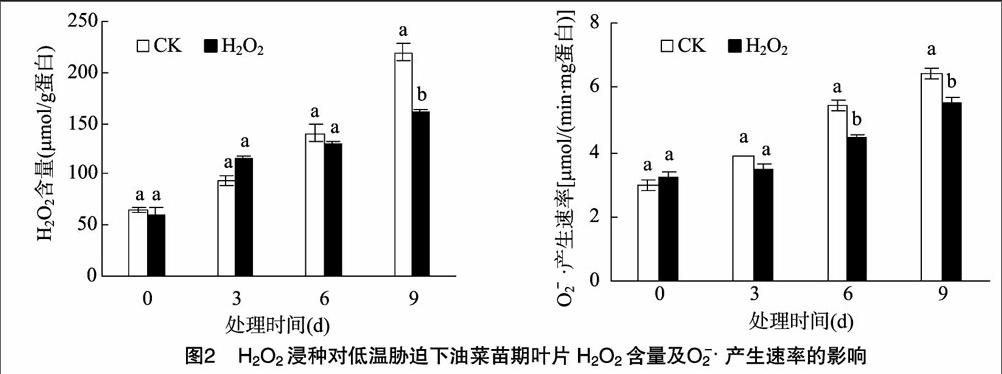
2.2 油菜叶片H2O2含量和O-2 · 产生速率的比较
O-2 · 和H2O2是植物体内2类重要的活性氧。图2显示,对照和H2O2处理油菜叶片中的 O-2 · 产生速率和H2O2含量均随胁迫时间的延长而明显上升。在胁迫初期(3 d时),H2O2处理下的油菜叶片H2O2含量高于对照处理,这可能是由于H2O2浸种处理使油菜提前进入氧化胁迫阶段,而在胁迫后期(9 d时),H2O2处理下的油菜叶片H2O2含量和 O-2 · 产生速率均显著低于对照。
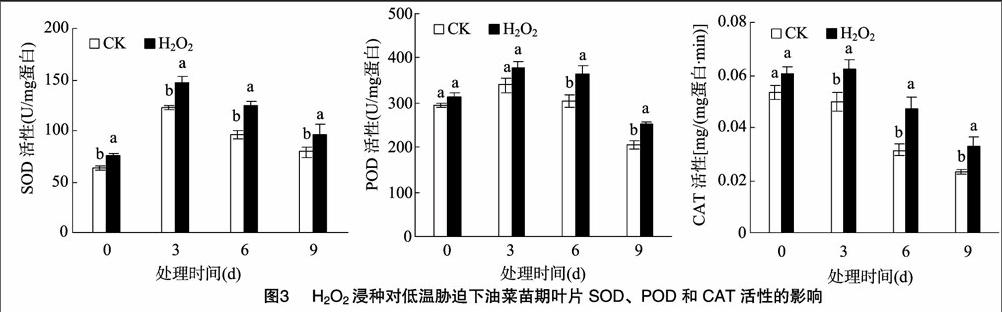
2.3 油菜幼苗SOD、POD、CAT活性比较endprint
SOD、POD和CAT是植物体内重要的3类抗氧化酶。由图3可以看出,H2O2浸种处理可提高低温胁迫下这3类酶的活性。与对照相比,在低温胁迫6 d,油菜叶片的SOD、POD、CAT活性分别提高了29.8%、21.0%、50.3%,说明H2O2浸种处理能有效提高逆境胁迫下油菜叶片中的抗氧化酶活性,从而提高其抗寒性,缓解低温对油菜的伤害。
2.4 油菜叶片AsA和GSH的比较
AsA和GSH是植物体内重要的抗氧化剂,通过AsA-GSH循环发挥作用。由图4可以看出,在低温胁迫期间,AsA含量呈上升趋势,GSH含量呈先升后降的趋势。整体而言,H2O2浸种处理的油菜AsA、GSH含量高于对照油菜。在低温胁迫6 d,H2O2浸种处理的油菜AsA、GSH含量分别比对照高出16.4%、28.7%。
另外,植物体内除氧化态的AsA、GSH外,还存在着还原态的DHA和GSSG。AsA/DHA和GSH/GSSG更能体现植物整体的氧化还原状况。从图4可以看出,AsA/DHA、GSH/GSSG的比值均随胁迫时间的延长先上升后趋于稳定。整体而言,H2O2浸种处理的油菜AsA/DHA和GSH/GSSG均高于對照油菜。在低温胁迫 9 d,H2O2浸种处理的油菜AsA/DHA和GSH/GSSG分别比对照高出15.6%、15.8%。
3 讨论
研究发现,在胁迫初期,H2O2浸种处理的油菜叶片MDA含量和O-2 · 产生速率均下降,而随着胁迫程度的加重,叶片的MDA含量及ROS水平迅速增加[6]。其变化趋势说明植物叶片对低温胁迫有一个适应过程,胁迫程度加重时,植物体内清除ROS的能力下降,植物受到氧化伤害。同时也说明H2O2浸种能在一定程度上有效缓解低温胁迫下油菜叶片ROS的大量积累,减少膜伤害。徐田军等的研究结果[16]也证实了该结论。本试验结果表明,在胁迫3、6、9 d,H2O2处理下MDA的含量比对照分别减少了26.9%、23.7%、 11.4%。另外,在胁迫后期(9 d时),H2O2处理下的油菜叶片H2O2含量和O-2 · 产生速率均显著低于对照。说明前期H2O2浸种处理可对低温胁迫下的幼苗后期生长起到一定的保护作用。
植物受到低温胁迫后,其体内的抗氧化酶系统就会得到加强[17],这是保护植物不受氧化胁迫的抗逆性机制之一[18]。SOD、POD和CAT作为植物细胞主要的保护酶,协调作用共同清除植物体内活性氧。万林等研究发现,H2O2浸种处理极大地促进了低温下油菜叶片中的POD、CAT活性的提高,使得植物体内多余的活性氧被迅速清除,降低了MDA含量,以减少膜伤害[8];吕军芬等发现H2O2浸种处理能显著提高低温胁迫下西瓜(Citrullus lanatus)叶片的SOD活性[19]。本试验结果表明,低温胁迫下油菜叶片的SOD、POD活性呈先升后下降的趋势,而CAT的活性呈一直下降的趋势。这可能是由于CAT对低温胁迫的反应与POD、SOD略有不同,CAT对低温胁迫比较敏感。与对照相比,H2O2浸种处理显著提高了油菜幼苗叶片中SOD、POD、CAT活性。结合MDA、H2O2含量,以及O-2 · 产生速率可以推断,前期(小于3 d)的低温胁迫是一个抗寒锻炼的过程。随着胁迫程度的增强,细胞膜抗氧化系统遭到破坏。
AsA和GSH是植物体内重要的非酶抗氧化剂。在防止细胞膜过氧化、保持细胞膜系统的完整性、延缓细胞的衰老和增强植物抗逆性方面发挥着重要功能[20]。本试验结果表明,在胁迫初期,AsA含量随着幼苗的生长而上升,而GSH含量则先升高后下降。H2O2处理的ASA含量均一直显著高于对照;处理后期(≥6 d时),H2O2处理的GSH含量也显著高于对照。这说明H2O2浸种能提高ASA、GSH含量,以减轻油菜的膜脂过氧化,增强其耐寒性。这与小麦(Triticum aestivum)[21]、草莓(Fragaria×ananassa)[22]等的研究相一致。
综上所述,低温胁迫下,H2O2浸种处理能够通过降低MDA含量、ROS水平以及提高抗氧化酶(SOD、POD、CAT)活性、增加非酶抗氧化剂(AsA、GSH)含量来提高油菜抗寒性,缓解低温胁迫伤害。尽管本研究没有涉及外源H2O2处理对油菜后期生长和产量的影响,但外源H2O2处理有助于低温胁迫下油菜苗期的生长发育,必然可以增加油菜生物量的积累,从而减少低温造成的产量损失。
参考文献:
[1]张冬晓. 我国油菜生产的发展与展望[J]. 中国油料作物学报,2001,23(4):79-81.
[2]周 琴,孙小芳,郭月玲,等. 6-BA和PP333对油菜幼苗抗寒性的影响[J]. 中国油料作物学报,2007,29(3):286-290.
[3]朱惠霞,孙万仓,邓 斌,等. 白菜型冬油菜品种的抗寒性及其生理生化特性[J]. 西北农业学报,2007,16(4):34-38.
[4]蒲媛媛,孙万仓. 白菜型冬油菜抗寒性与生理生化特性关系[J]. 分子植物育种,2010,8(2):335-339.
[5]陈 超. 低温条件下冬小麦糖代谢和抗氧化活性与耐寒性关系[D]. 哈尔滨:东北农业大学,2014.
[6]侯丽霞. H2O2对低温下油菜幼苗几个生理指标的影响[J]. 湖北农业科学,2013,52(21):5144-5146.
[7]周筱玲. H2O2浸种对油菜种子萌发的影响[J]. 九江师专学报(社会科学版),1997,15(6):32-35.
[8]万 林,张 曼,钟飞燕,等. H2O2浸种对晚播油菜苗期耐寒性的影响[J]. 中国油料作物学报,2015,37(6):811-819.
[9]Moloi M J,van der Westhuizen A J. The reactive Oxygen species are involved in resistance responses of wheat to the Russian wheat aphid[J]. Journal of Plant Physiology,2006,163(11):1118-1125.endprint
[10]Hodges D M,Delong J M,Forney C F,et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta,1999,207(4):604-611.
[11]Elstner E F. Mechanisms of oxygen activation in different compartments of plant cells[M]//Pelland E J,Steffen K L. Active oxygen/oxidative stress in plant metabolism. Rockville:American Society of Plant Physiologists,1991:13-25.
[12]Tan W,Liu J,Dai T,et al. Alterations in photosynthesis and antioxidant enzyme activity in winter wheat subjected to post-anthesis water-logging[J]. Photosynthetica,2008,46(1):21-27.
[13]Chance B,Maehly A C. Assay of catalases and peroxidases[J]. Methods in Enzymology,1955,2:764-775.
[14]Khanna-Chopra R,Selote D S. Acclimation to drought stress generates oxidative stress tolerance in drought-resistant than -susceptible wheat cultivar under field conditions[J]. Environmental and Experimental Botany,2007,60(2):276-283.
[15]Paradiso A,Berardino R,de Pinto M C,et al. Increase in ascorbate-glutathione metabolism as local and precocious systemic responses induced by cadmium in durum wheat plants[J]. Plant and Cell Physiology,2008,49(3):362-374.
[16]徐田軍,董志强,兰宏亮,等. 低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J]. 作物学报,2012,38(2):352-359.
[17]刘玉凤,李天来,高晓倩. 夜间低温胁迫对番茄叶片活性氧代谢及AsA-GSH循环的影响[J]. 西北植物学报,2011,31(4):707-714.
[18]张立军,宋广周,白 霜,等. H2O2对不同大豆品种低温萌发及主要抗氧化酶活性的影响[J]. 大豆科学,2008,27(1):97-100.
[19]吕军芬,郁继华. H2O2浸种对西瓜耐冷性生理生化指标的影响[J]. 甘肃农业科技,2004(4):30-32.
[20]许 英,陈建华,朱爱国,等. 低温胁迫下植物响应机理的研究进展[J]. 中国麻业科学,2015(1):40-49.
[21]郭丽红,王定康,王德斌,等. 抗坏血酸和谷胱甘肽在小麦幼苗冷激诱导抗冷性中的变化[J]. 昆明学院学报,2007,29(4):66-68.
[22]罗 娅. 低温胁迫与锻炼对草苟生理特性的影响和草每几丁质酶基因的克隆[D]. 雅安:四川农业大学,2007.endprint
