化学发光免疫分析技术在微生物检测中的应用
2017-11-29李静雯刘清珺杜美红赵瑞雪万宇平吴小胜冯月君
李静雯,刘清珺,杜美红*,赵瑞雪,万宇平,吴小胜,冯月君
(1.北京市理化分析测试中心 北京市食品安全分析测试工程技术研究中心,北京 100089;2.北京勤邦生物技术有限公司 北京市食品安全免疫快速检测工程技术研究中心,北京 102206)
化学发光免疫分析技术在微生物检测中的应用
李静雯1,刘清珺1,杜美红1*,赵瑞雪1,万宇平2,吴小胜2,冯月君2
(1.北京市理化分析测试中心 北京市食品安全分析测试工程技术研究中心,北京 100089;2.北京勤邦生物技术有限公司 北京市食品安全免疫快速检测工程技术研究中心,北京 102206)
化学发光免疫分析技术凭借其化学发光的高灵敏性和免疫反应的高特异性在微生物快速检测中广泛应用。该文着重叙述了化学发光免疫分析技术核心检测体系在微生物检测中的研究进展,并对其涉及到的样品前处理和检测新方法进行了综述。化学发光免疫分析技术检测微生物用时短、成本低,但特异性识别方法和检测的灵敏度有待提升,新型的发光体系、发光放大方法、可替代抗体的识别分子以及相关的前处理技术是未来研究的重点。
化学发光免疫分析技术;微生物检测;前处理;发光放大;识别分子
微生物检测是食品安全、临床诊断、环境监控、生物分析等领域的常见和必检项目,全球的微生物检测市场每年约有10亿检测量[1]。致病微生物的快速准确检测对及时发现并合理控制污染和防止疾病的进一步传播至关重要。因此,研发灵敏、快捷、成本低的微生物检测新技术具有重要的现实意义和广阔的应用前景。
目前微生物检测采用国标方法,即平板培养法。该方法需经过前增菌、选择性增菌、分离培养、生化鉴定等步骤,虽然结果较为准确,成本较低,但检测过程繁琐,一般需4~6 d的时间,不适用于致病微生物的快速筛查与污染控制。近年来,分子生物学和免疫学检测技术的蓬勃发展,使得微生物的快速检测方法不断创新。分子生物学检测技术,如聚合酶链式反应(Polymerase chain reaction,PCR)[2]、实时荧光定量PCR(Real-time quantitative PCR,qPCR)[3- 4]、环介导等温扩增(Loop-mediated isothermal amplification,LAMP)[5-6]生物芯片[7-9],以及免疫分析技术,如酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)[10-11]、化学发光免疫分析技术(Chemiluminescence immunoassay,CLIA)[12-13]、侧流免疫层析技术(Lateral flow immunoassay,LFI)[14-15]、电化学免疫分析技术(Electrochemical immunosensor,ECIS)[16]等均被应用于食品、环境样品的微生物快速检测,检出限达到100~104CFU/mL,检测时间为0.5~5 h(表1)。这些快速检测技术在缩短微生物检测时间和降低检出限等方面表现出巨大的优势。分子生物学技术以检测微生物的核酸(DNA和RNA)为特点,其灵敏度高、特异性好,但较难区别死、活菌,对检测体系、检测环境要求严格,检测人员需要有较高的专业背景,而且检测仪器昂贵,限制了其在基层部门微生物快速检测中的应用。免疫学检测技术以抗体特异性识别微生物细胞表面的抗原决定簇,成本低廉、特异性好,但是其检测用抗体较难制备和保存,目前并不能对所有目标菌进行检测,涉及的关键问题还需深入研究。化学发光免疫分析技术是近年来免疫分析技术中的研究热点,该技术已成为真菌毒素、药物、激素、肿瘤标志物等物质的重要检测方法,并开发出多种检测试剂盒[17]。化学发光免疫分析技术以其检测用时短、灵敏度高、设备兼容性强的特点在微生物检测中崭露头角,本文针对化学发光免疫分析技术在食品、环境等领域中微生物检测的研究进展及应用进行阐述。

表1 常见的微生物快速检测技术Table 1 Common rapid detection techniques of microbes
1 化学发光免疫分析技术检测微生物的原理
1.1 检测原理
1977年Halmann等[18]首先建立化学发光免疫分析技术,以参与化学发光反应的试剂(发光剂或催化剂)标记抗体,标记后的抗体与待测物经过抗原抗体反应和分离步骤,以化学发光的形式来定量反映待测物的含量。因为化学发光强度与化学发光反应速率相关,而反应速率由标记物的含量决定,所以化学发光强度可以作为定量依据[17]。相对于酶联免疫以颜色深浅定量、放射免疫以放射强度定量,化学发光检测具有灵敏度高、可检测范围大、检测结果稳定和不易被干扰等突出优势。化学发光免疫分析包括免疫反应系统和化学发光分析系统。免疫反应系统保证了检测的准确性和特异性,化学发光分析系统决定了检测的灵敏度。
1.2 免疫分析方法
化学发光免疫分析技术是一种利用抗原和抗体的特异性结合来选择性识别和测定待测物的免疫分析方法,一般分为竞争法和双抗夹心法。夹心法常用于大分子抗原的定量分析,微生物检测多采用此法[19]:用免疫磁珠或包被了抗体的微孔板捕获目标菌,加入标记抗体,形成夹心复合物;将游离标记抗体分离,再加入化学发光反应试剂,测定发光强度,目标菌浓度与发光强度成正比(图1)。竞争法检测微生物,将微生物的抗原决定簇包被在固相载体上,与目标菌竞争结合标记抗体,然后测定固相载体上标记物的含量,发光强度与目标菌浓度成反比(图2)。由于夹心法涉及两种抗体,检测的特异性优于竞争法,测定结果更为准确。Gehring等[20]以特异性识别大肠杆菌O157∶H7的O抗原和H抗原的两种抗体作为夹心双抗,避免了其他大肠杆菌种属的干扰,降低了检测的假阳性率。Li等[21]通过电化学发光免疫分析技术采用竞争法和夹心法检测大肠杆菌O157∶H7,并进行比较,发现夹心法的检出限较低(1.2×102CFU/mL)且线性范围更宽。

图1 化学发光免疫分析技术检测微生物的双抗夹心法原理[12]Fig.1 Principle of sandwich immunoassay format in microbiological detection by chemiluminescence immunoassay
1.3 化学发光体系
以标记物区分,化学发光体系一般分为3类:酶促化学发光、非酶促化学发光和电化学发光。酶促化学发光体系以催化剂为标记物,灵敏度和稳定性均优于以发光剂为标记物,所以微生物检测一般采用酶促化学发光体系。标记物多采用辣根过氧化物酶(Horseradish peroxidase,HRP)[13,19-20,22-25]和碱性磷酸酶(Alkaline phosphatase,ALP)[12,26]。Liu等[22]以HRP为标记物,催化鲁米诺与H2O2进行化学发光反应,最强发光波长为425 nm,用双抗夹心法对牛肉中的大肠杆菌O157∶H7进行检测,检出限为5.5×102CFU/mL,线性范围为102~105CFU/mL。Gehring等[26]以ALP为标记物,二氧化吖啶二钠盐(APS-5)为发光底物,同样利用双抗夹心法对牛肉中的大肠杆菌O157∶H7进行检测,检出限为7.6×103CFU/mL。APS-5的稳定性较差,显色温度需低于20 ℃,保存温度需低于-20 ℃,限制了其广泛使用。目前,常用的ALP催化的化学发光底物为二氧杂环乙烷类物质,其中二氧环乙烷二钠盐(AMPPD)的应用最为成功[12],其在ALP催化下发生分解反应,脱去磷酸基团,产生477 nm的持续稳定的化学发光。AMPPD性质十分稳定,在无酶催化下水解速率非常慢,极具应用潜力。以酶为标记物的化学发光是化学发光免疫分析的主流,所占比例约为80%[17]。非酶促发光体系一般以化学发光试剂为标记物,如鲁米诺、异鲁米诺、吖啶酯,在过渡金属离子、过氧化物酶等催化剂的作用下与H2O2反应,目前关于微生物检测的报道较少。电化学发光是一类特殊的化学发光反应体系,一般以联吡啶钌[Ru(bpy)3]2+为标记物,电极将其氧化为[Ru(bpy)3]3+,然后被电子载体N-羟基琥珀酰亚胺(N-Hydroxysuccinimide,NHS)还原,并释放1个光子回到基态,在620 nm波长处检测发光强度。[Ru(bpy)3]2+在化学发光反应过程中不消耗,兼具准确性和稳定性,便于开发全自动分析仪器,是近年来化学发光免疫分析技术的研究热点之一[20,27-28]。Morel等[29]利用该方法检测炭疽杆菌,检出限为3×102CFU/mL,比酶促化学发光免疫分析技术表现出更高的灵敏度。
2 化学发光免疫分析技术在微生物检测中的应用
2.1 样品前处理策略
食品、环境和医学微生物检测的主要挑战是样品中痕量目标菌(<10 CFU/g)的检测,和样品基质对检测的干扰。前处理过程能有效地从样品颗粒、干扰物和抑制剂中分离、浓缩目标菌,有助于提高低水平或散发性污染样品的检测灵敏度和准确性,避免微生物分布不均匀导致的检测结果代表性差的问题。此外,目标菌浓缩可以减少或消除对增菌步骤的需要。因此,前处理方法在微生物检测中有举足轻重的作用。目前,化学发光免疫分析技术常用的前处理方法有过滤、离心、免疫磁分离等(表2)。Wunderlich等[30]使用吸附过滤结合离心超滤的前处理方法,先将10 L样品水通过单层过滤膜,并用20 mL洗脱液将吸附物完全洗脱下来,再离心浓缩至1 mL,整个前处理过程将水中微生物的密度提高10 000倍,省去了增菌步骤,嗜肺军团菌的回收率达到99.8%。再利用微阵列化学发光芯片可检出0.39 CFU/mL的目标菌,检测全过程仅需90 min。过滤和离心等物理前处理方法可有效浓缩微生物,但无法实现目标菌的特异性分离,较适合液态、无较多颗粒干扰的检测样品。微生物过滤后需洗脱,面临浓度降低和回收不完全的问题。

表2 化学发光免疫分析技术结合前处理技术在微生物检测中的应用Table 2 Application of chemiluminescence immunoassay combined with pretreatment in microbiological detection
1979年免疫磁珠问世,磁性微粒表面偶联着抗体等识别分子,可与目标菌特异性结合,通过外加磁场定向移动并聚集,达到特异性分离和浓缩的目的[31]。免疫磁珠分离能够快速无损分离目标菌,不但排除了样品基质对检测的影响,还降低了其他种属微生物对目标菌检测的干扰,因此越来越多地应用于微生物检测的前处理。高明远课题组[32]以国产亚微米级的单分散磁性微球为基础,制备出捕获效率95%以上的免疫磁珠,用于沙门氏菌的富集分离。Du等[33-34]证实该纳米级免疫磁珠的捕获性能优于微米级免疫磁珠,利用该免疫磁珠对鸡肉和牛奶样品中100 CFU/mL的沙门氏菌免疫磁分离后进行了4 h增菌培养,即达到103CFU/mL以上,满足化学发光免疫分析技术检出限的需求。Yang等[12]利用万古霉素标记的磁珠捕获样品中的目标菌,菌密度增加20倍,与标记ALP的金黄色葡萄球菌抗体形成夹心,ALP催化AMPPD进行化学发光反应检测金黄色葡萄球菌,检出限达3.3 CFU/mL。
将免疫色谱、毛细管电泳等新兴的分离技术,与灵敏的化学发光结合,具有反应快,无需长时间温浴,可以同时进行多组分检测的优势。Yacoub-George等[35]采用集成的毛细管芯片免疫反应器将含有菌毒素、病毒和细菌的样品组分分离并同时检测,分离检测全过程仅需24 min,可检测出105CFU/mL以上的大肠杆菌O157∶H7。
2.2 化学发光免疫分析技术中的特异性识别策略
免疫分析技术建立在免疫识别基础上,识别分子保证了检测的特异性和准确性。化学发光免疫分析技术检测微生物的识别分子一般为抗体。多克隆抗体价格相对低廉,但需通过免疫动物获得,虽然经过分离纯化,但不可避免地与非目标菌存在交叉反应。单克隆抗体的特异性好,但杂交瘤技术非常昂贵且耗时[38]。此外,抗体活性易受环境、反应条件等多种因素的影响,制约了免疫分析技术的推广普及。近年来,国内外学者尝试使用新型识别分子代替抗体,适配体[39]、抗生素[12]、抗菌肽[21]、噬菌体[40]和分子印迹聚合物[41]等均在微生物特异性识别中得到应用(表3)。Kwun等[39]利用适配体作为识别分子偶联1,1′-草酰二咪唑,竞争法检测副溶血弧菌,目标菌与氧化石墨烯竞争结合适配体,检出限为2.23×103CFU/mL。Li等[21]利用抗菌肽Magainin Ⅰ作为识别分子,通过电化学发光免疫分析技术检测大肠杆菌O157∶H7,进一步降低了化学发光反应的本底值。Yue等[40]利用噬菌体作为识别分子,通过电化学发光免疫分析技术能检测出56 CFU/mL以上的铜绿假单胞菌。这些新型识别分子制备过程相对简单,制备成本低,在高温下稳定性好,有更宽的pH值耐受范围,而且应用灵活性强,容易标记各种酶分子或官能团。其中,对于微生物细胞这种大抗原,噬菌体和适配体是目前最有希望替代抗体的识别分子,但还需利用多种手段优化筛选方法以进一步提高识别分子与目标菌的亲和性。抗生素和抗菌肽简单易得,但特异性普遍较弱,一般用于初步捕获,检测需抗体配合。分子印迹聚合物较适合用于小抗原的识别,其制备常用本体聚合法,制备完成后存在模板分子难以去除导致实际产率低的问题[38]。

表3 新型识别分子特异性识别目标菌的作用机理Table 3 Mechanism of new recognition elements specific recognizing the target bacteria
2.3 化学发光免疫分析技术中的发光放大策略
灵敏度是微生物快速检测技术的关键指标。特别在低水平污染的样品中,灵敏度是决定微生物检测时间和准确性的重要因素。因此,提高化学发光免疫分析技术的灵敏度具有重要的研究价值。将化学发光反应的发光放大是提高灵敏度的主要手段。利用微粒比表面积大的特点,在其表面结合大量的催化剂、发光剂等,使得与待检物结合的标记物大大增加,灵敏度大幅提高,检出限降低。Mun等[42]将HRP标记到免疫磁珠上用来捕获沙门氏菌,利用100 nm免疫磁珠比沙门氏菌体积小很多的特点,用0.22 μm的过滤膜将免疫磁珠-沙门氏菌复合体与游离的免疫磁珠分离。由于免疫磁珠上可标记大量的HRP,所以检出限显著降低,10 CFU沙门氏菌即可检出。Wang等[43]通过纳米金颗粒辅助银形成树枝状分布的Ag+,利用Ag+对K2S2O8-Mn2+-鲁米诺反应体系显著的催化作用,使得灵敏度提高2个数量级,实现了100 CFU/mL沙门氏菌不需经过增菌步骤的直接化学发光免疫分析检测。
开发新的化学发光反应体系以提高检测灵敏度是化学发光免疫分析技术的发展趋势。Zhang等[36]以葡萄糖氧化酶作为标记物,催化葡萄糖和O2产生葡萄糖酸和H2O2,并利用漆酶在碱性环境下催化鲁米诺与H2O2的化学发光反应起到二次放大的作用,增加了化学发光强度,检出限为1.2×103CFU/mL。
2.4 化学发光免疫分析技术中固相材料的应用
固相材料用于固定抗体、酶、发光剂等物质,影响微生物检测的灵敏性和稳定性。化学发光免疫分析技术中使用的固相材料有微孔板、磁性微粒和多孔材料等[17](表4)。Magliulo等[23]利用聚苯乙烯微孔板为固相材料,并在1个主孔中设置4个子孔分别包被大肠杆菌O157∶H7、鼠伤寒沙门氏菌、单核增生李斯特菌和小肠结肠炎耶尔森菌的单克隆抗体,利用HRP标记的多克隆抗体同时检测这4种致病菌,检出限为104CFU/mL。该方法使用极少量的抗体,实现了快速、高通量、低成本的微生物检测。
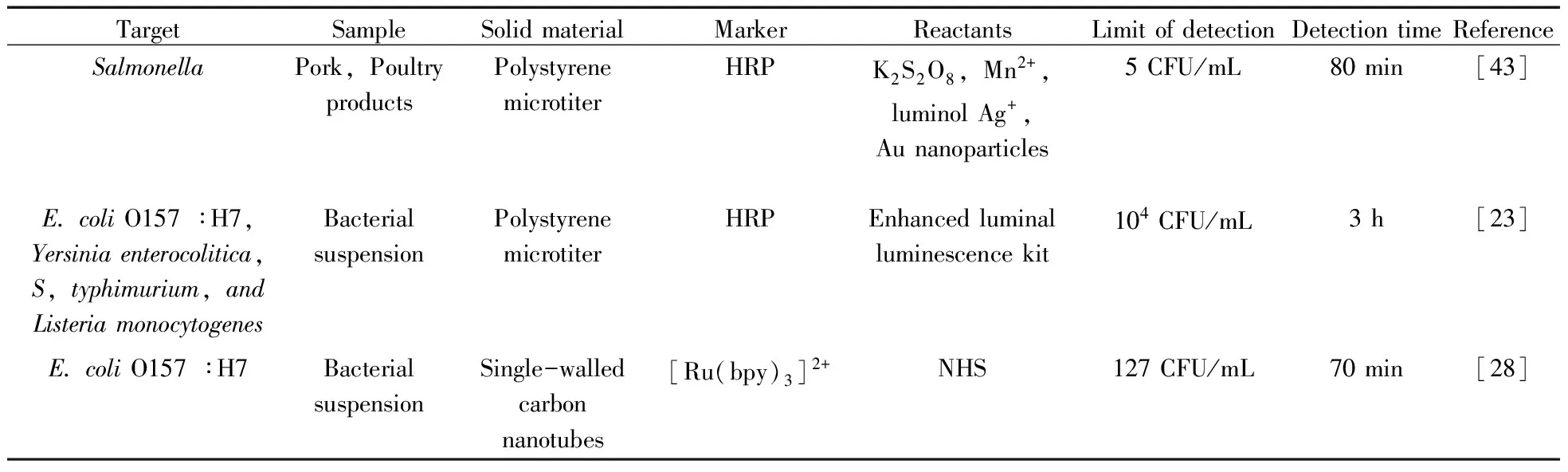
表4 固相材料在化学发光免疫分析技术检测微生物中的应用Table 4 Application of solid materials in microbiological detection by chemiluminescence immunoassay
微粒形态的固相材料包被上抗原,模拟制成目标菌标准品,即可采用竞争法检测微生物。Xiong等[13]将包被了葡萄球菌蛋白A的磁珠作为目标菌类似物,与金黄色葡萄球菌竞争结合HRP标记的抗体,检出限达6 CFU/mL。此方法有较高的灵敏度和较宽的线性范围,且抗原抗体一步孵育即可得出检测结果,全部检测过程仅需50 min,显示出良好的应用前景。
固相材料还可用于合成人工模拟酶,比天然酶更易制备且性质稳定。Yang等[44]将脱氧核酶序列与适配体序列组成一个单链DNA探针,将探针包裹到单碳纳米管上。其中适配体序列能特异性地与目标菌结合,导致脱氧核酶序列远离单碳纳米管与高铁血红素结合,形成HRP的模拟酶。该模拟酶能够催化鲁米诺-H2O2体系产生化学发光,可检测出103CFU/mL的沙门氏菌。
3 总结与展望
微生物检测技术,必须具备较高的灵敏度、显著的特异性、获得结果的快速性和检测成本的低廉性。化学发光免疫分析方法的灵敏性和检测范围远高于酶联免疫等其他免疫分析技术,兼具操作简便、检测时间短等优势,在微生物检测方面发展迅速。灵敏度是微生物快速检测技术的关键问题,化学发光体系中最成熟的是HRP-鲁米诺-H2O2和ALP-ADPPM体系,目前灵敏度达到102~103CFU/mL。配合免疫磁分离、超滤等前处理方法,检出限可降为10-1~100CFU/mL。新型的化学发光体系、纳米颗粒和固相材料的应用能进一步增强发光信号,降低本底噪音,提高检测的灵敏度。
免疫识别决定了化学发光免疫分析检测微生物的特异性和稳定性。由于抗体难制备与不易保存的缺点,噬菌体、适配体等新型可替代抗体的识别分子的研发是今后化学发光免疫分析领域研究的重点,对该技术的推广普及具有重要意义。微生物容易发生变异,一定程度上限制了免疫分析方法的稳定性,但这也是目前快速检测方法普遍面临的问题。必要时可结合生化鉴定、全基因组测序和基质辅助激光解吸电离飞行时间质谱等其他技术深入解析变异微生物,并进行鉴定和溯源。
食品行业的微生物监控,要求对样品进行活菌检测,但食品中活致病菌数量一般较少,直接进行化学发光免疫分析检测难以达到目的。通过对样品进行短暂增菌,使少量的活菌得到增殖,避免了检测结果的假阴性;同时区分了死、活菌,避免了假阳性结果。因此针对不同性质的待测样品开发成套的、结合前处理和增菌方案的化学发光免疫分析方法非常必要,可为该技术在微生物检测领域的推广普及奠定基础。
[1] Wang Y,Salazar J K.Compr.Rev.FoodSci.Saf.,2016,15(1):183-205.
[2] Bai Y L,Song M H,Cui Y,Shi C L,Wang D P,Paoli G C,Shi X M.Anal.Chim.Acta,2013,787(13):93-101.
[3] Hyeon J Y,Deng X.FoodMicrobiol.,2017,63:111-116.
[4] Yang Y J,Xu F,Xu H Y,Aguilar Z P,Niu R J,Yuan Y,Sun J C,You X Y,Lai W H,Xiong Y H.FoodMicrobiol.,2013,34(2):418-424.
[5] Fan F X,Du P C,Kan B,Yan M Y.PLoSOne,2015,10(4):e0124507.doi:10.1371/journal.pone.0124507.
[6] Yang W T,Song X N,Wang J X,Li Z,Ji M J,Li Y F.Biosci.Trends,2014,8(6):316-321.
[7] Bang J,Beuchat L R,Song H,Gu M B,Chang H I,Kim H S,Ryu J H.Int.J.FoodMicrobiol.,2013,161(2):134-141.
[8] Goji N,Macmillan T,Amoako K K.J.Pathogens,2011,2012:627036.doi:10.1155/2012/627036.
[9] Wang R J,Ni Y N,Xu Y,Jiang Y,Dong C Y,Chuan N.Anal.Chim.Acta,2015,853(1):710-717.
[10] Cho I H,Irudayaraj J.Int.J.FoodMicrobiol.,2013,164(1):70-75.
[11] Wu W H,Li J,Pan D,Li J,Song S P,Rong M G,Li Z X,Gao J M,Lu J X.Acs.Appl.Mater.Interfaces,2014,6(19):16974-16981.
[12] Yang S J,Hui O Y,Su X X,Gao H F,Kong W J,Wang M Y,Shu Q,Fu Z F.Biosens.Bioelectron.,2016,78:174-180.
[13] Xiong J,Wang W W,Zhou Y L,Kong W J,Wang Z X,Fu Z F.Microchim.Acta,2016,183(4):1507-1512.
[14] Chaivisuthangkura P,Pengsuk C,Longyant S,Sithigorngul P.J.Microbiol.Methods,2013,95(2):304.
[15] Jin S,Dai M,Ye B C,Nugen S R.Microsyst.Technol.,2013,19(12):2011-2015.
[16] Abbaspour A,Norouz-Sarvestani F,Noori A,Soltani N.Biosens.Bioelectron.,2015,68:149-155.
[17] Lin J M,Zhao L X,Wang X.ChemiluminescenceImmunoassay.Beijing:Chemical Industry Press(林金明,赵利霞,王栩.化学发光免疫分析.北京:化学工业出版社),2008:1-9.
[18] Halmann M,Velan B,Sery T.Appl.Environ.Microbiol.,1977,34(5):473-477.
[19] Ye J,Liu Y,Li Y.Trans.Asae,2002,45(2):473-478.
[20] Gehring A G,Albin D M,Irwin P L,Reed S A,Tu S I.J.Microbiol.Methods,2006,67(3):527-533.
[21] Li Z J,Yang H Y,Sun L J,Qi H L,Gao Q,Zhang C X.Sens.ActuatorsB,2015,210:468-474.
[22] Liu Y C,Ye J M,Li Y B.J.FoodProt.,2003,66(3):512-517.
[23] Magliulo M,Simoni P,Guardigli M,Michelini E,Luciani M,Lelli R,Roda A.J.Agric.FoodChem.,2007,55(13):4933-4939.
[24] Yacoub-George E,Hell W,Meixner L,Wenninger F,Bock K,Lindner P,Wolf H,Kloth T,Feller K A.Biosens.Bioelectron.,2007,22(7):1368-1375.
[25] Karoonuthaisiri N,Charlermroj R,Uawisetwathana U,Luxananil P,Kirtikara K,Gajanandana O.Biosens.Bioelectron.,2009,24(6):1641-1648.
[26] Gehring A G,Irwin P L,Reed S A,Tu S I,Andreotti P E,Akhavan-Tafti H,Handley R S.J.Immunol.Methods,2004,293(1/2):97-106.
[27] Liao N.J.Instrum.Anal.(廖妮.分析测试学报),2016,35(7):832-838.
[28] Yang H Y,Wang Y Q,Qi H L,Gao Q,Zhang C X.Biosens.Bioelectron.,2012,35(1):376-381.
[29] Morel N,Volland H,Dano J,Lamourette P,Sylvestre P,Mock M,Créminon C.Appl.Environ.Microbiol.,2012,78(18):6491-6498.
[30] Wunderlich A,Torggler C,Elsasser D,Luck C,Niessner R,Seidel M.Anal.Bioanal.Chem.,2016,408(9):2203-2213.
[31] Ugelstad J,Kaggerud K H,Hansen F K,Berge A.MacromolChem.,1979,180(3):737-744.
[32] Niu M,Du M H,Deng Y,Gao M Y.Chem.J.Chin.Univ.(牛牧,杜美红,邓奕,高明远.高等学校化学学报),2011,32(2):322-326.
[33] Dai F Y,Zhang M,Hu B B,Sun Y J,Tang Q W,Du M H,Zhang X.RscAdv.,2015,5(5):3574-3580.
[34] Dai F Y,Zhang M,Xu D X,Yang Y,Wang J X,Li M Z,Du M H.Biotechnol.Appl.Biochem.,2016,11(12).doi:10.1002/bab.1539.
[35] Yacoub-George E,Meixner L,Scheithauer W,Koppi A,Drost S,Wolf H,Danapel C,Feller K A.Anal.Chim.Acta,2002,457(1):3-12.
[36] Zhang Y,Tan C,Fei R H,Liu X X,Zhou Y,Chen J,Chen H C,Zhou R,Hu Y G.Anal.Chem.,2014,86(2):1115-1122.
[37] Park S,Min J,Kim Y K.Int.J.Environ.Anal.Chem.,2012,92(6):1-10.
[38] Dorst B V,Mehta J,Bekaert K,Rouah-Martina E,Coena D W,Dubruelc P,Blusta R,Robbens J.Biosens.Bioelectron.,2010,26(4):1178-1194.
[39] Kwun J,Yun S,Park L,Ji H L.Talanta,2014,119:262-267.
[40] Yue H,He Y,Fan E,Wang L,Lu S G,Fu Z F.Biosens.Bioelectron.,2017,94:429-432.
[42] Mun S,Choi S J.BioChipJ.,2015,9(1):10-15.
[43] Wang Z P,Duan N,Li J Q,Ye J,Ma S F,Le G W.Luminescence,2011,26(2):136-141.
[44] Yang M,Peng Z H,Neng Y,Chen Y Z,Zhou Q,Deng L.Sensors,2013,13(5):6865-6881.
Application of Chemiluminescence Immunoassay in Microbiological Detection
LI Jing-wen1,LIU Qing-jun1,DU Mei-hong1*,ZHAO Rui-xue1,WAN Yu-ping2,WU Xiao-sheng2,FENG Yue-jun2
(1.Beijing Engineering Research Center of Food Safety Analysis,Beijing Center for Physical and Chemical Analysis,Beijing 100089,China;2.Beijing Engineering Research Centre of Food Safety Immune Rapid Detection,Beijing Kwinbon Biotechnology Co.,Ltd.,Beijing 102206,China)
Chemiluminescence immunoassay is widely used in the rapid detection of microbes because of its high sensitivity of chemiluminescence and high specificity of immune response.In the paper,the advance of the coresystems of chemiluminescence immunoassay in microbiological detection is emphatically illustrated.The related sample pretreatments and the new detection methods are reviewed.Although Chemiluminescence immunoassay in the microbiological detection has the advantages of rapidness and low consumption,its specific recognition and sensitivity could be further improved.The innovative luminescence systems,the luminescence amplification methods,the alternative recognition elements and the related pretreatment techniques are the focuses in future research.
chemiluminescence immunoassay;microbiological detection;pretreatment;luminescence amplification;recognition element
2017-05-12;
2017-07-09
国家重大科学仪器设备开发专项(2013YQ140371);国家重点研发计划资助(2016YFF0203802);北京市科技计划项目(Z161100000916001);北京市自然科学基金项目(2162018)
*
杜美红,博士,副研究员,研究方向:食品安全微生物快速检测,Tel:010-58717271,E-mail:dumeihong@beijinglab.com.cn
10.3969/j.issn.1004-4957.2017.11.020
O657;O734
A
1004-4957(2017)11-1409-08
