非靶标代谢组研究温度对黄曲霉菌代谢的影响
2017-11-29谢华里李培武王秀嫔张良晓汪雪芳
谢华里,李培武,5*,王秀嫔,张 奇,张良晓,王 同,张 文,5,汪雪芳,5
(1.中国农业科学院油料作物研究所,湖北 武汉 430062;2.农业部油料作物生物学与遗传育种重点实验室,湖北 武汉 430062;3.农业部生物毒素检测重点实验室,湖北 武汉 430062;4.农业部油料产品质量安全风险评估实验室,湖北 武汉 430062;5.农业部油料及制品质量监督检验测试中心,湖北 武汉 430062)
非靶标代谢组研究温度对黄曲霉菌代谢的影响
谢华里1,2,3,4,李培武1,2,3,4,5*,王秀嫔1,3,4,5*,张 奇1,2,3,4,张良晓1,3,4,5,王 同1,2,3,张 文1,2,3,5,汪雪芳1,2,3,5
(1.中国农业科学院油料作物研究所,湖北 武汉 430062;2.农业部油料作物生物学与遗传育种重点实验室,湖北 武汉 430062;3.农业部生物毒素检测重点实验室,湖北 武汉 430062;4.农业部油料产品质量安全风险评估实验室,湖北 武汉 430062;5.农业部油料及制品质量监督检验测试中心,湖北 武汉 430062)
采用基于超高效液相色谱-高分辨质谱联用的非靶标代谢组学方法来研究温度对黄曲霉菌生理代谢的影响,使用交互偏最小二乘判别分析(OrthoPLS-DA)等化学计量学方法对代谢组数据进行多元统计分析,使用二级质谱信息和谱库检索定性黄曲霉菌代谢特征信息。使用内标结合混合质控样品的方法对非靶标代谢组方法进行质量控制。将该方法应用于研究温度对黄曲霉菌代谢组的影响,发现不同温度下有3 593个(T检验p<0.01)差异表达代谢特征,筛选出20个候选差异代谢物。研究结果表明,温度显著影响三羧酸循环、脂肪酸、苯丙氨酸、色氨酸、络氨酸等生物合成路径,并调控黄曲霉毒素、黄匹阿尼酸、曲酸等次生代谢物生物合成路径酶活性。研究发现曲酸和黄曲霉毒素前体化合物与黄曲霉毒素的累积变化规律相似,可作为候选靶标进行验证。该研究为开展我国黄曲霉毒素风险评估和分子预警研究提供了新的路径和方法。
黄曲霉菌;代谢组;高分辨质谱;黄曲霉毒素生物合成;温度
黄曲霉毒素是迄今发现毒性最强的一类污染花生和玉米等农产品的生物毒素,对我国农产品质量安全构成了很大威胁,特别是近年来对花生等油料农产品的出口贸易造成重大影响。当前,研究已经明确遗传、生物和非生物因素将影响黄曲霉毒素的形成,并已明确了参与黄曲霉毒素生物合成路径上的骨架基因,调控因子及生物合成酶[1]。此外黄曲霉菌全基因组测序已经完成,也对其次生代谢基因簇进行了生物信息学预测[2],黄曲霉毒素生物合成区室化分布[3]和光照如何调控黄曲霉毒素合成也已报道[4],这些研究基础为基于质谱技术结合基因挖掘策略进行黄曲霉次生代谢研究提供了较为充足的理论基础。温度和水分活度是生产和粮油仓储中影响黄曲霉毒素产生最重要的环境因子。当前对于以温度调控黄曲霉毒素形成的机制仍不明确,仅停留于最适宜温度为28~30 ℃,低温(<20 ℃)和高温(>35 ℃)抑制黄曲霉毒素产生的表观层面。而通过研究温度显著调控的靶点,可为黄曲霉毒素的防控提供参考靶点和理论支撑,也为开展黄曲霉污染早期分子预警和风险评估研究提供技术支撑。
代谢组学(Metabolomics或Metabonomics)是继基因组学、转录组学和蛋白质组学等系统生物学之后兴起的一个分支[5]。当前代谢组学主要分为靶向代谢组学和非靶向代谢组学,靶向代谢组学是针对特定数量或种类的代谢分析策略,具有主观目的性。而非靶向代谢组学是一种尽可能多的检测样本中代谢物的分析策略,从总体上对生物学问题在代谢水平上实现导航,具有无偏性。由此可见,非靶向代谢组学研究的代谢物集合更大,这对分析仪器平台提出了更高的精度要求。目前,代谢组学主要基于核磁共振和质谱分析平台并结合化学计量学进行代谢差异研究。其中高分辨质谱在非靶向代谢分析方面扮演着重要的角色。该平台主要通过一级精确质量数和二级质谱数据作为定性判据,为分析海量的代谢信息提供高分辨工具平台。目前主流的高分辨质谱有飞行时间质谱(TOF-MS)、静电场轨道阱(Orbitrap-MS)质谱和傅立叶变换离子回旋共振FTICR-MS质谱。静电场轨道阱(Orbitrap-MS)质谱(MS error<2 ppm)相比于飞行时间(TOF-MS)质谱(MS error<5 ppm)具有更低的测量质量误差,同时在仪器稳定性和重现性上显著优于飞行时间(TOF-MS)质谱[6],FTICR-MS虽是目前测量精度最高的质谱,但其扫描速度较前两者更慢,在代谢组学研究中应用较少。此外,将高分辨质谱技术应用于黄曲霉菌等真菌的研究报道较为缺乏,主要集中在利用高分辨质谱技术对黄曲霉菌新次生代谢物通路的结构鉴定研究方面[7-8]。
本文通过利用代谢组研究建立以黄曲霉菌为代表的丝状真菌的非靶标代谢组学方法,并利用该方法研究温度对黄曲霉菌生理代谢的影响,为深入理解黄曲霉菌响应环境因子机制提供一个有效的方法途径。
1 实验部分
1.1 试剂与材料
甲醇(MeOH)、乙酸乙酯(EA)、二氯甲烷(DCM)、乙腈(ACN)(色谱纯,美国Fisher 公司),甲酸购于Sigma-Aldrich 公司(Bornem,Belgium)。2-氯苯丙氨酸购于百灵威公司。超纯水通过Milli-Q Gradient System(Millipore,Brussels,Belgium)产生。PDA固体培养基(200 g马铃薯,洗净去皮切碎,加水1 000 mL蒸煮0.5 h,纱布过滤,再加葡萄糖10 g,充分溶解后趁热用纱布过滤,分装于三角锥形瓶中,加入琼脂15 g,摇匀。121 ℃灭菌20 min,冷却后贮存备用)。沙氏培养基购于海博生物公司。冷甘油缓冲溶液(-30 ℃):丙三醇和NaCl溶液(13.5 g/L)以3∶2(体积比)混合;清洗溶液:丙三醇和NaCl溶液(13.5 g/L)以1∶1(体积比)混合。PBS缓冲溶液:0.01 mol/L PBS缓冲液(pH 7.4):称取NaCl 8.0 g、Na2HPO4·12H2O 2.9 g、KCl 0.2 g、KH2PO40.2 g溶于900 mL去离子水中,用盐酸或氢氧化钠溶液调至pH 7.4,补加去离子水并定容至1 L。
1.2 菌株及培养条件
AF73菌株由中国农业科学院油料作物研究所质检中心(武汉)提供。黄曲霉菌在PDA固体培养基上28 ℃培养10 d后,用无菌水(含0.1%的吐温-80)将孢子从培养基上洗下,用血球板计数法计数。沙氏液体培养基中接种黄曲霉孢子悬液,使接种量达5×105个/mL,将培养瓶置于28 ℃恒温摇床(200 r/min)培养6 d,得到黄曲霉菌样品。
1.2 取样与样品准备
1.2.1黄曲霉菌猝灭方法采用改进的冷甘油缓冲溶液法猝灭[9],具体步骤为:快速转移黄曲霉菌株样品到预先加入冷甘油缓冲溶液猝灭剂的50 mL离心管中,混合液中样品体积和猝灭剂体积比保持在1∶4~1∶6之间。快速均质混合液(涡旋10 s)后,置于 -30 ℃冷却5 min。真空抽滤,快速过滤猝灭样品,吸取5 mL PBS清洗黄曲霉菌丝球,重复1次,收集得到样品,冷冻干燥8 h。
1.2.2黄曲霉菌细胞被膜破碎方法及代谢物提取采用非机械破碎方法中的有机溶剂穿透破碎结合超声机械破碎对细胞进行破碎和代谢物提取。提取溶剂为混合溶剂MeOH-DCM-EA(1∶1∶1,体积比),同时加入1%甲酸以提高化合物离子化效率,加入内标2-氯苯丙氨酸配成500 μg/L溶液。混合提取溶液配制好后,取2 mL提取液加入样品中进行代谢物超声(超声功率100%)提取20 min。
1.3 UHPLC-HRMS仪器条件
在高效液相色谱(Dionex,Sunnyvale,CA,USA)上进行色谱分离,色谱柱为C18反向色谱柱(Hypersil Gold,100 mm×2.1 mm i.d.3 μm,Thermo Fisher Scientific,USA)。使用Orbitrap Fusion静电轨道阱高分辨质谱(Thermo Scientific,USA)做质谱分析。
流动相:A为甲醇-水(95∶5,体积比,含0.1%甲酸和10 mmol/L甲酸铵)混合溶液;B为水-甲醇(95∶5,体积比,含0.1%甲酸和10 mmol/L甲酸铵)混合溶液。梯度洗脱程序为:0~2 min,85%B;2~8 min,85%~50%B;8~10 min,50%B;10~12 min,50%~30%B;12~13 min,30%B;13~15 min,30%~0%B;15~16 min,0%B;16~24 min,0%~85%B;24~28 min,85%B。流速为0.3 mL/min。柱温为40 ℃,自动进样室温度为15 ℃,进样量为2 μL。
高分辨质谱条件:离子源加热温度为300 ℃;喷雾电压:正离子模式下为3.5 kV,负离子模式下为3.0 kV;鞘气为40 Arb;辅气为5 Arb。离子传输毛细管温度为320 ℃,毛细管电压-1.9 kV。主要的一级精确质量数全扫参数如下:检测器选用Orbitrap,分辨率选择120 000 FWHM(半峰宽),扫描范围为100~1 000m/z,自动增益控制设定为1.0e6,注入时间为100 ms。一级扫描与二级扫描间主要的过滤参数如下:强度阈值为1.0e4,带电荷为1~2个,动态排除设定为1。数据依赖采集选择Top speed模式,循环时间为1 s。主要的二级质谱扫描(dd-ms2)参数如下:碎裂模式为选择高能碰撞诱导裂解模式(HCD),碰撞能正离子模式下设为35 eV,负离子模式设为30 eV。检测器类型为Orbitrap,分辨率设为30 000 FWHM,自动增益控制设为5.0e4,最大注入时间为100 ms,四极杆隔离宽度为1 Da。
1.4 数据预处理与多元统计分析
使用SIEVE 3.0(Thermo Scientific,USA)对原始数据分别进行峰对齐,提取,代谢物谱库检索定性得到原始峰表。经过处理后导入SIMCA14.1或在线代谢组学数据处理网站MetaboAnalyst 3.0(www.metaboanalyst.ca)[10]或XCMS[11](https://xcmsonline.scripps.edu)进行数据过滤、标准化等数据预处理和多元统计分析。使用代谢组数据库METLIN(https://metlin.scripps.edu/)、mzCloud(https://www.mzcloud.org/)、YMDB( http://www.ymdb.ca/)和KEGG (http://www. kegg. com/ )和本地库进行代谢物定性。
1.5 温度对黄曲霉菌代谢组的影响
分别以不同温度(18、28、38 ℃)培养的3组黄曲霉菌作为样品,使用上述的前处理步骤、检测条件和数据处理方法,对黄曲霉菌生理及次生代谢情况进行全组分分析,以期初步揭示不同温度条件对黄曲霉生理及其产毒的影响机制。



图1 非靶标代谢组方法确证图示Fig.1 Method validation plot involved in non-targeted metabolomicsaA.rincipal component analysis scores plot of three temperature and quality control sample;B.8 ℃ and 28 ℃ groups of samples were aligned with the original peak of total ion current;C.lot of retention time deviation for 18 ℃ and 28 ℃ groups of samples;18-BN and 28-BN represent the intracellular group of 18 ℃ and 28 ℃(18-BN和28-BN代表18,28 ℃组样品胞内的6个重复)
2 结果与讨论
2.1 非靶标代谢组学方法确证
非靶标代谢组学方法分析目标是数以千计的未知形式代谢物,其方法确证有别于目标物分析方法确证,更具挑战性[12]。为确保研究发现的差异是生物学差异而非测定误差带来的技术差异,需进行有效的质量控制。目前国际上常用方法是使用混合QC质控样品,即从样本中取少量、等量混匀用作QC样本,将其插入运行序列中用于监测仪器稳定性和可重复性并用于数据过滤[13]。本研究使用2-氯苯丙氨酸作为内标结合混合QC质控样品对数据质量进行监测,并用于方法确证[12,14]。分析结束后使用QC样品数据进行以下工作:对分析性能进行系统评价,判断进一步数据分析的必要性;进行代谢特征选取,滤除在QC 中变异大的代谢特征,通常LC-MS分析中过滤阈值RSD为20%[13,15-16]。将3种不同温度培养条件下样品(分胞内和胞外样品共36个)、3个空白样本和17个混合质控样,共56个原始样本数据经过数据预处理后进行主成分分析,结果见图1A。由图可见,17个质控样品较好地聚集在原点附近,图1B总离子流图中原始峰对齐效果也较好,未出现显著的峰漂移,由图1C可见保留时间变异在±0.08 s内,以上数据表明仪器的稳定性和重现性较好。
2.2全组分分析温度对黄曲霉菌生理及其产毒的影响
2.2.1温度对黄曲霉菌生理代谢轮廓分析采用UHPLC-HRMS分别在正负离子模式下对样本进行数据采集,在18、28、38 ℃培养条件下样本分别用正负离子模式采集到总离子流图(TIC)。从总离子流图可以总体上观察3个温度下的样品是否存在差异,但具体差异需进一步提取分析。
2.2.2潜在差异代谢物筛选由图2可见,质荷比分布云图可以对采集到的特征化合物质量分布和出峰时间有直观了解。在p≤0.01和差异表达倍数≥1.5情况下发现3 593个特征化合物,图中包含p值可视化、定向差异表达倍数值和特征化合物质荷比信息,且包含了每个样本的总离子流图和保留时间。图中上半部分绿色部分代表化合物强度增强的组分,下半部分代表了化合物减弱的部分,气泡的大小与特征值的差异表达倍数取log值后的大小相关,即气泡大者,差异表达倍数取log值后也大。本研究中,特征化合物主要分布为出峰时间较早的极性化合物,质量分布在100~600 Da左右,5~10 min出峰的中等极性化合物质量分布在200~800 Da左右,10~18 min出峰的弱极性化合物质量分布在200~1 000 Da。从气泡大小可看出,大部分特征化合物的差异表达倍数(Fold change)值较大,表明筛选的特征化合物差异显著。
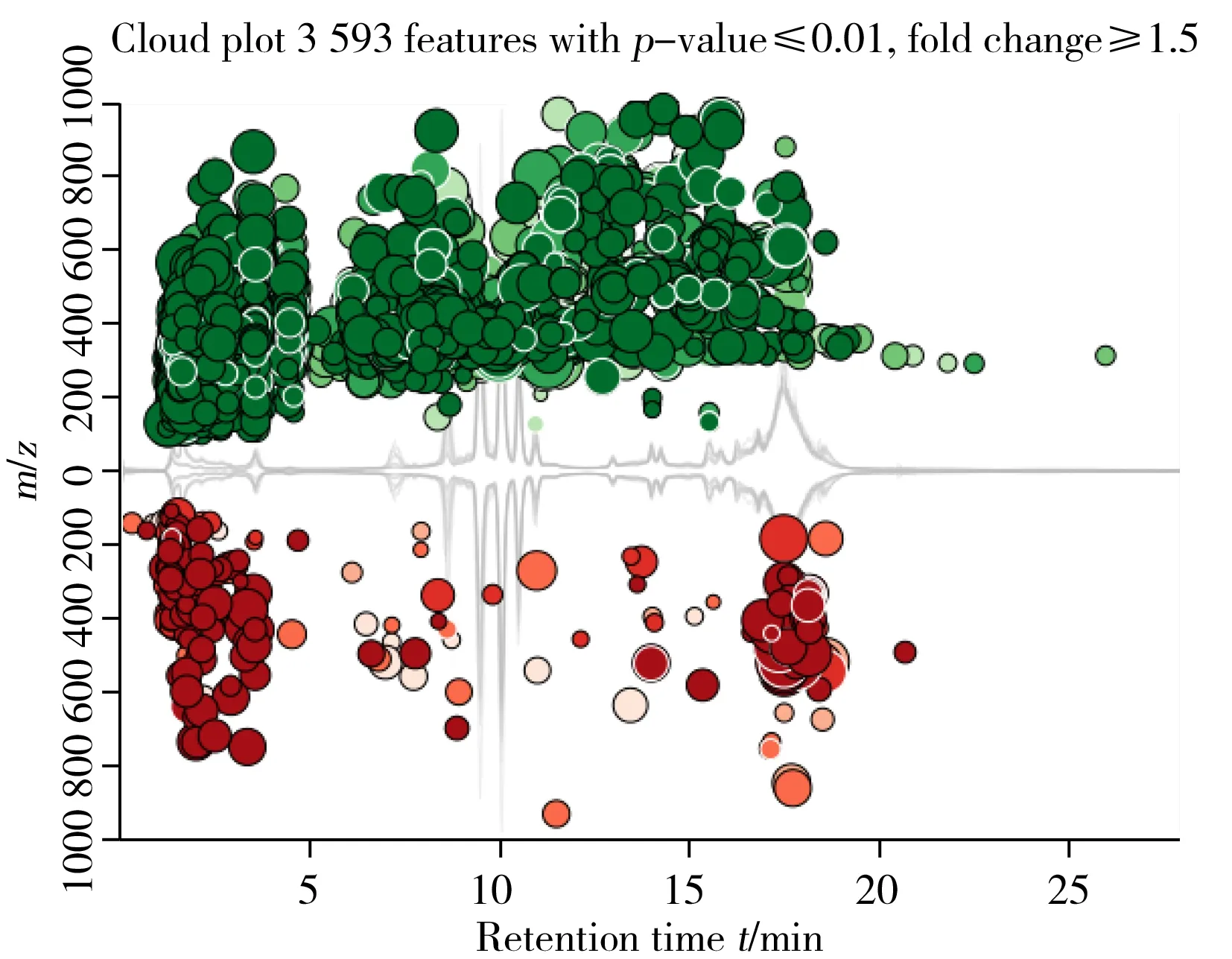
图2 黄曲霉菌数据集质荷比分布云图Fig.2 Cloud plot of aspergillus flavus data set
OrthoPLS-DA是一种有监督的模式识别分析方法,与PCA相比,可在不降低模型预测能力的前提下,增强模型的解释能力。本研究中,对18 ℃与28 ℃培养样品进行OrthoPLS-DA分析比较,得到该2个温度下培养组的OrthoPLS-DA得分图3A,同样,38 ℃与28 ℃培养组的比较也经过OrthoPLSDA分析,其得分图见图4A。从图3A,4A可看出,这两组都可以与28 ℃培养组明显区分。R2Y、Q2分别代表模型OrthoPLS-DA的解释能力和预测能力。本研究中18、28 ℃培养组模型的R2Y、Q2分别为0.98和0.96。28、38 ℃培养组模型的R2Y、Q2分别为0.99和0.92。说明两个模型都具有较高的解释能力和预测能力,分类效果明显。由于OrthoPLS-DA分析模型易出现过拟合,常采用如交叉检验(Cross-validation)、置换检验(Permutation test)或刀切法(Jackknife)来检验模型是否过拟合。本研究采用200次置换检验对模型进行验证(图5)。在置换检验验证中,R2-intercept和Q2-intercept两个参数用来检验OrthoPLS模型是否过拟合,经验表明,R2-intercept值不宜超过0.3~0.4,Q2-intercept不宜超过0.05。而对于OrthoPLS-DA模型是否过拟合,主要以Q2-intercept值为依据[18]。本研究中,18、28 ℃培养组置换检验(Permutation test)得到的R2-intercept和Q2-intercept值分别为0.607和-0.818。28、38 ℃培养组置换检验(Permutation test)得到的R2-intercept和Q2-intercept值分别为0.986和-0.252。从图5可见,两组中所有R2-intercept和Q2-intercept左边的点均低于右边的点,表明模型的预测能力大于任何一次随机排列y变量的预测能力,回归线的斜率也大于1,证明建立的两个OrthoPLS-DA模型没有出现过拟合。同时,对两个OrthoPLS-DA模型进行CV-ANOVA验证,p<0.001(分别为0.000 8和5.18×10-5),这说明采用OrthoPLS-DA模型筛选本研究中的差异代谢物具有统计学依据,可继续进行后续差异代谢物筛选。
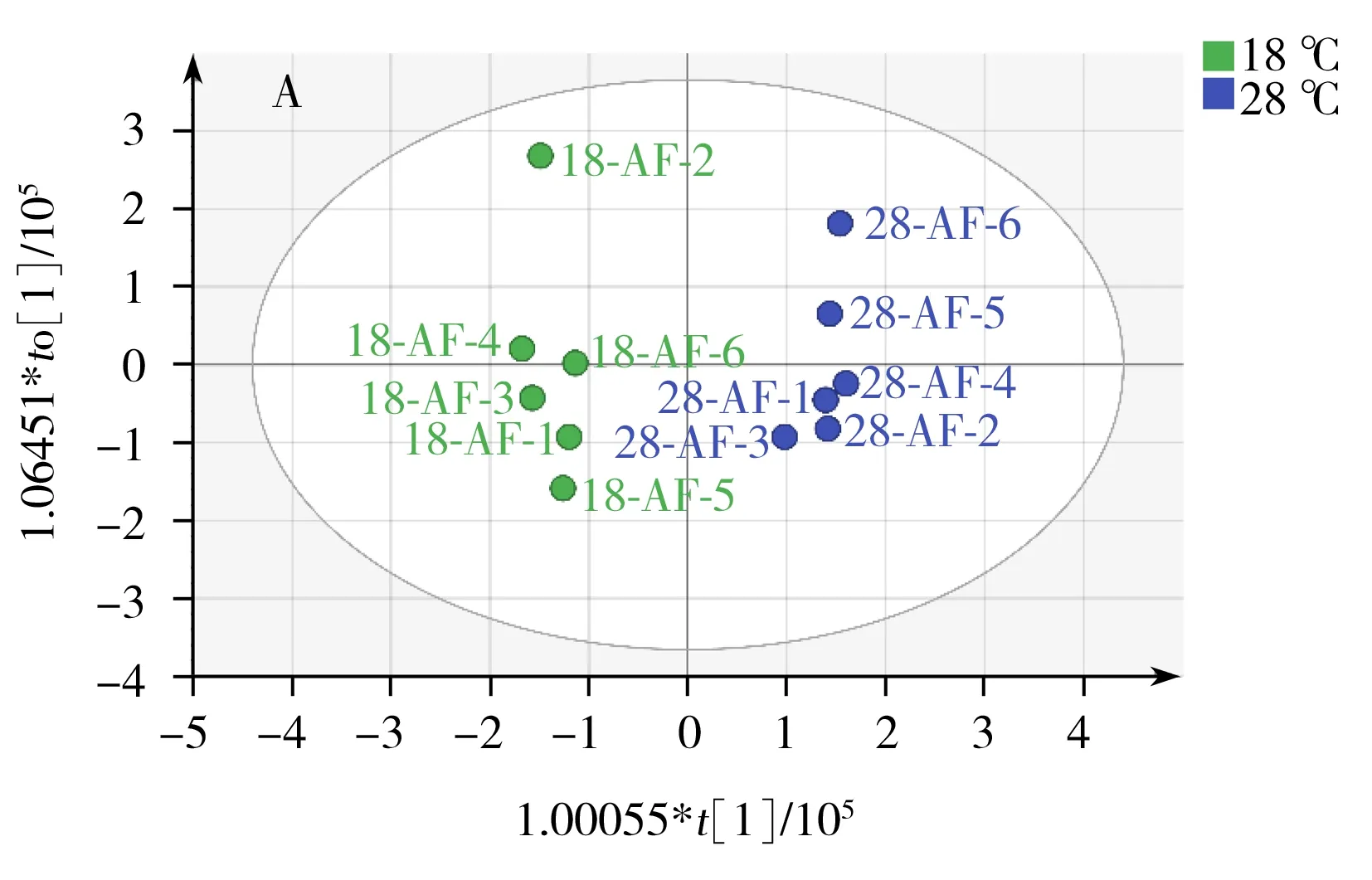

图3 18 ℃和28 ℃培养组的OrthoPLS-DA分析得分图(A)和差异化合物特征变量图(S-plot)(B)Fig.3 OrthoPLS-DA score plot of 18 ℃group and 28 ℃group(A) and the plot of feature importance(S-plot)(B)


图4 38 ℃和28 ℃培养组的OrthoPLS-DA分析得分图(A)和差异化合物特征变量图(S-plot)(B)
Fig.4 OrthoPLS-DA score plot of 38 ℃group and 28 ℃group(A) and the plot of feature importance(S-plot)(B)

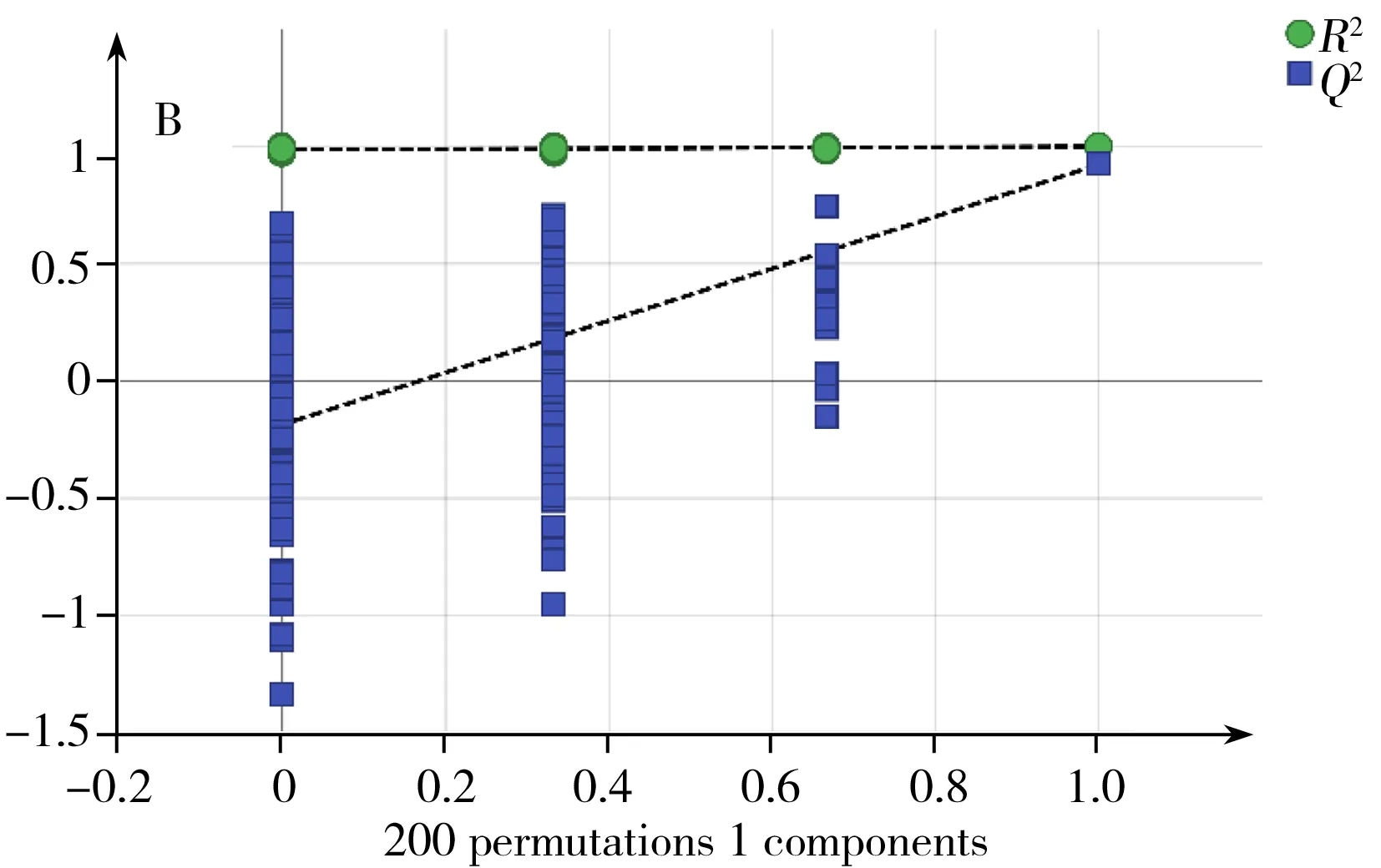
图5 18 ℃和28 ℃培养组(A)以及28 ℃和38 ℃培养组(B)的OrthoPLS-DA模型验证图Fig.5 OrthoPLS-DA permutationtest model validation plot of 18 ℃group and 28 ℃group(A) and 28 ℃group and 38 ℃group(B)
2.2.3潜在差异代谢物鉴定对重要特征变量进行选取,其中图3B和4B图中远离原点的化合物为差异显著的潜在的差异代谢物,同时以有统计学意义的变量(p<0.05)作为差异化合物判断标准,并通过MZcloud、Metlin和本地库等数据库进行二级质谱信息匹配及部分标准品验证,筛选出20个温度影响黄曲霉菌生理代谢的潜在差异代谢物(表1),其中缬氨酸、亮氨酸、苯丙氨酸、色氨酸、酪氨酸、硬脂酸、油酸、曲酸、黄匹阿尼酸、3a,3a′-二聚吡咯吲哚生物碱、黄曲霉毒素B1、黄曲霉毒素B2、氧甲基杂色曲霉毒素、降散盘衣酸、杂色曲菌素 B经过标品验证,对其相对含量进行了比较分析(图6)。

表1 温度影响黄曲霉菌生理代谢的潜在差异代谢物Table 1 Potential biomarkers of physiological metabolism of aspergillus flavus affected by temperature
(续表1)

Potentialbiomarkerst/minFormulaMassDaAdductionsKEGGIDMetabolicpathwayVariationtendencyDitryptophenaline(3a,3a′⁃二聚吡咯吲哚生物碱)13 69C42H40N6O4693 31838[M+H]+-Ditryptophenalinebiosynthesis18<28<38AflatoxinB1(黄曲霉毒素B1)9 97C17H12O6313 07066[M+H]+C06800Aflatoxinbiosynthesis18<28>38AflatoxinB2(黄曲霉毒素B2)9 51C17H14O6315 08631[M+H]+C16753Aflatoxinbiosynthesis18<28>38O⁃Methylsterigmatocystin(氧甲基杂色曲霉毒素)13 54C19H14O6339 08631[M+H]+C03944Aflatoxinbiosynthesis18<28<38Norsolorinicacid(降散盘衣酸)17 60C20H18O7369 09797[M-H]-C20452Aflatoxinbiosynthesis18<28<38VersicolorinB(杂色曲菌素B)16 14C18H10O7337 03537[M-H]-C20583Aflatoxinbiosynthesis18<28<38
-:no data





图6 3个温度条件下20个潜在差异代谢物的相对含量比较Fig.6 The relative content comparison of 20 potential differential metabolites under the 18,28,38 ℃
2.2.4潜在差异代谢物的代谢通路分析利用MBROLE 2.0[19]对鉴定的潜在差异代谢物进行代谢通路分析,结合表1和图6A、B、C可看出,各潜在差异代谢物变化趋势如下:18 ℃相较于28 ℃组,三羧酸循环中的苹果酸、柠檬酸,脂肪酸生物合成中的软脂酸(Palmitic acid)和硬脂酸(Stearic acid),油酸(Oleic acid)和亚油酸(Linoleic acid),缬氨酸(Valine),亮氨酸(Leucine),苯丙氨酸(Phenylalanine),色氨酸(Tryptophan),络氨酸(Tyrosine)下调。其中色氨酸是必需氨基酸,在生物体中起着至关重要的作用,在能量代谢中是蛋白质合成或分解的中间体。这些化合物的下调说明低温抑制了黄曲霉菌的能量代谢,同时也降低了对黄曲霉毒素合成[20]提供乙酰辅酶A等前体化合物反应原料供应。从图6D、E可以发现,低温显著下调了黄曲霉毒素B1、B2、黄匹阿尼酸、曲酸、3a,3a′-二聚吡咯吲哚生物碱等次生代谢物。黄匹阿尼酸的生物合成[21]前体物质包括色氨酸,而色氨酸的下调导致黄匹阿尼酸的合成下调。此外,经过标品鉴定的黄曲霉毒素生物合成路径上的前体物质降散盘衣酸、杂色曲菌素 B在低温18 ℃下都实现了下调,但并未完成阻断。推测原因如下:低温(18 ℃)降低了黄曲霉毒素生物合成路径上的合成酶活性;低温(18 ℃)使黄曲霉菌三羧酸循环,脂肪酸合成,必须氨基酸等与能量代谢路径有关的化合物下调,而能量代谢可产生乙酰辅酶A,该化合物才可进一步合成丙二酰辅酶A和黄曲霉毒素生物合成路径上的首个稳定的前体物质降散盘衣酸。从图6C可见,高温38 ℃相比于28 ℃培养条件,黄曲霉初生代谢三羧酸循环中的苹果酸、柠檬酸、琥珀酸相继下调,但下调幅度较18 ℃和28 ℃组小。说明高温稍微抑制了黄曲霉菌的呼吸代谢,降低了为黄曲霉毒素生物合成前体原料。从图6A、B、C可见,缬氨酸、亮氨酸、苯丙氨酸、色氨酸、络氨酸代谢,脂肪酸生物合成中的软脂酸和硬脂酸,油酸和亚油酸,碳代谢中的山梨醇、木糖醇相继上调。说明温度的升高提升了黄曲霉菌碳代谢、脂肪生物合成等路径中酶活性,温度促进了这些代谢中的酶促反应,从而使黄曲霉生成更多的脂质并进行生物质积累,这与Elmer[22]等的研究结果相似。在次生代谢方面,从图6D、E可见,升温使黄匹阿尼酸出现上调,3a,3a′-二聚吡咯吲哚生物碱也出现上调,曲酸和黄曲霉毒素B1,B2在38 ℃出现显著下调,但前体化合物降散盘衣酸、杂色曲菌素B、氧甲基杂色曲霉素却上调,原因可能是:38 ℃条件下抑制了黄曲霉毒素合成路径上从氧甲基杂色曲霉毒素转化到黄曲霉毒素的酶的活性。特别地,温度调控黄曲霉毒素和黄匹阿尼酸的生物合成的结果与Yu等[23]转录组研究结果相吻合,高温使黄曲霉毒素的重要调控因子AflR和AflS出现下调,从而使黄曲霉毒素的合成量降低。总而言之,温度调控了三羧酸循环、脂肪酸等初生代谢途径,并影响黄曲霉毒素、黄匹阿尼酸、曲酸等次生代谢物生物合成路径酶活性。这一研究结果从代谢水平上对影响黄曲霉菌生长和产毒的重要非生物因子——温度如何调控黄曲霉菌生长和产毒素机制有了更深的理解。
3 结 论
本研究利用非靶标代谢组方法研究了18、28、38 ℃ 3个温度条件对黄曲霉菌生理代谢机制的影响。共鉴定出20个温度显著调控黄曲霉菌生理代谢的潜在差异代谢物,发现温度主要影响三羧酸循环、脂肪酸生物合成、糖代谢和氨基酸代谢等能量代谢通路以及黄曲霉毒素、曲酸、黄匹阿尼酸、3a,3a′-二聚吡咯吲哚生物碱等次生代谢通路。表明温度通过影响上述代谢通路调控黄曲霉菌的生长和产生黄曲霉毒素、曲酸、黄匹阿尼酸等次生代谢物。这些差异代谢物为黄曲霉毒素风险评估研究提供了候选参考目标,为黄曲霉毒素分子预警提供了新的分析方法。
[1] Roze L V,Hong S Y,Linz J E.AnnualReviewofFoodScienceandTechnology,2013,4:293-311.
[2] Khaldi N,Seifuddin F T,Turner G,Haft D,Nierman W C,Wolfe K H,Fedorova N D.FungalGeneticsandBiology,2010,47(9):736-741.
[3] Chanda A,Roze L V,Kang S,Artymovich K A,Hicks G R,Raikhel N V,Calvo A M,Linz J E.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2009,106(46):19533-19538.
[4] Bayram O,Krappmann S,Ni M,Bok J W,Helmstaedt K,Valerius O,Braus-Stromeyer S,Kwon N J,Keller N P,Yu J H,Braus G H.Science,2008,320(5882):1504-1506.
[5] Kong H W,Dai W D,Xu G W.Chin.J.Chromatogr.(孔宏伟,戴伟东,许国旺. 色谱),2014,32(10):1052-1057.
[6] Rubert J,Zachariasova M,Hajslova J.FoodAddit.Contam.,2015,32(10):1685-1708.
[7] Nielsen K F,Larsen T O.FrontiersinMicrobiology,2015,6:71.
[8] Arroyo-Manzanares N,Di Mavungu J D,Uka V,Malysheva S V,Cary J W,Ehrlich K C,Vanhaecke L,Bhatnagar D,De Saeger S.FoodAdditives&ContaminantsA,2015,32(10):1656.
[9] Smart K F,Aggio R B,Van Houtte J R,Villas-Boas S G.NatureProtocols,2010,5(10):1709-1729.
[10] Xia J G,Sinelnikov I V,Han B,Wishart D S.NucleicAcidsRes.,2015,43(W1):W251-W257.
[11] Tautenhahn R,Patti G J,Rinehart D,Siuzdak G.Anal.Chem.,2012,84(11):5035-5039.
[12] Godzien J,Alonso-Herranz V,Barbas C,Armitage E G.Metabolomics,2015,11(3):518-528.
[13] Naz S,Vallejo M,Garcia A,Barbas C.J.Chromatogr.A,2014,1353:99-105.
[14] Dunn W B,Wilson I D,Nicholls A W,Broadhurst D.Bioanalysis,2012,4(18):2249-2264.
[15] Dunn W B,Broadhurst D,Begley P,Zelena E,Francis-McIntyre S,Anderson N,Brown M,Knowles J D,Halsall A,Haselden J N,Nicholls A W,Wilson I D,Kell D B,Goodacre R.NatureProtocols,2011,6(7):1060-1083.
[16] Engskog M K R,Haglof J,Arvidsson T,Pettersson C.Metabolomics,2016,12(7):114.
[17] Zhang Y X,Yang X,Xie B J,She Y X,Du P F,Zou P,Jin F,Jin M J,Shao H,Wang S S,Zheng L F,Wang J.J.Instrum.Anal.(张艳欣,杨鑫,谢冰洁,佘永新,杜鹏飞,邹攀,金芬,金茂俊,邵华,王珊珊,郑鹭飞,王静.分析测试学报),2016,35(5):501-507.
[18] Eriksson L.Multi-andMegavariateDataAnalysis.3nd ed.Byrne T,Johansson E,Trygg J,Vikstrom C.Sweden:Umetrics Inc,2013:422.
[19] Lopez-Ibanez J,Pazos F,Chagoyen M.NucleicAcidsRes.,2016,44(W1):W201-W204.
[20] Yu J J,Chang P K,Ehrlich K C,Cary J W,Bhatnagar D,Cleveland T E,Payne G A,Linz J E,Woloshuk C P,Bennett J W.Appl.Environ.Microbiol,2004,70(3):1253-1262.
[21] Seshime Y,Juvvadi P R,Tokuoka M,Koyama Y,Kitamoto K,Ebizuka Y,Fujii I.Bioorganic&MedicinalChem.Lett.,2009,19(12):3288-3292.
[22] Shih C N,Elmer H M.ZLebensmUnters.-Forsch.,1975,158:215-224.
[23] Yu J J,Fedorova N D,Montalbano B G,Bhatnagar D,Cleveland T E,Bennett J W,Nierman W C.FEMSMicrobiolLett.,2011,322(2):145-149.
Study on Effects of Temperature on Metabolism of Aspergillus Flavus Based on Untargeted Metabolomics
XIE Hua-li1,2,3,4,LI Pei-wu1,2,3,4,5*,WANG Xiu-pin1,3,4,5*,ZHANG Qi1,2,3,4,ZHANG Liang-xiao1,3,4,5,WANG Tong1,2,3,ZHANG Wen1,2,3,5,WANG Xue-fang1,2,3,5
(1.Oil Crops Research Institute of the Chinese Academy of Agricultural Science,Wuhan 430062,China;2.Key Laboratory of Biology and Genetic Improvement of Oil Crops,Wuhan 430062,China;3.Ministry of Agriculture,Key Laboratory of Detection for Mycotoxins,Wuhan 430062,China;4.Ministry of Agriculture,Laboratory of Risk Assessment for Oilseeds Products,Wuhan 430062,China;5.Ministry of Agriculture,Quality Inspection and Test Center for Oilseeds Products,Ministry of Agriculture,Wuhan 430062,China )
A method of non-targeted metabolomics coupled to ultra-high performance liquid chromatography- high resolution mass spectrometry was used to investigating effect of temperature on the metabolism of aspergillus flavus. Multivariate statistical analysis on the metabolomics data was carried out by using chemometric methods of OrthoPLS-DA(alternative partial least squares discriminant analysis) etc. The metabolism characteristics of aspergillus flavus were identified by MS/MS and library searching. In the study,the non-targeted metabolomics analytical method was validated by using internal standard and pooled quality control samples. The method was applied to investigate the effect of temperature on the metabolome of aspergillus flavus,and 3 593(T-test,p<0.01) differential metabolites were found under different temperature conditions. Twenty candidate biomarkers were screened out. The results showed that temperature significantly affected the biosynthetic pathways of tricarboxylic acid cycle,fatty acid,phenylalanine,tryptophan and tyrosine,and regulated the secondary metabolites biosynthetic pathway enzymesactivity of aflatoxin,cyclopiazonic acid and kojic acid. This study provide a new insight for risk assessment and early warning research of aflatoxin in China.
aspergillus flavus;metabolomics;high-resolution mass spectrum;aflatoxins biosynthesis;temperature
2017-02-08;
2017-08-17
国家自然科学基金(31640062);国家农产品质量安全风险评估重大项目;国家粮食行业科研专项(201513006)
*
李培武,研究员,研究方向:农产品质量与食物安全,Tel:027-86812943,E-mail:peiwuli@oilcrops.cn 王秀嫔,副研究员,研究方向:农产品质量安全检测技术,E-mail:xiupinwang@163.com
10.3969/j.issn.1004-4957.2017.11.003
O657.63
A
1004-4957(2017)11-1304-09
