谷胱甘肽S-转移酶基因在B型烟粉虱寄主转换中的差异比较
2017-11-29张友军
何 超, 谢 文, 张友军*
(1.湖南农业大学植物保护学院, 长沙 410128; 2. 中国农业科学院蔬菜花卉研究所, 北京 100081)
谷胱甘肽S-转移酶基因在B型烟粉虱寄主转换中的差异比较
何 超1,2, 谢 文2, 张友军2*
(1.湖南农业大学植物保护学院, 长沙 410128; 2. 中国农业科学院蔬菜花卉研究所, 北京 100081)
烟粉虱是一种世界性的重大农业害虫,其寄主范围十分广泛,对农作物危害严重。为研究GST基因家族在B型烟粉虱寄主转换中的响应机制,本文首先通过分析B型烟粉虱寄主转换后,23个GST基因表达量的变化,然后利用转录组数据、PCR、克隆、测序得到GST7基因全长,最后对GST7基因进行生物信息学分析。结果表明:烟粉虱GST7和GST13在辣椒寄主上的表达量与在原始寄主棉花上有显著差异,且GST7表达量上升了2.31倍;生物信息学分析结果显示GST7基因的开放阅读框全长657 bp,编码219个氨基酸,没有信号肽,没有跨膜结构,理论等电点pI为4.81,其分子量为25.07 kD,系统发育树分析表明GST7基因属于Delta亚家族。本研究发现GST7基因在烟粉虱适应不适寄主植物中起到一定作用,为将来RNAi研究GST7基因的功能奠定了基础。
烟粉虱; 基因克隆; 序列分析
烟粉虱Bemisatabaci(Gennadius)属于半翅目,粉虱科,小粉虱属,是一种世界性的农业害虫,对农业生产造成了巨大的损失[1]。烟粉虱主要是通过刺吸寄主植物韧皮部、分泌蜜露、传播植物型病毒对农作物造成危害[2-3]。烟粉虱是一个复合种,现在已经报道的至少有36个隐种,而且其寄主范围非常广泛,可以取食900多种植物[4-7]。Middle East-Asia Minor1(B型)和Mediterranean(Q型)是入侵性最强和危害农作物最严重的2个烟粉虱隐种。20世纪90年代末,B型烟粉虱在我国被发现,并成为危害我国很多经济作物的主要害虫[8-10]。烟粉虱在不同寄主植物上适合度差异很大,很可能与烟粉虱对不同植物的次生代谢产物的耐受性有关,很多研究是从昆虫三大解毒酶(P450、GST、CCE)的生化和分子响应为切入点而开展工作[11-13]。如2008年,安志兰测定了B型烟粉虱(羧酸酯酶、乙酰胆碱酯酶和谷胱甘肽S-转移酶)在棉花、一品红、茄子和番茄4种寄主植物上的酶活力,结果表明B型烟粉虱茄子种群谷胱甘肽S-转移酶活性最高[14];2009年,宋月芹通过离体酶活性测定表明甜菜夜蛾取食寄主植物后,体内磷酸酯酶、谷胱甘肽S-转移酶和乙酰胆碱酯酶活性均发生变化[15];2014年,Mohammed Shabab报道GST16参与了植物生长素的解毒[16]。然而,目前还没有通过荧光定量PCR的方法分析烟粉虱在寄主转换中GST基因mRNA表达量的变化报道。
谷胱甘肽S-转移酶(glutathioneS-transferases,GSTs)是一种多功能氧化酶,通过三肽谷胱甘肽(tri-peptide glutathione,GSH)与底物相结合,增加产物的溶解性,从而更好地排出体外,降低有毒物质对生物体产生的影响[17-18]。B型烟粉虱能在甘蓝上很好地生长,而辣椒是一种不适宜的寄主[19]。对于这种现象,GSTs是否在其中起到关键作用还未见报道。本文通过分析B型烟粉虱在3种不同寄主(棉花、辣椒、甘蓝)上23个GSTs基因表达量差异,进一步通过生物信息学方法和原核表达的方法来确定是否GST7在B型烟粉虱寄主适应性中起到了一定的作用,为以后进一步研究GSTs与烟粉虱寄主适应性提供理论依据。
1 材料与方法
1.1 试验材料
B型烟粉虱为2004年采自中国农业科学院蔬菜花卉研究所北圃场基地的甘蓝(‘京丰1号’)上,后转移到棉花(‘中棉49’)上长期饲养,室内连续饲养超过150代,期间从未接触过任何化学农药,烟粉虱在L∥D=14 h∥10 h光周期、温度为24~26℃、相对湿度50%~70%的条件下继代饲养;每2~3个月检测一次,看是否被其他烟粉虱污染。试验中用到的寄主植物棉花(‘中棉49’)、甘蓝、辣椒(‘中椒4’)单独种在12 cm的营养钵里面,选择大小基本一致(高30 cm)的植株进行试验。
1.2 主要试剂
Trizol试剂(Trizol Reagent,北京生化科技有限公司);DNA胶回收试剂盒(Gel Extraction Kit北京全式金生物技术有限公司);反转录试剂盒(PrimeScriptTM1stStrand cDNA Synthesis Kit,TaKaRa);TaqQ5酶(New England Biolabs);载体T1(北京全式金生物技术有限公司);感受态细胞(北京全式金生物技术有限公司);实时荧光定量PCR试剂(TransStart Green QpcrSupermix UDG,北京全式金生物技术有限公司);SDS-PAGE(北京康为世纪生物科技有限公司)。
1.3 B型烟粉虱在3种不同寄主上转换
随机挑选大小相似的棉花、甘蓝、辣椒植株放在无虫笼中(60 cm×60 cm×60 cm),一共9个无虫笼,每个无虫笼里放一株植株,棉花、甘蓝、辣椒3种寄主各3个重复;试验中B型烟粉虱都来源于棉花虫源,每次从棉花上取100头不分性别的烟粉虱成虫放到一个无虫笼中,直到9个无虫笼都有烟粉虱,释放烟粉虱时,让烟粉虱自然飞到寄主上,烟粉虱取食48 h后,收集试虫立即放入液氮中,-80℃保存,供后续RNA提取。
1.4 烟粉虱总RNA的提取、cDNA的合成以及荧光定量PCR
RNA抽提采用Trizol方法,首先将已经收集好的试虫(每个重复大约70头)放入匀浆器中再加入1 mL Trizol快速研磨,然后用氯仿去除蛋白质等杂质,用75%乙醇洗涤,最后用无RNA酶的水进行溶解。对提取的RNA进行琼脂糖凝胶电泳,检测其完整性,选取OD260/OD280值在2.0附近的RNA用DNA酶(TaKaRa,Japan)处理以去除包含的基因组DNA,再进行第一链和第二链cDNA的合成(Prime Script first-strand cDNA synthesis kit,TaKaRa, Japan),cDNA定量到1 μg,于-20℃保存备用。
荧光定量PCR引物参照表1,荧光定量PCR反应体系是:1 μL cDNA,10 μL TransStart®Green qPCR SuperMix UDG (TransGen, China),引物0.4 μL,加超纯水至20 μL。Real-time PCR的反应程序为94℃预变性600 s, 接下来40个循环 95℃变性5 s,60℃退火 15 s,72℃延伸34 s(收集荧光信号);无RNA酶和无cDNA模板对照分别为了检验试验中是否有基因组DNA的污染和引物二聚体的存在,以保证引物的扩增效率;相对定量的分析方法采用2-△△Ct[20],选用HSP90和RPL29作为内参基因[21]。
表1荧光定量PCR所用GSTs基因及引物信息
Table1GeneandprimerofGSTsforreal-timePCR

基因Gene正向引物(5′⁃3′)Forwardprimer(5′⁃3′)反向引物(5′⁃3′)Reverseprimer(5′⁃3′)大小/bpLength基因登录号Accessionno.GST1TCTTTCCTCAAAATGAACCCGCATTCTTGTTTTTGCCGTATTTGTTGG119MF036015GST2GGCAAGGAAGACTCTCAATACCCAGTCACCGAACCGCTGGTAGAGT103MF036016GST3CAGGTCCTAAGTTCACACTGGCGCATTTTCTGGCTTCGGTCGGA125MF036017GST4AAGGCCACGATGAGGTGAAATCACGAGTGCAACATCAGCT123MF036018GST5ACCTGGCCAACGAGTACATGCACCTGCAAACATGAACGGG150MF036019GST6GGTGGACCAAGCACTGGATTTTAGATTTAGACACTTTTTGGAACCG124MF036020GST7TTGCCTCTCGGTTGTCTTGCTCGAATCCGCTGTCGTCCAAAC149MF036021GST8AGCAGGGATGACCTTCACGATAGTCTCTGCTTTGATTAAACCACCT123MF036022GST9CGAAAGGAGAACAAATGACCCCATGATGGCACGACTCTCTGTTAGA106MF036023GST10TGGTGATTTACCCGTAGACGAGGACCACGAGAGTGACATCAGCAACA131MF036024GST11GACAATGGGTTCTACCTGTGGGACGATTGCTCGTTTTTTAGGGTCT109MF036025GST12CCGCAAAACTGATTGGTGTGGTTGGAACCGTGTGCTGTGGATT108MF036026GST13ACTTCCCCATCCGAGGTCTTGAAGGGCGTGGTTGGCTTTATT121MF036027GST14ATGCCAAAAAATGTGGTCTCGTAAATAGGTTGAAATAGCTTGACGC106MF036028GST15CCGCAATGAAACCAAAAACTCCTTTTCCCAGTCATCTTCGCCAG136MF036029GST16GCGACTGGAGAAGCAAGTGAAAGGGGTGTTTTTCCTCCACGGTAAG135MF036030GST17TTGAAAGGTGCTGGCGAAACAACCATCAACTTCCAAAACGGG147MF036031GST18GTCGTTCATCAATCGCTGGCGTTCTTGGTGGTAGGCCCTC148MF036032GST19GCGGTATTCAGCCATTACAAAACGTATCTCCGAAGCAGTACTTCCCTG150MF036035GST20GCACTGGATTCAAAGAGGGCTTGGAATCTGCGAGCACTGAAG135MF036033GST21AGTTTCCTGCTGGCACTGTTCCTAAGGGGGTCAGATGAGTGTAGGC125MF036034GST22GAAGGGCTCACCAGAACGATGTGTGAACTATGCGCGCAAT136MF036036GST23CGAAGGGCTCATCTCAACGATGTGTGGAGGTATCGGGCTA138MF036037RPL29TCGGAAAATTACCGTGAGGAACTTGTGATCTACTCCTCTCGTG144HSP90ATCGCCAAATCTGGAACTAAAGCGTGTTTTGAGACGACTGTGACGGT135
1.5 基因的克隆与序列分析
采用上述合成的cDNA为模板,利用特异性引物GST7-F:ATGGATTTGTACTACTATC和GST7-R:AATTAGCTGACATCAATGGCTAA扩增GST7的全长。反应体系为:cDNA模板1 μL,5×PCR buffer 5 μL,dNTP 0.5 μL上下游引物各1.25 μL,Q5 DNA聚合酶0.25 μL,然后超纯水补足25 μL,PCR扩增条件:98℃预变性30 s;98℃10 s,60℃退火25 s,72℃延伸30 s, 35个循环;最后总延伸2 min。扩增产物用1.5%的琼脂糖凝胶电泳检测,然后胶回收目的片段,回收的扩增片段连接到T1载体上(按照说明书操作)再转化到感受态大肠杆菌中,经过蓝白斑与抗生素筛选,随机挑取多个白色菌落扩大培养,选取PCR鉴定呈阳性的克隆菌液送至北京擎科生物技术有限公司进行测序分析。得到序列后,利用DNAMAN6进行序列的比对,采用ExPAsyProtemics Server(http:∥cn.expasy.org/tools/pi_tool.ttml)预测蛋白质的理化性质。用SignalP 4.1 软件(http:∥www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,跨膜结构域的预测利用TMHMN2.0(http:∥www.cbs.dtu.dk/services/TMHMM-2.0/),采用MEGA6.0软件邻接法(Neighbor-joining)构建系统发育树,各分支均进行1 000次重复检验,基因结构图通过BLASTN比对B型烟粉虱基因组(http:∥www.whiteflygenomics.org/cgi-bin/bta/index.cgi)。
1.6 数据分析
各个寄主处理间,GSTs基因mRNA表达量差异采用单因素方差分析(ANOVA),平均数的多重比较采用图基检测(Tukey test),显著性水平P<0.05,数据处理软件为SPSS19.0。
2 结果与分析
2.1 GSTs基因在各寄主上表达量的变化
荧光定量PCR结果表明:GST7、GST13、GST10和GST18在辣椒、甘蓝寄主上的表达量相对于棉花寄主有显著差异,其中GST7表达量上升了2.31倍,GST13下降了60%,GST10和GST18分别下降了55%和0.53%,GST14则升高了1.52倍(图1)。

图1 23个GST基因在3种寄主上的表达量差异Fig.1 Expression levels of 23 GST genes in three hosts
2.2 B型烟粉虱GST7全长序列分析
GST7基因ORF序列长657 bp,编码219个氨基酸(图2a、b);进一步通过生物信息学分析发现,GST7没有信号肽,没有跨膜结构,理论等电点pI为4.81,其分子量为25.07 kD;另外,通过比对B型烟粉虱基因组序列,发现GST7基因在Scaffold 147上,有5个外显子,4个内含子,内含子大小分别为:1 693、1 119、1 321、552 bp(图2C)。

图2 GST7的序列分析Fig.2 Analysis of GST7 sequence
2.3 烟粉虱GST7基因系统发育树分析
将GST7推导出来的氨基酸序列与NCBI已公布的其他昆虫GST序列(果蝇、丽蝇蛹集金小蜂、豌豆长管蚜、长红锥蝽)进行序列比对,然后用MEGE6.0软件中的邻接法进行系统发育树构建,结果表明,谷胱甘肽S-转移酶一共有6个亚家族(Delta、Epsilon、Theta、Zeta、Omega、Sigma),B型烟粉虱GST7基因属于Delta亚家族,与DmGSTd11、RpGSTd1和NvGSTd5聚为一支(图3)。
3 讨论
谷胱甘肽S-转移酶作为第二阶段解毒的关键酶,在昆虫的生长发育中起着关键的解毒作用,包括对外源物质、内源物质的解毒,以及保护自身自由基的氧化作用[22-24]。杂食性昆虫一般会利用自己的解毒系统去适应广泛的寄主植物,尤其是代谢寄主植物的次生代谢物质[26],且通过特异解毒酶系的改变而与寄主植物相互适应协同进化[27]。烟粉虱寄主非常广泛,可取食900多种植物[25]。为明确烟粉虱谷胱甘肽S-转移酶基因家族在烟粉虱寄主适应中尤其是寄主转换中的作用,本文通过研究B型烟粉虱23个谷胱甘肽S-转移酶基因表达量在3种寄主中的变化差异,发现烟粉虱GST7和GST13在辣椒这种不适宜寄主上的表达量相对于在原始适宜寄主棉花上的表达量都有显著差异,且GST7表达量上升了2.31倍(图1),GST7的诱导表达可能表明GST7基因在B型烟粉虱适应辣椒这种不适宜的寄主过程中会起到一定的作用。一般认为,当昆虫遇到新的植物次生代谢物质时,昆虫体内的解毒酶活性会增加以适应不利的环境条件。2011年,周奋启等通过酶活力的测定表明,取食黄瓜的与取食苘麻、番茄、茄子的B型烟粉虱种群,其谷胱甘肽S-转移酶(GSTs)活力之间存在显著性差异[29];2015年,Halon利用荧光定量PCR和原核表达等手段研究表明BtGST2在烟粉虱适应寄主中起到关键的作用[11];2016年,Zou等报道谷胱甘肽S-转移酶SlGSTE1可能在寄主适应中起到一定的作用[30],对比本文研究,都表明谷胱甘肽S-转移酶在昆虫适应寄主中的次生代谢物质有重要作用。
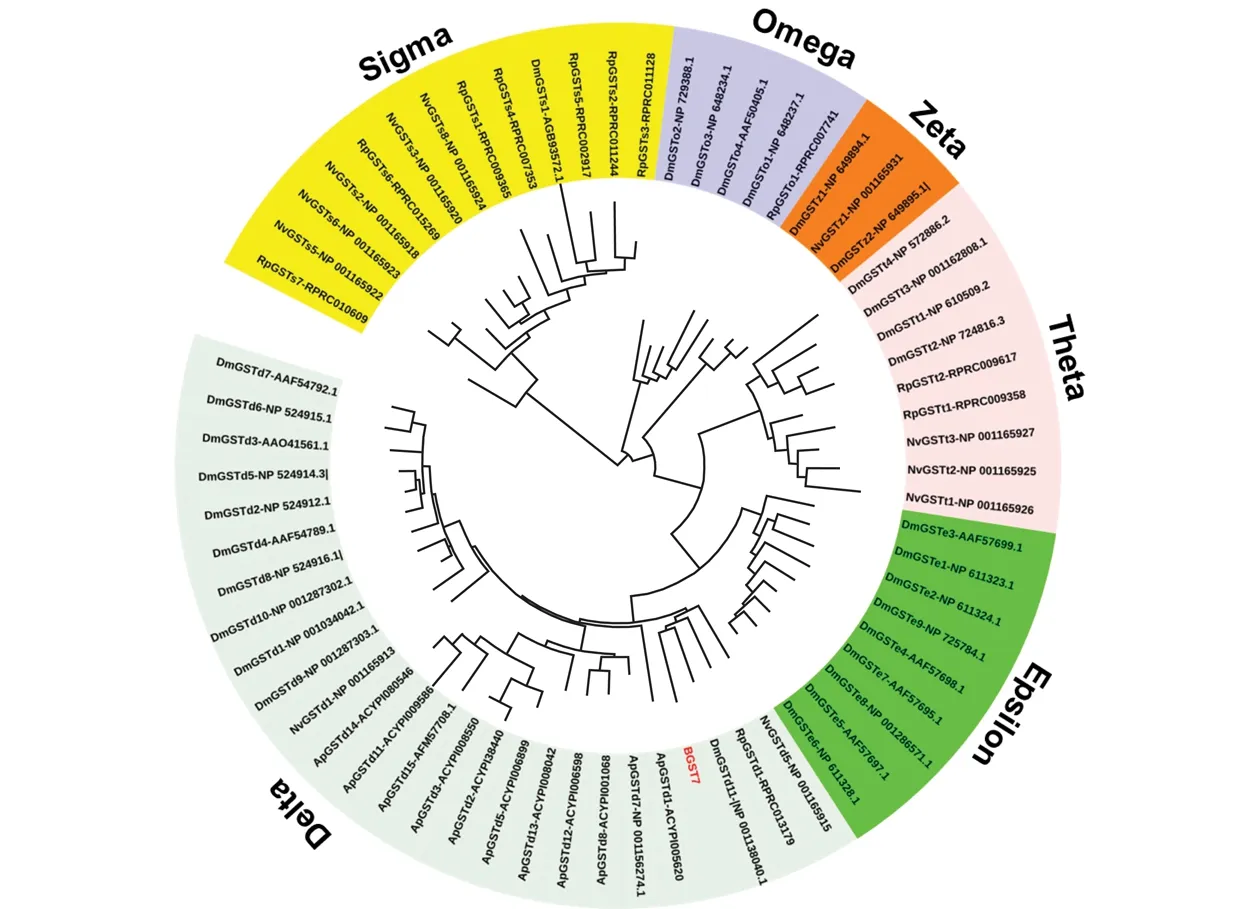
图3 B型烟粉虱GST7与其他物种GST基因系统发育进化树构建分析(邻接法)Fig.3 Phylogenetic analysis of GST7 in B type of Bemisia tabaci with other insect GST genes based on amino acid sequences (neighbor-joining method)
昆虫Delta亚家族在面对环境的选择压力中扮演着重要的作用[31],让昆虫更好地去适应各种寄主植物的次生代谢物质,而本研究发现的烟粉虱最重要的响应诱导基因GST7就属于昆虫特有的Delta亚家族(图3)。
[1] Gnankine O,Mouton L,Savadogo A,et al. Biotype status and resistance to neonicotinoids and carbosulfan inBemisiatabaci(Hemiptera:Aleyrodidae) in Burkin Faso, West Africa [J].International Journal of Pest Management,2013,59(2):95-102.
[2] Brown J K, Frohlich D R, Rosell R C.The sweetpotato or silverleaf whiteflies: biotypes ofBemisiatabacior a species complex?[J].Annual Review of Entomology,1995,40(1):511-534.
[3] Jones D R.Plant viruses transmitted by whiteflies [J]. European Journal of Plant Pathology, 2003, 109(3): 195-219.
[4] Dinsdale A, Cook L, Riginos C, et al. Refined global analysis ofBemisiatabaci(Hemiptera: Sternorrhyncha: Aleyrodoidea: Aleyrodidae) mitochondrial cytochrome oxidase 1 to identify species level genetic boundaries [J]. Annals of the Entomological Society of America, 2010, 103(2): 196-208.
[5] De Barro P J, Liu S S, Boykin L M, et al.Bemisiatabaci: a statement of species status [J]. Annual Review of Entomology, 2011, 56: 1-19.
[6] Esterhuizen L L, Mabasa K G, van Heerden S W, et al. Genetic identification of members of theBemisiatabacicryptic species complex from South Africa reveals native and introduced haplotypes [J]. Journal of Applied Entomology, 2013, 137(1-2): 122-135.
[7] Barbosa L F, Marubayashi J M, De Marchi B R, et al. Indigenous American species of theBemisiatabacicomplex are still widespread in the Americas[J]. Pest Management Science, 2014, 70(10): 1440-1445.
[8] Chu Dong, Wan Fanghao, Zhang Youjun, et al. Change in the biotype composition ofBemisiatabaciin Shandong Province of China from 2005 to 2008 [J]. Environmental Entomology, 2010, 39(3): 1028-1036.
[9] Pan H, Chu D, Ge D, et al. Further spread of and domination byBemisiatabaci(Hemiptera: Aleyrodidae) biotype Q on field crops in China[J]. Journal of Economic Entomology, 2011, 104(3): 978-985.
[10] 罗晨, 姚远, 王戎疆, 等. 利用mtDNA COI 基因序列鉴定我国烟粉虱的生物型[J].昆虫学报, 2002, 45(6): 759-763.
[11] Halon E, Eakteiman G, Moshitzky P, et al. Only a minority of broad-range detoxification genes respond to a variety of phytotoxins in generalistBemisiatabacispecies [J]. Scientific Reports, 2015, 5:17975.
[12] Deng P, Chen Longjia, Zhang Zonglei, et al. Responses of detoxifying, antioxidant and digestive enzyme activities to host shift ofBemisiatabaci(Hemiptera: Aleyrodidae) [J]. Journal of Integrative Agriculture, 2013, 12(2): 296-304.
[13] Xu Hongxing, Hong Yue, Zhang Minzhu, et al. Transcriptional responses of invasive and indigenous whiteflies to different host plants reveal their disparate capacity of adaptation [J]. Scientific Reports, 2015, 5:10774.
[14] 安志兰, 褚栋, 郭笃发, 等. 寄主植物对 B 型烟粉虱(Bemisiatabaci)几种主要解毒酶活性的影响[J]. 生态学报, 2008, 28(4): 1536-1543.
[15] 宋月芹, 孙会忠, 李涛, 等. 不同寄主植物对甜菜夜蛾解毒酶活性的影响[J]. 中国农学通报, 2009, 25(19): 203-205.
[16] Shabab M, Khan S A, Vogel H, et al. OPDA isomeraseGST16 is involved in phytohormone detoxification and insect development [J]. FEBS Journal, 2014, 281(12): 2769-2783.
[17] Ranson H, Paton M G, Jensen B, et al. Genetic mapping of genes conferring permethrin resistance in the malaria vector,Anophelesgambiae[J]. Insect Molecular Biology, 2004, 13(4): 379-386.
[18] Enayati A A, Ranson H, Hemingway J. Insect glutathione transferases and insecticide resistance [J]. Insect Molecular Biology, 2005, 14(1): 3-8.
[19] Jiao Xiaoguo, Xie Wen, Guo Litao, et al. Differing effects of cabbage and pepper on B and Q putative species ofBemisiatabaci[J]. Journal of Pest Science, 2014, 87(4): 629-637.
[20] Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR [J]. Nucleic Acids Research, 2001, 29(9): e45-e45.
[21] Li Rumei, Xie Wen, Wang Shaoli, et al. Reference gene selection for qRT-PCR analysis in the sweetpotato whitefly,Bemisiatabaci(Hemiptera: Aleyrodidae) [J]. PLoS ONE, 2013, 8(1): e53006.
[22] Mannervik B, Helena Danielson U, Ketterer B.Glutathione transferases—structure and catalytic activity [J]. CRC Critical Reviews in Biochemistry, 1988, 23(3): 283-337.
[23] Francis F, Vanhaelen N, Haubruge E.GlutathioneS-transferases in the adaptation to plant secondary metabolites in theMyzuspersicaeaphid [J]. Archives of Insect Biochemistry and Physiology, 2005, 58(3): 166-174.
[24] Yang X, He C, Xie W, et al. GlutathioneS-transferases are involved in thiamethoxam resistance in the field whiteflyBemisiatabaciQ (Hemiptera: Aleyrodidae) [J]. Pesticide Biochemistry and Physiology, 2016.
[25] Boykin L M, De Barro P J. A practical guide to identifying members of theBemisiatabacispecies complex: and other morphologically identical species [J]. Frontiers in Ecology and Evolution, 2014, 2: 45.
[26] Brattsten L B, Wilkinson C F, Eisner T.Herbivore-plant interactions: mixed-function oxidases and secondary plant substances [J]. Science, 1977, 196(4296): 1349-1352.
[27] Lindroth R L. Host plant alteration of detoxication activity inPapilioglaucusglaucus[J]. Entomologia Experimentalis et Applicata, 1989, 50(1): 29-35.
[28] Hayes J D, Flanagan J U, Jowsey I R.Glutathione transferases[J].Annual Review of Pharmacology and Toxicology, 2005, 45: 51-88.
[29] 周奋启,陆艳艳,姚远,等.不同寄主植物对B型烟粉虱种群保护酶和解毒酶的影响[J].江苏农业学报,2011,27(1):57-61.
[30] Zou Xaopeng, Xu Zhibin, Zou Haiwang, et al. GlutathioneS-transferase SlGSTE1 inSpodopteralituramay be associated with feeding adaptation of host plants [J]. Insect Biochemistry and Molecular Biology, 2016, 70: 32-43.
[31] Ranson H, Claudianos C, Ortelli F, et al. Evolution of supergene families associated with insecticide resistance [J]. Science, 2002, 298(5591): 179-181.
(责任编辑: 田 喆)
ComparisonoftheresponsesofglutathioneS-transferasegenesinBemisiatabaciBtodifferenthostplanttransfers
He Chao1,2, Xie Wen2, Zhang Youjun2
(1.CollegeofPlantProtectionofHunanAgriculturalUniversity,Changsha410128,China; 2.DepartmentofPlantProtection,InstituteofVegetablesandFlowers,ChineseAcademyofAgriculturalSciences,Beijing100081,China)
The sweet potato whiteflyBemisiatabaciwith wide host range is an important worldwide agricultural pest, causing serious damage to the crops. In order to study the response of glutathioneS-transferases (GSTs) ofB.tabaciB to host transfer, the expression of 23 GST genes were analyzed and then the transcriptome data, PCR and sequencing were used to get the ORF ofGST7 gene. The bioinformation ofGST7 was also elucidated. The results indicated that the expression levelsGST7 andGST13 had significant difference in pepper compared with that in cotton (up to 2.31-fold forGST7). In addition, bioinformatics analysis showed that the open reading frame ofGST7 gene was 657 bp, encoding 219 amino acids, and it contained no signal peptide and transmembrane structure. The theoretical isoelectric point (pI) was 4.81 and its molecular weight was 25.07 kD. The phylogenetic tree analysis showed thatGST7 belonged to the Delta subfamily. These results suggest thatGST7 gene may play an important role in host plant adaptation ofB.tabaciB and provide a fundamental study forGST7 gene.
Bemisiatabaci; gene cloning; sequence analysis
2017-01-15
2017-05-12
“十三五”国家重点研发计划(2016YFD0201000)
* 通信作者 E-mail:zhangyoujun@caas.cn
S 433.3
A
10.3969/j.issn.0529-1542.2017.06.011
