孟鲁司特钠对慢性阻塞性肺疾病模型大鼠NF-κB、TNF-α mRNA表达的影响
2017-11-28胡建英王雅敏李峤坷
胡建英 王雅敏 李峤坷
(武警四川总队医院呼吸科,四川 成都 614000)
孟鲁司特钠对慢性阻塞性肺疾病模型大鼠NF-κB、TNF-α mRNA表达的影响
胡建英 王雅敏 李峤坷1
(武警四川总队医院呼吸科,四川 成都 614000)
目的探讨孟鲁司特钠对慢性阻塞性肺疾病(COPD)模型大鼠核因子(NF)-κB、肿瘤坏死因子-α信使核糖核酸(TNF-α mRNA)表达的影响。方法选购清洁级SD成年雄性大鼠24只,以薰香烟法和气管注入脂多糖建立COPD大鼠模型,按随机数字表法分为模型组和用药组各12只。模型组给予10 ml/kg生理盐水灌胃,1次/d;用药组给予0.2 ml孟鲁司特钠灌胃,1次/d,两组均连续灌胃4 w。末次给药结束,检测两组支气管肺泡灌洗液白细胞总数和中性粒细胞(PMN)、单核巨噬细胞(AM)绝对计数及NF-κB、TNF-α、TNF-α mRNA表达情况。结果与模型组相比,用药组白细胞总数、PMN、AM计数较低(Plt;0.05);模型组与用药组TNF-α表达强度分别为(3.30±0.51)、(2.70±0.67),NF-κB表达强度分别为(2.90±0.61)、(2.30±0.71),差异有统计学意义(Plt;0.05);用药组TNF-α mRNA表达(0.50±0.07)低于模型组(0.63±0.09)(Plt;0.05)。结论孟鲁司特钠治疗COPD模型大鼠,能抑制NF-κB、TNF-α活性和TNF-α mRNA表达,孟鲁司特钠对COPD具有一定的疗效。
慢性阻塞性肺疾病;孟鲁司特钠;肿瘤坏死因子-α mRNA;核因子-κB
目前尚不十分明确慢性阻塞性肺疾病(COPD)的发病机制,其以肺血管、肺实质、气道的慢性炎症为特征,肺泡巨噬细胞、中性粒细胞增加,造成炎症细胞激活而释放多种细胞因子和介质,促进中性粒细胞炎症反应和破坏肺结构〔1〕。有害气体或颗粒、烟雾等均会造成肺部抗氧化、氧化及抗蛋白酶、蛋白酶的失衡,吸烟能诱导炎症,造成肺脏损伤,吸入有害气体或颗粒会引起肺部炎症,与COPD的发病有密切联系〔2〕。孟鲁司特钠为白三烯受体拮抗剂,能避免白三烯和受体相结合,能缓解气道痉挛,抑制气道炎症,减轻气道阻塞,降低气道高反应性;能促进淋巴细胞凋亡,对气道淋巴细胞核因子(NF)-κB的激活起到抑制作用〔3〕。本研究探讨孟鲁司特钠对COPD模型大鼠NF-κB、肿瘤坏死因子(TNF)-α mRNA表达的影响。
1 材料与方法
1.1实验器材 上海精益医用器材厂提供的血球计数板;购自香港华粤企业公司的UNIVERSAL 16R低温离心机;Olympus显微镜;郑大二附院气管镜室提供的灌肺气管插管针。
1.2实验药品、试剂 北京中杉金桥公司的鼠抗NF-κB克隆抗体;武汉博士德生物工程有限公司的兔抗鼠TNF-α多克隆抗体;瑞氏(Wright)染液;Solarbio 公司的磷酸盐缓冲液;沙河牌香烟购自郑州卷烟厂,烟碱量为12 mg,焦油量为15 mg;脂多糖购:美国Sigma公司,货号:Sigma-L2880,规格:10 mg,纯度:≥99%;孟鲁司特钠购自鲁南贝特制药有限公司,国药准字H20083330,规格:5 mg,纯度:99%。
1.3实验动物 选取清洁级SD成年雄性大鼠24只,12周龄,体重210~250 g,平均(230.21±13.75)g,合格证号SCXK(京)2009-0007,均购自北京华阜康生物科技有限公司。饲养于温度为19℃~25℃、湿度为55%~65%的环境下,每日光照10~12 h,噪音lt;60 dB,每周进行2次清洗消毒鼠笼,自由饮食、饮水,适应性喂养1 w后开始实验。本实验已通过动物研究委员会同意。
1.4分组和制备模型 采用随机数字表法将常规喂养1 w的24只大鼠分为模型组和用药组各12只。在实验第1天和第15天将200 μg脂多糖向大鼠器官内缓慢注入,实验第2~14天和第16~32天分别将大鼠置于自制的600 cm×30 cm×40 cm的烟熏箱中进行被动吸烟,2次/d,10支/次,60 min/次,两次之间需间隔≥2 h。被动吸烟完成后,将大鼠放回原饲养笼中饲养,待大鼠出现活动明显减少、偶有咳嗽、食欲下降、喘息等症状时,即造模成功。
1.5给药方法 模型组大鼠在造模后每日接受10 ml/kg生理盐水灌胃,1次/d,不给予其他任何处理。在25 ml注射用生理盐水中加入1 g孟鲁司特钠中进行稀释,备用。用药组大鼠在造模后每日给予0.2 ml(6 mg/kg)孟鲁司特钠灌胃,1次/d,两组均连续灌胃4 w。
1.6检测方法
1.6.1支气管肺泡灌洗液的制备 所有动物在最后一次用药后48 h内进行颈椎脱臼法处死,分离气管,将右肺支气管结扎,以“T”形切口将气管插管插入左肺支气管,并将3 ml生理盐水经气管插管缓慢注入,保留3 min后将其吸出,以单层纱布过滤,反复4次,回收支气管肺泡灌洗液。
1.6.2细胞计数及分类 擦拭干净血球计数板,将盖玻片盖上,用毛细血管吸取制备的支气管肺泡灌洗液,经上侧面加入血球计数板,放入显微镜下,计数全部细胞。计数的全部×2×1/4×10 000=细胞数;细胞数×支气管肺泡灌洗液毫升数=支气管肺泡灌洗液中的细胞总数。取支气管肺泡灌洗液12 ml,4℃ 2 000 r/min离心8 min,取适量沉渣涂片。以瑞氏染色法染色:在灌洗液涂片区滴满染液,2 min后滴加pH6.4磷酸盐缓冲液,切勿溢出染色区,染色5~10 min后,将染液以流水冲洗掉,将玻片晾干。镜检300个细胞分类计数,计算中粒细胞和巨噬细胞所占百分比,在计算出某种细胞在支气管肺泡灌洗液中的总数。
1.6.3肺组织标本制作 将左主支气管夹闭,在右主支气管内固定硅胶管,在右肺内注入10%甲醛,至其膨胀、边缘变锐。结扎右主支气管扎并浸入10%甲醛、固定。14 d内实施脱水、石蜡包埋、切片、苏木素-伊红(HE)染色。
1.6.4SP法免疫组化检测 将浸泡玻片以清洁剂刷洗,以流水冲净后烤干,泡酸1 d并再次冲净、烤干,以95%酒精浸泡12 h后烤干,再采用多聚赖氨酸浸泡并烤干。苯脱蜡,梯度酒精脱苯,并用蒸馏水清洗3 min,重复3次,以磷酸盐缓冲液清洗5 min,滴加3%氧化氢试剂A。将其置于室温下30 min,将内源性过氧化物酶去除,以磷酸盐缓冲液清洗3 min,重复3次。在抗原修复液的容器中浸入切片,在温度为98℃~100℃的微波炉中加热7 min,操作2次,加热后冷却30 min于室温环境下,用磷酸盐缓冲液清洗3 min,重复3次。滴加正常山羊血清封闭液试剂B,置于室温下孵育30 min。将多余液体甩去,滴加1∶50稀释的一抗(兔抗鼠TNF-α多克隆抗体或鼠抗NF-κB克隆抗体),于4℃下过夜。而后将其置于37℃下复温45 min,用磷酸盐缓冲液清洗3 min,重复3次。滴加50 μl Ⅱ抗试剂C,用磷酸盐缓冲液清洗3 min,重复3次。滴加辣根酶标记链霉卵白素染色试剂盒内试剂D,用磷酸盐缓冲液清洗3 min,重复3次。DAB显色,时间5~10 min,随后将其置于流水下冲洗10 min,终止反应。苏木素衬染90 s,兰化5 min,盐酸酒精分化10 s(30%盐酸与75%酒精,体积比为1∶100),水冲5 min,脱水、透明、封片。将其置于显微镜下观察。以已知阳切片为阳性对照;以磷酸盐缓冲液为阴性对照。以定位明确都的背景清晰、棕黄色细胞为阳性细胞计数,以连续切片400倍视野的HE染色结果计数视野细胞数10个,参考切片免疫组化结果,记录NF-κB和TNF-α表达情况。每张切片随机选择5个视野于高倍镜下,半定量分析表达强度。0分:未着色,1分:阳性细胞lt;总数25%,2分:弥漫性着为色弱阳性,3分:弥漫性着色为中等强度,4分:弥漫性着色为强阳性。
1.6.5RT-PCR法检测 按美国Tripure RNA提取试剂盒操作说明进行总RNA提取,按大连宝生物RT-PCR剂盒操作说明进行RT-PCR提取。PCR扩增条件:2 min 94℃预变性,0.5 min 94℃变性,55℃退火0.5 min,72℃延伸1 min。循环28个后,72℃再延伸8 min。经琼脂糖电泳PCR产物后,以凝胶扫描仪进行NDA电泳条带光量子强度分析,以β-actin DNA电泳条带光量子强度和TNF-α电泳条带光量子强度比值为TNF-α mRNA 表达水平参数。由上海博亚公司合成引物。β-actin上游引物:5′-ATCATGTTTCAGACCTTCA-3′,下游引物:5′-CATCTCTTGCTCGAAGTC-3′,PCR扩增片段长度312 bp;TNF-α上游引物:5′-ACCCAAGCTTATGCACGGAAAGCATGATC-3′,下游引物:5′-CCCAAGCTTCACAGAGCAATGACTCCAA-3′,PCR扩增片段长度725 bp。
1.7统计学方法 采用SPSS20.0软件进行t检验。
2 结 果
2.1两组支气管肺泡灌洗液白细胞总数和PMN、AM计数比较 与模型组相比,用药组白细胞总数、PMN、AM计数显著降低(Plt;0.001)。见表1。
2.2两组TNF-α、NF-κB表达强度比较 与模型组相比,用药组TNF-α、NF-κB表达强度显著降低(Plt;0.001)。见表2,图1。
2.3两组TNF-α mRNA表达比较 与模型组(0.63±0.09)相比,用药组TNF-α mRNA表达(0.50±0.07)显著降低(t=21.558,P=0.000)。

表1 两组支气管肺泡灌洗液白细胞总数和PMN、AM计数比较
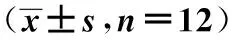
表2 两组 TNF-α、NF-κB表达强度比较

图1 NF-κB免疫组化染色(×200)
3 讨 论
反复不断的气道感染和吸烟史是COPD发生与发展的主要原因,烟雾中含有大量的有害物质,如甲醛、氢氰酸、丙烯醛等,是氧化物的主要来源〔4〕。氧化物能促使组织产生炎症细胞,会直接损伤肺组织,促使多种炎症细胞浸润肺间质和肺泡腔,而炎症细胞能产生氧化物,诱导肺组织分泌、合成炎症介质并损伤肺组织,形成恶性循环〔5,6〕。此外,香烟中的烟雾能造成下呼吸道对细菌感染的易感性增加,加重支气管和肺损伤,对病变进展起到促进作用。脂多糖在内毒素对机体起致病性方面发挥重要的作用,其能促使中性粒细胞、上皮细胞、单核巨噬细胞等释放炎症因子,介导肺组织和气道炎症反应〔7,8〕。
TNF-α为炎性介质,能经诱导多种细胞因子并与其相互协同,促进炎症反应;能造成中性粒细胞被激活,使其吞噬功能增强〔9〕。TNF-α的大量释放和慢性刺激会造成组织免疫病理损伤。TNF-α过度表达会加重肺组织损伤,引起炎症反应的慢性化〔10〕。NF-κB为DNA结合蛋白,能调控免疫细胞、肺炎症和气道上皮细胞中的黏附分子、细胞因子及趋化因子等的基因表达,参与肺部的免疫及炎症反应〔11〕。COPD气道炎症的发生发展与NF-κB的活化有密切关系。TNF-α能增强气道巨噬细胞、上皮细胞和肺组织中NF-κB活性。激活后的NF-κB,会促使炎症细胞因子mRNA转录,而合成TNF-α、白介素-8等炎性细胞因子〔12〕。上述炎症因子能使炎症细胞活化,对炎性细胞的释放、合成炎性介质发挥促进作用。本研究说明孟鲁司特钠能降低抑制NF-κB、TNF-α活性和TNF-α mRNA表达,对COPD具有一定的疗效。孟鲁司特钠能竞争性的与白三烯受体结合,能经减少激活的淋巴细胞、嗜酸性粒细胞、巨噬细胞和细胞素、肥大细胞等炎症标志物,降低气道的高反应性〔13〕。其主要作用机制包括:①对气道内脱颗粒和嗜酸粒细胞浸润发挥抑制作用,避免细胞-EOS发挥作用;②对气道上皮细胞生长因子受体表达起抑制作用,避免杯状细胞化生;③避免LTD4刺激平滑肌细胞分裂〔14,15〕。孟鲁司特钠能避免气道内聚集炎症细胞,抑制巨噬细胞过氧化物、嗜酸粒细胞阳离子蛋白等炎症介质释放,发挥改善患者肺功能、减轻气道炎症等作用。本研究仍存在一定的不足之处,如研究样本量较少,未分析孟鲁司特钠的作用强度是否与用药剂量有关等,后期仍需深入研究。
1刘圣金,王 瑞,吴德康,等.矿物药青礞石对AECOPD痰热证大鼠肺组织NF-κB表达及血清中相关因子的干预作用〔J〕.中成药,2017;39(2):404-7.
2Zaitsev AA,Ovchinnikov YV,Bezlepko AV,etal.Clinical guidelines for management of patients with acute chronic obstructive pulmonary disease〔J〕.Voen Med Zh,2015;336(3):31-7.
3陈晓明,张伟兵,田晓彦,等.盐酸氨溴索对慢性阻塞性肺疾病大鼠肺组织细胞凋亡和血清炎症因子的影响〔J〕.临床肺科杂志,2017;22(3):526-31.
4Rajanandh MG,Nageswari AD,Ilango K.Pulmonary function assessment in mild to moderate persistent asthma patients receiving montelukast, doxofylline, and tiotropium with budesonide: a randomized controlled study〔J〕.Clin Ther,2014;36(4):526-33.
5Jameel B,Tran H,Jersmann H,etal.Potential link between the Sphingosine-1-Phosphate (S1P) system and defective alveolar macrophage phagocytic function in chronic obstructive pulmonary disease (COPD)〔J〕.PLoS One,2015;10(10): e0122771.
6吴成周.孟鲁司特钠治疗稳定期慢性阻塞性肺疾病疗效评价〔J〕.中国药业,2017;26(2):47-9.
7尚立芝,王 峰,谢文英,等.爱罗咳喘宁对慢性阻塞性肺疾病大鼠可溶性细胞间黏附分子1、肿瘤坏死因子-α、白细胞介素-6及炎细胞的影响〔J〕.中国老年学杂志,2015;35(17):4762-4.
8Matsuse H,Kohno S.Leukotriene receptor antagonists pranlukast and montelukast for treating asthma〔J〕.Expert Opin Pharmacother,2014;15(3):353-63.
9郑少强,刘德纲.慢性阻塞性肺疾病大鼠血清和肺组织中IL-10、TNF-α及IFN-γ的表达及意义〔J〕.中国老年学杂志,2017;37(7):1613-5.
10虞玉英,胡克崇,徐慧芳.布地奈德联合孟鲁司特钠对慢性阻塞性肺疾病患者肺功能及血清中IL-6、IL-8和TNF-α的影响〔J〕.中国生化药物杂志,2014;34(7):153-5.
11王新杰.孟鲁司特钠联合BiPAP呼吸机对COPD合并呼吸衰竭患者CRP、TNF-α、NT-proBNP的影响〔J〕.标记免疫分析与临床,2016;23(9):1024-6.
12龚 丽,罗百灵,张 姗.COPD患者肺组织中NF-κB和GRP78的表达水平及意义〔J〕.国际呼吸杂志,2017;37(1):18-22.
13秦 艳.孟鲁司特钠治疗慢性阻塞性肺疾病122例临床疗效观察〔J〕.国际呼吸杂志,2016;36(9):658-61.
14Liu JL,Zhao XH,Zhang DL,etal.Effect of montelukast on the expression of interleukin-18, telomerase reverse transcriptase, and Bcl-2 in the brain tissue of neonatal rats with hypoxic-ischemic brain damage〔J〕.Genet Mol Res,2015;14(3):8901-8.
15屈 磊,龚传明,章 涛,等.孟鲁司特钠对COPD急性发作患者肺功能及炎性介质的影响〔J〕.西南国防医药,2015;25(10):1058-61.
〔2017-04-26修回〕
(编辑 滕欣航)
R563
A
1005-9202(2017)21-5264-04;
10.3969/j.issn.1005-9202.2017.21.020
1 武警四川总队医院ICU
胡建英(1967-),女,副主任医师,主要从事慢性阻塞性肺疾病的研究。
