重型再生障碍性贫血免疫抑制治疗后继发轻度认知功能障碍的临床研究
2017-11-28万楚成
耿 伟,余 琴,万楚成
(湖北省十堰市太和医院(湖北医药学院附属医院)血液内科,湖北 十堰 442000)
重型再生障碍性贫血免疫抑制治疗后继发轻度认知功能障碍的临床研究
耿 伟,余 琴,万楚成
(湖北省十堰市太和医院(湖北医药学院附属医院)血液内科,湖北 十堰 442000)
目的搜集免疫抑制治疗(immunosuppressive therapy, IST)后重型再生障碍性贫血(Severe aplastic anemia, SAA)患者的临床指标,构建评判该患者继发轻度认知功能障碍(Mild Cognitive Impairment, MCI)的风险性模型,并验证其应用价值。方法连续性纳入湖北省十堰市太和医院于2013年4月至2016年3月接诊经IST治疗后SAA患者为研究队列,完善研究对象的各项临床资料及实验室检查结果。并对其进行为期12个月的随访以确认预后,依据随访结果,预判远期继发MCI的风险及相关危重度评判分析。结果本次研究最终纳入175例SAA患者、13例失访,25例患者于随访期内继发MCI。①Cox回归分析显示,经IST治疗后SAA患者不良预后的影响模型由对IST治疗应答、围IST期感染次数、NSE、MoCA评分组成,上述因素均为研究队列经IST治疗后12个月内继发MCI的独立影响因素;②NSE≥6.82ng/mL、MoCA评分lt;25.59的SAA患者,经IST治疗后进展至MCI阶段的时间更短,具有更高的危重度评判效能。结论对IST治疗应答、围IST期感染次数、NSE、MoCA评分是经IST治疗后SAA患者继发MCI的危险因素,其中NSE、MoCA评分可被用于量化经IST治疗后SAA患者的认知功能受损危重度。
再生障碍性贫血;认知功能;免疫抑制剂
再生障碍性贫血(Aplastic anemia, AA)是指T淋巴细胞异常活化导致骨髓损伤、造血细胞凋亡,从而引起骨髓造血功能衰竭[1]。其中重型再生障碍性贫血(Severe aplastic anemia, SAA)具有起病急、进展快、病死率高的特点,其不良预后转归显著增加医疗资源消耗、影响远期生活质量[2-3]。SAA发病机制中免疫因素占重要地位,抑制免疫治疗是无条件移植造血干细胞患者的主要治疗方案[4]。近年来使用抗胸腺细胞球蛋白(anti thymocyte globulin, ATG)/ 抗淋巴细胞球蛋白(anti lymphocyte globulin, ALG)联合环孢素A(Cyclosporine A, CsA)行免疫抑制疗法(immunosuppressive therapy, IST)治疗SAA的疗效已获得临床充分肯定[5-6]。伴随SAA临床疗效的提升,近年来对其预后转归研究不断深入,发现SAA尤其是经过IST治疗后的SAA患者可伴有一系列认知功能障碍,直至痴呆的发生。认知功能障碍泛指各类病因所致认知功能的损害,包括轻度认知功能障碍(Mild Cognitive Impairment, MCI)至痴呆的一系列病理进程。MCI起病隐匿,如不能得到及时干预极易恶化至痴呆阶段,严重影响患者预后转归[7]。当前血液内科医师普遍对SAA患者继发MCI的危害性认知不足,忽视了经受IST治疗后的患者对认知功能产生的不利影响[8]。
有鉴于当前对MCI及其后续转归尚无有效、针对性的治疗方式,如能对MCI阶段或易于继发MCI的高危SAA患者及时进行早期临床干预,并进一步探索MCI的发病机理,从而增强判别早期认知功能受损的能力,对于尽早评判经IST治疗后SAA患者的远期预后转归、切实提高SAA患者的诊疗水平、降低预后风险均有重要临床价值。
1 资料与方法
1.1 研究对象
1.1.1 病例来源 前瞻性、连续性纳入湖北省十堰市太和医院于2013年4月1日至2016年3月19日收治的SAA患者为观察队列,并对其进行为期一年的随访,所有患者均符合以下标准:①首诊于本院的SAA患者、诊断明确、诊疗资料完整;②接受IST治疗期满4个月;③接受相同的干预措施。
1.1.2 入选标准 ⑴SAA的诊断标准依据中华医学会血液学分会、红细胞疾病学组于2010年发布的《再生障碍性贫血诊断治疗专家共识》[9]:①骨髓细胞增生程度低于正常的25%,如介于正常的25%至50%,则残存的造血细胞lt;30%;②血常规:需具备下列三项中的两项:中性粒细胞绝对值(Absolute neutrophil count, ANC)lt;0.5×109/L、网织红细胞绝对计数(Actual reticulocyte count, ARC)lt;20×109/L、血小板计数(blood platelet count, BPC)lt;20×109/L。⑵MCI的诊断标准依据中国防治认知功能障碍专家共识专家组于2006年发布的《中国防治认知功能障碍专家共识》[10]执行。该共识同时提出,确诊MCI后需要完善相关认知功能量表的评定,以量化患者认知功能的受损程度。
1.1.3 排除标准 ①对SAA的治疗产生干扰因素的疾病:骨髓增生异常综合征、阵发性睡眠性血红蛋白尿症、甲亢、白血病、骨髓纤维化、严重的凝血功能异常;②已发生危及生命、难以控制,或以当前临床水平难以解释的感染;③相关既往史:血栓栓塞、脑卒中、脑外伤、精神异常;④IST治疗失败,即患者未脱离血制品输注依赖或仍符合SAA诊断标准;⑤常年酒精嗜好、长期服用各类影响精神状态药物(抗焦虑药、镇静剂、止痛剂);⑥各种类别的认知功能受损患者,且接受过相关治疗;⑦合并语言、视觉、听力障碍,导致不能完成正常随访的患者;⑧完全不能使用普通话进行交流,无法正常沟通,易于造成认知功能量化评定误差的患者。
1.1.4 剔除标准 如研究队列在随访进程中出现以下情况,应及时将其剔除出研究队列,以避免易混因素对结果的干预:①患者及其家属因诊疗流程与院方存在纠纷;②其他因素引起病情急骤变化以至对认知功能指标产生干扰;③随访期间继发(伴发)各类脑卒中或颅脑外伤;④其他随访期意外情况。
1.2 资料收集 ①所有研究对象均完善血常规、骨髓穿刺、骨髓活检检查,予以CsA行IST治疗:3 mg/(kg·d),每日两次,持续6个月,维持血CsA浓度为150~250 ng/mL,随后根据具体浓度及三系血细胞变化逐渐减量。获得治疗反应前予以粒细胞集落刺激因子、促红细胞生成素输注,十一酸睾酮片口服,并于必要时输注浓缩红细胞以维持患者的血红蛋白≥70 g/L。②登记研究对象的各项临床资料:年龄、性别、受教育年限、围IST期间感染次数,并搜集IST治疗后相关实验室检查指标:可溶性转铁蛋白受体(serum transferrin receptor, sTfR)、血清铁蛋白(serum ferritin, SF)、神经元特异性烯醇化酶(Neuron-specific enolase, NSE)、S100蛋白(S-100 protein, S-100)。③依据相关文献[6],结合相关血细胞指标评定IST疗效:血红蛋白(Hemoglobin HGB)gt;100g/L、血小板计数(blood platelet count, BPC)gt;100×109/L、中性粒细胞绝对值(Absolute neutrophil count, ANC)gt;1.5×109/L视为对IST治疗应答为完全反应(complete reaction, CR);患者脱离血制品输注依赖,血液学检查好转,不再符合SAA标准,但上述血常规结果未达到CR标准,视为对IST治疗应答的部分反应(partial response, PR)。④完善患者的相关认知功能量表:简易精神状态检查表(Mini-mental State Examination, MMSE)、日常生活能力量表(Activity of Daily Living Scale, ADL)、蒙特利尔认知评估量表(Montreal Cognitive Assessment, MoCA)等;并汇总相关临床指标,评定急性生理与慢性健康评分-Ⅱ(Acute Physiology and Chronic Health Evaluation, APACHE-Ⅱ)。⑤于2014年4月至2017年3月,陆续完成对患者为期12个月的随访,获取预后结果以便于完成下阶段数据分析。随访形式为电话通知,邀约至医院完善相关检查。随访的终点事件为患者IST治疗结束后一年内继发/未继发MCI,将继发MCI的患者设为实验组、未继发MCI的患者设为对照组,如有患者退出随访队列,记载其终止随访的原因及随访截止的时间,以便于下阶段的删失处理。
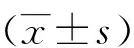
2 结果
2.1 一般情况 基于纳入及排除标准,本次研究最终纳入175例SAA患者。其中男性90例、女性85例;年龄位于14~66岁、中位数年龄33岁、四分位数间距(23,52)岁。最终162例患者完成随访,随访进程中13例患者失访,失访区间位于随访进程的3~11月,利用SPSS软件的“删失值替代功能”进行替代处理。依据随访结果,25例患者于随访期内继发MCI。
2.2 预后转归分析结果 以纳入研究对象的年龄、性别、受教育年限、治疗应答效果、围IST期感染次数、各项认知功能量表、相关实验室检查等临床资料为单因素,以其预后转归结果为结局事件,采用逐步回归法进行单因素Cox回归分析,从而探寻经IST治疗后SAA患者不良预后的影响因素。结果显示对IST治疗应答为CR级别(HR=0.628,Plt;0.05)、围IST期感染次数(HR=1.661,Plt;0.05)、NSE(HR=1.274,Plt;0.05)、MoCA(HR=0.715,Plt;0.05)是本次研究对象远期不良预后转归(MCI)的影响因素,其中IST治疗应答、MoCA评分为保护因素(见表1)。即为不考虑其他影响因素的情况下:①对IST治疗应答为CR级别的患者,远期继发MCI的风险为非CR级别的患者的62.8%;②围IST期感染次数每增加1次,继发MCI的风险升高66.1%;③NSE含量每增加1 ng/mL,继发MCI的风险增加27.4%;④MoCA评分每增加1分,继发MCI的风险降低28.5%。
2.3 影响因素对于MCI继发几率的预测价值 通过ROC曲线以进一步明确各项影响因素对于经IST治疗后SAA患者继发MCI的评判效能。除去前述非连续性变量(治疗应答分级),以围IST期感染次数、NSE、MoCA评分结果作为评判结局转归的潜在临界值、以继发MCI为结局事件,依据检验状态变量为危险性或保护性,分别绘制ROC曲线,得到各项指标的曲线下面积、95%置信区间,曲线见图1和图2,ROC曲线相关参数见表2。并取曲线最左上端确定相应指标的最佳截点,根据易用性原则对结果进行微调以获取评判预后转归的临界值:①围IST期感染次数不具备评判研究对象不良预后的显著预测效果(P=0.109);②NSE对于评判研究对象不良预后具有显著预测效果(Plt;0.05),其临界值取6.82 ng/mL时可获取最佳预测敏感性及特异度;③MoCA对于评判研究对象不良预后具有显著预测效果(Plt;0.05),其临界值取25.59分时可获取最佳预测敏感性及特异度。
表1经IST后SAA患者继发MCI的影响因素分析(单因素Cox回归分析全变量模型)
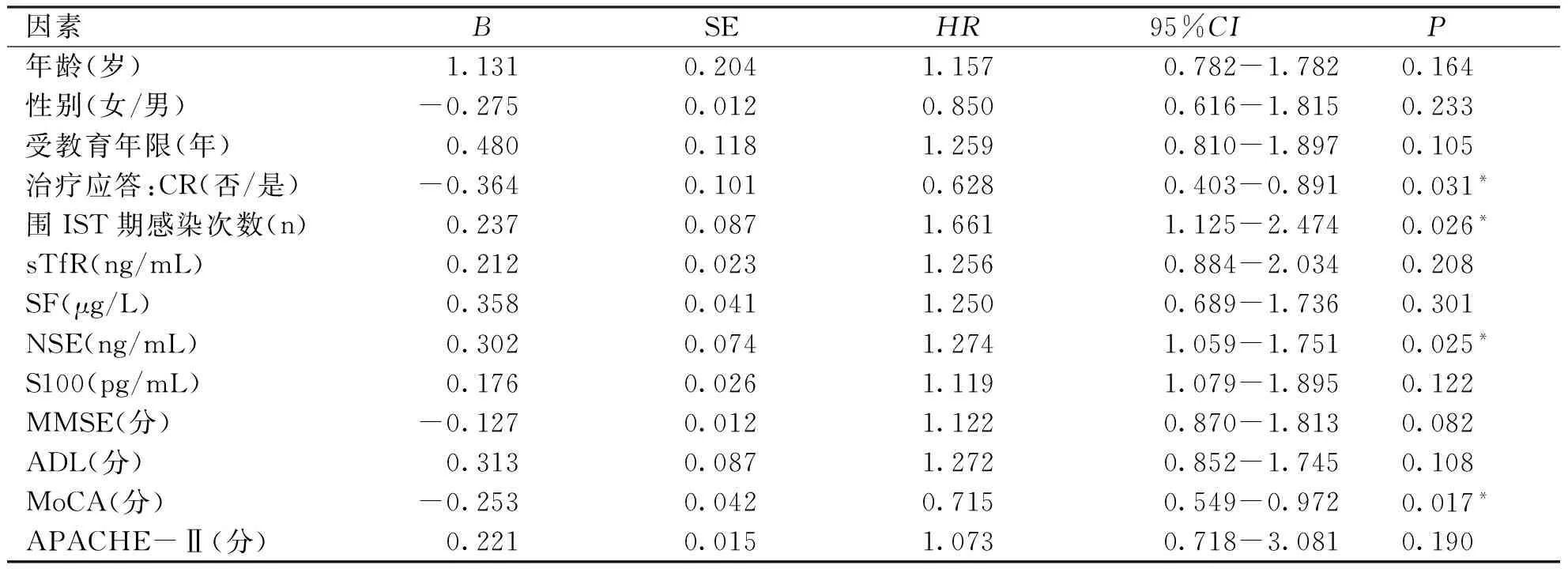
因素BSEHR95%CIP年龄(岁)1.1310.2041.1570.782-1.7820.164性别(女/男)-0.2750.0120.8500.616-1.8150.233受教育年限(年)0.4800.1181.2590.810-1.8970.105治疗应答:CR(否/是)-0.3640.1010.6280.403-0.8910.031*围IST期感染次数(n)0.2370.0871.6611.125-2.4740.026*sTfR(ng/mL)0.2120.0231.2560.884-2.0340.208SF(μg/L)0.3580.0411.2500.689-1.7360.301NSE(ng/mL)0.3020.0741.2741.059-1.7510.025*S100(pg/mL)0.1760.0261.1191.079-1.8950.122MMSE(分)-0.1270.0121.1220.870-1.8130.082ADL(分)0.3130.0871.2720.852-1.7450.108MoCA(分)-0.2530.0420.7150.549-0.9720.017*APACHE-Ⅱ(分)0.2210.0151.0730.718-3.0810.190
*Plt;0.05,协变量赋值备注:性别(女=0、男=1);治疗应答(否=0、是=1);其余变量均为连续性变量。

图1 危险性因素预测经IST后SAA患者不良预后的ROC 曲线

图2 保护性因素预测经IST后SAA患者不良预后的ROC 曲线
表2影响因素用于评判经IST后SAA患者不良预后ROC曲线的相关参数

因素曲线下面积95%可信区间上限下限P评判效能敏感度特异度尤登指数临界值围IST期感染次数0.5630.4080.7560.10953.1%49.5%0.026—NSE0.8920.7210.9890.016*86.9%78.2%0.6516.82(ng/mL)MoCA0.9210.7801.0000.009*86.6%84.4%0.71025.59(分)
*Plt;0.05。
3 讨论
当前关于MCI病理生理进程对认知功能的影响研究基本都停留于理论学术水平,其中经IST治疗后对于认知功能影响的研究尤其进展迟缓。虽有推测SAA病变本身及IST治疗均可导致患者脑组织灌注的波动、合成ATP减少[11]、诱发氧化应激反应损伤神经元轴突,但相关病理生理进程对认知功能的影响并未得到充分有效的证实[12]。随着实验室检查技术的突破,近年来新兴指标层出不穷,在敏感性、特异度、可重复性、可操作性、无创或低创伤方面不断优化,已经具备足够的临床应用价值[6-7,13]。除了血液细胞学相关指标之外,sTfR、SF、NSE、S100等指标均被用于精确评判SAA病情进展及神经系统状态。有鉴于下述依据,本次临床试验尽可能纳入相关指标以完善研究覆盖面:①sTfR通过与SF在血管内皮细胞表面的特异性结合与分离,完成自血液循环向脑组织输送铁元素的循环,相关指标的变动有助于反映脑组织功能受损的程度及变化情况[14];②S100B蛋白为活化的神经胶质细胞分泌,对认知功能损害及预后判断有重要影响,可作为神经系统受病理-环境变化致损后的生化标志物之一;③NSE是神经元损伤的特异性蛋白,当神经元受损、血脑屏障通透性下降,NSE可特异性释放入血,成为评判神经系统受损及恢复程度的指标。此外,为充分、早期量化评定认知功能,本次研究选取MMSE、MoCA、ADL三项量表以评判经IST治疗后SAA患者的认知功能,以初步预判观察队列的认知功能转归:①MoCA量表覆盖视觉空间结构、执行功能、命名、注意力、语言、延迟回忆、抽象思维、定向力八个方面,得分越低则表明认知功能受损程度越重;②MMSE量表覆盖记忆力、定向力、注意力、计算力、语言能力等5个部分,得分gt;26分视为认知功能正常;③ADL量表覆盖6项躯体生活自理表及8项工具性日常生活量表,得分lt;14分为日常生活能力正常、评分越高则受损程度越重。最终,本研究在前述基础上、回溯过往临床样本,对其评判预后构建风险模型及应用性研究:①Cox回归分析显示,经IST治疗后SAA患者不良预后的影响模型由对IST治疗应答、围IST期感染次数、NSE和MoCA评分组成,上述因素均为研究队列经IST治疗后12个月内继发MCI的独立影响因素;②NSE≥6.82 ng/mL、MoCA评分lt;25.59的SAA患者,经IST治疗后进展至MCI阶段的时间更短,具有更高的危重度评判效能。
但本研究仍存在一定不足之处,有待下阶段进一步改进:①本研究仅局限于内地一省开展,研究对象的族群、地域因素较为单一,势必会对结果产生一定影响;②限于部分患者费用问题及医疗保险审核政策,许多项分子生物学检测难以全面开展[15];③为简化研究,本次临床试验并未探讨部分血液检查指标(SF、WBC等)男女差异性对结局指标的影响,有待下阶段在本研究结果之上做出进一步细化研究。有鉴于上述缺陷,今后仍应进一步深入研究与SAA的相关因素,使结果更加具有推广性。但血液内科医生应积极借鉴本研究已探明的结果,增强风险识别能力、切实改善SAA患者的预后转归、有效降低医-患风险。
[1] Marsh J C, Ball S E, Cavenagh J, et al. Guidelines for the diagnosis and management of aplastic anaemia[J].Br J Haematol,2009,147(11):43-70.
[2] 何薇, 谢晓恬. 获得性再生障碍性贫血发病机制研究最新进展[J]. 中华实用儿科临床杂志,2016,31(3): 238-240.
[3] 叶蕾, 井丽萍, 杨文, 等. 围免疫抑制治疗期感染对重型再生障碍性贫血患者血液学反应及生存的影响[J].中华血液学杂志,2015,36(8):670-675.
[4] 宋琳, 彭广新, 武志洁, 等. ATG/ALG联合环孢素A与环孢素A联合雄激素一线治疗输血依赖非重型再生障碍性贫血的疗效比较:单中心回顾性研究[J]. 中华血液学杂志,2016,37(11):946-950.
[5] Tichelli A, Schrezenmeier H, Socie G, et al. A randomized controlled study in patients with newly diagnosed severe aplastic anemia receiving antithymocyte globulin(ATG),cyclosporine,with or without G-CSF:a study of the SAA Working Party of the European Group for Blood and Marrow Transplantation[J]. Blood,2011, 117(17):4434-4441.
[6] Listed N.Incidence of aplastic anemia:the relevance of diagnostic criteria.By the international agranulocytosis and aplastic anemia study[J].Blood,1987,70(6):1718-1721.
[7] Thacker E L, McKnight B, Pasty B M, et al. Atrial fibrillation and cognitive decline: a longitudinal cohort study[J]. Neurology,2013,81(2):119-125.
[8] 李建平, 杨文睿, 李园, 等. ATG/ALG联合环孢素A治疗老年重型再生障碍性贫血16例疗效及安全性评估[J].中华血液学杂志,2016,37(7):607-611.
[9] 中华医学会血液学分会, 红细胞疾病学组. 再生障碍性贫血诊断治疗专家共识[J].中华血液学杂志, 2010,31(11):790-793.
[10]中国防治认知功能障碍专家共识专家组.中国防治认知功能障碍专家共识[J].中华内科杂志, 2006,45(2): 171-173.
[11]谢永欣. 再生障碍性贫血患者血清IFN-γ、IL-4和T细胞亚群的表达[J]. 遵义医学院学报, 2012, 35(2):127-129.
[12]李东风, 冯强, 刘 翠. 几种常用痴呆量表比较分析[J].基础医学,2011,20(6):450-451.
[13]Scheinberg P H, Wu C O, Nunez O, et al. Treatment of severe aplastic anemia with a combination of horse antithymocyte globulin and cyclosporine, with or without simlimus: a prospective randomized study[J]. Haematologica,2009,94(10):348-354.
[14]Bu Y K B, Akgun N A, Bulus A D, et al. Can soluble transferrin receptor be used in diagnosing iron deficiency anemia and assessing iron response in infants with moderate acute malnutrition[J]. Archivos Argentinos De Pediatria, 2017, 115(2):125.
[15]张凤奎, 张莉, 郑以州, 等. 关于《再生障碍性贫血诊断治疗专家共识》的几点商榷[J]. 中华血液学杂志, 2011,32(5):359-360.
[收稿2017-06-28;修回2017-09-08]
(编辑:王福军)
Evaluationofriskanalysismodelandapplicationonpatientswithsevereaplasticanemiaafterimmunosuppressivetherapyfollowedbysecondarymildcognitiveimpairment
GengWei,YuQin,WanChucheng
(Department of Hematology,Taihe Hospital of Shiyan City,Hubei University of Medicine,Shiyan Hubei 442000,China)
ObjectiveTo assess clinical indicators of severe aplastic anemia (SAA) after immunosuppressive therapy (IST) and construct the evaluation of patients with secondary Mild Cognitive Impairment (MCI) and verify its application value.MethodsContinuous admission into Taihe Hospital of Shiyan City in April, 2013 to March, 2016 after SAA patients with IST treatment was collected for the study of the cohort. The study of the object of the clinical data and laboratory results were improved. A 12-month follow-up to confirm the prognosis, based on follow-up results, was performed to predict the long-term risks and associated secondary MCI assessment analysis of patients.ResultsThe study eventually included 175 patients with SAA, 13 cases lost and 25 patients followed up for follow-up MCI. (1) Cox regression analysis showed that the adverse prognosis of patients with SAA after IST treatment was affected by IST treatment response, IST infection, Neuron-specific enolase (NSE) and Montreal Cognitive Assessment (MoCA) scores. All of these factors were the study cohort followed by IST treatment within 12 months MCI independent influencing factors.(2) Upon NSE ≥ 6.82 ng/ml, SAA patients with MoCA score lt;25.59 had shorter time to progress to MCI stage after IST treatment, and had higher risk of assessment.ConclusionRisk factors of SAA patients after IST treatment followed by MCI includes IST treatment response, IST infection period, NSE and MoCA score, in which NSE and MoCA scores could be used to quantify the cognitive impairment degree in SAA patients treated with IST.
Aplastic anemia; cognitive function; immunosuppressive agents
万楚成,男,主任医师,硕士生导师,研究方向:恶性血液病的诊断、治疗及骨髓移植,E-mail:370877110@qq.com。
R556.5
A
1000-2715(2017)05-0536-05
