白藜芦醇改善脂多糖诱导的大鼠学习记忆减退与抑制炎症相关蛋白表达有关
2017-11-28李明刚邓媛媛龚其海
李明刚,邓媛媛,龚其海
(1.遵义医学院 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099;2.遵义市播州区人民医院,贵州 遵义 563100)
基础医学研究
白藜芦醇改善脂多糖诱导的大鼠学习记忆减退与抑制炎症相关蛋白表达有关
李明刚1,2,邓媛媛1,龚其海1
(1.遵义医学院 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099;2.遵义市播州区人民医院,贵州 遵义 563100)
目的观察白藜芦醇对阿尔茨海默病(AD)样神经炎症大鼠模型的作用及其机制。方法雄性SD大鼠随机分空白对照组(n=10),模型组(n=15),阳性药组(n=15),白藜芦醇10、20、40 mg/kg剂量组(n=15)。除空白对照组外,各组大鼠腹腔注射脂多糖(0.5 mg/kg),空白对照组注射相同体积的溶媒,每周1次,共13周。造模期间,阳性药组灌胃布洛芬40 mg/kg,白藜芦醇不同剂量组分别每日一次灌胃白藜芦醇10、20、40 mg/kg,连续13周,空白对照组和模型组以等体积蒸馏水灌胃。Morris水迷宫检测大鼠的空间学习和记忆能力;透射电镜观察大鼠海马神经元超微结构;免疫印迹法检测肿瘤坏死因子-α(TNF-α)、环氧合酶2(COX-2)和白细胞介素-1β(IL-1β)的蛋白表达。结果白藜芦醇和布洛芬显著缩短模型大鼠的空间逃避潜伏期;减轻海马神经元超微结构损伤;降低海马组织TNF-α、COX-2和IL-1β的过度表达。结论白藜芦醇通过下调炎症相关蛋白的表达,改善LPS诱导的大鼠学习记忆减退。
白藜芦醇;脂多糖;阿尔茨海默病;炎症;大鼠
阿尔茨海默病(Alzheimer disease,AD)是一种常见于中老年人的中枢退行性疾病。临床表现为认知障碍和日常生活能力下降,同时常伴有精神及运动障碍。AD的病因及病理生理学机制迄今尚未完全阐明,可能涉及到氧化应激、基因突变、神经炎症、线粒体功能障碍及环境毒素等方面。其中神经炎症反应贯穿AD的发生与发展过程[1]。当中枢神经系统受到诸如炎症、外伤等损伤时,可导致β-淀粉样蛋白(Aβ)沉积,进而激活星形胶质细胞和小胶质细胞等炎症反应细胞,释放肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)及环氧合酶-2(cyclooxygenase-2,COX-2)等炎性因子,这些炎症因子阻止小胶质细胞有效地去除淀粉样斑块,从而使炎症反应加重,Aβ含量增加,最终加速AD的发展[2-3]。
白藜芦醇(resveratrol,Res)是一种多酚类化合物,广泛存在于蔬菜、水果、茶叶等植物。现代药理学研究发现,白藜芦醇具有抗炎、增强免疫、抗氧化、调节内分泌等作用[4-6]。本题组既往研究发现:白藜芦醇可改善脂多糖(lipopolysaccharide,LPS)诱导的急性神经炎症大鼠模型的学习记忆功能,其机制与减少TNF-α和COX-2的表达及淀粉样前体蛋白的水平有关[7]。然而,AD是进行性的慢性发展过程,急性神经炎症模型并不能完全模拟AD-样神经炎症。因此,本研究在既往工作基础上,通过LPS诱导的大鼠慢性神经炎症模型,评价白藜芦醇对AD样神经炎症模型学习记忆减退的影响,在此基础上,通过检测海马炎症相关蛋白的表达,探索白藜芦醇对AD样大鼠神经炎症模型可能的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SD大鼠85只,雄性,SPF级,体重250±20 g,购自第三军医大学大坪医院实验动物中心(许可证号:SCXK渝2007-0005)。饲养于SPF级实验动物房/屏障系统实验动物房,5只/笼。
1.1.2 主要药品和试剂 白藜芦醇(经HPLC检测,纯度大于98%)从湖南华光生物有限公司购买;LPS从美国Sigma公司购买;TNF-α、IL-1β及COX-2抗体均购自英国Abcam公司;β-actin抗体购自江苏碧云天生物技术公司。
1.1.3 仪器 MT-200 Morris水迷宫为成都泰盟科技公司产品;垂直电泳系统及全自动凝胶图象分析仪均为美国BIO-RAD公司产品。
1.2 实验方法
1.2.1 动物分组及给药 大鼠适应性饲养1周后,随机分为6组:空白对照组,模型组,阳性药组,白藜芦醇低、中、高剂量组,除空白对照组为10只大鼠外,其余各组n=15。大鼠腹腔注射LPS(0.5 mg/kg)造模,每周1次,连续13周,空白对照组同法注射等体积生理盐水。造模期间,阳性药组灌胃布洛芬40 mg/kg,白藜芦醇各剂量组分别每日1次灌胃白藜芦醇10、20、40 mg/kg,连续13周,空白对照组和模型组则给予等量蒸馏水。
1.2.2 Morris水迷宫 大鼠学习记忆功能采用Morris水迷宫检测,方法同本研究组既往报道[8]。
1.2.3 Western blot检测TNF-α、COX-2和IL-1β的蛋白水平 水迷宫检测结束后,麻醉各组大鼠,断头取海马。提取海马总蛋白并计算蛋白浓度。将样品制备后上样至8% SDS-PAGE凝胶梳孔,电泳,转膜,封闭,一抗TNF-α(1∶1 000)、COX-2(1∶1 000)、IL-1β(1∶1 000)、β-actin孵育过夜后,二抗山羊抗兔IgG(H+L)孵育,洗膜,ECL发光显影,凝胶成像系统和Quantity One定量分析系统检测条带吸光度积分值,将目的条带积分光密度比上内参β-actin的积分光密度可得目的蛋白的相对表达量。
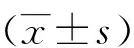
2 结果
2.1 白藜芦醇对LPS诱导的大鼠学习记忆减退的影响 Morris水迷宫结果显示,各组大鼠的逃避潜伏期随着训练时间延长而逐渐缩短。从第3天起,模型组的逃避潜伏期明显长于对照组(Plt;0.05),而白藜芦醇 40 mg/kg组大鼠在第3天和第4天的逃避潜伏期均较模型组显著缩短(Plt;0.05),布洛芬40 mg/kg及白藜芦醇20 mg/kg大鼠在第4天的逃避潜伏期明显缩短 (Plt;0.05)。这表明长期腹腔注射LPS可诱导大鼠的学习记忆减退,而布洛芬、白藜芦醇对LPS诱导的学习记忆减退具有改善作用(见表1)。
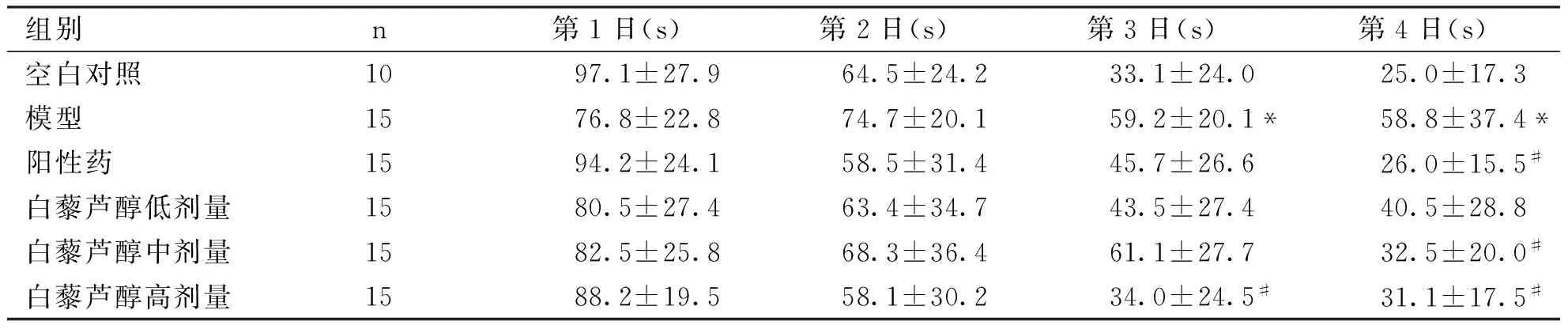
组别n第1日(s)第2日(s)第3日(s)第4日(s)空白对照1097.1±27.964.5±24.233.1±24.025.0±17.3模型1576.8±22.874.7±20.159.2±20.1*58.8±37.4*阳性药1594.2±24.158.5±31.445.7±26.626.0±15.5#白藜芦醇低剂量1580.5±27.463.4±34.743.5±27.440.5±28.8白藜芦醇中剂量1582.5±25.868.3±36.461.1±27.732.5±20.0#白藜芦醇高剂量1588.2±19.558.1±30.234.0±24.5#31.1±17.5#
与空白对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05。
2.2 白藜芦醇对LPS诱导的大鼠海马神经元超微结构的影响 透射电镜观察到,对照组大鼠海马CA1区神经元形态规则,染色质分布均匀,线粒体、内质网结构清晰,核糖体丰富。模型组与空白对照组比较,大鼠海马CA1区神经元细胞核不规则,异染色质增多并聚集,核周间隙明显加大,线粒体出现肿胀或空泡。与模型组比较,布洛芬组海马CA1区神经元超微结构损伤明显减轻,大多数核染色质分布均匀,细胞器结构清晰。与布洛芬组相似,长期给予白藜芦醇20 mg/kg或40 mg/kg的大鼠海马CA1区神经元的超微结构较规则,且白藜芦醇40 mg/kg的高剂量组的超微结构损伤不明显(如图1所示)。综上可知,LPS反复腹腔注射导致大鼠海马CA1区神经元的超微结构受损,布洛芬和白藜芦醇(20、40 mg/kg)长期给药可减轻LPS导致的神经元超微结构损伤。
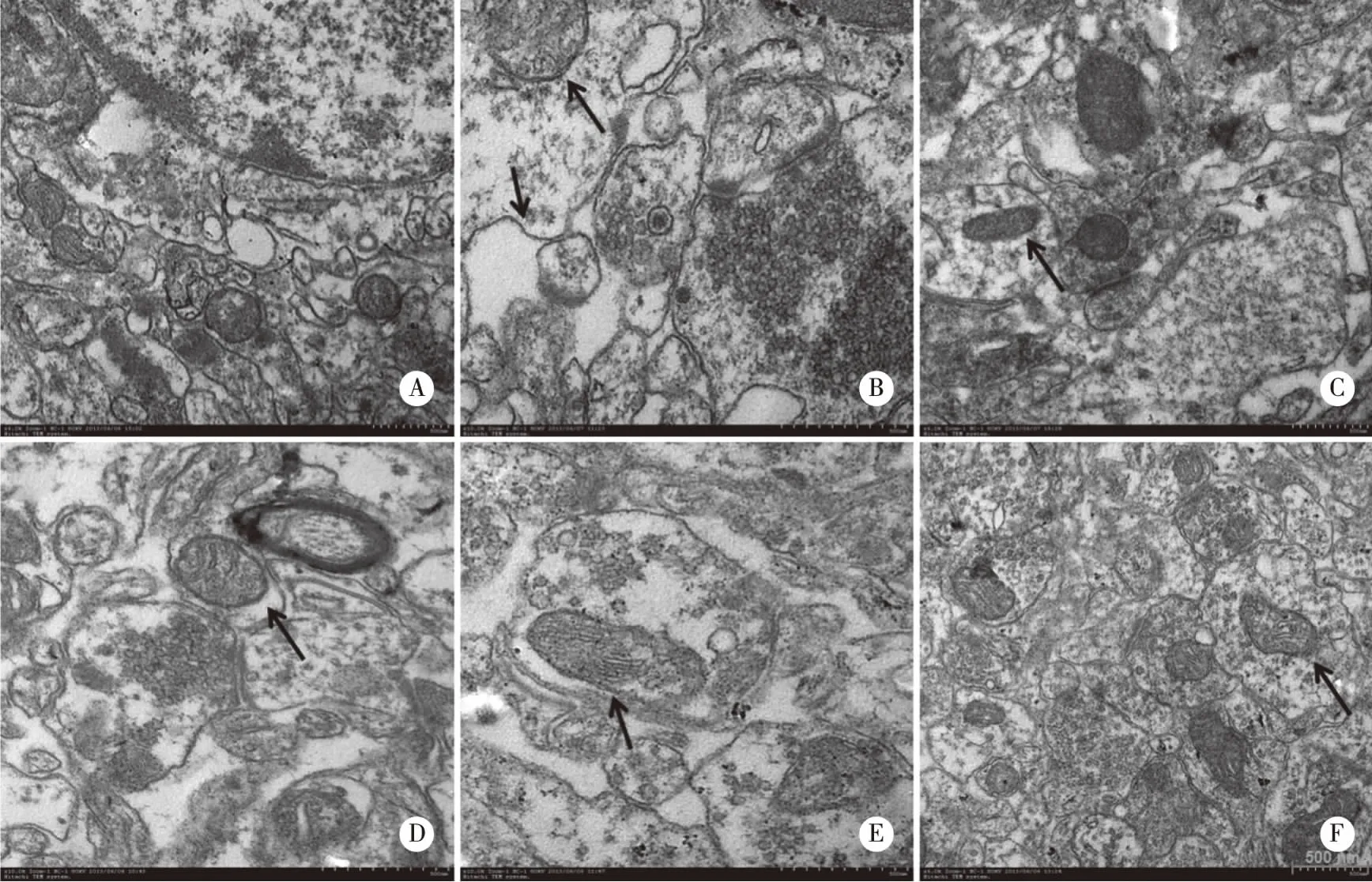
A:空白对照组;B:模型组;C:布洛芬组;D-F:白藜芦醇低、中、高剂量组。图1 白藜芦醇对LPS诱导的大鼠海马CA1区神经元超微结构的影响(500 nm)
2.3 白藜芦醇对LPS诱导的大鼠海马IL-1β、TNF-α及COX-2蛋白表达的影响 Western blott检测了大鼠海马炎症相关蛋白的表达。结果如图2所示,与空白对照组相比,模型组海马组织中IL-1β、TNF-α以及COX-2的蛋白表达均显著升高(Plt;0.01),布洛芬长期给药可以降低上述各蛋白在模型大鼠海马内的过度表达(Plt;0.01,Plt;0.05,Plt;0.01),同时,白藜芦醇各剂量治疗组能够不同程度的降低大鼠海马内上述蛋白的表达。此提示白藜芦醇可降低LPS诱导的类AD样炎症模型中大鼠海马IL-1β、TNF-α和COX-2的过度表达。

与空白对照组比较,*Plt;0.05,**Plt;0.01;与模型组比较,#Plt;0.05,##Plt;0.01。图2 白藜芦醇对脂多糖诱导的大鼠海马IL-1β、TNF-α及COX-2蛋白表达的影响
3 讨论
神经炎症在AD发病机制中的作用至关重要[9-10]。LPS作为细菌内毒素,无论是与脑细胞孵育、脑部注射或者是全身注射均能诱导明显的炎症反应[11-13]。在本实验中,我们通过反复腹腔注射LPS诱导慢性神经炎症。发现连续注射LPS 13周后,大鼠在水迷宫定位航行实验中的逃避潜伏期明显长于空白对照组,且海马CA1区神经元超微结构受损,证实长期腹腔给予LPS可引起大鼠学习记忆减退和神经元损伤,提示造模成功。而给予阳性药布洛芬40 mg/kg或受试药白藜芦醇20~40 mg/kg能改善大鼠的行为学症状和神经元损伤。
基于炎症反应在AD发病过程中的关键作用,我们进一步检测了炎症相关介质COX-2、TNF-α和IL-1β在海马组织中的蛋白表达。COX-2是前列腺素生成过程中的关键限速酶,而前列腺素作为一种炎性介质可激活小胶质细胞形成炎症环路。在AD发病过程中COX-2表达上调,可见COX-2在AD炎症级联反应中的扮演了关键角色[14-15]。同时,AD的进展过程中,过度激活的小胶质细胞产生炎症因子和细胞毒性物质,如TNF-α、IL-1β,其中涉及“细胞因子循环”引起慢性炎症反应,进而加速AD的进程[16-17]。在炎症或其他疾病的存在下,TNF-α通常被小胶质细胞大量释放,它作为内源性热源,增加了谷氨酸的释放,引起神经毒性发生[18]。而白细胞介素1族包括11种细胞因子,其中IL-1β具有最强的促炎能力,它在神经炎症中含量增多,它的存在会抑制小胶质细胞对Aβ的吞噬作用,不利于Aβ斑块的清除,加重AD患者的病情[19-20]。本研究发现,反复腹腔注射LPS后,大鼠海马组织的炎症介质COX-2、TNF-α和IL-1β的表达明显增加,提示长期注射LPS可诱导大鼠的AD样慢性神经炎症。同时,阳性药布洛芬及受试药白藜芦醇明显降低模型大鼠COX-2、TNF-α和IL-1β的过度表达,即白藜芦醇具有抗AD样慢性神经炎症的作用。在既往研究中,我们发现白藜芦醇能够抑制LPS诱导的大鼠海马中炎症因子COX-2、TNF-α和IL-1β mRNA表达的增加[21],因此,本研究从蛋白水平进一步对其进行了证实。
综上所述,本研究证实白藜芦醇可改善反复腹腔注射LPS诱导的大鼠空间学习记忆减退和海马神经元损伤,其机制与抑制炎症介质COX-2、TNF-α和IL-1β的过度表达有关。
[1] Heppner F L,Ransohoff R M,Becher B.Immune attack:the role of inflammation in alzheimer disease [J].Nature Reviews Neuroscience,2015,16(6):358.
[2] Miguel R P J,Maria M R J.A Review:Inflammatory process in alzheimer's disease,role of cytokines [J].The Scientific World Journal,2012,2012(6):756357.
[3] Krause D L,Norbert M.Neuroinflammation,microglia and implications for anti-inflammatory treatment in alzheimer's Disease [J].International Journal of Alzheimers Disease,2010,2010(1):5429-5438.
[4] Bellaver B,Souza D G,Souza D O,et al. Resveratrol increases antioxidant defenses and decreases proinflammatory cytokines in hippocampal astrocyte cultures from newborn,adult and aged Wistar rats [J].Toxicology in Vitro,2014,28(4):479-484.
[5] Baur J A,Sinclair D A.Therapeutic potential of resveratrol:the in vivo evidence [J].Nature Reviews Drug Discovery,2006,5(6):493-506.
[6] 李明刚,邓媛媛,龚其海.白藜芦醇抗神经退行性疾病的研究进展 [J].中国新药与临床杂志,2016,35(10):699-703.
[7] Gong Q H,Fei L,Feng J,et al. Resveratrol attenuates neuroinflammation-mediated cognitive deficits in rats [J].Journal of Health Science,2010,56(6):655-663.
[8] 龚其海,石京山,杨丹莉.蛇床子素减轻Aβ(25-35)诱导的大鼠学习记忆减退及海马神经元结构损伤 [J].遵义医学院学报,2011,34(4):335-337.
[9] Knott A B,Bossy‐Wetzel E.Impairing the mitochondrial fission and fusion balance:a new mechanism of neurodegeneration [J].Annals of the New York Academy of Sciences,2008,1147(1):283-292.
[10]Gibson G E,Karuppagounder S S,Shi Q.Oxidant‐induced changes in mitochondria and calcium dynamics in the pathophysiology of alzheimer's disease [J].Annals of the New York Academy of Sciences,2008,1147(1):221-232.
[11]Kahn M S.A potential role for LPS-induced inflammation in the induction of Alzheimer's disease-related pathology and cognitive deficits [J].Dissertations amp; Theses - Gradworks,2011.1491006.
[12]Lykhmus O,Mishra N,Koval L,et al. Molecular mechanisms regulating LPS-induced Inflammation in thebrain [J].Frontiers in Molecular Neuroscience,2016,9.
[13]李明刚,邓媛媛,石京山,等.反复腹腔注射脂多糖诱导大鼠阿尔茨海默病样神经炎症 [J].遵义医学院学报,2014,37(3):295-299.
[14]Casolini P,Catalani A,Zuena A R,et al. Inhibition of COX-2 reduces the age-dependent increase of hippocampal inflammatory markers,corticosterone secretion,and behavioral impairments in the rat [J].Journal of Neuroscience Research,2002,68(3):337-343.
[15]Singh S,Singh R,Kushwah A S,et al. COX-2 pharmacology and its anti-inflammatory strategy in alzheimer's Disease [J].Ijrapronline Com,2013,3:14-28.
[16]Wang W Y,Tan M S,Yu J T,et al. Role of pro-inflammatory cytokines released from microglia in Alzheimer’s disease [J].Annals of Translational Medicine,2015,3(10):136.
[17]Cameron B,Landreth G E.Inflammation,microglia and alzheimer's disease [J].Neurobiology of Disease,2010,37(3):503.
[18]Alvarez A,Sampedro C,Cacabelos R.Overexpression of inflammation markers in alzheimer's disease:clinical correlates [J].Alzheimers amp; Dementia the Journal of the Alzheimers Association,2009,5(4):P133.
[19]Castillo L M,Moreno E,Rodríguezagudelo Y,et al. IL-1,TNF-and reactive serum proteins as biomarkers of mild cognitive impairment and alzheimer disease progression [J].Advances in Alzheimers Disease,2015,4(4):99-109.
[20]Xie L,Lai Y,Lei F,et al. Exploring the association between interleukin-1β and its interacting proteins in Alzheimer's disease [J].Molecular Medicine Reports,2015,11(5):3219-3228.
[21]龚其海,杨丹莉,石京山,等.白藜芦醇减轻慢性神经炎症所致的大鼠空间学习记忆减退 [J].中国新药杂志,2011,30(18):1817-1821.
[收稿2017-04-18;修回2017-06-17]
(编辑:谭秀荣)
基础医学研究
Resveratrolimproveslipopolysaccharide-inducedlearningandmemoryimpairmentthroughinhibitionofinflammation-relatedproteinexpressioninrats
LiMinggang1,2,DengYuanyuan1,GongQihai1
(1.Key Laboratory of Basic Pharmacology of Ministry of Education and Joint International Research Laboratory of Ethnomedicine of Ministry of Education,Zunyi Medical University,Zunyi Guizhou 563099,China; 2.People’s Hospital of Zunyi City Bozhou District,Zunyi Guizhou 563100,China)
ObjectiveTo observe the effects of resveratrol (Res) on Alzheimer's disease (AD)-like neuroinflammation in rats and explore its mechanisms.MethodsMale SD rats were randomly divided into sham-operated group (n=10) as control group,model group (n=15),positive group and model + Resveratrol (Res 10,20 and 40 mg/kg) groups (n=15 per groups).To construct inflammatory model,rats in the model group were intraperitoneally injected with lipopolysaccharide (LPS) at the dose of 0.5 mg/kg once a week continuously for 13 weeks.Meanwhile,the intragastric administration of distilled water,Ibuprofen (IBU,40 mg/kg) or Res (10,20 and 40 mg/kg) once a day for each group.Morris water maze was applied to investigate the cognitive function.Electron microscope was used to detect the hippocampal neuronal morphology.The expression of tumor necrosis factor (TNF-α),interleukin-10(IL-10) and cyclooxygenase-2 (COX-2) was analyzed by western blot assay.ResultsThe swimming distances in model group were obviously longer than those in sham group,while Res or IBU treatment significantly shortened the swimming distances compared with those in model rats.Electron microscopy showed that Res significantly reduced the ultrastructural damage of hippocampal neurons.Moreover,the overexpression of TNF-α,COX-2 and IL-1β protein in the hippocampus were significantly decreased after Res treatment.ConclusionRes improves spatial learning and memory in LPS-induced rats,and the possible mechanisms are due to inhibiting the expressions of pro-inflammatory cytokines.
Alzheimer’s disease; inflammation; lipopolysaccharide; resveratrol; rat
教育部“长江学者和创新团队发展计划”创新团队(NO:IRT_17R113)。
龚其海,男,博士,教授,硕士生导师,研究方向:神经药理学,E-mail:gqh@zmc.edu.cn。
R965
A
1000-2715(2017)05-0491-05
