CaMK II介导20-HETE诱导的乳鼠心肌细胞凋亡及肥大作用研究
2017-11-28贾蝉忆郭立荣陈远寿
贺 滟,贾蝉忆,韩 勇,郭立荣,陈远寿
(1.遵义医学院 基础医学院生理学教研室,贵州 遵义 563099;2.遵义医学院 基础医学院形态学实验室,贵州 遵义 563099)
基础医学研究
CaMK II介导20-HETE诱导的乳鼠心肌细胞凋亡及肥大作用研究
贺 滟1,贾蝉忆1,韩 勇1,郭立荣2,陈远寿1
(1.遵义医学院 基础医学院生理学教研室,贵州 遵义 563099;2.遵义医学院 基础医学院形态学实验室,贵州 遵义 563099)
目的探究CaMK II在20-HETE诱导的乳鼠心肌细胞凋亡和肥大中的作用。方法原代培养乳鼠心肌细胞,随机分为正常对照组(Con组),20-HETE组,20-HETE+KN-93组以及KN-93组;采用CCK-8法检测细胞活性、TUNEL法检测凋亡、HE染色后检测心肌细胞表面积、BAC法检测细胞内蛋白浓度;RT-qPCR检测心肌肥大特征性基因心钠肽(ANP)的表达;Western Blot检测CaMK II及其磷酸化蛋白表达。结果与对照组相比,20-HETE组心肌细胞活性显著下降,细胞凋亡率显著升高(Plt;0.05);同时,20-HETE明显促进心肌细胞表面积增加、蛋白浓度升高以及肥大基因ANP的表达上调(Plt;0.05);使用CaMK II抑制剂KN-93共孵育后,阻断了20-HETE诱导的细胞凋亡和肥大的作用(Plt;0.05);20-HETE促进心肌细胞CaMK II蛋白以及磷酸化CaMK II蛋白表达(Plt;0.05),具有激活CaMK II作用。结论20-HETE激活CaMK II信号通路诱导心肌细胞肥大和凋亡。
20-羟二十烷四烯酸;CaMK II;细胞肥大;细胞凋亡
20-羟二十烷四烯酸(20-hydroxyeicosatetraenoic acid ,20-HETE)是近年来发现的由细胞色素P-450(Cytochrome P450,CYP450)催化花生四烯酸(Arachidonic acid,AA)生成的代谢产物,它的生成与很多血管性疾病的发生发展相关,如高血压、脑血管疾病、肾脏疾病、冠心病、妊娠毒血症等[1]。近年研究发现20-HETE具有诱导心肌细胞凋亡作用[2],但其中机制尚待进一步阐明。此外,有大量证据表明20-HETE参与了心衰相关的非适应性心肌肥大进程中,如在异丙肾上腺素诱导的大鼠心肌肥大模型中,CYP4A和4F基因的表达增高、20-HETE的生成增加,抑制20-HETE生成可减小异丙肾上腺素诱导的心肌肥大[3],但目前20-HETE促进心肌肥大的机制尚不清楚。
CaMK II是广泛存在的一类由Ca2+/CaM激活的丝/苏氨酸蛋白激酶[4],可活化多种下游底物,包括离子通道、钙调节蛋白以及相关转录因子。在心脏中,CaMK II的激活一方面通过调节细胞内钙动员引起钙超载导致线粒体损伤以及活化多种凋亡信号通路诱导细胞凋亡,另一方面CaMKII可活化肥大相关转录因子,促进心肌细胞肥大[5-6]。而我们的前期研究发现20-HETE亦可通过诱发心肌细胞钙超载、过氧化损伤等机制导致细胞凋亡及心肌缺血再灌注损伤[7-8]。然而20-HETE对于心脏的作用是否与激活CaMK II相关,CaMK II信号通路是否参与了20-HETE诱导的细胞凋亡和肥大进程中,目前尚无报道。因此,本研究主要观察20-HETE对于培养的乳鼠心肌细胞凋亡及肥大的影响,并探究这其中CaMK II信号通路发挥的作用。
1 材料与方法
1.1 主要试剂与仪器 20-HETE、KN-93及II型胶原酶(Sigma公司,美国),胰蛋白酶(Hyclone公司,美国),青链霉素(哈药集团制药总厂,中国)、胎牛血清(江苏恩莫阿赛生物,中国),DMEM/F12培养基(HyClone公司,美国),CCK-8细胞活性检测试剂盒(同仁公司,日本),TUNEL细胞凋亡检测试剂盒(南京凯基生物公司,中国),逆转录试剂盒及荧光SYBR Green I(TaKaRa公司,日本),RNA引物合成(大连宝生物公司,中国),BCA蛋白定量试剂盒及4',6-二脒基-2-苯基吲哚(DAPI)(上海碧云天公司,中国),兔抗CaMKIIδ及兔抗磷酸化CaMKIIδ(p-CaMKIIδ-Thr287)抗体(Abcam公司,美国),β-actin及HRP标记二抗(Proteintech公司,美国),荧光显微镜(Olympus公司,日本),激光共聚焦显微镜(Leica公司,德国),PCR仪(BIO-RAD公司,美国)、酶标仪(Thermo公司,美国)、垂直电泳系统(BIO-RAD公司,美国),CO2细胞培养箱(Thermo公司,美国)。
1.2 实验方法
1.2.1 乳鼠心肌细胞原代培养 实验采用1~3日龄SD大鼠,购自第三军医大学实验动物中心。乳鼠开胸取出心脏,在冷DMEM/F12液中清洗后剪成1~3 mm3小块并移入三角烧杯中,加入胰酶及胶原酶,置于37 ℃恒温搅拌器中重复消化5次,每次7 min。细胞悬液置于含有15%胎牛血清的DMEM/F12中终止消化,1 000 g离心10 min,弃上清,加入含15%胎牛血清的DMEM/F12混匀悬浮,利用差速贴壁分离法将细胞置于培养箱中孵育90 min,将分离的心肌细胞以2~5×105个/mL的密度接种于6孔或96孔细胞培养板中。加入1%青、链霉素及0.1 mmol/L的5-溴脱氧尿嘧啶(抑制成纤维细胞生长),于5%CO2细胞培养箱37 ℃培养48 h后,更换无血清培养基继续培养12 h,用于后续实验。
1.2.2 实验分组 细胞无血清培养12 h后,分为对照组,培养液不做任何药物处理继续培养24 h;溶媒组(Vehicle组),培养液中加入相同浓度20-HETE的溶解物(乙醇)培养24 h;不同浓度20-HETE组(1 nmol/L、3 nmol/L、10 nmol/L、50 nmol/L、100 nmol/L)继续培养24 h,CCK-8法检测心肌细胞活性;其他实验将培养的细胞随机分为4组:对照组,培养液不做任何药物处理继续培养24 h;20-HETE组,培养液中加入100 nmol/L的20-HETE后继续培养24 h;20-HETE+KN-93组,培养液中加入KN-93(3 μmol/L)孵育30 min后加入100 nmol/L 20-HETE培养24 h;KN-93组(3 μmol/L),培养液中加入KN-93后培养24 h。
1.2.3 CCK-8法检测细胞活性 乳鼠心肌细胞于96孔板中更换无血清培养液培养12 h后,分别加入1 nmol/L、3 nmol/L、10 nmol/L、50 nmol/L和100 nmol/L不同浓度20-HETE,继续培养24 h检测细胞活性,分别加入10 μL CCK-8溶液孵育2 h,酶标仪450 nm波长检测吸光度,每组设置6个复孔,重复3次,取平均值。
1.2.4 TUNEL法检测心肌细胞凋 亡各组心肌细胞处理24 h后,4%多聚甲醛固定细胞20 min,PBS溶液冲洗3次,0.1% Triton X-100溶液处理10 min,PBS冲洗后加入50 μL TUNEL反应混合液,37 ℃避光孵育60 min,PBS溶液冲洗后加入DAPI(1 μg/mL)染色5 min标记所有细胞核,用抗荧光淬灭封片液封片后荧光显微镜下观察。激发波长范围为450~500 nm,发射波长范围为515~565 nm,TUNEL阳性细胞为绿色荧光,计算每100个细胞中核阳性荧光占百分比。
1.2.5 HE染色法检测心肌细胞表面积 将乳鼠心肌细胞接种于6孔板中,使用不同药物处理后进行HE染色,采用Image-pro plus 6.0软件分析系统测量心肌细胞的表面积。随机选择5个视野,每视野随机测定10个心肌细胞,每组重复3次。
1.2.6 BAC法检测心肌细胞内总蛋白浓度 将乳鼠心肌细胞接种于6孔板中,按照实验分组的细胞处理方式作用24 h后,收集细胞,PBS洗涤3次,加入RIPA细胞裂解液,冰上裂解30 min,12 000 g,4 ℃离心30 min,收集上清,依照BCA蛋白浓度检测试剂盒说明书,将标准品和样品分别加到96孔板的标准品孔和样品孔中,各孔加入200 μL BCA工作液,37 ℃放置30 min,用酶标仪测定595 nm波长的吸光度,根据标准曲线和使用的样品体积计算出样品的蛋白浓度
1.2.7 RT-qPCR检测心肌细胞心钠肽(ANP)基因的表达 用Trizol提取心肌细胞中的总RNA,测定RNA纯度,紫外分光光度计波长260 nm和280 nm检测吸光度(A),A260nm/A280nm值为1.8~2.0。将其逆转录为cDNA,进行PCR扩增。引物序列:β-actin 150 bp,上游:5'-GGAGATTACTGCCCTGGCTCCTA-3 ',下游:5 '-GACTCATCGTACTCCTGCTTGCTG -3';ANP 195 bp,上游:5-TGACAGGATTGGAGCCCAGAG-3 ',下游:5'- TCGATCGTGATAGATGAAGACAGGA- 3 '。反应条件为,预变性94 ℃、30 s;变性94 ℃、5 s;退火60 ℃、30 s;共40个循环,结果分析采用2-ΔΔCt方法。
1.2.8 Western blot 检测心肌细胞CaMK II及磷酸化CaMK II的表达 乳鼠心肌细胞使用不同药物处理后,加入细胞裂解液,离心后取上清液BCA法检测蛋白浓度。每上样孔取60μg总蛋白经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜后封闭1 h,分别加入一抗(兔抗CaMKIIδ以及兔抗p-CaMKIIδ-Thr287,稀释比例:1∶1 000)4 ℃摇床孵育过夜。加入二抗(抗鼠或抗兔,稀释比例:1∶2 000)室温孵育1 h。ECL法显影,暗室曝光,软件分析蛋白条带光度值,β-actin作为内参(稀释比例:1∶1 000),以靶蛋白/β-actin的比值反应蛋白表达水平。
2 结果
2.1 不同浓度的20-HETE对心肌细胞存活率的影响 结果如图1所示,不同浓度的20-HETE(1、3、10、50、100 nmol/L)处理的心肌细胞培养24 h后,均可降低心肌细胞的存活率,表明20-HETE具有细胞损伤作用,且呈浓度依赖性降低心肌细胞活性。与对照组相比,100 nmol/L的20-HETE处理后心肌细胞活性显著下降至(58.3±4.22)%(Plt;0.05,见图1)。
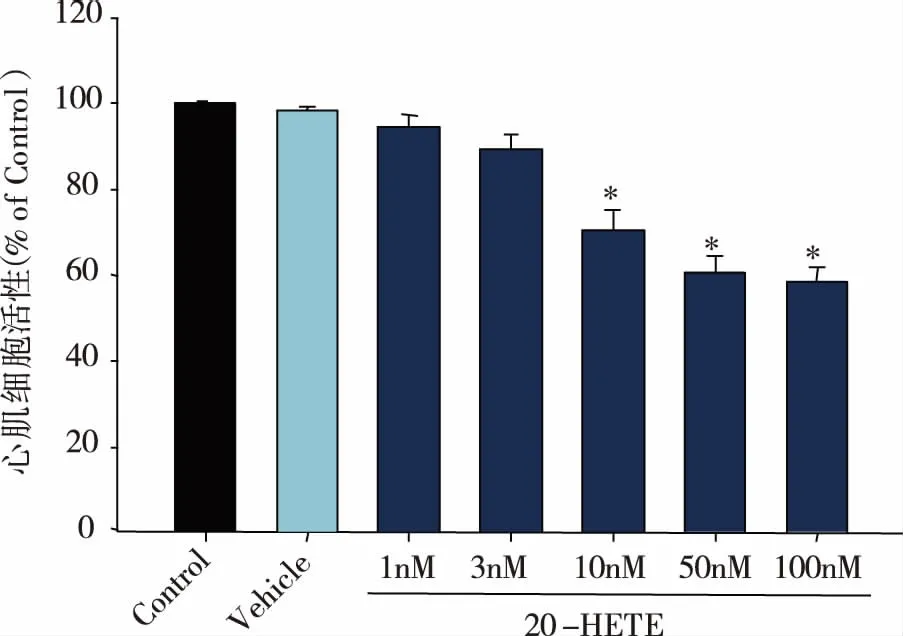
*:与Con组相比,Plt;0.05。 图1 不同浓度处理条件下20-HETE对心肌细胞活性的影响
2.2 KN-93阻断20-HETE诱导的乳鼠心肌细胞凋亡 结果如图2所示,与对照组相比,20-HETE组TUNEL染色阳性细胞由2.0±1.05显著增加至49.8±2.3(Plt;0.05),提示20-HETE具有诱导乳鼠心肌细胞凋亡作用。而当培养液中加入KN-93(3 μmol/L)共同孵育24 h后,TUNEL染色阳性细胞数量显著下降至23.1±4.12(Plt;0.05),单独KN-93组细胞凋亡与对照组相比差异无统计学意义(Pgt;0.05,见图2)。
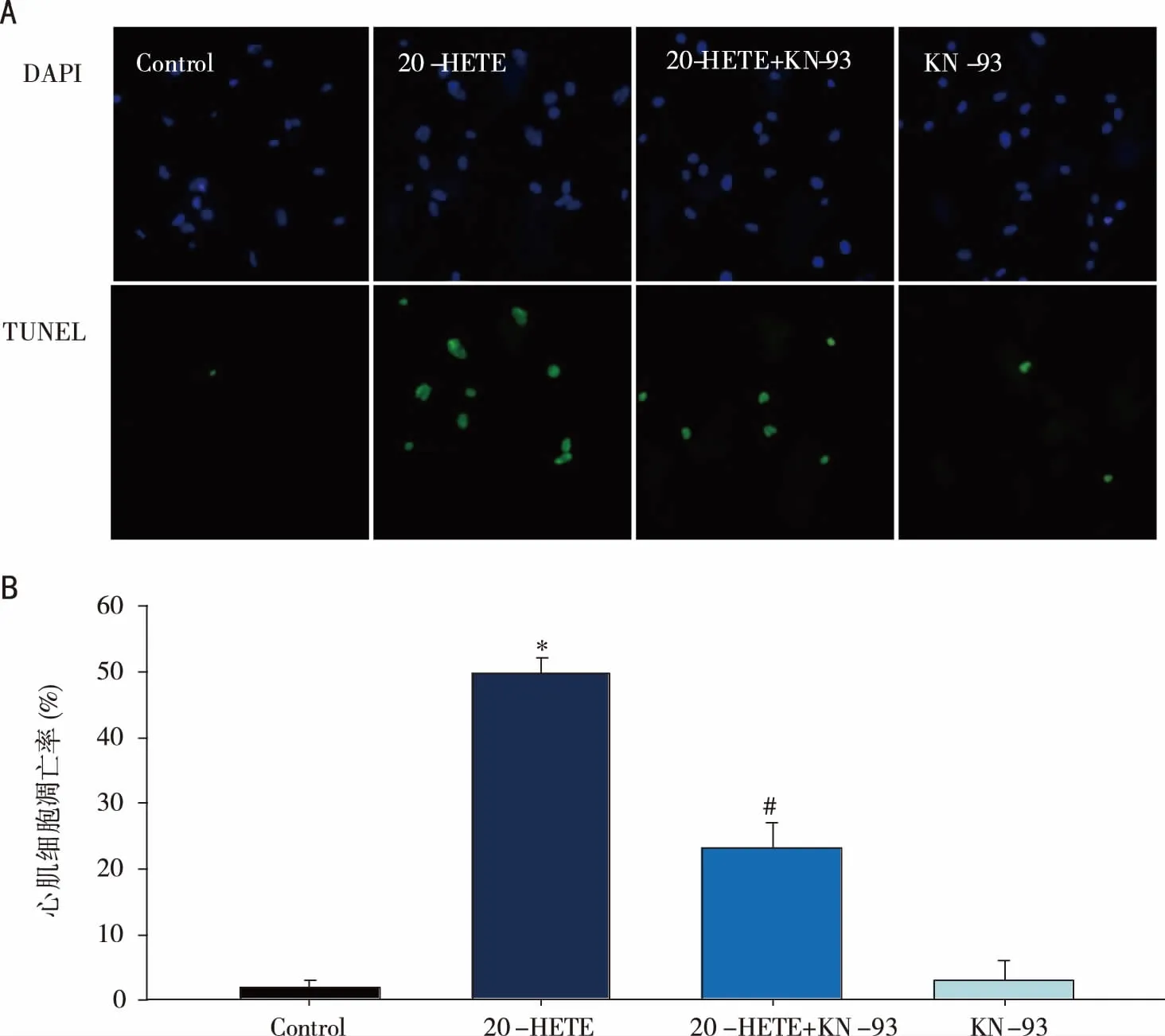
A:TUNEL染色后心肌细胞荧光图片(400×);B:TUNEL染色阳性细胞统计图。*:与Con组相比,Plt;0.05;#:与20-HETE组相比,Plt;0.05。图2 KN-93对20-HETE诱导的心肌细胞凋亡影响
2.3 20-HETE对心肌细胞表面积、总蛋白浓度的影响及KN-93的作用 为观察20-HETE对心肌细胞肥大的作用,细胞经20-HETE处理后,HE染色、IPP6图像分析软件测量心肌细胞表面积,BAC法检测心肌细胞内总蛋白浓度,结果见表1。20-HETE处理后的心肌细胞表面积由(501.2±20.5)μm2显著增加至(956.7±85.5)μm2(Plt;0.05),而与KN-93共同孵育后,与20-HETE组相比细胞表面积降至(687.5±102.0)μm2(Plt;0.05),单独KN-93组与对照组相比无显著差异(Pgt;0.05,见表1),通过对各组细胞总蛋白浓度检测发现,与对照组相比20-HETE组细胞总蛋白浓度显著增加至(2.46±0.05)mg/mL(Plt;0.05),而KN-93组细胞总蛋白浓度下降至(1.83±0.05)mg/mL(Plt;0.05),而与对照组相比无显著差异(Pgt;0.05,见表1)。
表1 20-HETE对心肌细胞表面积、总蛋白浓度的影响及KN-93的作用
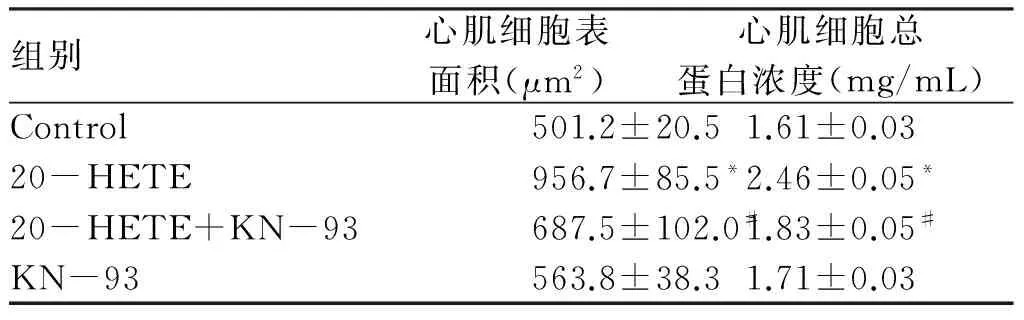
组别心肌细胞表面积(μm2)心肌细胞总蛋白浓度(mg/mL)Control501.2±20.51.61±0.0320-HETE956.7±85.5*2.46±0.05*20-HETE+KN-93687.5±102.0#1.83±0.05#KN-93563.8±38.31.71±0.03
*:与Con组相比,Plt;0.05;#:与20-HETE组相比,Plt;0.05。
2.4 20-HETE及KN-93对肥大特征性基因ANP表达的影响 心钠肽(atrial natriuretic peptide,ANP)表达增高是心肌肥大的特征性变化指标,因此本研究通过RT-qPCR检测了ANP的mRNA表达,结果发现20-HETE处理后心肌细胞ANP基因表达与对照组相比增加了53.9%(Plt;0.05),与20-HETE组相比,使用KN-93共孵育后显著降低了ANP基因的表达(Plt;0.05)。如上结果表明20-HETE可有效促进心肌细胞相关肥大基因的表达,而KN-93可部分阻断20-HETE的作用(见图3)。
2.5 20-HETE对CaMK II蛋白及磷酸化CaMKII蛋白水平表达的作用 CaMKIIδ亚型特异性表达于心肌组织,CaMKIIδ表达升高、活性增强(磷酸化水平增加)被认为与细胞凋亡、肥大甚至心衰密切相关。因此本研究检测了20-HETE对CaMKIIδ蛋白和磷酸化水平的影响。结果发现与空白对照组相比, 20-HETE处理后的心肌细胞中CaMKIIδ和磷酸化的CaMKIIδ蛋白表达与对照组相比明显增加(Plt;0.05),KN-93共孵育后阻断了这种效应(Plt;0.05)。如上结果表明20-HETE具有促进CaMKIIδ表达升高、活性增强的作用(见图4)。
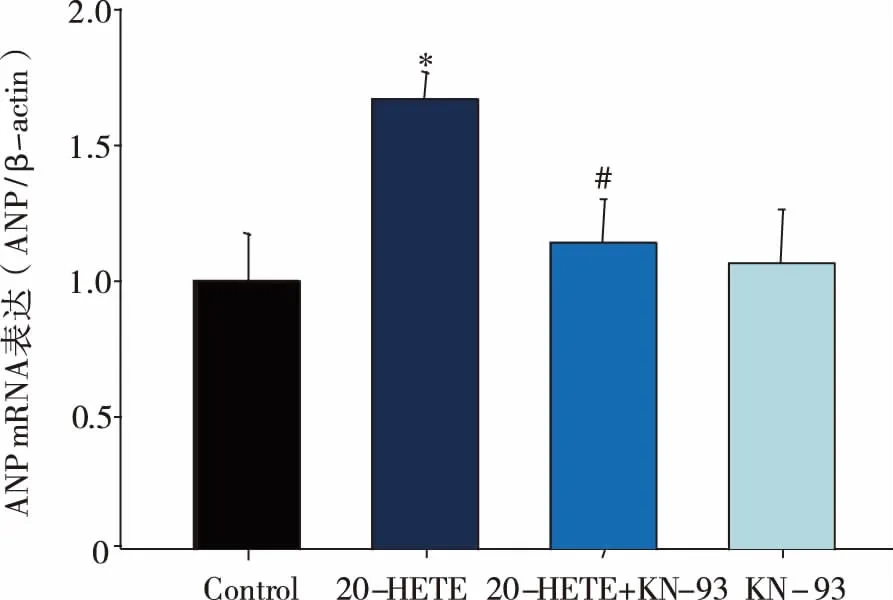
*:与Con组相比,Plt;0.05;#:与20-HETE组相比,Plt;0.05。图3 20-HETE及KN-93对ANP基因表达的影响

*:与Con组相比,Plt;0.05;#:与20-HETE组相比,Plt;0.05。图4 20-HETE对CaMKIIδ蛋白表达及磷酸化水平的作用
3 讨论
研究表明体内多种活性物质如内皮素-1(ET-1)、血管紧张素II(AngII)、去甲肾上腺素(NE)、异丙肾上腺素(ISO)等在促进心肌肥大及细胞凋亡方面发挥重要作用,从而参与相关心血管疾病的发生发展[9]。近年来的研究发现,另外一种内源性活性物质20-HETE具有诱导心肌细胞凋亡作用以及参与多种因素诱发的心肌肥大进程中。2004年Granville等[10]首先发现在心肌组织中表达CYP4A和4F酶,抑制20-HETE合成可改善再灌注后的心脏功能恢复[11]。我们的前期研究发现,在离体大鼠心脏灌流模型中,20-HETE可通过增加活性氧簇(ROS)生成、诱发心肌细胞凋亡加重再灌注后心肌损伤[8]。此外,在培养的乳鼠心肌细胞中发现,20-HETE参与了血管紧张素II诱导的心肌细胞凋亡[2,12]。与如上研究一致,本研究中发现20-HETE可呈浓度依赖性降低心肌细胞活性,TUNEL检测结果表明,20-HETE具有显著促进细胞凋亡作用。
目前有大量证据表明20-HETE参与了心衰相关的非适应性心肌肥大进程中。如在异丙肾上腺素诱导的大鼠心肌肥大模型中,CYP4A和4F基因的表达增高、抑制20-HETE生成可显著降低心肌肥大程度[13]。在苯并芘(benzo(a)pyrene)诱导心肌肥大进程中,促进包括CYP4F4在内的多种CYP ω-羟化酶的表达以及20-HETE的生成[14]。此外20-HETE也参与了AngII诱导的心肌肥大进程中[15]。本研究中发现20-HETE处理后,心肌细胞表面积明显增加、蛋白合成显著增强,同时心肌肥大标志性基因ANP表达增高,表明20-HETE具有直接促进心肌细胞肥大的效应,但其中机制尚待进一步研究。
CaMK II是广泛存在的一类由Ca2+/CaM激活的丝/苏氨酸蛋白激酶[4],包括4种不同亚型(CaMKIIα、CaMKIIβ、CaMKIIγ和CaMKIIδ),其中在心脏中主要表达CaMKIIδ。CaMKⅡ的表达增高和活性增强在心肌肥大和心肌细胞凋亡的发生中起着非常重要的作用[5-6]。如在压力超负荷、钙调神经磷酸酶(CaN)诱导的心肌肥大中,CaMKII的活性和表达增加[16]。另外,CaMK II的激活也参与了缺血再灌注损伤、内质网应激等多种因素诱导的细胞凋亡进程中[17-18]。在心脏中CaMKII的激活依赖于Ca2+/CaM,CaMKII与Ca2+/CaM结合后构象改变暴露出活性中心,同时调节域中的自身磷酸化位点Thr287磷酸化,这是CaMKII发挥功能的重要特征[19]。
近年研究发现β-肾上腺素能受体(β-AR)激动剂(如异丙肾上腺素)以及G蛋白偶联受体(GPCRs)激动剂(如AngII、NE、ET-1)等活性物质,可通过升高细胞内Ca2+浓度或者增加ROS含量、导致CaMK II氧化激活等途径活化CaMK II[20-21]。而在本研究中发现,20-HETE可促进心肌细胞CaMKIIδ蛋白过表达,同时提高CaMKIIδ的Thr287位点磷酸化水平,表明20-HETE具有明显激活CaMK II的作用。虽然20-HETE激活CaMKII的具体机制尚待探明,但我们前期研究表明,20-HETE具有激活心肌细胞L-型钙离子通道、增加细胞内Ca2+浓度以及诱发细胞内ROS生成等生物作用[7-8],细胞内Ca2+浓度升高是激活CaMKII的必要条件,而细胞内ROS水平增高则可对CaMKII调节结构域氧化修饰,阻止与催化结构域的重新结合从而保持激酶活性[4]。因此,20-HETE对心肌细胞内Ca2+浓度及ROS生成的影响是其激活CaMKII的重要的潜在机制。
在心脏中,CaMKII的激活进一步引起细胞内Ca2+浓度升高,导致线粒体内钙超载诱发凋亡,CaMKII还可通过激活c-jun氨基末端激酶(JNK)及核因子-κB(NF-κB)等信号转导通路诱导心肌细胞凋亡[5]。另一方面,CaMKII激活后介导II类组蛋白脱酰酶(HDAC)的活化解除其对心肌细胞强化因子(MEF22)的抑制,通过转录因子MEF22激活诱导心肌肥大[6]。CaMKII还可通过ERK信号通路以及钙调神经磷酸酶(CaN)介导的活化T细胞核因子(NFAT)通路诱导ANP等肥大基因表达[22-23]。在本研究中,应用CaMK II特异性抑制剂KN-93抑制其作用,有效阻断了20-HETE诱导的细胞凋亡及肥大效应,降低细胞凋亡率、细胞表面积、蛋白合成以及肥大基因ANP的表达,证实CaMKII介导了20-HETE所诱导的心肌细胞凋亡与肥大作用。
综上所述,本研究在培养的乳鼠心肌细胞中发现,20-HETE具有上调CaMKIIδ表达和提高其磷酸化水平的作用,并通过激活CaMKII诱导了心肌细胞凋亡和肥大,这可能是20-HETE加重心肌缺血再灌注损伤的重要机制,为临床治疗相关的缺血性心肌病以及心衰的药物治疗靶点提供了新思路。
[1] Hoopes S L,Garcia V,Edin M L,et al.Vascular actions of 20-HETE [J].Prostaglandins amp; Other Lipid Mediators,2015,120:9-16.
[2] Bao Y,Wang X,Li W,et al.20-Hydroxyeicosatetraenoic acid induces apoptosis in neonatal rat cardiomyocytes through mitochondrial-dependent pathways [J].J Cardiovasc Pharmacol,2011,57(3):294-301.
[3] Tse M M,Aboutabl M E,Althurwi H N,et al.Cytochrome P450 epoxygenase metabolite,14,15-EET,protects against isoproterenol-induced cellular hypertrophy in H9c2 rat cell line [J].Vascular Pharmacology,2013,58(5-6):363-373.
[4] Erickson J R,He B J,Grumbach I M,et al.CaMKII in the cardiovascular system:sensing redox states [J].Physiol Rev,2011,91(3):889-915.
[5] Feng N,Anderson M E.CaMKII is a nodal signal for multiple programmed cell death pathways in heart [J].Journal of Molecular and Cellular Cardiology,2017,103:102:109.
[6] Anderson M E,Brown J H,Bers D M.CaMKII in myocardial hypertrophy and heart failure [J].J Mol Cell Cardiol,2011,51(4):468-473.
[7] Zeng Q,Han Y,Bao Y,et al.20-HETE increases NADPH oxidase-derived ROS production and stimulates the L-type Ca2+channel via a PKC-dependent mechanism in cardiomyocytes [J].American Journal of Physiology Heart and Circulatory Physiology,2010,299(4):1109-1117.
[8] Han Y,Zhao H,Tang H,et al.20-Hydroxyeicosatetraenoic acid mediates isolated heart ischemia/reperfusion injury by increasing NADPH oxidase-derived reactive oxygen species production [J].Circ J,2013,77(7):1807-1816.
[9] Tham Y K,Bernardo B C,Ooi J Y,et al.Pathophysiology of cardiac hypertrophy and heart failure:signaling pathways and novel therapeutic targets [J].Archives of Toxicology,2015,89(9):1401-1438.
[10]Granville D J,Tashakkor B,Takeuchi C,et al.Reduction of ischemia and reperfusion-induced myocardial damage by cytochrome P450 inhibitors [J].Proc Natl Acad Sci U S A,2004,101(5):1321-1326.
[11]Nithipatikom K,Endsley M P,Moore J M,et al.Effects of selective inhibition of cytochrome P-450 omega-hydroxylases and ischemic preconditioning in myocardial protection [J].Am J Physiol Heart Circ Physiol,2006,290(2):H500.
[12]Zhao H,Qi G,Han Y,et al.20-Hydroxyeicosatetraenoic Acid Is a Key Mediator of Angiotensin II-induced Apoptosis in Cardiac Myocytes [J].J Cardiovasc Pharmacol,2015,66(1):86-95.
[13]Althurwi H N,Maayah Z H,Elshenawy O H,et al.Early changes in cytochrome P450s and their associated arachidonic acid metabolites play a crucial role in the initiation of cardiac hypertrophy induced by isoproterenol [J].Drug Metabolism and Disposition:the Biological Fate of Chemicals,2015,43(8):1254-1266.
[14]Aboutabl M E,Zordoky B N,Hammock B D,et al.Inhibition of soluble epoxide hydrolase confers cardioprotection and prevents cardiac cytochrome P450 induction by benzo(a)pyrene [J].Journal of Cardiovascular Pharmacology,2011,57(3):273-281.
[15]Elkhatali S,El-sherbeni A A,Elshenawy O H,et al.19-Hydroxyeicosatetraenoic acid and isoniazid protect against angiotensin II-induced cardiac hypertrophy [J].Toxicology and Applied Pharmacology,2015,289(3):550-559.
[16]Backs J,Backs T,Neef S,et al.The delta isoform of CaM kinase II is required for pathological cardiac hypertrophy and remodeling after pressure overload [J].Proc Natl Acad Sci U S A,2009,106(7):2342-2347.
[17]Roe N D,Ren J.Oxidative activation of Ca2+/calmodulin-activated kinase II mediates ER stress-induced cardiac dysfunction and apoptosis [J].Am J Physiol Heart Circ Physiol,2013,304(6):H828-839.
[18]Di carlo M N,Said M,Ling H,et al.CaMKII-dependent phosphorylation of cardiac ryanodine receptors regulates cell death in cardiac ischemia/reperfusion injury [J].Journal of Molecular and Cellular Cardiology,2014,74(3):274-283.
[19]Erickson J R.Mechanisms of CaMKII Activation in the Heart [J].Frontiers in Pharmacology,2014,5(5):59.
[20]Anderson M E.Oxidant stress promotes disease by activating CaMKII [J].Journal of Molecular And Cellular Cardiology,2015,89(Pt B):160-167.
[21]Zhang T,Zhang Y,Cui M,et al.CaMKII is a RIP3 substrate mediating ischemia- and oxidative stress-induced myocardial necroptosis [J].Nature Medicine,2016,22(2):175-182.
[22]Cipolletta E,Rusciano M R,Maione A S,et al.Targeting the CaMKII/ERK Interaction in the Heart Prevents Cardiac Hypertrophy [J].Plos One,2015,10(6):e0130477.
[23]Kreusser M M,Lehmann L H,Keranov S,et al.Cardiac CaM Kinase II genes delta and gamma contribute to adverse remodeling but redundantly inhibit calcineurin-induced myocardial hypertrophy [J].Circulation,2014,130(15):1262-1273.
[收稿2017-07-24;修回2017-08-25]
(编辑:谭秀荣)
基础医学研究
StudyontheroleofCaMKII-mediated20-HETE-inducedhypertrophyandapoptosisinneonatalratcardiomyocytes
HeYan1,JiaChanyi1,HanYong1,GuoLirong2,ChenYuanshou1
(1.Department of Physiology,School of Basic Medical Sciences,Zunyi Medical University,Zunyi Guizhou 563099,China; 2.Morphological Laboratory,School of Basic Medical Sciences,Zunyi Medical University,Zunyi Guizhou 563099,China)
ObjectiveTo investigate the role of CaMKII on 20-HETE-induced cardiomyocyte apoptosis and hypertrophy in neonatal rats.MethodsPrimary cultured neonatal rat cardiomyocytes were randomly divided into normal control group (Con group),20-HETE group,20-HETE+KN-93 group and KN-93 group.CCK-8 method was used to detect the cell activity and TUNEL assay was performed to analyze the cell apoptosis.The surface area of cardiomyocytes was measured after HE staining and total intracellular protein levels were detected by commercial BCA protein kit.RT-qPCR was used to measure the expression of hypertrophic biomarkers ANP.Western blot assay was performed to measure the expression of CaMKII and phospho-CaMKII.ResultsCompared with Con group,the cell viability was obviously decreased and the apoptotic rate was significantly increased in 20-HETE group (Plt;0.05).Meanwhile,the cell surface area and total protein levels were significantly increased and the mRNA expression of hypertrophic markers ANF was up-regulated by 20-HETE treatment (Plt;0.05),whereas co-treatment with KN-93 (3 μmol/L) significantly attenuated the effects of 20-HETE-induced apoptosis and hypertrophy (Plt;0.05).Finally,treatment with 20-HETE significantly increased the protein expression of CaMKII and phospho-CaMKII in cardiomyocytes (Plt;0.05),indicating 20-HETE activated the CaMKII signaling pathway.Conclusion20-HETE activates the CaMKII signaling pathway,which is involved in 20-HETE-induced apoptosis and hypertrophy in neonatal rat cardiomyocytes.
20-HETE; CaMKII; hypertrophy; apoptosis
国家自然科学基金资助项目(NO:81460040);贵州省科学技术基金资助项目(NO:黔科合LH字[2014]7544);遵义医学院博士启动基金项目(NO:F-659)。
陈远寿,男,教授,硕士生导师,研究方向:神经生理学,E-mail:hotfog@126.com;韩勇,男,副教授,研究方向:心脏生理学,E-mail:hany@zmc.edu.cn。
R542.2
A
1000-2715(2017)05-0475-07
