糖蜜发酵裂殖壶菌生产二十二碳六烯酸
2017-11-27班甲陈骏佳付尽国杨李胜陆剑华李浩洋
班甲,陈骏佳,付尽国,杨李胜,陆剑华,李浩洋
(广东省生物工程研究所(广州甘蔗糖业研究所), 广东省甘蔗改良与生物炼制重点实验室,广东省生物质高值化利用工程实验室,广东省植物纤维综合利用工程技术研究开发中心,广州市植物纤维综合利用重点实验室,广东 广州,510316)
糖蜜发酵裂殖壶菌生产二十二碳六烯酸
班甲,陈骏佳*,付尽国,杨李胜,陆剑华,李浩洋
(广东省生物工程研究所(广州甘蔗糖业研究所), 广东省甘蔗改良与生物炼制重点实验室,广东省生物质高值化利用工程实验室,广东省植物纤维综合利用工程技术研究开发中心,广州市植物纤维综合利用重点实验室,广东 广州,510316)
对糖蜜作为碳源发酵裂殖壶菌生产二十二碳六烯酸(docosahexaenic acid,DHA)进行了初步研究:选择不同来源的甘蔗糖蜜与粗糖蜜培养裂殖壶菌生产DHA,考察了糖蜜来源、糖蜜添加比例对裂殖壶菌发酵生物量、菌体油脂含量与DHA含量的影响。结果表明,甘蔗糖蜜中的杂质(灰分、胶体)对菌体生长与油脂积累存在明显的抑制作用,即使大幅降低糖蜜添加比例效果也不理想,限制了其作为替代碳源在实际生产上的应用。在此基础上考察了杂质含量相对较低的粗糖蜜的情况,在添加比例低于80%的情况下,其培养效果与对照葡萄糖非常接近,可以部分替代葡萄糖用于裂殖壶菌发酵生产。
裂殖壶菌;DHA;糖蜜;发酵
二十二碳六烯酸(docosahexaenic acid,DHA)是一种重要的ω-3长链不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)[1],具有促进大脑与视网膜发育,抗凝血,降低血脂,防治老年人痴呆症与癌症等重要功效[2-5]。人体只能利用食物中获取的亚麻酸合成少量DHA,无法满足身体营养需求,所以从饮食中获取DHA已成为共识。因传统深海鱼油提取DHA存在诸多缺点[6-7],利用微生物发酵生产DHA已成为主流[8-9]。裂殖壶菌因其较快的生长速度和较高的油脂与DHA含量,一直以来被认为是理想的DHA生产菌株[10]。目前裂殖壶菌发酵原料主要为葡萄糖,生产成本较高,利用廉价或废弃生物质(甜高粱汁[11]、清酒发酵废液[12]、粗甘油[13]等)作为原料培养裂殖壶菌生产DHA已见报道,为降低生产成本提供了新的思路。
糖蜜为制糖产业副产物,含有丰富的蔗糖、还原糖(葡萄糖,果糖)、氨基酸、维生素与微量元素等营养物质,且价格低廉,是一种优良的发酵原料。其缺点为含有大量的胶体、灰分等杂质,不同程度地影响了发酵产品的产量与质量[14-15]。
本实验选择了不同来源的甘蔗糖蜜与粗糖蜜培养裂殖壶菌生产DHA,考察了糖蜜来源、糖蜜添加比例对裂殖壶菌发酵生物量、菌体油脂含量与DHA含量的影响,为以廉价糖蜜作为碳源工业化生产DHA提供理论依据。
1 材料与方法
1.1菌株
裂殖壶菌(Schizochytriumsp.),海水中分离筛选,保存于-70 ℃超低温冰箱中。
1.2糖蜜
甘蔗糖蜜分别取自广东、广西8家糖厂;粗糖蜜取自广州华侨糖厂与东莞东糖集团。
1.3培养基
普通种子培养基(g/L):葡萄糖30、酵母粉10、(NH4)2SO40.8、Na2SO45、MgSO4·7H2O 2、KH2PO40.5、KCl 0.5、CaCl2·2H2O 0.1,pH 6.0。
普通发酵培养基(g/L)[16]:葡萄糖40、酵母粉10、(NH4)2SO40.8、Na2SO45、MgSO4·7H2O 2、KH2PO40.5、KCl 0.5、CaCl2·2H2O 0.1、FeSO4·7H2O 0.003、MnCl2·4H2O 0.001、ZnSO4·7H2O 0.0008、CoCl2·6H2O 0.000 02、Na2MoO4·2H2O 0.000 01、CuSO4·5H2O 0.000 6、NiSO4·6H2O 0.000 8、VB10.005、维生素VB120.014、生物素0.006,pH 6.0。
糖蜜种子与发酵培养基:糖蜜处理液以培养基中总还原糖30 g/L或40 g/L计算加入,其余成分与普通培养基相同。
1.4培养方法
[17]提供的方法进行。
1.5糖蜜预处理
将糖蜜加蒸馏水稀释至锤度55°BX,加入浓H2SO4调至pH2,90 ℃水浴加热30 min,将蔗糖充分水解为还原糖,待糖液温度降至70 ℃加NaOH调节 pH 7.0,加入聚丙烯酰胺3 mg/L,保温10 min,8 000 r/min离心10 min,取上清液备用。
1.6测定方法
生物量:按参考文献[17]提供的方法进行。油脂含量:按参考文献[17]提供的方法进行。DHA含量的测定:按参考文献[17]提供的方法进行。还原糖浓度:采用DNS法测定[1]。糖蜜成分:糖蜜锤度、蔗糖、还原糖、胶体与灰分测定参照QB/T2684—2005[18]。
2 结果与分析
2.1不同来源甘蔗糖蜜灰分分析与预处理
2.1.1 甘蔗糖蜜灰分分析
甘蔗糖蜜中的灰分以钾盐与钙盐为主,其含量随甘蔗品种、种植气候、成熟程度、土壤条件、田间管理和制糖工艺流程等不同而变化[15]。本实验调查了广东翁源、广西南宁、崇左、贵港等地共8家糖厂糖蜜中的灰分,试图寻找到灰分含量较低的糖蜜作为发酵原料。从表1中的结果可以看出,糖蜜灰分含量与糖厂所在地区和制糖工艺存在一定联系:广东翁源因气温偏低导致蔗汁中胶体含量高,在制糖澄清过程中加入石灰量大,所以糖蜜灰分含量明显高于广西各地糖蜜;广西扶南糖厂因采用碳酸法制糖,其工艺除杂效果要好于亚硫酸法,所以糖蜜灰分含量最低。根据上述结果采集广东翁源、广西良圻、广西大新3家糖厂的糖蜜作为发酵实验原料。
2.1.2 糖蜜预处理
选择广东翁源、广西良圻、广西大新3家糖厂糖蜜,对其进行了酸化、中和、絮凝、离心处理,将糖蜜中的蔗糖基本分解为还原糖,去除了糖蜜中大部分胶体及部分钾离子、钙离子,结果见表2。
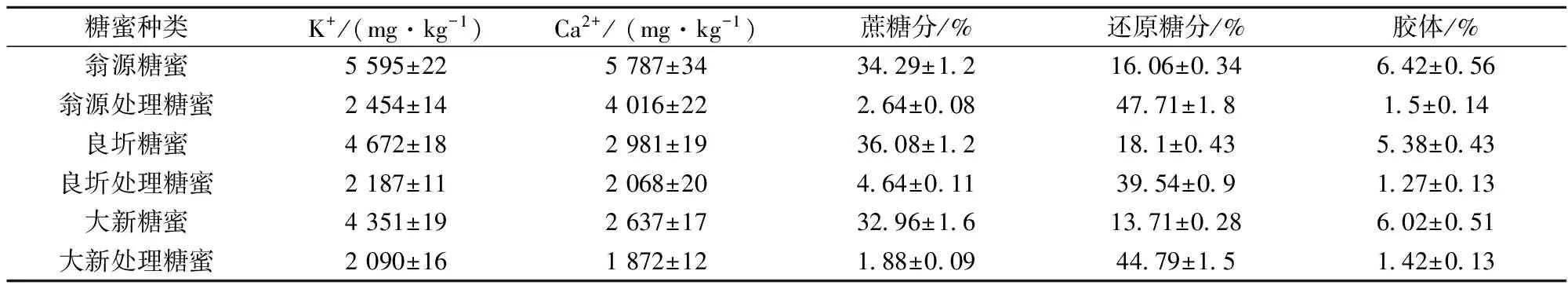
表2 预处理后糖蜜主要成分
2.2不同来源甘蔗糖蜜培养裂殖壶菌
裂殖壶菌对葡萄糖、果糖都可以很好地利用[17],故以葡萄糖为对照,考察不同来源甘蔗糖蜜作为碳源对裂殖壶菌生物量、菌体油脂含量与DHA含量的影响。发酵培养基中糖蜜处理液以还原糖40 g/L计算加入,结合表3和表4的结果可以看出:良圻与大新2种糖蜜处理液中杂质含量接近,由于良圻糖蜜还原糖含量偏低,导致其加入量增加,使得其培养基中的K+、Ca2+含量高于大新糖蜜培养基;翁源与大新2种糖蜜处理液的加入量接近,由于翁源糖蜜中灰分含量太高,导致其培养基中的K+、Ca2+含量最高。图1结果表明:与葡萄糖相比,以3种甘蔗糖蜜为碳源培养裂殖壶菌其生物量、菌体油脂含量均有不同程度下降,说明甘蔗糖蜜处理液中残留的杂质(灰分、胶体)对裂殖壶菌的生长与油脂积累存在明显的抑制作用,油脂中DHA含量差异不显著,说明甘蔗糖蜜中杂质并不会特异性抑制细胞内DHA的合成。在胶体含量接近的情况下,3种甘蔗糖蜜培养基中灰分含量越低,发酵结果越好,说明甘蔗糖蜜中灰分含量对裂殖壶菌生长与油脂积累影响显著,与预期结果相符。

表3 甘蔗糖蜜培养基中的杂质含量

表4 大新糖蜜培养基中的杂质含量
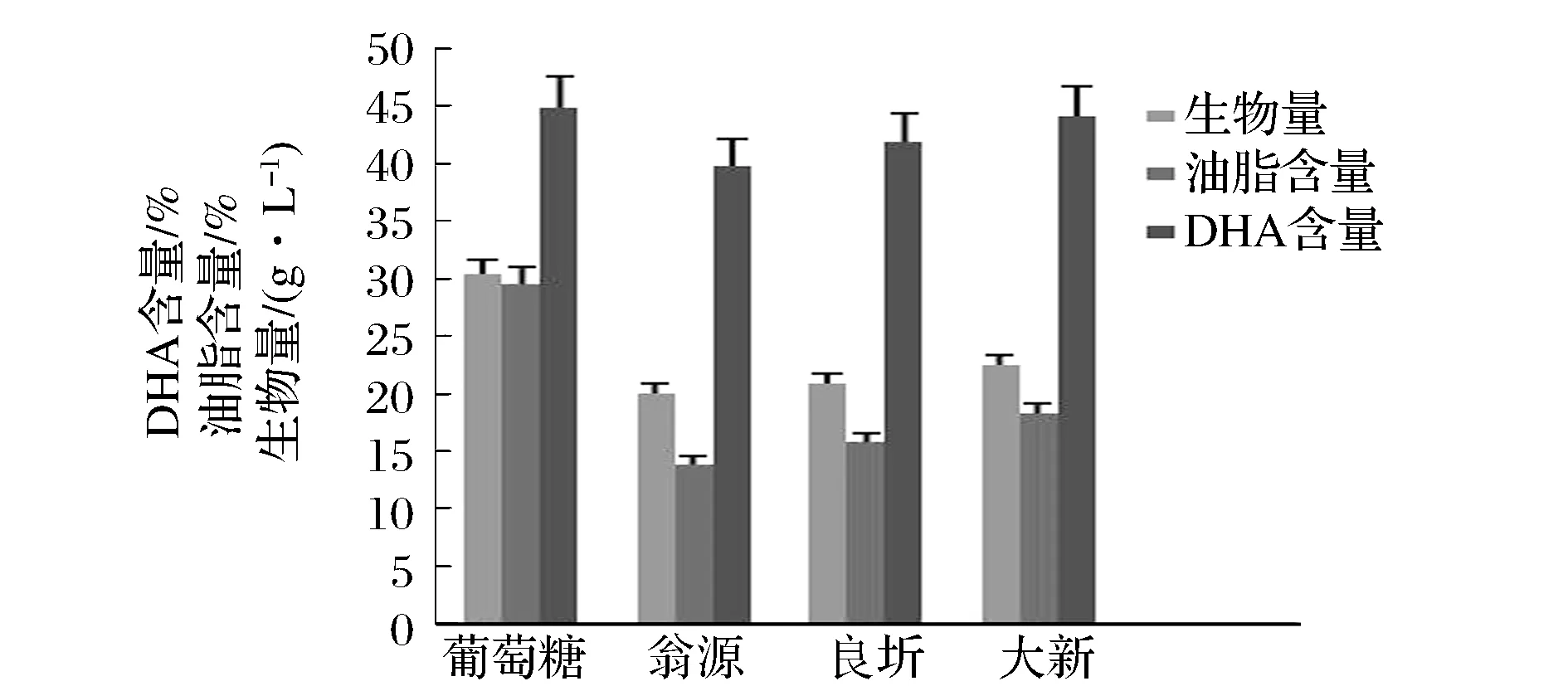
图1 不同来源甘蔗糖蜜培养裂殖壶菌对生物量、油脂含量、DHA含量的影响Fig.1 The effect of molasses from different sugar refineries on biomass, lipid and DHA production by Schizochytrium sp.
2.3不同甘蔗糖蜜添加比例培养裂殖壶菌的比较
根据先前的实验结果,选择大新糖厂糖蜜培养裂殖壶菌。以葡萄糖为对照,糖蜜处理液按照培养基中总还原糖的30%、60%、90%比例加入,余下部分通过葡萄糖补足,比较不同糖蜜添加比例对裂殖壶菌发酵的影响。图2中的结果显示裂殖壶菌发酵各项指标与甘蔗糖蜜添加比例成负相关,甘蔗糖蜜添加比例越高,菌体生物量与油脂含量越低,添加比例下降到30%的结果与对照相比仍存在明显差距。

图2 不同糖蜜添加比例对裂殖壶菌发酵影响Fig.2 The effect of different molasses formula on biomass, lipid and DHA production by Schizochytrium sp.
2.4粗糖蜜预处理
从上述的实验结果可以看出,甘蔗糖蜜中杂质含量太高,即使大幅降低其添加比例对裂殖壶菌的生长与油脂合成的抑制作用仍然很显著,进一步除杂的成本又太高,并不适合作为裂殖壶菌发酵的替代碳源。制糖工业除了以甘蔗、甜菜为原料制作成品糖外,还以原糖或砂糖为原料精炼生产各种精制糖,即炼糖。炼糖的生产过程一般包括蜜洗、清净、脱色、结晶、分蜜和干燥等工序,在此过程中产生的糖蜜即为粗糖蜜[19]。粗糖蜜的总糖分与甘蔗糖蜜相当,杂质含量相对较少,更适宜作为发酵原料。故本实验分别选取了以砂糖为原料的广州华侨糖厂粗糖蜜(华蜜)与以原糖为原料的东莞东糖集团粗糖蜜(东蜜),对这2种粗糖蜜进行了预处理,成分分析结果见表5。
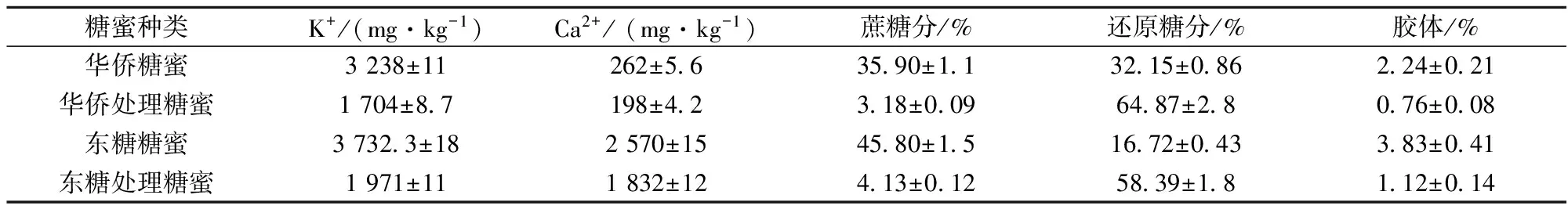
表5 预处理后粗糖蜜主要成分
从表5中可以看出,以砂糖为原料的华蜜中的杂质要大大低于以原糖为原料的东蜜,分析原因一是砂糖中的杂质成分要大大低于原糖;二是华侨糖厂的工艺为采用压滤糖汁除去不溶物,采用膜过滤脱色,整个炼糖过程几乎未添加助剂;而东糖的工艺为传统亚硫酸法,与普通甘蔗制糖类似,需添加石灰等大量助剂,导致糖蜜中杂质较多。
2.5粗糖蜜培养裂殖壶菌
以葡萄糖与大新糖蜜为对照,考察2种粗糖蜜作为碳源对裂殖壶菌生物量、菌体油脂含量与DHA含量的影响。发酵培养基中糖蜜处理液以还原糖40g/L计算加入,结合表6和图3的结果可以看出:因为2种粗糖蜜中灰分与胶体含量低于大新糖蜜,且其还原糖含量较高,使得在培养基中的添加量减少,所以2种粗糖蜜培养基中的灰分与胶体含量都要低于大新糖蜜培养基,以2种粗糖蜜为碳源培养裂殖壶菌其生物量、菌体油脂含量均有较大幅度的提升;华侨与东糖2种糖蜜相比,因为华侨糖蜜杂质量更少,还原糖含量更高,所以培养结果也优于东糖糖蜜。实验结果再次验证了糖蜜中的杂质(灰分,胶体)是影响发酵结果的关键因素,除杂工艺的高成本限制了甘蔗糖蜜的应用,选择低杂质含量的粗糖蜜是一个更优的选择。
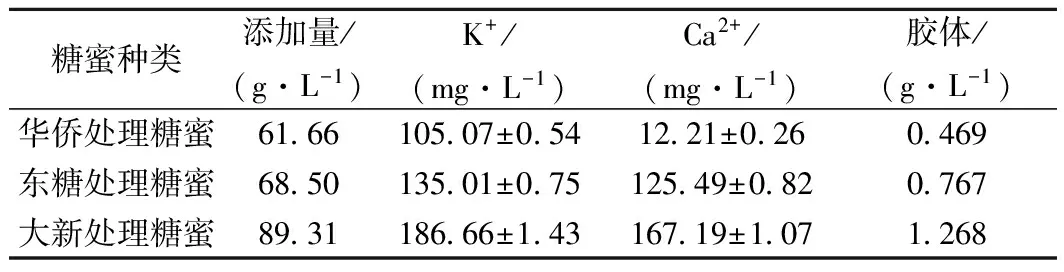
表6 粗糖蜜培养基中的杂质含量
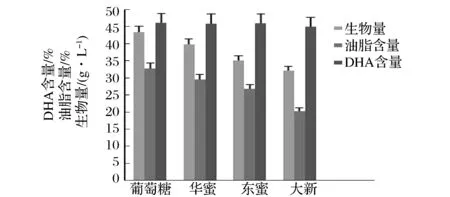
图3 不同来源粗糖蜜培养裂殖壶菌对生物量、油脂含量和DHA含量的影响Fig.3 The effect of refined molasses from different sugar refineries on biomass, lipid and DHA production by Schizochytrium sp.
2.6不同粗糖蜜添加比例培养裂殖壶菌的比较
根据先前的实验结果,选择华侨糖厂粗糖蜜培养裂殖壶菌。以葡萄糖为对照,糖蜜处理液按照培养基中总还原糖的40%、60%、80%加入,余下部分通过葡萄糖补足,比较不同糖蜜添加比例对裂殖壶菌发酵的影响。结合表7和图4的结果可以看出:因为华蜜的杂质含量较低,还原糖含量高,在添加比例60%的条件下其发酵结果依然良好,与对照相比差别不大,添加比例提高到80%后生物量与油脂含量有明显下降;结合成本因素考虑,在实际生产中的添加比例为60%~80%。3种华蜜培养基中的Ca2+与胶体含量都比较低,差别不大,K+含量可能是决定发酵结果的关键因素。对比添加30%大新糖蜜培养基与添加60%华侨糖蜜培养基,两种培养基中K+含量接近,前者略低,胶体含量也比较接近,Ca2+含量后者远低于前者,使得后者发酵结果要优于前者。以上结果再次说明K+、Ca2+等灰分含量是影响糖蜜发酵培养裂殖壶菌的关键因素,获得低灰分含量,高还原糖含量的糖蜜原料是其在裂殖壶菌发酵中开展大规模应用的重点。

表7 华侨糖蜜培养基中的杂质含量

图4 不同粗糖蜜添加比例对裂殖壶菌发酵影响Fig.4 The effect of different refined molasses formula on biomass, lipid and DHA production by Schizochytrium sp.
3 结论
甘蔗糖蜜价格低廉,营养丰富,是一种优良的发酵原料。但其中含有的大量灰分和胶体是其作为发酵原料的主要限制因素。为此首先调查了广东广西各地8家糖厂甘蔗糖蜜的灰分情况,从中选择了灰分含量较低的3种糖蜜经预处理后作为碳源培养裂殖壶菌,甘蔗糖蜜中的杂质(灰分、胶体)对菌体生长与油脂积累存在明显的抑制作用,即使大幅降低糖蜜添加比例效果也不理想,继续去除灰分等杂质的成本又很高,限制了其作为替代碳源在实际生产上的应用。在此基础上又考察了杂质含量相对较低的粗糖蜜的情况,在添加比例低于80%的情况下,其培养效果与对照葡萄糖非常接近,可以部分替代葡萄糖用于裂殖壶菌发酵生产。
参考文献
[1] 陈丽珠.高密度培养裂殖壶菌生产二十二碳六烯酸[D].厦门:厦门大学, 2008.
[2] ZHUO Zhi-hong, ZHANG Le-ming, MU Qi-tian, et al. The effect of combination treatment with docosahexaenoic acid and 5-fluorouracil on the mRNA expression of apoptosis-related genes, including the novel gene BCL2L12, in gastric cancer cells[J].InVitroCellular amp; Developmental Biology-Animal, 2009,45(1-2):69.
[3] SISCOVICK D F, RAGHUNATHAN T E, KING I, et al. Dietary intake and cell membrane levels of longer-chain n-3 polyunsaturated fatty acids and the risk of primary cardiac arrest [J]. The Journal of the American Medical Association, 1995, 274(17):1 363.
[4] MORLEY R. Nutrition and cognitive development[J].Nutrition,1998,14(10):752.
[5] KIM Y J, CHUNG H Y. Antioxidative and anti-inflammatory actions of docosahexaenoic acid and eicosapentaenoic acid in renal epithelial cells and macrophages [J]. Journal of Medicinal Food, 2007, 10(2):225.
[6] GILL I, VALIVETY R. Polyunsaturated fatty acids.part1:occurrence,biological activities and applications[J].Trends in Biotechnology,1997,15 (10):401.
[7] SIJTSMA L, SWAAF M E.Biotechnological production and application of the ω-3 polyunsaturated fatty acid docosahexaenoic acid[J]. Applied Microbiology and Biotechnology,2004(64):146-153.
[8] WARD O P, SINGH A. Omega-3/6 fatty acids: alternative sources of production[J]. Process Biochemistry,2005,40(12):3 627.
[9] 徐天宇. 利用生物技术生产二十碳五烯酸和二十二碳六烯[J]. 食品与发酵工业, 1995,21(1):56-64.
[10] 魏萍, 马小琛, 任路静, 等. 裂殖壶菌发酵生产DHA研究进展[J].食品工业科技, 2010(10):398-404.
[11] LIANG Y, SARKANY N, CUI Y,et al. Use of sweet sorghum juice for lipid production bySchizochytriumlimacinumSR21[J]. Bioresource Technology, 2010, 101:3 623-3 627.
[12] YAMASAKI T, AKI T, SHINOZAKI M,et al. Utilization of Shochu distillery wastewater for production of polyunsaturated fatty acids and xanthophylls using thraustochytrid[J].Journal of Bioscience and Bioengineering, 2006, 102(4):323-327.
[13] CHI Z Y, PYLE D, WEN Z Y, et al. A laboratory study of producing docosahexaenoic acid from biodiesel-waste glycerol by microalgal fermentation[J]. Process Biochemistry, 2007, 42(11):1 537-1 545.
[14] 保国裕. 糖蜜清净方法与作用探讨[J].甘蔗糖业, 2000(6):48-51.
[15] 黄俊杰. 碱性果胶酶在废糖蜜中的应用[D].昆明:昆明理工大学, 2009.
[16] LIPPMEIER J C, CRAWFORD K S, OWEN C B,et al. Characterization of both polyunsaturated fatty acid biosynthetic pathways inSchizochytriumsp. [J]. Lipids, 2009,44:621-630.
[17] 班甲, 陈骏佳, 付尽国, 等. 裂殖壶菌高密度发酵生产DHA[J].广东化工, 2016, 43(336):63-66.
[18] 全国食品工业标准化技术委员会制糖分技术委员会. QB/T2684—2005[S].北京: 中国标准出版社, 2006.
[19] 郑晓云. 精炼糖最佳清净工艺研究[D].北京:中国农业大学, 2005.
UseofmolassesforDHAproductionbySchizochytriumsp.
BAN Jia, CHEN Jun-jia*, FU Jin-guo, YANG Li-sheng, LU Jian-hua, LI Hao-yang
(Guangdong Provincial Bioengineering Institute (Guangzhou Sugarcane Industry Research Institute), Guangdong Provincial Key Laboratory of Sugarcane Improvement and Biorefinery, Guangdong Provincial Engineering Laboratory of Biomass High Value Utilization, Guangdong Provincial Engineering Technology Research and Development Center of Biomass Comprehensive Utilization, Guangzhou Key Laboratory of Biomass Comprehensive Utilization, Guangzhou 510316, China)
Docosahexaenic acid production bySchizochytriumsp. using molasses as carbon source was studied. Molasses from different sugar refineries were prepared as carbon source. Molasses sources and molasses proportion in the medium were investigated to evaluate the effect on the resultant dry cell weight, total lipid content and DHA yield. The results indicated that the colloid and excessive metal ions in the cane molasses had the noticeable negative effects on the growth ofSchizochytriumsp.. The growth was depressing even if the proportion of molasses significantly reduced. The application of the cane molasses as a substitute carbon source in the actual production was limited. On this basis the prospect of refined sugar molasses was evaluated. The result was very close between glucose and refined sugar molasses when the refined sugar molasses proportion in the medium was below 80%, refined sugar molasses might partly substitute for glucose as carbon source ofSchizochytriumsp..
Schizochytriumsp.; docosahexaenic acid(DHA); molasses; fermentation
10.13995/j.cnki.11-1802/ts.015075
硕士研究生(陈骏佳教授为通讯作者,E-mail:gzcsircjj@163.com )。
2017-06-30,改回日期:2017-08-03
