辛烯基琥珀酸酐纤维素酯的合成及其结构表征
2017-11-27田俊青赵丹马小涵赵天天邓婧刘雄
田俊青,赵丹,马小涵,赵天天,邓婧,刘雄
(西南大学 食品科学学院,重庆,400715)
辛烯基琥珀酸酐纤维素酯的合成及其结构表征
田俊青,赵丹,马小涵,赵天天,邓婧,刘雄*
(西南大学 食品科学学院,重庆,400715)
甘薯渣中含有丰富的纤维素成分,利用超声波辅助酶水解,碱解和酸解的方法提取纤维素,将甘薯渣中的纤维素利用DMAc/LiCl均相体系与辛烯基琥珀酸酐对其进行改性。该研究以纤维素为原料,采用CCD 中心组合试验设计研究mDMAP/m纤维素、nOSA/n纤维素、反应温度、反应时间4个因素对辛烯基琥珀酸酐纤维素酯取代度的影响,并对辛烯基琥珀酸酐纤维素酯取代度的工艺条件进行了优化。结果表明,对辛烯基琥珀酸酐纤维素酯合成的影响大小顺序为mDMAP/m纤维素gt;nOSA/n纤维素gt;反应温度gt;反应时间,从回归模型方差分析表中求得最佳工艺条件为mDMAP/m纤维素=0.48,温度78.64 ℃,时间186.52 min,nOSA/n纤维素=1.93,此条件下取代度预测值为0.385,验证试验预测精度高达94.81%,并对辛烯基琥珀酸酐纤维素酯进行红外光谱、扫描电镜等研究,以探讨其基团分布、表观形貌等特征。
纤维素;DMAc/LiCl;辛烯基琥珀酸酐纤维素酯;结构
纤维素是地球上最丰富的天然高分子聚合物,是通过β-1,4糖苷键链接的天然多糖,广泛存在于植物、动物和菌类体内,从第一次发现纤维素起,先后在高分子化学和食品化学领域引起广泛关注。
纤维素的羟基与酸、酸酐、酰卤在催化剂的作用下,生成纤维素酯类衍生产物[1-4],将长链烷基引入纤维素中,进行疏水性改性,改性后可使纤维素分子同时具备了亲水性和亲油性,双亲性的纤维素是制备稳定的pickering稳定乳液的重要纤维素基材料,同时改性纤维素材料所接入的羧基是具有吸附性效果的功能基团[5]。在食品行业中,利用辛烯基琥珀酸酐进行疏水性改性的原料来源,主要包括淀粉[6]、阿拉伯胶[7]、β-葡聚糖[8]等性质较为活泼的多糖,且广泛用作食品、涂料等行业的增稠剂及乳化稳定剂[9-10],而纤维素较少有人研究,可能是由于纤维素分子内、分子间以氢键形式连接,具有很强的极性与作用力,水与一般溶剂难以触及,对纤维素、膳食纤维进行蒸汽闪爆和微波热碱预处理后进行辛烯基琥珀酸酐的改性[11-12],也只能使其暴露更多非结晶区的羟基,结晶区羟基间氢键排列规则且稳定,故辛烯基琥珀酸酐对纤维素的改性仅仅局限于表面,导致纤维素在改性反应中的不均匀性,直接影响改性产物的性能,存在很大的局限性。而均相化合成可深入纤维素的结晶区与非结晶区,破坏氢键,更多的可对纤维素内部结晶区羟基进行修饰,理论上存在OSA对纤维素进行均相化疏水性改性的可能性,但截止到目前尚未有相关文献对其均相化合成进行报道,以期合成后利用辛烯基琥珀酸酐基团的功能性,将其应用于食品行业乳化剂、增稠剂的开发、重金属和色素的吸附[13-15],解决食品工业发展所带来的新型乳化剂的利用问题和环境污染问题,因此合成辛烯基琥珀酸酐纤维素酯也是植物资源高值化利用研究的重点之一。适合均相酯化反应体系有离子液体、DMSO/TBAF.3H2O、DMAc/LiCl等,考虑到成本和溶剂稳定性,本文选择真溶剂体系DMAc/LiCl均相化合成纤维素酯[16-18],溶解与合成图见图1和图2。

图1 纤维素溶解的机理图[16-18]Fig.1 Mechanism of cellulose dissolution[16-18]

图2 辛烯基琥珀酸酐纤维素酯合成图[19]Fig.2 Composite image of octenyl succinic anhydride cellulose ester[19]
本实验是以氯化锂/N,N-二甲基乙酰胺(LiCl /DMAc)为均相溶剂体系,在4-二甲基氨基吡啶的催化下,以辛烯基琥珀酸酐作为改性剂,重点研究不同mDMAP/m纤维素(催化剂DMAP与纤维素质量之比)、nOSA/n纤维素(辛烯基琥珀酸酐与纤维素物质的量之比)、反应温度、反应时间下对辛烯基琥珀酸酐纤维素酯合成的影响,并对其合成工艺进行响应面分析,在最佳工艺条件下对辛烯基琥珀酸酐纤维素酯进行红外光谱、扫描电镜等分析,以探讨其基团分布、微观形貌等性质,以期对辛烯基琥珀酸酐纤维素酯的实际应用提供理论指导,同时为进一步的研究提供理论依据。
1 材料与方法
1.1材料与试剂
纤维素晶体(自提);辛烯基琥珀酸酐(OSA) (分析纯),美国Sigma公司;N,N-二甲基乙酰胺(DMAc)分析纯,成都科龙化工试剂厂;氯化锂(LiCl)(分析纯),成都科龙化工试剂厂;4-二甲基氨基吡啶(DMAP)(分析纯),成都科龙化工试剂厂;三乙胺(TEA)(分析纯),成都科龙化工试剂厂;DMAc溶剂使用前要进行4A分子筛除水。
1.2仪器与设备
数控超声波清洗器(KQ 3200DB),昆山市超声仪器有限公司;高压均质机(GYB60-6s),上海东华高压均质机厂;实验型喷雾干燥机(YC-015),上海雅程仪器设备有限公司;SARTORIUS电子天平(BS-223S),北京赛多利斯仪器系统有限公司;电热恒温鼓风干燥箱(DHG-9140),上海齐欣科学仪器有限公司;数显恒温磁力搅拌油浴锅(HH-8K),上海齐欣科学仪器有限公司;傅里叶变换红外光谱(Spectrun100),美国Perkin-Elmer公司;扫描电子显微镜(SU3500),日本日立公司。
1.3实验方法
1.3.1 薯渣纤维素的制备
采用课题组前期研究建立的薯渣纤维素的制备技术,确定的工艺流程为:
甘薯渣预处理→超微粉碎,过180目筛→超声波辅助淀粉酶处理→灭酶→热碱处理→H2O2漂白→烘干、粉碎→超声波辅助65%硫酸水解→调节PH到中性→充分洗涤→均质→纤维素悬浮液→冷冻干燥→纤维素晶体[20]
1.3.2 薯渣纤维素和辛烯基琥珀酸酐的的酯化合成反应
纤维素(C)需要使用水、甲醇和DMAc等先后对纤维素进行溶剂交换处理,使其活化,以削弱纤维素大分子链之间的强作用力,LiCl做除水处理,再将纤维素溶解在在DMAc/LiCl溶剂体系中[21]。具体操作如下:首先,将1 g纤维素和80 mL DMAc溶剂加入到装有冷凝回流,机械搅拌和氮气保护的三口烧瓶(250 mL)中,并将三口烧瓶置于140 ℃油浴锅中加热60 min,使薯渣纤维素充分活化。然后,加入7.612 g LiCl,保持温度为140 ℃,搅拌速率保持200 r/min,时间为3 h。最后,将反应体系温度降至室温,继续保持搅拌速率搅拌12 h后,样品纤维素溶液完全溶解呈现均相的状态的LiCl/DMAc溶液,用乙醇醇沉,乙醇、丙酮洗涤3次以上后可得到再生纤维素(RC)用于性质研究。
酯化合成反应时,将均相纤维素溶液的三口烧瓶置于冰水浴中,加入一定量的DMAP作为酯化反应催化剂,TEA作为缚酸剂。分别将不同量的辛烯基琥珀酸酐溶解到5 mL的DMAc溶剂,然后用恒压滴液漏斗滴加该混合液体,30 min内滴完。将三口烧瓶置于不同温度(60、70、80、90、100 ℃)下的油浴锅中保温一定时间。待反应结束后,加入80%乙醇-水混合液使纤维素酯化产物沉淀,离心后倾去上清液;纤维素酯沉淀物经洗涤、离心(重复3次)后于真空冷冻干燥条件下干燥48 h,得到类白色纤维素酯类产物,即为辛烯基琥珀酸酐纤维素酯(OSA-C)样品[22-24]。
1.4辛烯基琥珀酸酐纤维素酯取代度的测定
辛烯基琥珀酸酐纤维素酯末端含有较多的羧酸基团,这是酐单元有3个羟基可用,它会导致改性纤维素的取代度的变化[25],由此可用碱水解-酸返滴定法基于碱水解酯后,碱与羧酸的中和计算产物的取代度。纤维素酯取代度的测定常用碱水解-酸返滴定法并略做修改,首先取0.2 g的样品粉末,加入20 mL DMSO溶液将样品粉末进行溶胀处理,磁力搅拌1 h后,加入50 mL 0.25 mol/L的NaOH溶液,在恒温磁力搅拌水浴锅中加热至70 ℃,磁力搅拌12 h,加入2~3滴酚酞指示剂,使用0.25mol/L的HCl溶液滴定反应烧杯中过量的NaOH,当酚酞变为粉红色时终止滴定,记录滴定所用的HCl,用未改性纤维素进行相同试验,做空白处理[26-28]。
DS可通过式(1)计算:

(1)
DS为辛烯基琥珀酸酐纤维素酯的取代度,nNaOH=(VNaOH×CNaOH-VHCl×CHCl)/2为纤维素酯化产物中羧酸基团的摩尔含量,m为样品质量,162为纤维素链段的葡萄糖单元的摩尔质量(AGU)和 210为纤维素酯化产物中每个葡萄糖单元上增加的辛烯基琥珀酸酐单元质量。
1.5辛烯基琥珀酸酐纤维素酯性质测定方法
1.5.1 红外光谱分析(FT-IR)
根据GBT 6040—2002,取适量的干燥样品与光谱级kBr(质量比1∶100)共同研磨,在常压或真空条件下加压成型,制成透明状片剂,利用傅里叶变换红外光谱仪进行扫描,扫描范围400~4 000 cm-1,分辨率2 cm-1,每个样品累计扫描32次。
1.5.2 扫描电镜分析(SEM)
采用扫描电子显微镜进行观察,先将双面胶粘结在样品座上,再均匀的把样品粉末撒在上面,用气枪吹去未粘住的粉末,进行喷金,取出后放入扫描电镜进行观察。
1.6工艺优化试验设计
1.6.1 单因素试验
分别考察不同酯化反应条件,mDMAP/m纤维素、nOSA/n纤维素、反应温度、反应时间4个试验因素对辛烯基琥珀酸酐纤维素酯合成的影响,以取代度为测定指标进行单因素实验。
1.6.1.1 不同mDMAP/m纤维素对辛烯基琥珀酸酐纤维素酯的影响
将1 g纤维素均相溶解于DMAc/LiCl溶剂体系中,控制nOSA/纤维素为1∶1,反应温度90 ℃,反应时间3 h,改变mDMAP/m纤维素为0.1、0.2、0.3、0.4、0.5时,考察不同mDMAP/m纤维素对辛烯基琥珀酸酐纤维素酯的影响。
1.6.1.2 不同反应温度对辛烯基琥珀酸酐纤维素酯的影响
将1 g纤维素均相溶解于DMAc/LiCl溶剂体系中,控制nOSA/n纤维素为1∶1,mDMAP/m纤维素之比为0.4,反应时间3 h,改变反应温度为60、70、80、90、100 ℃时,考察不同反应温度对辛烯基琥珀酸酐纤维素酯的影响。
1.6.1.3 不同反应时间对辛烯基琥珀酸酐纤维素酯的影响
将1 g纤维素均相溶解于DMAc/LiCl溶剂体系中,控制nOSA/n纤维素为1∶1,mDMAP/m纤维素为0.4,反应温度为80 ℃,改变反应时间1、2、3、4、5 h时,考察不同反应时间对辛烯基琥珀酸酐纤维素酯的影响。
1.6.1.4 不同nOSA/n纤维素对辛烯基琥珀酸酐纤维素酯的影响
将1 g纤维素均相溶解于DMAc/LiCl溶剂体系中,控制mDMAP/m纤维素为0.4,反应温度80 ℃,反应时间3 h,改变nOSA/n纤维素为0.5、1、1.5、2、2.5时,考察不同nOSA/n纤维素对辛烯基琥珀酸酐纤维素酯的影响。
1.6.2 响应面优化试验设计
对单因素试验结果进行显著性分析,选择对取代度影响较大的因素条件,以取代度为响应值,对辛烯基琥珀酸酐纤维素酯合成的条件进行优化,采用CCD中心组合试验设计,运用Design-Expert(Version 8.0)试验设计原理,建立数学回归模型,进行数据分析,其因素水平设计见表1。

表1 CCD中心组合试验设计因素水平表
1.7数据处理
采用Origin、Excel 2007和SPSS 22.0对试验数据进行作图及统计分析,差异显著性(plt;0.05)用不同字母(a/b)表示,采用Design-Expert(version8.6)软件对响应面试验得到的数据进行线性回归和方差分析。
2 结果与分析
2.1不同反应条件对辛烯基琥珀酸酐纤维素酯取代度的影响
2.1.1不同mDMAP/m纤维素对辛烯基琥珀酸酐纤维素酯的影响
图3考察mDMAP/m纤维素对辛烯基琥珀酸酐纤维素酯的影响,DMAP是一种产生较少副产物的吡啶,更是一种有效的催化剂,图3是对催化剂用量对取代度DS值的影响呈现,催化剂添加量对酯化合成的速率是先增加后缓慢减小,直到速率不在变化为止。随着mDMAP/m纤维素从0.1增加到0.4时,OSA纤维素酯的DS从0.066 7上升到0.228 9,表明催化剂用量的增加显著提高了DMAc/LiCl溶剂体系中纤维素酯化的效率,然而增大到0.5时,OSA纤维素酯的DS值基本上是恒定的,且与mDMAP/m纤维素为0.4时无显著性,这表明在给定条件下,催化剂用量的进一步增加对纤维素酯化反应没有显著性影响,这有可能是,羟基已经被OSA基团饱和,或OSA引起的空间位阻抑制了纤维素进一步的酯化,因此选择0.4用于进一步的研究。
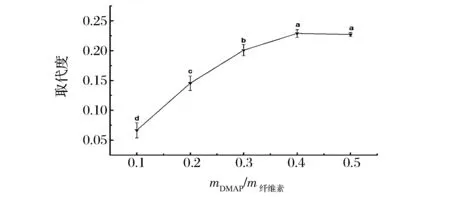
图3 不同mDMAP/m纤维素对辛烯基琥珀酸酐纤维素酯的影响Fig.3 Effect of differentmDMAP / mcellulose ratio on octenyl succinic anhydride cellulose ester注:用LSD法进行多重比较,标有不同小写字母者表示组间差异显著(plt;0.05);标有相同小写字母者表示组间差异不显著(pgt;0.05),图4~图6同。
2.1.2 不同反应温度对辛烯基琥珀酸酐纤维素酯的影响
图4考察反应温度对辛烯基琥珀酸酐纤维素酯的影响,反应温度不仅影响催化剂反应速率,而且也影响摩尔分子间的运动速率,温度对酯化合成反应如图4所示,随着温度从60 ℃上升到80 ℃,OSA纤维素的DS值逐渐从0.115 0上升到0.278 9,原因可能是高温促进OSA扩散到纤维素的结晶区,有助于提高酯化效率,然而温度过高,可能使纤维素在反应过程中,发生降解反应,从而引起OSA纤维素酯DS的减小,也可能是很高的温度,将会导致所形成酯的水解作用,在本研究中温度从80 ℃进一步增加到100时,DS值显著降低,这一观察与LI和LIU等的观点相一致[29-30],也可能是由于纤维素和纤维素衍生物在高温下的热负荷和改性的可逆反应所引起的。

图4 不同反应温度对辛烯基琥珀酸酐纤维素酯的影响Fig.4 Effect of different temperture on octenyl succinic anhydride cellulose ester
2.1.3 不同反应时间对辛烯基琥珀酸酐纤维素酯的影响
图5考察反应时间对辛烯基琥珀酸酐纤维素酯的影响,当时间从60 min增加到180 min时,DS值从0.066 6增加到0.278 9,可能是因为反应时间的增加会提高酯化剂和纤维素分子的碰撞机率和碰撞时间,使DS明显提高,然而进一步延长反应时间DS值减小[29],这一研究结果与LI[29]的相似,这种现象可能是由于酯化反应过程中,产生水而引起OSA纤维素酯的水解,随着反应体系中水分含量的增加,水解反应增强,使OSA纤维素酯的DS减小,当超过180 min时不良和副反应可能影响酯化反应的产生。也可能是因为延长反应时间,将会导致纤维素的降解,从而减小DS。

图5 不同反应时间对辛烯基琥珀酸酐纤维素酯的影响Fig.5 Effect of different reaction time onoctenyl succinic anhydride cellulose ester
2.1.4 不同nOSA/n纤维素对辛烯基琥珀酸酐纤维素酯的影响
图6考察nOSA/n纤维素对辛烯基琥珀酸酐纤维素酯的影响,酯化剂的浓度也是影响反应速率的重要因素,反应效率随着反应摩尔比的增加而增加,在较高浓度的酯化剂下,这些纤维素分子与附近的OSA分子有较大的可及性,当nOSA/n纤维素从0.5增加到1.5时,OSA添加量的增加可以改变纤维素和OSA的摩尔碰撞速率和酯化反应平衡速率,当OSA添加量多时,纤维素与OSA的摩尔碰撞机率增大,DS值显著增大,试验中发现当OSA添加量增大到一定程度时,nOSA/n纤维素大于2.0时会有纤维素酯析出,DS值没有明显的显著性,这可能是因为由于空间位阻作用,取代度达到饱和,也可能是因为可逆反应趋向平衡,致使DS值变化没有显著性,说明合适的nOSA/n纤维素,可以获得最大纤维素酯取代度[30]。
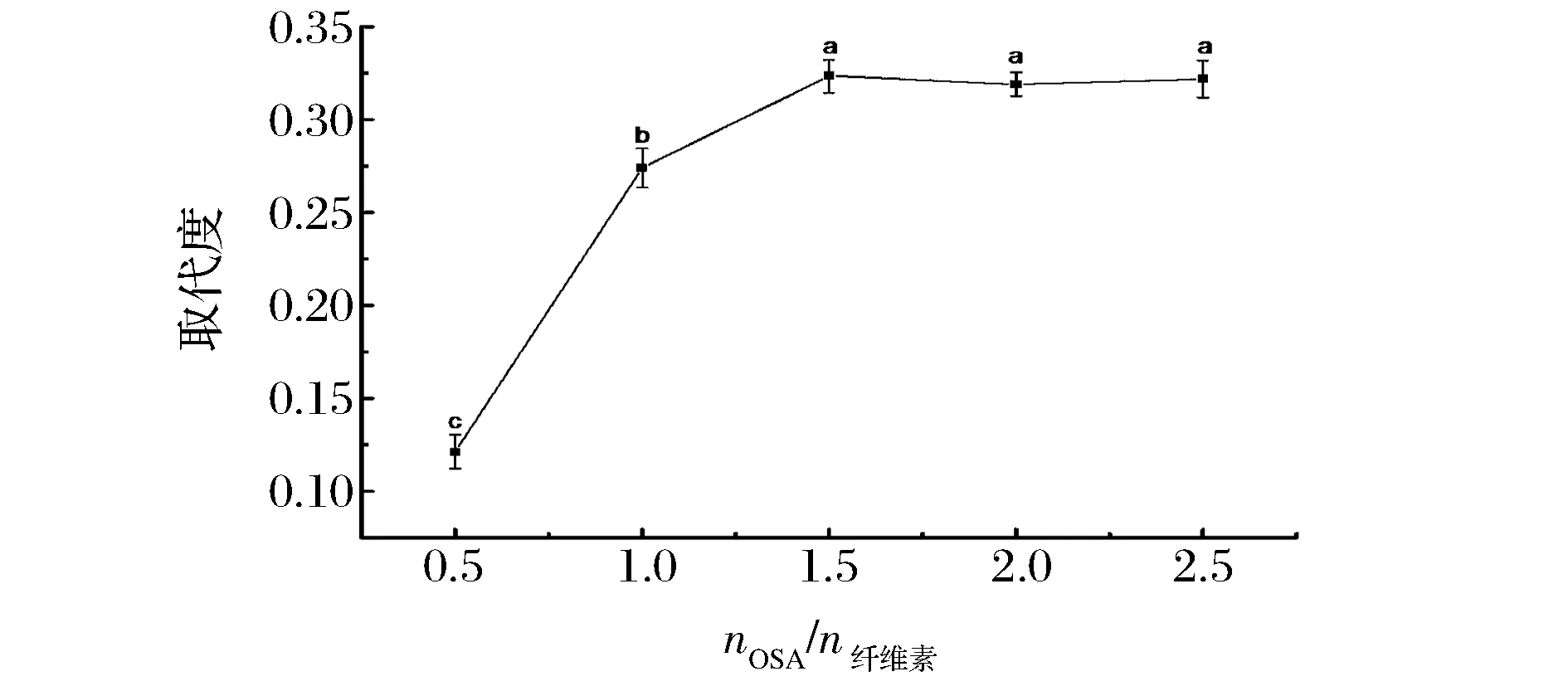
图6 不同nOSA/n纤维素对辛烯基琥珀酸酐纤维素酯的影响Fig.6 Effect of different ratios of nOSA/n cellulose on octenyl succinic anhydride cellulose ester
2.2响应面试验结果
通过单因素试验确定试验的最佳水平,采用CCD中心组合试验设计,设计4因素5水平共30个试验,其中24个分析因素试验,6个零点试验,优化辛烯基琥珀酸酐纤维素酯合成的工艺条件。设计的试验方案和结果见表2。
2.3回归模型的建立和方差分析
使用响应面分析法对表2中的试验数据进行多元回归拟合,得到mDMAP/m纤维素、反应温度、反应时间、nOSA/n纤维素相关回归系数,其回归方程为
DS=0.35+0.049A+0.020B+0.020C+0.035D-0.011AB+0.004AC+0.014AD+0.012BC-0.029BD-0.013CD-0.039A2-0.043B2-0.051C2-0.028D2
(2)
式中:DS为取代度;A为mDMAP/m纤维素;B为反应温度,℃;C为反应时间,min;D为nOSA/n纤维素。
进一步对回归方程进行分析,所得的方差分析结果见表3。


表2 CCD中心组合试验设计方案及结果

表3 回归模型方差分析
注:**代表极显著水平plt;0.01,*代表显著水平plt;0.05。
2.4两因素交互作用
为进一步研究相关变量之间的交互作用,并在整个待定区域内确定各因素的最优取值范围,绘制了各自变量对响应值交互影响的响应面曲图面和等高线图(图7~图11)。
综合分析图7、图9、图10可知,响应值随温度的升高出现先增大后减小的趋势,原因是反应体系中温度的升高,有利于酯化纤维素的生成和酯化反应的进行,但温度过高会促进纤维素的氧化降解,也可能导致纤维素酯的水解,降低了辛烯基琥珀酸酐的利用率,从而降低了取代度。分析图8、图10、图11可知,在试验水平范围内,响应值随nOSA/n纤维素摩尔之比的增大而逐渐趋于平稳,表明在反应体系辛烯基琥珀酸酐添加量的增大,可以增加纤维素与辛烯基琥珀酸酐的碰撞机率和速率,从而促进酯化反应的正向进行,从而增大取代度。
由图9、图11响应图可知,响应值随时间的增大先升高后减小,说明过高的温度不利于反应的进行,形成酯会发生水解作用,不利于反应的正向进行,从而取代度降低;由图6、图7响应面图可知,响应值随mDMAP/m纤维素的增大先升高后平稳,说明催化剂的用量可以增大反应速率,从而提高取代度,当催化剂进一步增加,取代度趋于平稳,可能是辛烯基琥珀酸酐引起的空间位阻抑制了纤维素进一步的酯化,从而取代度变化无显著性差异。

图7 mDMAP/m纤维素和温度的交互作用对取代度的响应面和等高线图Fig.7 Response surface and contour plots of mDMAP / mcellulose and temperature interaction on the degree of substitution

图8 mDMAP/m纤维素和nOSA/n纤维素的交互作用对取代度的响应面和等高线图Fig.8 Response surface and contour plots of mDMAP/mcellulose and nOSA/ncellulose interaction on the degree of substitution

图9 时间和温度的交互作用对取代度的响应面和等高线图Fig.9 Response surface and contour plots of time and temperature interaction on the degree of substitution

图10 nOSA/n纤维素和温度的交互作用对取代度的响应面和等高线图Fig.10 Response surface and contour plots of nOSA/ncellulose and temperature interaction on the degree of substitution

图11 nOSA/n纤维素和时间的交互作用对取代度的响应面和等高线图Fig.11 Response surface and contour plots of nOSA/ncellulose and time interaction on the degree of substitution
2.5最佳工艺的确定与验证
利用 Design Expert8.0 软件进行分析,从上述回归模型方差分析表中求得最佳工艺条件为:mDMAP/m纤维素为0.48,温度78.64 ℃,时间186.52 min,nOSA/n纤维素为1.93,此条件下取代度预测值为0.3850。在工业生产中为了便于实践操作,对优化条件的参数取整后修正为mDMAP/m纤维素为0.5,温度79 ℃,时间187 min,nOSA/n纤维素为2。为检验响应面模型的可靠性,按上述最佳工艺条件重复 3 次试验。验证试验结果表明,在修正的最佳工艺条件下,取代度预测值为0.365 0±0.035 0,预测精度高达94.81%,再次证明回归模型的准确性。
2.6辛烯基琥珀酸酐纤维素酯性质分析
2.6.1 红外光谱分析
红外光谱分析(图12):C和RC中纤维素的特征峰基本存在,3 000~3 750 cm-1处—OH有强的伸缩振动峰,3 346 cm-1附近有宽而强的吸收峰,是纤维素羟基的伸缩振动吸收,证明薯渣纤维素中存在缔合状态的氢键,是所有纤维素的特征谱带。2 912 cm-1处存在—CH2的不对称伸缩振动吸收峰,1 420 cm-1附近出有—CH2的弯曲振动峰,1 383 cm-1处的吸收峰为 C—H 的弯曲振动,1 320 cm-1处的峰是 O—H 的面内弯曲振动产生的,1 160 cm-1处的吸收峰是纤维素的C—O—C不对称伸缩振动、C—O 的不对称桥式伸展振动及 C—OH 弯曲振动引起的,1 060 cm-1处的强吸收峰是由于纤维素结构上的伯羟基的 C—O—C 不对称“桥”伸缩振动吸收峰,896 cm-1为环状 C—O—C 不对称面外伸缩振动,CH2(CH2OH)非平面摇摆振动产生的特征峰。C中杂峰较少,说明薯渣纤维素纯度较高。RC中具备纤维素的特征峰,其中在2 912 cm-1处存在—CH2的伸缩振动峰,但峰型减弱,有可能是因为纤维素聚合度减小,纤维素大分子氢键断裂,导致再生纤维素中以小分子量纤维素的形式存在。

图12 纤维素、再生纤维素、辛烯基琥珀酸酐纤维素酯的红外光谱图Fig.12 Infrared spectra of cellulose、regenerated cellulose and octenyl succinic anhydride cellulose ester

2.6.2 扫描电镜分析
扫描电子显微镜能观察样品表面和内部断面的形貌以及尺寸,C、RC、OSA—C的扫描电镜图如图13所示,从图13中的(a)、(b)、(c)不难看出,薯渣纤维素中呈现管状和不规则片状,基本保持了纤维素原有的结构特征,经过一系列提取之后,化学试剂可能破环纤维素的形状,这与本实验室先前对甘薯渣纤维素的研究一致[35],倍数放大后可以观察到纤维素致密的中空管束状破裂,片状结构在周围分散,纤维素表面形貌致密。图13中的(d)、(e)、(f)中,RC基本保持原纤维素的结构,经过DMAc/LiCl溶剂后,纤维素的管束状态破坏,呈现厚实的长条状、片状结构,增大倍数后可以明显观察到管束状向内凹陷,导致中空状态基本消失,纤维素表面变得粗糙,出现不平整的状态。图13中的(g)、(h)、(i)中,OSA—C结构改变,呈结块状和不规则球状,倍数放大后观察到有形态类似小球状的结构在表面出现,更多的小分子纤维素暴露,利于酯化反应进行,还有可能是酯化反应的结果,反应过程中分子内部发生了重排。

图13 纤维素(a/b/c)、再生纤维素(d/e/f)、辛烯基琥珀酸酐纤维素酯(g/h/i)的扫描电镜图Fig.13 Scanning electron microscopy of cellulose(a/b/c)、 regenerated cellulose(d/e/f) and octenyl succinic anhydride cellulose ester(g/h/i)
4 结论
在单因素试验的基础上利用响应面软件优化制备OSA—C的最佳条件,得出对酯化反应影响的4个因素显著性顺序为:mDMAP/m纤维素gt;nOSA/n纤维素gt;反应温度gt;反应时间。在分析上述4个因素对整个反应的交互作用的基础上获得工艺的最佳条件为mDMAP/m纤维素为0.48,温度78.64 ℃,时间186.52 min,nOSA/n纤维素为1.93,此条件下取代度预测值为0.385 0,验证试验预测精度高达94.81%。
红外光谱分析表明:辛烯基琥珀酸酐基团成功取代了纤维素表面的部分羟基,达到了对纤维素进行辛烯基琥珀酸酐改性修饰的目的;SEM表征显示:改性后的纤维素形态改变较大,呈结块状和不规则球状,表面结构疏松,倍数放大后观察到有形态类似小球状的结构在表面出现,说明均相化反应使更多结晶区的小分子纤维素暴露,使其反应活性增加,这些结论证实了在均相溶液体系中,辛烯基琥珀酸酐对纤维素进行修饰的可能性,成功合成了辛烯基琥珀酸酐纤维素酯,后续研究中将对吸附性和乳化性进行评价,以期应用于重金属、色素的吸附和乳化剂、增稠剂的开发,解决食品工业带来的环境污染问题和新型乳化剂的利用问题,充分实现纤维素资源的高值化利用。
[1] KOSCHELLA A, FENN D, ILLY N, et al. Regioselectively functionalized cellulose derivatives: A mini review[J].Macromolecular Symposia, 2006, 244(1):59-73.
[2] HEINZE T, LIEBERT T. Unconventional methods in cellulosefunctionalization[J]. Progress in Polymer Science, 2001, 26(9):1 689-1 762.
[3] EDGAR K J, BUCHANAN C M, DEBENHAM J S, et al. Advances in cellulose ester performance andapplication[J]. Progress in Polymer Science, 2001, 26(9):1 605-1 688.
[4] KLEMM D, HEUBLEIN B, FINK H, et al. Cellulose: Fascinating biopolymer and sustainable raw material[J]. Angewandte Chemie International Edition, 2005, 44(22):3 358-3 393.
[5] NIKIFOROVA T E, KOZLOV V A. A mechanism of sorption of heavy metal ions from aqueous solutions by chemically modifiedcellulose[J]. Protection of Metals and Physical Chemistry of Surfaces, 2012, 48(6):620-626.
[6] WANG C,HE X W,HUANG Q,et al.The mechanism of starch granule reacted with OSA by phase transition catalyst in aqueous medium[J].Food Chemistry,2013,141(4):3 381-3 385.
[7] 石燕,李翠,罗琦,等.辛烯基琥珀酸-阿拉伯胶酯的合成工艺及乳化性能[J].食品科学, 2017(4):211-216.
[8] 刘嘉,董楠,赵国华.辛烯基琥珀酸燕麦β -葡聚糖酯的合成[J].食品与发酵工业,2016,42(10):93-98.
[9] WANG C, HE X W, HUANG Q, et al. The mechanism of starch granule reacted with OSA by phase transition catalyst in aqueous medium[J]. Food Chemistry,2013, 141(4):3 381-3 385.
[10] BAO J S,XING J,PHILLIPS D L,et al. Physical properties of octenyl succinic anhydride modified rice,wheat,and potato starches[J].J Agric Food Chem,2003,51:2 283-2 287.
[11] 胡建雪, 赵伟, 杨瑞金. 辛烯基琥珀酸纳米纤维素纤维酯的制备及性质研究[J]. 食品工业科技, 2015, 36(18):276-280.
[12] 杨婧,郑为完,高媛媛,等.辛烯基琥珀酸豆渣膳食纤维素酯的合成及应用[J].食品科学,2013,34(12):86-89.
[13] HOKKANEN S, REPO E, SILLANPM. Removal of heavy metals from aqueous solutions by succinic anhydride modified mercerizednanocellulose[J]. Chemical Engineering Journal, 2013, 223(3):40-47.
[14] YOSHIMURA T, MATSUO K, FUJIOKA R. Novel biodegradable superabsorbent hydrogels derived from cotton cellulose and succinic anhydride: Synthesis and characterization[J]. Journal of Applied Polymer Science, 2010, 99(6):3 251-3 256.
[15] EDGAR K J, BUCHANAN C M, DEBENHAM J S, et al. Advances in cellulose ester performance and application[J]. Progress in Polymer Science, 2001, 26(9):1 605-1 688.
[16] A DAM S GROSS, ALEXIS T BELL, JHIH-WEI CHU. Preferential interactions between lithium chloride and glucan chains in N,N-dimethylacetamide drive cellulose dissolution[J].The Journal of Physical Chemistry B,2013,117(12):3 280-3 286.
[17] ZHANG Chao, LIU Ruigang, XIANG Junfeng.Dissolution mechanism of cellulose in N,N-dimethylacetamide/lithium chloride: Revisiting through molecular interactions[J].The Journal of Physical Chemistry B,2014,118:9 507-9 514.
[18] BOCHEK A M. Effect of hydrogen bonding on cellulose solubility in aqueous and nonaqueous solvents[J]. Russian Journal of Applied Chemistry, 2003, 76(11):1 711-1 719.
[19] FOX S C, LI B, XU D, et al. Regioselective esterification and etherification of cellulose: A review.[J]. Biomacromolecules, 2011, 12(6):1 956-1 972.
[20] 陆红佳, 郑龙辉, 刘雄. 超声波辅助酶结合碱法提取薯渣纤维素的工艺研究[J]. 食品工业科技, 2012,33(1):234-237.
[21] WANG Z, ZHOU Y, YANG Y. Cellulose esterification and its application to films[J]. Progress in Chemistry, 2014, 16(1):105-109.
[22] 钟金锋, 覃小丽, 柴欣生. 丁二酸纤维素酯合成过程取代度的预测模型[J]. 食品科学, 2014, 35(23):104-107.
[23] KOTELNIKOVA N, BYKHOVTSOVA Y, MIKHAILIDI A, et al. Solubility of lignocellulose in N,N-dimethylacetamide/lithium chloride. WAXS, 13C CP/MAS NMR, FTIR and SEM studies of samples regenerated from the solutions[J]. Cellulose Chemistry amp; Technology, 2014, 48(7):643-651.
[24] SINGH R K, SHARMA O P, SINGH A K. Evaluation of cellulose laurate esters for application as green biolubricant additives[J]. Industrial amp; Engineering Chemistry Research, 2014, 53(25):10 276-10 284.
[25] MANSOURI S, KHIARI R, BETTAIEB F, et al. Synthesis and characterization of carboxymethyl cellulose from tunisian vine stem: Study of water absorption and retention capacities[J]. Journal of Polymers and the Environment, 2015, 23(2):190-198.
[26] X D ELJKO STOJANOVI, KATARINA JEREMI, SLOBODAN JOVANOVI, et al. A comparison of some methods for the determination of the degree of substitution of carboxymethyl starch[J]. Starch-Stärke, 2005, 57(2):79-83.
[27] SHANG W, SHENG Z, SHEN Y, et al. Study on oil absorbency of succinic anhydride modified banana cellulose in ionic liquid[J]. Carbohydrate Polymers, 2016, 141:135-142.
[28] ZHONG J F, CHAI X S, HU H C, et al. Determination of degree of substitution in succinic anhydride modified cellulose by headspace gas chromatography.[J]. Journal of Chromatography A, 2012, 1 229:302-304.
[29] LI W Y,JIN A X, LIU C F, et al.Homogeneous modification of cellulose with succinic anhydride in ionic liquid using 4-dimethylaminopyridine as a catalyst[J]. Carbohydrate Polymers, 2009,78(3):389-395.
[30] LIU C F, SUN R C, ZHANG A P, et al.Homogeneous modification of sugarcane bagasse cellulose with succinic anhydride using a ionic liquid as reaction medium[J]. Carbohydrate Research, 2007,342(7):919-926.
[31] FANG J M, FOWLER P A, SAYERS C, et al. The chemical modification of a range of starches under aqueous reaction conditions[J]. Carbohydrate Polymers, 2004, 55(3):283-289.
[32] NAGAOKA S, TOBATA H, TAKIGUCHI Y, et al. Characterization of cellulose microbeads prepared by a viscose-phase-separation method and their chemical modification with acid anhydride[J]. Journal of Applied Polymer Science, 2010, 97(1):149-157.
[33] HUI R, CHEN Q H, FU M L, et al. Preparation and properties of octenyl succinic anhydride modified potato starch.[J]. Food Chemistry, 2009, 114(1):81-86.
[34] WANG J P, SU L H, WANG S. Physicochemical properties of octenyl succinic anhydride-modified potato starch with different degrees of substitution.[J]. Journal of the Science of Food amp; Agriculture, 2010, 90(3):424-429.
[35] 陆红佳, 郑龙辉, 刘雄. 纳米薯渣纤维素的表观结构及其理化特性研究[C].中国农业工程学会农产品加工及贮藏工程分会学术年会暨全国食品科学与工程博士生学术论坛、管产学研助推食品安全重庆高峰论坛,2011.
Synthesisandstructurecharacterizationofoctenylsuccinicacidcelluloseester
TIAN Jun-qing, ZHAO Dan, MA Xiao-han, ZHAO Tian-tian, DENG Jing, LIU Xiong*
(College of Food Science,Southwest University,Chongqing 400715,China)
The sweet potato residue is rich in cellulose. The ultrasonic assisted enzyme hydrolysis, alkaline hydrolysis and acid hydrolysis were used in the extraction of the cellulose and then MAc/LiCl homogeneous system with octenyl succinic anhydride was applied in modifying the cellulose. The influence ofmDMAP/mcellulose,nOSA/ncellulose, reaction temperature and reaction time on the degree of substitution of octenyl succinic anhydride cellulose ester were studied using CCD core combination test. The optimum conditions for the degree of substitution of octenyl succinic anhydride cellulose ester were selected. The results showed that the order of the factors in the synthesis of octenyl succinic anhydride cellulose ester was:mDMAP/mcellulosegt;nOSA/ncellulosegt;reaction temperaturegt; reaction time. The optimum conditions were:mDMAP/mcellulose0.48, reaction temperature 78.64 ℃ , reaction time186.52 min. Under the above conditions, the substitute degree ofnOSA/ncellulosewas1.93; the predicted value was 0.385, and the prediction accuracy was as high as 94.81%. The distribution, apparent morphology of octene succinic anhydride cellulose ester was studied by infrared spectroscopy and SEM.
cellulose; DMAc / LiCl; octenyl succinic anhydride cellulose ester; structure
10.13995/j.cnki.11-1802/ts.014287
硕士研究生(刘雄教授为通讯作者,E-mail:liuxiong848@ hotmail.com)。
重庆市科委民生专项一般项目(cstc2015shmszx0367)2015—甘薯渣纤维高值化利用关键技术研究
2017-03-13,改回日期:2017-05-07
